Klinické téma: Náhrada funkce ledvin
Posted By karelkrejci On 8.1.2013 @ 9:24 In 4.3. Náhrada funkce ledvin | Comments Disabled
Úvod
Hemodialýza a ostatní mimotělní metody náhrady funkce ledvin jsou spolu s peritoneální dialýzou život zachraňující výkony. U pacientů s akutní renálním selháním umožňují překlenout fázi do případné reparace renálních funkcí. U chronického renálního selhání jde u pacientů indikovaných k transplantaci ledviny o dočasný výkon, u ostatních se jedná o doživotní terapii prodlužující život o přiměřené kvalitě.
Extrakorporální metody
Hemodialýza
Při této extrakorporální metodě je krev z cévního přístupu pacienta odváděna do mimotělního oběhu dialyzačního přístroje a musí být antikoagulovaná. Podkladem vlatního očišťování krve při hemodialýze je přechod látek z krve přes semipermeabilní membránu do dialyzačního roztoku, který protiproudově protéká v dialyzátoru na druhé straně membrány. Látky přecházejí přes membránu hlavně difůzí, částečně i filtrací. Dialyzační roztok, který již protekl dialyzátorem, obsahuje látky odstraněné z krve a odchází do odpadu. Očištěná krev se pak vrací návratovou jehlou do oběhu pacienta.
Hemofiltrace
Na rozdíl od hemodialýzy užívá tato metoda k očišťování krve jen filtraci, nikoli difůzi. Dialyzátorem v tomto případě protéká pouze krev. Velikost filtrace při jedné proceduře se pohybuje mezi 30–100 litry, odstraněná tekutina se v průběhu procedury nahrazuje substitučním roztokem. Hemofiltrace oproti hemodialýze zajišťuje stabilnější hemodynamiku pacienta a odstraňuje lépe látky o větší molekulární hmotnosti díky větší propustnosti filtrační membrány. Naopak, nízkomolekulární látky jsou díky možnosti difůze lépe odstraňovány dialýzou.
Hemodiafiltrace
Hemodiafiltrace spojuje výhody obou předchozích metod. Je prováděna podobně jako hemofiltrace s vysokopropustnými membránami, v tomto případě však dialyzátorem protéká jak krev, tak dialyzační roztok. Množství filtrátu je při této metodě menší než u hemofiltrace, i tak musí být ale volum doplňován substitučním roztokem. Substituční roztoky jsou dostupné buď v komerčně dodávaných vacích, nebo jsou on-line připravovány přístrojem.
Kontinuální mimotělní eliminační metody
Kontinuální eliminační metody jsou indikovány u nemocných s akutním renálním selháním v kritickém stavu. Jsou aplikovány po dobu několika dní do reparace funkce ledvin nebo do stabilizace stavu pacienta, kdy je možno přejít na intermitentní metodu, nejčastěji hemodialýzu. Kontinuální metody využívají stejných fyzikálně chemických principů jak intermitentní metody. Nejčastěji využívané jsou tzv. kontinuální venovenózní hemofiltrace a kontinuální venovenózní hemodiafiltrace. Péče o tyto pacienty probíhá na anesteziologicko-resuscitačních odděleních nebo na specializovaných metabolických jednotkách intenzivní péče. Podrobnější specifikace těchto metod přesahuje rámec tohoto textu.
Cévní přístup k extrakorporálním metodám
Arteriovenózní spojka
Pro účinné očišťování krve mimotělními metodami je potřeba zajistit dostatečný minutový průtok krve dialyzátorem nebo hemofiltrem, který by měl činit zhruba 200 – 400 ml/min. K tomuto účelu se nejlépe hodí chirurgem vytvořená arteriovenózní spojka na nedominantní horní končetině. Nejčastěji je využíváno end-to-side napojení vena cephalica na arteria radialis na předloktí, lze rovněž využít podobného typu anastomosy vena cephalica na brachiální artérii v loketní jamce. Žilní část spojky se po několika týdnech dilatuje, její stěna se arterializuje a je dobře přístupná k opakovanému zavádění dialyzačních jehel a poskytuje adekvátní krevní průtok. V některých případech není možno využít vlastního cévního řečiště a k vytvoření spojky je potřeba zvolit umělohmotnou protézu.
Dialyzační katétr
Zavedení katétru je metodou volby pro krátkodobé zajištění dialyzačního přístupu u pacientů s akutním renálním selháním. Často je ale využíván i u pacientů před rozvojem jejich dialyzačních arteriovenózních zkratů nebo při jejich zániku jako dočasný přístup. K zajištění dostatečného průtoku krve jsou katétry zaváděny do velkých žil. K tomuto účelu se nejlépe hodí vnitřní jugulární žíla, nejlépe pravá, kdy katetr zavádíme přímo směrem k horní duté žíle. Méně vhodný přístup je cestou podklíčkové žíly, při kterém zahnutý průběh katetru více alteruje žilní stěnu v této oblasti a může být příčinou rozvoje pozdních stenóz výtokového žilního traktu. Vzácně lze využít i katetrizaci femorální žíly v případě, že je vyčerpán přístup ve výše uvedených oblastech nebo zde není katetrizace možná. Dialyzační katetr je v typickém případě dvouluminální, současně zajišťující přívod krve do mimotělního oběhu i návrat očištěné krve do oběhu pacienta.
Dialyzační a substituční roztoky
Dialyzační roztok je připravován z vodovodní vody (očištěné složitým procesem zakončeným reverzní osmózou) a dialyzačního koncentrátu. Výsledné složení dialyzačního roztoku závisí na požadavcích, které máme na substituci či odstranění látek u konkrétního pacienta, principiálně však upravujeme hlavně minerální složení krve a acidobazickou rovnováhu. Roztok tak obsahuje hlavní minerály a bikarbonát v podobné koncentraci, jaká je v extracelulární tekutině zdravého člověka, u diabetiků je přidávána ještě glukóza v prevenci hypoglykémie. V průběhu dialýzy pak můžeme částečně regulovat složení roztoku, rychlost jeho průtoku a případně teplotu.
Substituční roztok nahrazuje tekutinu, odfiltrovanou v průběhu hemofiltrace nebo hemodiafiltrace. Lze využít komerčně dostupné vaky nebo opět on-line přípravu roztoku. Jeho složení se blíží fyziologickým plasmatickým koncentracím, s výjimkou látek, které chceme odstranit (urea, kreatinin).
Indikace extrakorporálních metod
Akutní renální selhání
Při stanovení vhodného termínu zahájení akutní dialýzy je třeba zohlednit celou řadu okolností, především vyvolávající příčinu selhání, dynamiku onemocnění, přítomné komorbidity a stav pacienta. Jednoznačnou indikací k okamžitému zahájení dialýzy jsou:
- Příznaky urémie (perikarditida, encefalopatie, koagulopatie, nauzea, vomitus);
- Refrakterní převodnění;
- Oligurie > 3 dny;
- Intoxikace dialyzovatelnou látkou;
- Hypertermie.
Z laboratorních hodnot lze pomocně využít tato kritéria:
- Hyperkalémie > 6,5 mmol/l při selhání konzervativních léčebných opatření;
- pH < 7,1;
- Urea v séru > 30 mmol/l;
- Kreatinin v séru > 500 μmol/l;
- Těžká dysnatrémie < 115 – 120 nebo > 155 – 160 mmol/l;
- Hyperkalcémie > 4,5 mmol/l;
- Hyperurikémie > 1000 μmol/l.
Chronické renální selhání
Zahájení chronického dialyzačního programu je podobně jako v případě akutní hemodialýzy ovlivněno klinickým a laboratorním stavem pacienta. Mělo by k němu být přistoupeno u dobře se cítícího pacienta bez uremických příznaků, s připravenou arterivenózní spojkou (pokud nebyla indikována peritoneální dialýza). Při správném načasování zahájení chronického programu využíváme tedy hlavně laboratorní parametry hodnotící úroveň reziduální renální funkce, především glomerulární filtraci. Její hodnota pod 10 ml/minutu (0,17 ml/s) je obvykle akceptována jako hranice zahájení náhrady funkce ledvin.
Nejčastější komplikace extrakorporálních metod
Akutní komplikace
K nejčastějším akutním komplikacím patří krvácení při uremické poruše hemostázy někdy podpořené antikoagulační terapií při mimotělním oběhu. Většinou se projevuje jako nevýznamná komplikace s krvácením z vpichů po dialyzačních jehlách, může však jít i o život ohrožující krvácení. Další komplikací bývá naopak tendence ke srážení krve v dialyzátoru, často související s hypotenzí pacienta a nízkými krevními průtoky dialyzátorem. Komplikací výkonu může být i hypertenzní reakce, dále křeče a zvracení. Život ohrožující komplikaci představuje anafylaktoidní reakce na užitý dialyzátor a dysekvilibrační syndrom (příliš účinná první dialýza s rychlou změnou koncentrace solutů v mozkomíšním moku s křečemi, bezvědomím a otokem mozku). Závažnou komplikací může být i vniknutí vzduchu do mimotělního oběhu s následnou vzduchovou embolií.
Chronické komplikace
K nejčastějším chronickým komplikacím patří progresivní ateroskleróza zřejmě související s chronickým zánětem způsobeným opakovaným kontaktem krve s dialyzační membránou s aktivací trombocytů a koagulačních faktorů. Dále často pozorujeme poruchu imunity se sníženou imunokompetencí celulární složky imunity. Můžeme se setkat i s malnutricí pacientů související z části s uvedenou reakcí organismu na bioinkompatibilní dialyzační membrány, z části se ztrátami některých živin do dialyzačního roztoku. Důležitou komplikaci pak představují často se opakující problémy se zajištěním cévního přístupu u dlouhodobě (léta) dialýzovaného pacienta.
Peritoneální dialýza
Princip a nejčastější metody
Peritoneální dialýza je na rozdíl od výše popsaných eliminačních procedur intrakorporální metoda, při které je jako dialyzační membrána využívána pobřišnice. Výměna solutů probíhá mezi kapilárami pobřišnice a dialyzačním roztokem napuštěným do dutiny břišní. Proces probíhá v závislosti na koncentračním gradientu těchto látek a propustnosti membrány, pohyb vody je pak ovlivněn rozdílným osmotickým gradientem mezi plasmou a dialyzačním roztokem. Jako osmoticky aktivní látky v dialyzačním roztoku se dnes užívají hlavně polymery glukózy a některé aminokyseliny.
Nejčastější formou peritoneální dialýzy je tzv. kontinuální ambulantní peritoneální dialýza (CAPD), při které se čtyřikrát denně provede napuštění a vypuštění dialyzačního roztoku do dutiny břišní, noční výměna trvá 8–10 hodin. Kromě asi 20 minut, kdy dochází k napouštění a vypouštění roztoku, je dialyzační roztok nepřetržitě v kontaktu s kapilární sítí peritonea (kontinuální). Velkou výhodou této metody je, že je prováděna v domácích podmínkách (ambulantní) a lze ji v některých případech zajistit pomocí přístroje, který provádí výměny v noci automaticky bez přispění pacienta (automatizovaná peritoneální dialýza, APD).
Zavedení peritoneálního dialyzačního katetru
Zajištění trvalého přístupu do peritoneální dutiny je základní podmínkou provádění této eliminační metody. Nejčastěji je k tomuto účelu využívan chirurgickou cestou přes břišní stěnu zavedený silikonový Tenckhoffův peritoenální katetr, který je svým intraperitoneálním koncem situován do nejhlubšího místa malé pánve. Po dvou až třech týdnech je katetr vhojen do břišní stěny a je možno začít s výkony.
Dialyzační roztok
Peritoneální dialyzační roztoky mají podobné složení jako dialyzační roztok určený pro hemodialýzu, navíc obsahují osmoticky účinnou látku, zajišťující transport vody přes peritoneální membránu.
Indikace peritoneální dialýzy
Akutní renální selhání
V některých případech je u dospělých možno indikovat peritoneální dialýzu i v terapii akutního renálního selhání, dialyzační katetr lze v takovém případě zavést i punkční cestou. Obvykle je však v této indikaci využívána extrakorporální metoda. Indikační kritéria k zahájení akutní dialýzy jsou obdobná jako u extrakorporálních metod.
Chronické renální selhání
Chronický dialyzační program zahajujeme po vhojení peritoneálního katetru opět na základě identických kritérií užívaných u extrakorporálních eliminačních metod.
Výhody metody oproti extrakorporální dialýze
- Hemodynamická stabilita u pacientů s kardiovaskulárními chorobami;
- Nezávislost na nemocnici;
- Eliminace napichování cévního přístupu;
- Bez krevních ztrát oproti extrakorporální metodě.
Kontraindikace peritoneální dialýzy
Absolutní
- Rozsáhlé srůsty v dutině břišní po nitrobřišních operacích (omezený kontakt dialyzačního roztoku s peritoneem);
- Karcinomatóza peritonea;
- Aktivní zánětlivá onemocnění dutiny břišní.
Relativní
- Kolostomie a nefrostomie;
- Polycystické ledviny;
- Porucha motoriky a vizu pacienta;
- Nespolupracující pacient.
Nejčastější komplikace peritoneální dialýzy
Infekční komplikace
- Infekce výstupu peritoneálního katetru či tunelová infekce v břišní stěně;
- Peritonitida při nedodržení aseptické manipulace.
Neinfekční komplikace
- Poruchy funkce peritoneálního katetru (dislokace, zalomení);
- Únik dialyzačního roztoku kolem katetru, do skrota či pohrudniční dutiny;
- Břišní kýla v důsledku zvýšeného nitrobřišního tlaku po instalaci roztoku;
- Porucha ultrafiltrační schopnosti peritonea.
Transplantace ledviny
Transplantace ledviny představuje preferovanou metodu náhrady funkce ledvin u indikovaných pacientů. Tito pacienti jsou v naprosté většině případů chronicky dialyzováni a zařazeni do čekací listiny k transplantaci. Pokud je nalezen vhodný orgán ať už od živého nebo zemřelého dárce, je možno provést transplantaci již v období těsně před definitivním selháním funkce ledvin (obr. 1). Nezbytnou podmínkou pro to, aby byl orgán akceptován imunitním systémem příjemce, je základní imunologická shoda.
Obr. 1. Možnosti léčby terminální fáze onemocnění ledvin.
Kontraindikace zařazení nemocného k transplantaci ledviny
- Generalizované nádorové onemocnění;
- Chronická, neefektivně léčená nebo nevyléčitelná infekce;
- Závažné interní onemocnění;
- Nespolupracující nemocný;
- Preference dialýzy před transplantací.
Operační výkon
Většinou je ledvinný štěp uložen v pravé jámě kyčelní extraperitoneálně, může být ale implantován i do levé jámy kyčelní. K anastomóze renálních cév se převážně využívá techniky end-to-side napojení na externí ilickou arterii a žílu, v některých případech na společný ilický svazek. Implantace močovodu do stěny močového měchýře bývá doplněna antirefluxní plastikou. Štěp zpravidla leží přímo pod chirurgickou incizí a lze jej vyhmatat.
Potransplantační komplikace
Pooperační komplikace
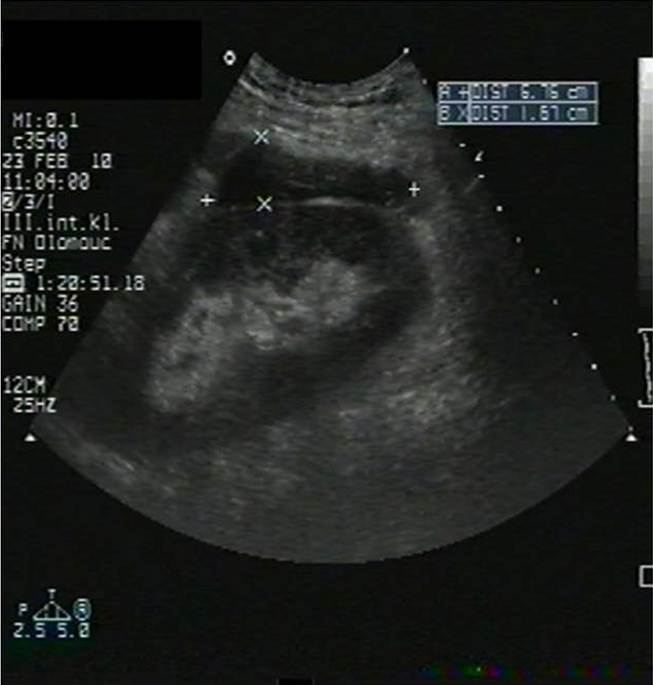
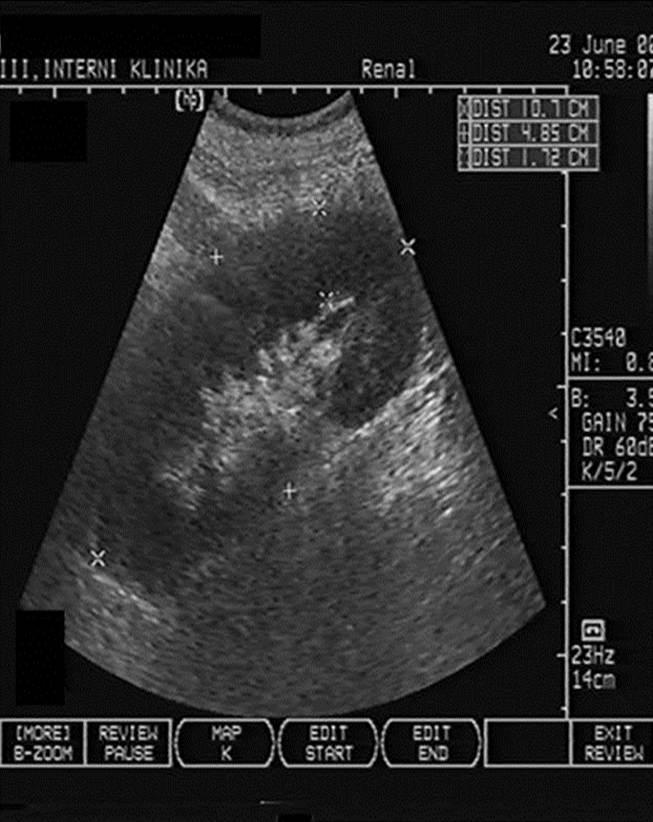
- Pooperační hematom v okolí štěpu (obr. 2a);
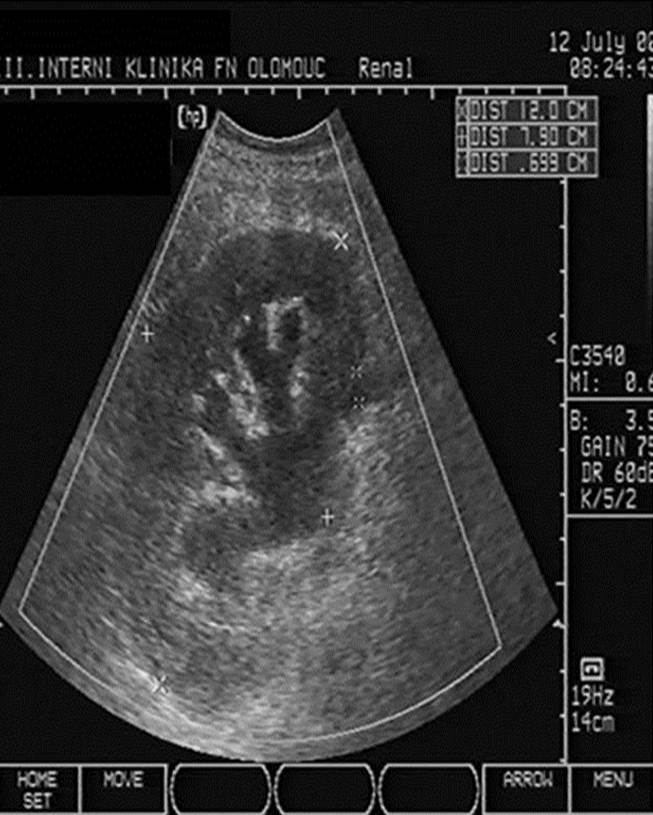
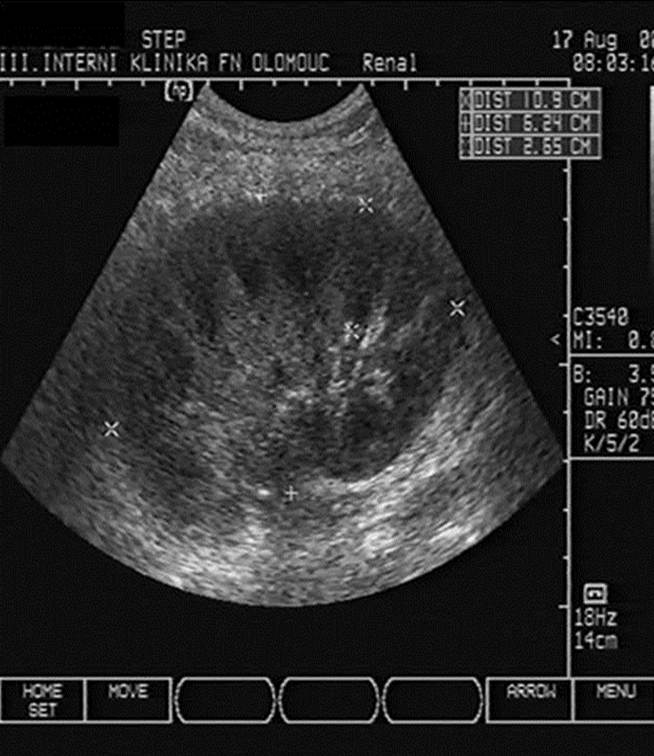
- Dilatace dutého systému ledviny při obstrukci močových cest (obr. 2b);
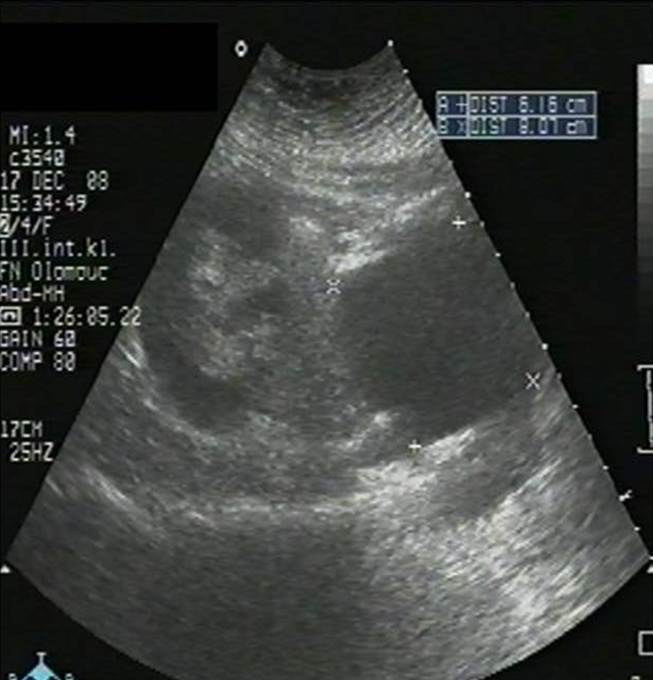
- Lymfokéla při nahromadění lymfy ze štěpu či okolních tkání (obr. 2c);
- Infekční komplikace rány;
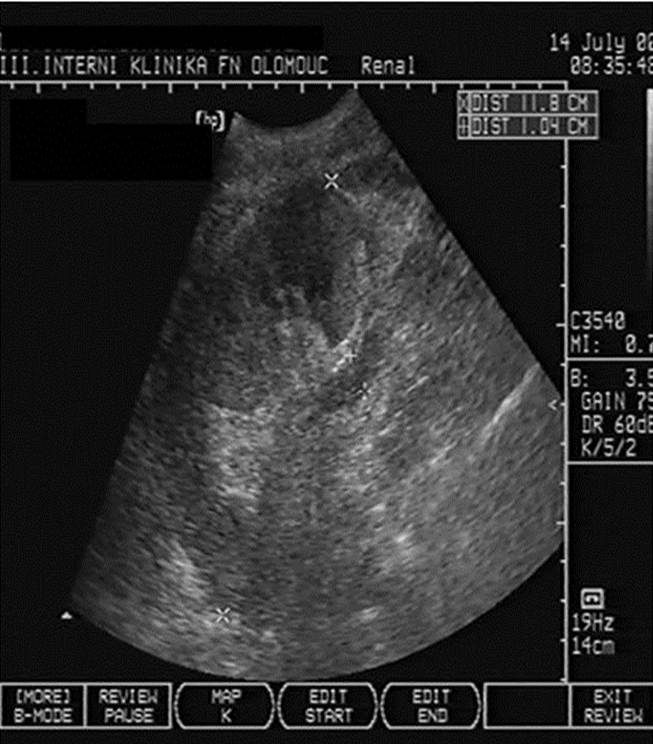
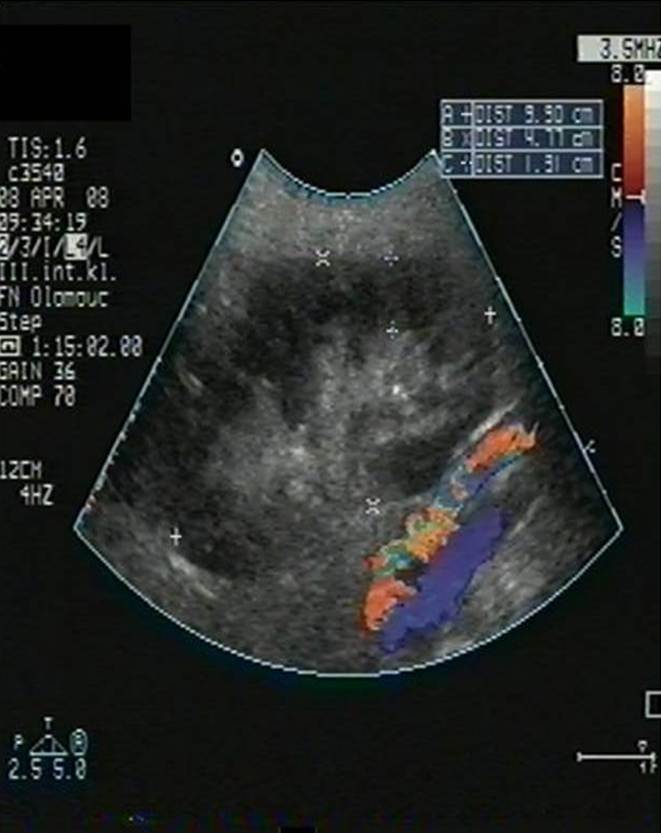
- Trombóza renální žíly (obr. 3a) či tepny (obr. 3b).
Obr. 2a-c. Pooperační komplikace. Obr. 2a. Čerstvý pooperační hematom nad transplantovanou ledvinou. Nad dolní poílovinou transplantované ledviny lze v podélném řezu vidět hypoechogenní kolekci tekutiny velikosti asi 67 x 16 mm. Pacient 7. den po transplantaci. Obr. 2b. Hydronefróza a hydroureter transplantované ledviny při močové píštěli a urinomu. Na podélném řezu transplantovanou ledvinou je patrná dilatace pánvičky, kalichů a kalíšků a rovněž proximální části ureteru na téměř 7 mm. Příčinou obstrukce je juxtavezikulární útlak močovdu urinomem (není zobrazen) při močové píštěli. Obr. 2c. Lymfokéla poblíž hilu transplantované ledviny. Příčný řez štěpem. V blízkosti hilu se nachází zadržená tekutina vel. asi 61 x 90 mm odpovídající nahromaděné lymfě.
Obr. 3a,b. Obr. 3a. Akutní trombóza renální žíly transplatnované ledviny. V oblasti hilu transplatnované ledviny vidíme renální vénu dilatovanou na 10 mm vyplněnou čerstvým hypoechogenním trombem. Obr. 3b. Akutní uzávěr renální artérie transplantované ledviny. Štěp s podélným rozměrem při dolní hranici normy a s normální tloušťkou parenchymu. V CDI zobrazení (color dopler imaging) vidíme v blízkosti hilu a dolního pólu štěpu probíhající hlavní ilický svazek – arteria a vena iliaca communis. Nelze však zachytit renální artérii, ani její větve a prokrvení parenchymu.
Porucha funkce štěpu
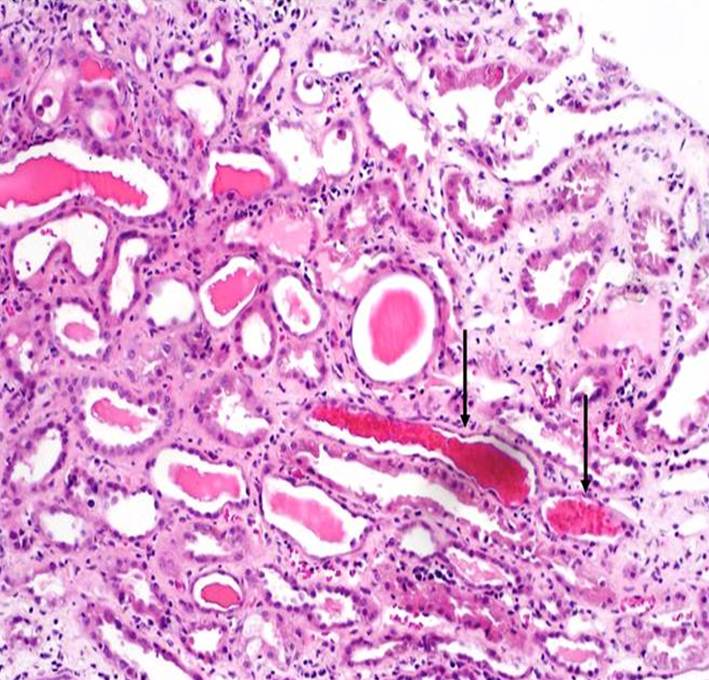
Akutní tubulární nekróza
Jde o ischemické poškození ledvinného štěpu (obr. 4), ke kterému došlo v období mezi vynětím ledviny z organizmu dárce a implantací orgánu do těla příjemce. Projevuje se oligurií až anurií bezprostředně po transplantaci. Diagnostika je založena na klinickém obraze nedostatečné tvorby moči při vyloučení cévního uzávěru a obstrukce močových cest. Pacienta je nutno po několik dní podpůrně dialyzovat, poté většinou dojde k nástupu funkce štěpu.
Obr. 4. Akutní tubulární nekróza – histologický obraz. Na snímku jsou v některých tubuolech zachyceny hemosiderinové válce (šipky) a jednotlivé deskvamované epitelie (horní třetina snímku). Edém intersticia je mírný s nevýraznou lymfocytární infiltrací. Barvení HE, zvětšení 100x.
Akutní rejekce
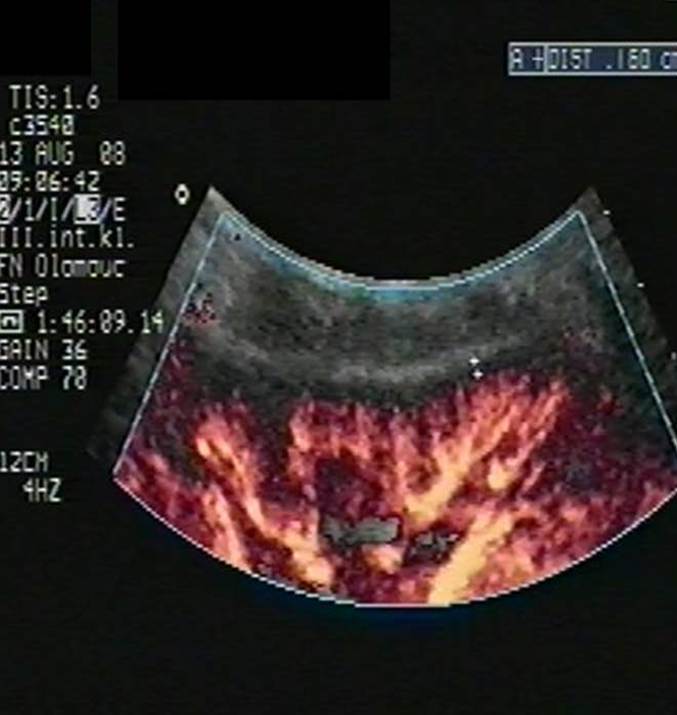
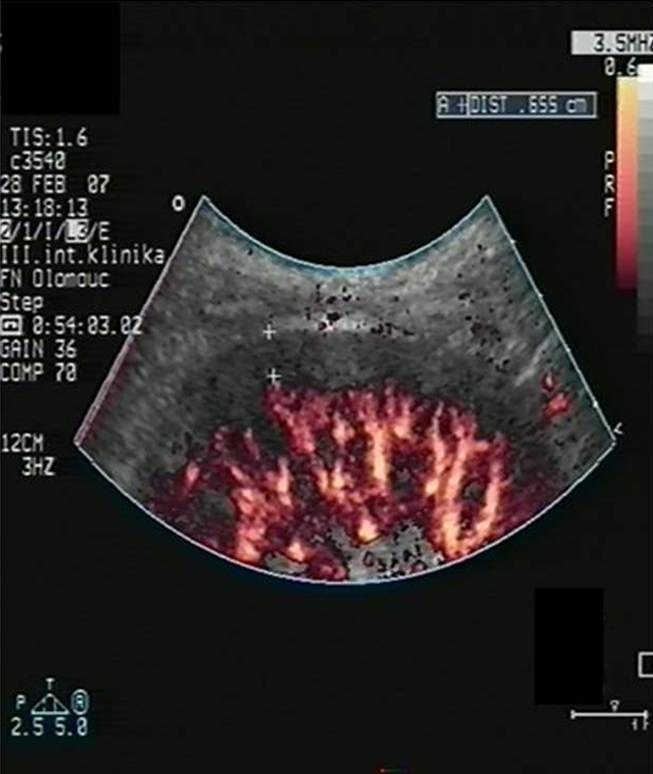
Akutní rejekce se objevuje nejdříve okolo 5. dne po transplantaci a poté kdykoli v potransplantačním průběhu, nejčastěji však v prvním roce po transplantaci. Jde o obrannou imunitní reakci organismu vůči cizorodým (převážně HLA) antigenům transplantované ledviny. Typickým klinickým projevem je vzestup sérového kreatininu oproti nejlepším dosaženým hodnotám, vzácněji dochází k poklesu množství moči či celkovým zánětlivým projevům. Diagnostika je založena kromě klinického průběhu na ultrazvukovém a bioptickém vyšetření štěpu. Typickým ultrazvukovým projevem pozorovaným při akutní rejekci je edém parenchymu štěpu (obr. 5a,b) a redukce prokrvení periferních parenchymových částí (obr. 6a,b).
Obr. 5a,b. Obr. 5a. Normální ultrazvukový obraz transplantované ledviny – celkový obraz. Normální podélný i příčný rozměr štěpu, hladká kontura povrchu, normální echogenita a rovnoměrná fyziologická tloušťka parrenchymu. Ostrá a dobře zřetelná hranice parenchym-střední echokomplex. Kalichopánvičkový systém bez dilatace a bez známek nefrolitiázy. Ledvina bez patologického nálezu. Obr. 5b. Edém transplantované ledviny při akutní rejekci – celkový obraz. V porovnání s obr. 5a je ledvina zvětšená a zakulacená. Je přítomna hyperechogenita a výrazné ztluštění parenchymu, zřetelný řetězec edematózních dřeňových pyramid a setřelá kortiko-medulární hranice při hypoechogenitě centrálního sinu.
Obr. 6a,b. Obr. 6a. Dobré prokrvení periférie parenchymu štěpu na úrovni interlobulárních artérií (ILLA) v PDI zobrazení. ILLA dosahují téměř až ke kapsule štěpu. Velmi dobře, stabilizovaně fungující štěp bez známek rejekčního postižení. Obr. 6b. Manifestní akutní celulární rejekce (stupeň I A) transplantované ledviny. Při porovnání s obr. 6a vidíme v PDI zobrazení na úrovni ILLa zřetelnou redukci prokrvení periférie parenchymu na 4 – 5 mm.
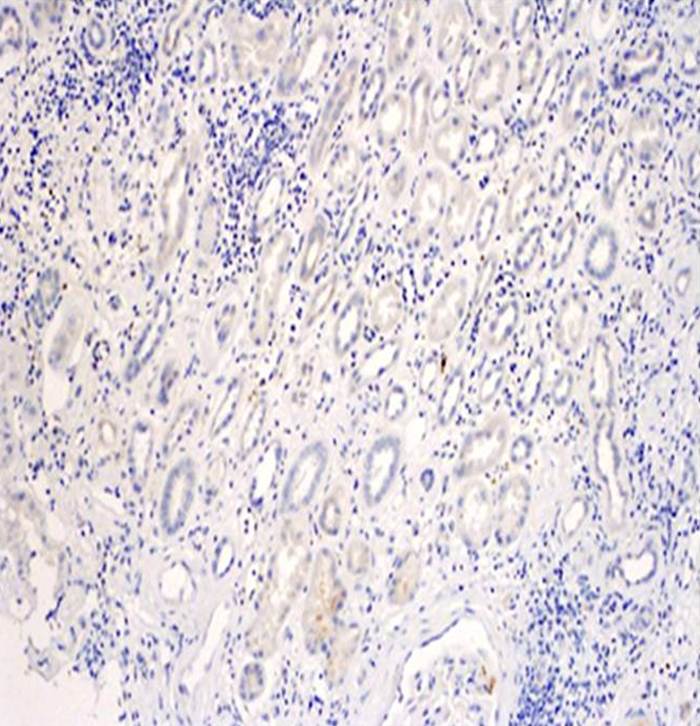
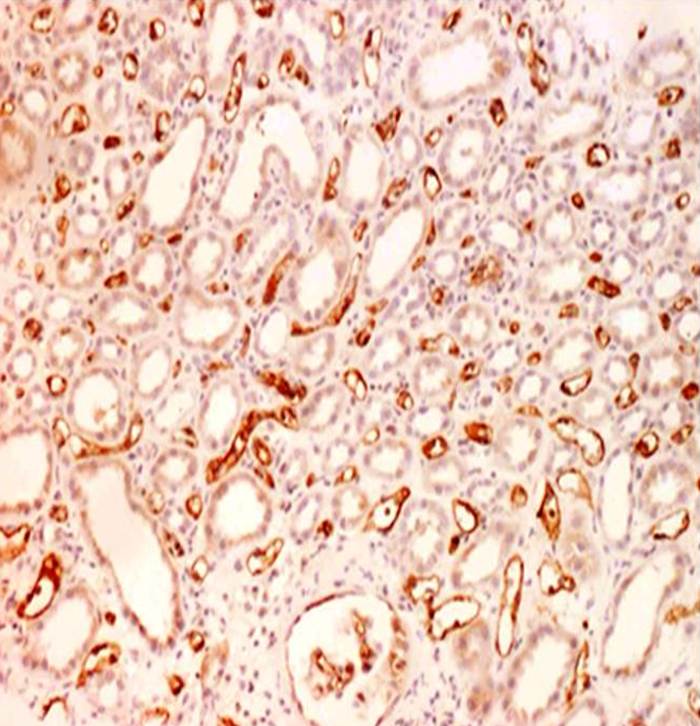
Někdy lze pozorovat i vzestup vaskulární rezistence. Bioptické vyšetření poskytne u těchto pacientů přesnou klasifikaci typu rejekčního postižení (obr. 7a – buňkami zprostředkovaná rejekce, obr. 7b – protilátkami zprostředkovaná rejekce) a odhalí i některé skryté (subklinické) formy rejekčního postižení štěpu. Léčebným opatřením je aplikace antirejekční terapie v závislosti na typu rejekčního postižení (vysoké intravenózní dávky steroidů, podání protilátky proti lymfocytům, intravenózní imunoglobuliny či opakované plasmaferézy).
Obr. 7a,b. Obr. 7a. Rejekce zprostředkovaná T-buňkami. Kůra ledviny s difúzním intersticiálním edémem a infiltrátem, který je tvořen drobnými a aktivovanými lymfocyty. Negativita C 4d v imunohistochemickém vyšetření svědčí proti přítomnosti aktivace komplementu a rejekce zprostředkované protilátkami. Zvětšení 100x. Obr. 7b. Rejekce zprostředkovaná protilátkami (humorální rejekce). Pozitivita C 4d všech peritubulárních struktur (zbarveny hnědě) v imunohistochemickém vyšetření. Vedlejším nálezem je akutní tubulární nekróza. Zvětšení 200x.
Nefrotoxicita kalcineurinových inhibitorů
Kalcineurinové inhibitory (cyklosporin a takrolimus) jsou základními imunosupresivy, které jsou součástí většiny imunosupresivních protokolů po transplantaci ledviny. Jedním z jejich nežádoucích účinků je však nefrotoxické působení, které může být příčinou akutního či chronického zhoršení funkce štěpu. Diagnostika je někdy možná na podkladě záchytu zvýšených krevních hladin těchto imunosupresiv se současným zlepšením funkce ledvinného štěpu po snížení jejich dávky, nezřídka je ale nutno přistoupit k bioptickému vyšetření (Obr. 8). Po verifikaci diagnózy následuje další úprava dávkování nebo změna za jinou skupinu imunosupresiv.
Obr. 8. Nefrotoxicita kalcineurinových inhibitorů – chronické změny. Typický obraz proužkovité kortikální nekrózy (šipky). Barvení modrý trichrom, zvětšení 40x.
V časném potransplantačním období se nejčastěji setkáváme s infekcí operační rány, močovou infekcí nebo bakteriální pneumonií. V prvním půl roce po transplantaci je častější výskyt infekcí obvykle pozorovaných u imunokompromitovaných pacientů – herpetické infekce včetně cytomegalovirové infekce, mykotické infekce, vzácněji Pneumocystová infekce. Nejčastěji se ale setkáváme s infekcí močových a dýchacích cest. V pozdějším období kdy je dávkování imunosupresiv již nižší než v potransplantačním období, je výskyt infekčních komplikací podobný jako u ostatní populace, dominují infekce močových cest a dýchacích cest.
Nádorové komplikace
V delším odstupu od transplantace je výskyt nádorového onemocnění u pacientů po transplantaci ledviny průměrně tři krát vyšší oproti ostatní populaci. Nejčastěji se setkáváme s nádory kůže, potransplantační lymfoproliferací včetně lymfomů, častější jsou rovněž nádory původních ledvin a urotelu. U těchto pacientů je nutno v pravidelných ročních intervalech provádět základní onkologický skríning.
Imunosuprese po transplantaci ledviny
Indukční imunosuprese
Jejím cílem je v bezprostředním potransplantačním období zajistit toleranci organismu příjemce vůči cizorodým antigenům dárce a zabránit nebo oddálit vznik akutní rejekce. Podáváme vysoké dávky injekčních steroidů nebo některé druhy antilymfocytárních a antireceptorových protilátek.
Udržovací imunosuprese
Navazuje na indukční imunosupresi, je méně intenzivní a je cílená na profylaxi akutní rejekce. Sestává většinou z kombinace tří imunosupresivních léků – kalcineurinového inhibitoru (cyklosporin nebo takrolimus), antimetabolitu (mykofenolát mofetil nebo mykofenolát sodný) a steroidů.
Antirejekční terapie
Spočívá v parenterální aplikaci vysokých dávek steroidů nebo protilátek proti lymfocytům v případě buňkami zprostředkované akutní rejekce nebo v podání intravenózních imunoglobulinů a sérii plasmaferéz v případě protilátkami zprostředkované rejekce.
Zpracoval: MUDr. Karel Krejčí, PhD., 3. Interní klinika – nefrologická LF UP a FN Olomouc
Article printed from Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF a FZV UP Olomouc: http://pfyziolklin.upol.cz
URL to article: http://pfyziolklin.upol.cz/?p=7371
URLs in this post:
[1] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-1.jpg
[2] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-2_.jpg
[3] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-3_.jpg
[4] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-4_.jpg
[5] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-5_.jpg
[6] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-6_.jpg
[7] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-7_.jpg
[8] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-8_.jpg
[9] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-9_.jpg
[10] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-10_.jpg
[11] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-11_.jpg
[12] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-12_.jpg
[13] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-13_.jpg
[14] Image: http://pfyziolklin.upol.cz/wp-content/uploads/2013/01/Obr-14_.jpg
Click here to print.