Úvod
Autor: Ondřej Veselý
Pracoviště: Ústav patologické fyziologie LF UP Olomouc, Dětská endokrinologická ambulance Svitavské nemocnice a.s.
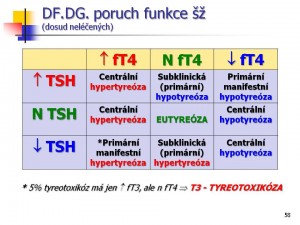
Hypertyreóza je zvýšená funkce štítné žlázy způsobená buď endogenní nadprodukcí hormonů štítné žlázy tj. tyroxinu a trijodthyroninu nebo exogenním přísunem/předávkováním léků používaných v léčbě hypotyreózy tj. především levothyroxinu. Příčina zvýšené endogenní tvorby T-hormonů může být buď vzácně na úrovní hypofýzy v podobě adenomu produkujícího TSH (centrální hypertyreóza) nebo na úrovni samotné štítné žlázy (periferní hypertyreóza). Příčina periferní hypertyreózy může být autoimunní , kam počítáme na prvním místě Graves-Basedowovu tyreotoxikózu způsobenou tvorbou protilátek proti TSH receptoru na tyreocytech (tzv. TRAK protilátky), méně často hyperfunkční fázi Hashimotovy chronické lymfocytární autoimunní tyreoiditidy, která jinak ve finále spěje do hypofunkce. Dále příčina autonomní, kdy se v parenchymu štítné žlázy vytvoří jeden (toxický adenom) nebo více uzlů (polynodózní toxická struma) zvýšeně produkujících T4 a T3 i přes supresi TSH (fyziologicky zvýšení hladiny periferních hormonů štítné žlázy vede ke snížení tvorby TRH hypothalamem a TSH hypofýzou a tím i zpětnovazebně ke snížení produkce T4/T3, u automnoních uzlů dochází ke ztrátě této regulace) . Příčinou může být i rychlá destrukce tyreocytů s uvolněním zásob T-hormonů při de Quervainově subakutní tyreoiditidě. Vzácně se mohou hormony štítné žlázy zvýšeně tvořit v tyreoidální tkání v rámci teratomu vaječníků (struma ovarii) nebo v samotné štítné žláze vlivem nadbytku hCG (podobnost molekuly hCG a TSH) u choriokarcinomu (zhoubný nádor z trofoblastu). Fyziologicky se hCG tvoří také v těhotenství a zvyšuje tvorbu tyreoidálních hormonů, což je v graviditě žádoucí pro potřeby vyvíjejícího se plodu, ale obvykle to nevede k projevům hyperfunkce. Příznaky hypertyreózy jsou všeobecně známé, zahrnují změny (a) kožní: teplá, opocená kůže daná zvýšeným prokrvením kůže jako následkem hypermetabolismu , vlasy jsou jemné, řídké, nehty lomivé, rýhované, vzácně i pretibiální myxedém (častěji se vyskytující u hypotyreóz). (b) svalové: snížení svalové síly, zvýšená svalová únavnost, zvýšené šlachově-svalové reflexy. (c) metabolické: zvýšená produkce tepla vede ke snížené snášenlivosti horkého prostředí a letních teplot, dále bývá přítomna hyperfagie, zvýšená motilita GIT s častějšími stolicemi, úbytek na váze a také osteoporóza, zvýšený metabolický obrat je také příčinou hypoalbuminemie, v lipidogramu dochází k poklesu celkového, LDL i HDL-cholesterolu, následkem zvýšené potřeby Mg2+ se vyvíjí hypomagnesemie, následkem zvýšené aktivity Na+/K+ ATPázy se může vyvinout hypokalemie. (d) nervové: neklid, nervozita, nesoustředěnost, nespavost až projevy manické či připomínající delirium, ale pozor u starých lidí může být projevem hypertyreózy i apatie. (e) oběhové které jsou nejzávažnější, vlivem zvýšené citlivosti myokardu na katecholaminy vzniká tachykardie a různé srdeční arytmie, cirkulace je následkem zvýšených metabolických nároků orgánů na dodávku živin a kyslíku hyperkinetická, se sníženým periferním odporem, což vede k poklesu diastolického tlaku, a se zvýšeným minutovým srdečním výdejem, což vede ke vzestupu systolického tlaku, život pacienta pak je ohrožen jak vznikem maligních poruch srdečního rytmu tak srdečním selháním. (f) oční: u pacientů s Graves-Basedowskou tyreotoxikózou se v 30 – 60% případů vyvíjí tzv. endokrinní orbitipatie (zánětlivé prosáknutí okohybných svalů a retrobulbárního vaziva) vedoucí protruzi očního bulbu (exoftalmus), postižení okohybných svalů s rozvojem diplopie (dvojité vidění), která významně snižuje kvalitu života a ve finále hrozba ztráty zraku při ulceracích rohovky a útlaku optického nervu zánětlivě expandujícím obsahem očnice. Léčba hypertyreózy závisí na příčině. V případě G-B tyreotoxikózy se iniciálně podávají tyreostatika snižující tvorbu hormonů štítné žlázy, což u menší části pacientů vede k trvalé remisi, ale u větší části dochází k recidivě a je nutná léčba operativní tj. totální tyreoidektomie či léčba radiojodem.Toxický adenom a polynodózní toxická struma má jediné účinné léčebné opatření a to její operativní odstranění. Součástí léčby je i léčba symptomatická a to zejména cílená na oběhové potíže (podávání beta-blokátorů) .
Fibrilace síní (FiS) postihuje 1 – 2% populace a je tak nejčastější setrvalou srdeční arytmií a výskyt stoupá s věkem (degenerativní změny myokardu s úbytkem kardiomyocytů a přibýváním vaziva). Patofyziologicky patří mezi supraventrikulární arytmie vznikající na podkladě re-entry fenomenu případně ektopické aktivity. Na EKG záznamu chybí vlna P, jsou přítomny drobné fibrilační vlnky o vysoké frekvenci (nad 300/min) s nepravidelným převodem na komory, komory tepou s frekvencí 100-150/min, komplexy bývají obvykle normální morfologie, „štíhlé“, ale pokud se zvýší převod na komory, jsou QRS aberované. Mezi příčiny či rizikové faktory vzniku FiS kromě věku patří ICHS, srdeční selhání, kardiomyopatie, chlopenní vady, arteriální hypertenze, obezita, cukrovka, syndrom spánkové apnoe, CHOPN, chronická onemocnění ledvin, genetické predispozice a v neposlední řadě onemocnění štítné žlázy.FiS může vzniknout v terénu strukturálně změněného myokardu síní i myokardu zdánlivě nepostiženého. Samotná FiS pak postupně vede k anatomicko-histologickým změnám myokardu síní a to v přímé úměře k délce trvání této arytmie. Výsledkem je tak uzavření bludného kruhu a „fibrilací síní indukovaná remodelace myokardu“. Hemodynamickým následkem FiS je snížené plnění komor pro ztrátu koordinovaného stahu síní. Chybění příspěvku síní k plnění komor vede k poklesu systolického volumu (SV) asi o 15%, což představuje problém pro tu část pacientů s FiS, kteří mají SV již snížený v důsledku základního srdečního onemocnění. FiS tedy může být jak následkem, tak příčinou srdečního selhání. Fibrilace síní je dále spojená se zvýšeným rizikem trombembolie, což se vysvětluje stagnací krve v „oušcích“ síní (hlavně levé) , vznikem nástěnných trombů a následně jejich embolizací , především do velkého oběhu s rizikem vzniku centrální mozkové příhody (CMP). Pacienti s FiS tak mají asi dvakrát vyšší mortalitu než jejich vrstevníci bez FiS. Relativní riziko CMP je zvýšeno asi pětinásobně. Zhoršená je i kvalita života následkem zhoršení fyzické zdatnosti, poklesem kognitivních funkcí (cerebrální mikroinfarkty), zvýšenou potřebou hospitalizace. Klinicky mohou být pacienti s FiS asymptomatičtí nebo mají příznaky závisející na trvání FiS, nepravidelnosti a frekvenci komor, přítomnosti jiného srdečního onemocnění a individuální vnímavosti pacientů. Mezi potíže spojené s FiS patří palpitace, stenokardie, dušnost, vertigo, snížená fyzická i mentální kondice, ale FiS se také může manifestovat CMP či srdečním selháním. Léčba fibrilace síní zahrnuje jednak farmakoterapii a za druhé postupy nefarmakologické. Farmakoterapie cílí jak na léčbu onemocnění predisponujícího ke vzniku FiS, na prevenci trombembolie podáváním leků s antitrombotickým či antikoagulačním efektem , tak na vlastní FiS pomocí antiarytmik, aby se dosáhlo obnovy a udržení sinusového rytmu a optimalizovala se srdeční frekvence. Nefarmakologické postupy zahrnují elektrokardioverzi či naopak kardiostimulaci tam kde je FiS spojená s pomalou, velmi nepravidelnou akcí komor nebo jsou přítomny AV blokády, implantace síňových kardioverterů, katetrizační ablace AV uzlu.
Kazuistika
Anamnéza: 69-letá žena odeslána praktickým lékařem na oddělení urgentního příjmu pro měsíc trvající potíže: zadýchávání při chůzi a do schodů, palpitace při zátěži i v klidu, bez bolestí na hrudi, bez kašle, teplot, zahlenění., bez synkopy. Doposud neužívala trvale žádné léky, není dispenzarizována s žádným chronickým onemocněním, nebyla hospitalizována, nekouří, alkohol příležitostně.
Ve vstupním somatickém nálezu nápadná tachykardie 160/min, nepravidelnost pulzu a hmatná štítná žláza. Plíce poslechově se sklípkovým dýcháním, bez vedlejších dechových fenomenů, srdeční ozvy ohraničené, bez šelest, krční žíly bez kongesce, břicho bez patologického nálezu, dolní končetiny bez otoků, TK 140/80 mmHg, dechová frekvence 16/min, TT 36,6stC, spO2 94%.
Na EKG záznamu obraz fibrilace síní s frekvencí komor 180/min, QRS 0,08, Qr III, ST izoel, T pozitivní. Na RTG S+P obě plíce rozvinuté, plicní parenchym bez přesvědčivých ložisek, infiltrací. Kresba cévní akcentovaná až překrvení v malém oběhu. Bránice hladká, zevní úhly minimálně otupeny, pleurální změny bazálně vlevo. Srdeční stín rozšířen. Proveden základní laboratorní screening: krevní obraz, urea, kteatinin, ALT, AST, ALP, GMT, bilirubin, Na, K, Cl, CRP vše norma. Patologické výsledky: TSH pod 0,0004 mIU/L (n 0,35-4,94), fT4 52,5 pmol/L (n 9,1-19,1), glykemie 6,4 mmol/L (n do 5,6), BNP 3036 ng/L (n do 125).
Podán bolusově blokátor vápníkového kanálu (verapamil), kličkové diuretikum (furosemid) do infuze a subkutánně nízkomolekulární heparin (LWMH, fraxiparin).S pracovní diagnosou hypertyreóza s tachyfibrilací síní a rychlou komorovou odpovědí (170-180/min) odeslána k přijetí, došetření a nastavení léčby na interní kliniku.
Zde umístěna na jednotku intenzivní péče (JIP), zahájena léčba betablokátorem (bisoprolol) a tyreostatikem (thiamazol). Na této terapii dosaženo částečné korekce komorové odpovědi na 130-140/min, byla oběhově stabilní, přeložena na standartní oddělení.
Echokardiograficky srdeční oddíly nezvětšeny, levá komora bez hypertrofie, globální ejekční frakce snížená na 40-55%, mitrální regurgitace III.st., aortální regurgitace II.stupně, trikuspidální regurgitace II.stupně, známky lehké až středně těžké plicní hypertenze. Doplněno laboratorní vyšetření , z výsledků vybíráme: TGAb 18,3 kU/l (n do 4,1), TPOAb 1485,8 kU/l (n do 1,5), TRAK nad 40,0 U/L (n do 1,5), celkový cholesterol 1,92 mmol/L (n 2,9-5,0), HDL-C 0,66 mmol/L (n 1,2-2,7), LDL-C 0,84 mmol/L (n 1,2-3,0), TAG 0,93 mmol/L (0,45-1,7), S-Mg 0,68 mmol/L (n 0,8-0,94), celková bílkovina 52,3 g/L (n 65-85), albumin 29,5 g/L (n 35-52). Sonografie štítné žlázy:pravý lalok je 53x22x16mm, objem10ml, levý lalok je 58x25x24 mm, objem 18ml, dolní pól zapadá mírně retrosternálně, istmus šíře 14mm, struktura obou laloků je nehomogenní, zhrubělá, smíšené echogenity, bilaterálně polynodózní přestavba, difuzně zvýšeně vaskularizovaná. Bilaterálně solidní, převážně hyperchogenní nody, místy s drobnými hypoechogenními okrsky, s „halo“ lemy, vel. 5-15mm. Největší nodus v istmu 15x12x10 mm objem 0,9ml. Ve střední části pravého laloku navíc 1 solidní nodus, s kalcifikacemi ve stěně, velikost 12x10x10mm, objem 0,6ml, v dolní části levého laloku je velký solidní nodus zhrubělé struktury, převážně hyperechogenní, vel. 28x26x21mm, objem 8ml, difuzně zvýšené vaskularizovaný. Současně provedena biopsie tenkou jehlou (FNAB) z velkého uzlu v LL a z uzlu s kalcifikací v PL, v obou případech s nálezem degenerativních změn bez přítomnosti suspektních buněk (Bethesda II). Scintigrafie štítné žlázy hyperfunkční difúzní struma s vícečetnými mírně hypoaktivními nodozitami.
Stav tedy diagnosticky uzavřen jako fibrilace síní při nově zachycené hypertyreóze, pozitivita tyreoidálních protilátek a sono obraz svědí pro autoimunní původ, jedná se o tzv. hashitoxikózu, dle UZ a scinti současně přítomna polynodózní struma. Následkem hypotyreózy je i laboratorně zachycená hypomagnesemie, hypocholesterolemie a hypoproteinemie. Současně přítomno chronické srdeční selhání (NYHA II-III) a lehká až střední těžká plicní hypertenze, degenerativní chlopenní vady (mitrální, aortální, trikuspidální regurgitace).
Po týdnu pacientka propuštěna domů s farmakoterapií zahrnující tyreostatikum (thiamazol), betablokátor (bisoprolol), kardiotonikum (dioxin), kalium šetřící diuretikum (spironolakton), LWMH (fraxiparin) a hořčík (magnesium lacticum).
Za 6 týdnů po od první hospitalizace po částečném zklidnění tyreotoxikózy (předoperačně fT4 14,1 pmol/L (n 9,1-19,1), fT3 6,18 pmol/L (n 2,6-5,7), TSH pod 0,004 mIU/L (n 0,35-4,94)) přistoupeno k definitivnímu řešení a to operativnímu odstranění celé štítné žlázy neboli totální tyreidektomii. Výkon proběhl bez komplikací. Týden po výkonu zahájena substituce levothyroxinem, vzhledem k tachyarytmii v pozadí iniciálně nižší dávkou a pro perzistující FiS převedena z LWMH na warfarin.
Závěr
K fibrilaci síní je potřeba přistupovat jako k symptomu-příznaku a pátrat po její příčině. Diferenciální diagnostika příčin FiS, pak nezahrnuje jenom onemocnění kardiální, ale i extrakardiální mezi něž vzhledem k výskytu patří především thyreopatie. Součástí vyšetření pacientů s FiS by tedy mělo být i laboratorní stanovení TSH jakožto základního parametru funkce štítné žlázy a v případě patologie doplnit hladiny periferních hormonů tj. tyroxinu a trijodthyroninu respektive jejich volných frakcí fT4, fT3, protilátek proti štítné žláze (TGAb, TPOAb, TRAK) a rovněž sonografické vyšetření štítnice.
Literatura
1. ĆIHÁK R., HEINC P. et. al. Doporučené postupy u pacientů s fibrilací síní. Cor Vasa 2011; 53(Suppl.1), str. 27-52
2. KLENER P. a kol. Vnitřní lékařství, díl I. Nakladatelství Karolinum, Praha 1998. str. 68-69
3. LÍMANOVÁ Z. et al. Trendy soudobé endokrinologie 2: Štítná žláza. Galén 2006, 1.vydání, str. 135-150
4. JISKRA J. Poruchy štítné žlázy, praktický přehled nejen pro laickou veřejnost. Mladá fronta 2011, str. 21-30