Úvod
Chronická myeloidní leukémie (CML) je nádorové myeloproliferativní onemocnění vznikající transformací hemopoetické kmenové buňky. Vyznačuje se přítomností chromozomu Philadelphia (Ph), který vzniká reciprokou translokací mezi chromozomy 9 a 22. Výsledkem této změny je vytvoření fúzního genu BCR-ABL1.
Epidemiologie
CML představuje asi 15-20% všech leukémií. Incidence onemocnění je přibližně 1-2/100 000 obyvatel a rok. Výskyt CML narůstá s věkem, nadpoloviční většina pacientů je starších 60 let. Poměr postižení mužů a žen je zhruba 1,3 : 1,0. Každoročně je v ČR zachycených asi 150 – 200 nových případů tohoto onemocnění.
Etiologie a patogeneze
Příčina vzniku onemocnění není známa, jako rizikový faktor se uvádí expozice ionizujícímu záření. Důkazem je vyšší výskyt leukémií u přeživších výbuchů atomových bomb v Hirošimě a Nagasaki.Vliv jiných látek, léků či chemikálií na vznik CML nebyl jednoznačně prokázán.
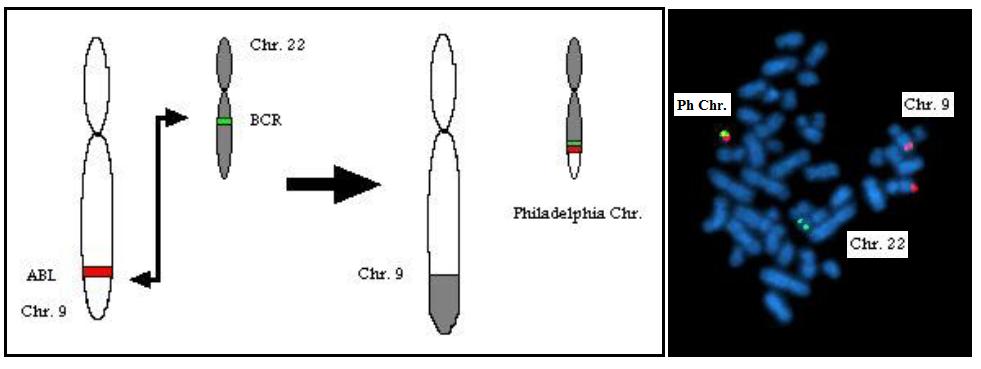
Vznik CML je spjat s reciprokou translokací chromozomů 9 a 22, čímž vzniká fúzní gen BCR-ABL1. Protoonkogen ABL (gen Abelsonovy myší leukémie) se z dlouhého raménka chromozomu 9 dostává ke genu BCR (breakpoint cluster region) na chromozomu 22. Jejich spojením pak vzniká fuzní leukemický gen BCR-ABL1. Jeho transkripcí vzniká onkoprotein Bcr-Abl1- konstitutivně aktivovaná tyrozinová kináza, která kromě jiného aktivuje mitogenní signální dráhy (zvyšuje proliferaci) a narušuje apoptózu. Výsledkem je proliferace krevních elementů hlavně v myeloidní řade, avšak Ph chromozom je možné nalézt i v buňkách řady erytroidní, megakaryocytární, monocytoidní a také v některých lymfocytech. Asi u 5 % pacientů s CML se přítomnost Ph chromozomu nepodaří prokázat, leukemický gen BCR-ABL1 je výsledkem tzv. variantní translokace (kromě chromozomu 9 a 22 jsou v ní zahrnuty i jiné chromozomy).
Obr. č. 1 (vlevo): Vznik chromozomu Philadelphia (autor: Obeidat A., www.wikipedia.org)
Obr. č. 2 (vpravo): Chromozóm Philadelphia – zobrazení metodou FISH (www.wikipedia.org)
Klinický obraz
Neléčená CML probíhá typicky ve třech fázích:
- chronické
- akcelerované
- blastické
U naprosté většiny pacientů (více než 80 %) je diagnóza stanovená v chronické fázi nemoci. Ta může probíhat zcela bez symptomů nebo jsou příznaky nemoci jen mírné – únava, nevýkonnost, noční pocení či váhový úbytek. Počty neutrofilních segmentů i trombocytů nejsou zpočátku výrazně snížené – infekce a krvácení tedy nepatří do typického klinického obrazu chronické fáze CML. V současnosti se udává, že až u ⅓ pacientů je diagnóza stanovena náhodně (při odběru krve při jiném vyšetření) v době, kdy nemají potíže. Chronická fáze trvá průměrně 3-4 roky, jsou však i nemocní s průběhem několik měsíců nebo i 10 let. S postupem času se agresivita choroby stupňuje – zvyšuje se rychlost proliferace leukemických buněk a onemocnění postupně přechází do akcelerované fáze.
Akcelerovaná fáze je charakterizovaná zvýrazněním příznaků chronické fáze – zvyšuje se únavnost, nevýkonnost, úbytek hmotnosti a objevují se neinfekční teploty. Zvětšující se slezina může utlačovat břišní orgány a způsobovat dyspepsii. Mohou se objevit i bolesti kostí způsobené subperiostálními infiltráty. V periferní krvi přibývá blastů, může být zvýšen i počet bazofilů nebo eozinofilů a objevuje se kolagenní fibróza kostní dřeně. Při cytogenetickém vyšetření jsou navíc zjišťovány nové chromozomální aberace mimo Ph chromozom a onemocnění přechází do své blastické fáze (ta však může vzniknout i náhle z fáze chronické).
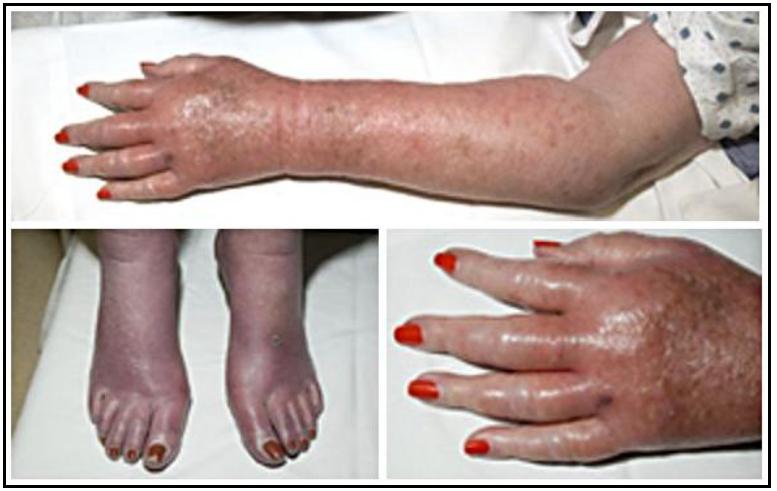
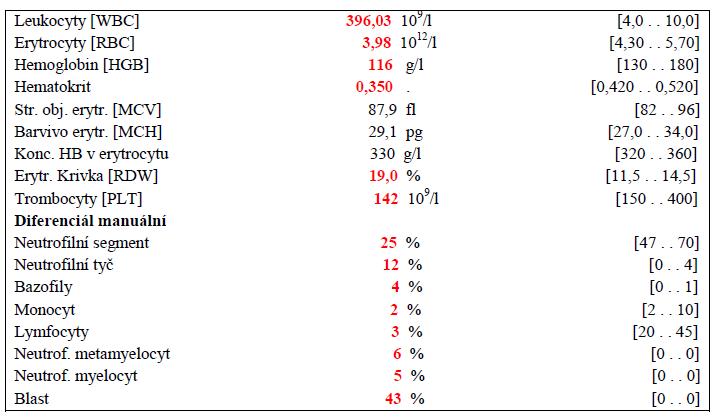
Blastický zvrat je svým klinickým průběhem a nálezem v kostní dřeni a periferní krvi podobný akutní myeloidní leukémii. Dále se zhoršuje celkový klinický stav – komplikovaný krvácivými příznaky, infekcemi a anémií. Je přítomná výrazná splenomegalie, někdy doprovázená také hepatomegalií. Mohou se objevit i vaskulární komplikace – leukostáza, erytromelalgie (bolestivá vyrážka až zduření kůže akrálních částí končetin) a priapizmus (trvalá a bolestivá erekce). V blastické fázi tvoří blasty nad 30% buněk kostní dřeně a periferní krve. Blasty mohou být nejen myeloidní (tzv. myeloblastický zvrat, 60%), ale i lymfoidní (tzv. lymfoblastický zvrat, 30 %) nebo se mohou vyskytovat oba typy blastů současně – tzv. myelo-lymfoblastický zvrat (10%).
Obr. č. 3: Erytromelalgie (autoři: Herbert L. Fred, MD and Hendrik A. van Dijk, www.wikipedia.org)
Kriteria pro diagnostiků jednotlivých fází CML:
Upraveno podle: Faber E. Chronická myeloidní leukémie. In: Faber E. et al. Základy hematologické diagnostiky. 1. vyd. Olomouc, Univerzita Palackého v Olomouci, Lékařská fakulta, 2012; 160-165.
Laboratorní výsledky
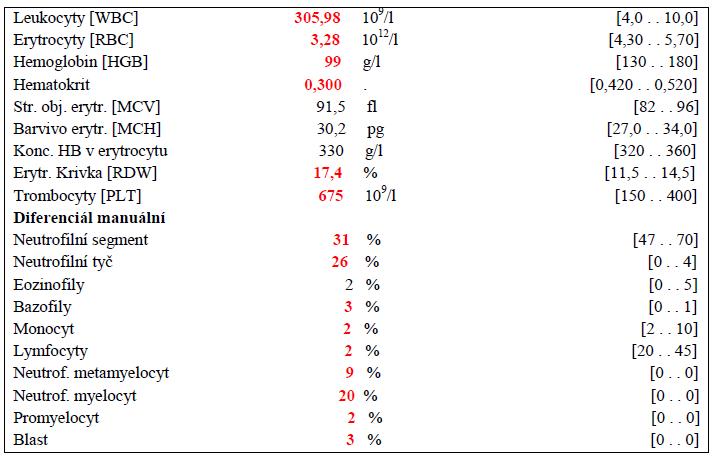
Typickým znakem CML je výrazná leukocytóza, která v průměru dosahuje hodnot kolem 150×109/l (vynímečně však až do 400×109/l). Diagnostický pro onemocnění je tzv. posun doleva, k nevyzrálým formám granulocytů. V krevním obraze jsou zastoupeny všechny vývojové stupně granulocytů (rozdíl oproti akutní myeloidní leukémii). Absolutní počet bazofilů a eozinofilů bývá zvýšen, trombocytóza často dosahuje hodnot přes 1000×109/l (nižší hodnoty trombocytů mohou signalizovat akceleraci nebo blastický zvrat). Část pacientů je v čase diagnózy anemická, u části nemocných však může být nalezena i erytrocytóza (zvýšené množství červených krvinek). K dalším typickým laboratorním nálezům patří snížený index alkalické fosfatázy (ALP) v leukocytech. Zvýšené hodnoty kyseliny močové a laktátdehydrogenázy (LDH) jsou způsobeny zvýšeným obratem leukocytů. Diagnózu CML potvrzuje nález Ph chromozomu a fúzního génu BCR-ABL1 cytogenetickým a molekulárně-genetickým vyšetřením.
Ukázka výsledků krevního obrazu pacienta v chronické fázi CML :
Upraveno podle: Faber E. Chronická myeloidní leukémie. In: Faber E. et al. Základy hematologické diagnostiky. 1. vyd. Olomouc, Univerzita Palackého v Olomouci, Lékařská fakulta, 2012; 160-165.
Ukázka výsledků krevního obrazu pacienta v blastické fázi CML :
Upraveno podle: Faber E. Chronická myeloidní leukémie. In: Faber E. et al. Základy hematologické diagnostiky. 1. vyd. Olomouc, Univerzita Palackého v Olomouci, Lékařská fakulta, 2012; 160-165.
Diagnostický postup
- anamnéza a fyzikální vyšetření
- vyšetření krevního obrazu a diferenciálního rozpočtu bílých krvinek
- biochemický rozbor krve
- vyšetření kostní dřeně
- cytogenetické vyšetření krve a kostní dřeně
- molekulárně genetické vyšetření krve a kostní dřeně
- další doplňující vyšetření, např. ultrazvuk břicha
Diferenciální diagnostika
Z hlediska diferenciální diagnostiky je potřeba odlišit následující onemocnění a stavy:
- Leukemoidní reakce
- Osteomyelofibróza
- Akutní leukemie
- Ph-negativní (atypická) chronická myeloidní leukemie
- Chronická myelomonocytární leukemie
- Polycytemia vera
- Esenciální trombocytopenie
Léčba
Výběr vhodné léčby u konkrétního pacienta s CML závisí především na fázi onemocnění a aktuálním nálezu v krevním obraze. Po záchytu zvýšeného počtu leukocytů (leukocytóze) a/nebo trombocytů (trombocytóze) je nutné iniciálně zahájit tzv. cytoredukční terapii, jejímž cílem je snížit hodnoty krvinek na hodnotu bezpečnou pro zahájení specifické léčby tyrozinkinázovými inhibitory. K cytoredukci je možné použít perorálne podávané cytostatikum hydroxyureu, anebo přístrojovou cytoredukci – leukaferézu event. trombocytaferézu . Rychlost nástupu efektu přístrojové cytoredukce je důležitá při tzv. syndromu leukostázy. Lékem první volby v chronické fáze onemocnění je tyrozinkinázový inhibitor - imatinib (Glivec). Mechanizmus jeho účinku spočívá v blokaci vazebného místa Bcr-Abl1 pro ATP, tím dochází k selektivní inhibici proliferace BCR-ABL1 pozitivních leukemických línií. Imatinib neovlivňuje genetickou informaci zdravé buňky jako klasická cytostatika, ale působí jen v leukemických buňkách, protože Bcr-Abl1 kináza je přítomna jen v nich (ve zdravých buňkách se normálně nenachází). Komplikací léčby imatinibem je vznik rezistence (20-30% pacientů v průběhu 5 let), proto byly vyvíjeny nové skupiny léčiv – tyrozínkinázové inhibitory druhé generace: dasatinib, nilotinib a bosutinib. V situaci, kdy ani tato léčba není účinná, je indikovaná alogenní transplantace hematopoetických buněk. U akcelerované fáze je léčba podobná, iniciální dávkování imatinibu je však vyšší než u fáze chronické. V případě blastické fáze by po léčbě tyrosinkinázovými inhibitory měla následovat alogenní transplantace kostní dřeně. Paliativní účinek u CML má v terapii hydroxyurea anebo interferon α. Hodnocení léčebné odpovědi na terapii přesahuje rozsah tohoto článku a zájemci podrobnější informace mohou najít v početných publikacích věnovaných této problematice.
Prognóza
Zavedení imatinibu do klinické praxe v roce 2001 zcela změnilo prognózu dosud fatálního onemocnění s průměrnou dobou přežití 3-4 roky. Při současných možnostech cílené léčby je předpokládaná délka života srovnatelná s normální populací.
Literatura
1.) Faber E. Chronická myeloidní leukémie. In: Faber E. et al. Základy hematologické diagnostiky. 1. vyd. Olomouc, Univerzita Palackého v Olomouci, Lékařská fakulta, 2012; 160-165.
2.) Faber E, Urbanová R. Chronická myeloidní a chronická lymfatická leukemie. Interní Med. 2010; 12(6): 321-324.
3.) Doubek M, Adam Z. Chronická myeloidní leukémie In: Adam Z, Vorlíček J. et al. Hematologie II. Přehled maligních hematologických nemocí. 1. vydání. Praha, Grada Publishing, 2001; 70-82.
4.) Klener P. Chronická myeloidní leukémie. In: Klener P. et al. Vnitřní lékařství. 4. , přepracované a
doplněné vydání. Praha, Galén a Univerzita Karlova v Praze, 2011; 463-465.
5.) Demitrovičová Ľ, Mikušková E. Chronická myeloidná leukémia – nové trendy v liečbe. Onkológia (Bratisl.), 2008, roč. 3(5): 305-310.
6.) Žáčková D. Chronická myeloidní leukemie. Informace pro pacienty a jejich blízké. Brno, Česká
leukemická skupina – pro život (CELL), 2012
7.) Rohoň P, Faber E. Chronická myeloidní leukémie. In: Pospíšilová Š, Dvořáková D, Mayer J. et al.
Molekulární hematologie. Praha, Galén, 2013; 178-186.
Zpracoval: Martin Čerňan
LF UP a FN Olomouc