Charakteristika SIRS
Syndrom systémové zánětové odpovědi (SIRS; systemic inflammatory response syndrome) je generalizovaná akutní zánětová reakce, která se rozšiřuje na celý organismus.
Spočívá v intenzivní a nevyvážené imunitní odpovědi na primární lokální, mnohočetné anebo kombinované poškození. Původní poškození může být vyvoláno mechanicky, radiačně, termicky, chemicky anebo biologicky. Následný zánět se při SIRS neomezí pouze na vlastní zasaženou oblast, ale rozšíří se i na ostatní části těla.
I normální zánět vyvolává celotělovou reakci. Hlavní rozdíl SIRS proti normální zánětové odpovědi je ve ztrátě její kontroly. Zánět při SIRS ztrácí svůj původní obranný charakter a mění se v delokalizovaný a deregulovaný autoagresivní proces. Vede k sekundární devastaci vzdálených orgánů, které působením původní příčiny vůbec nemusely být postiženy. Intenzita SIRS je úměrná síle a rozsahu působení škodlivého podnětu. U hypersenzitivních (alergických) osob se SIRS může vyvinout i po působení malého podnětu. Rozvoj SIRS mohou modifikovat genetické dispozice.
Klasifikace SIRS
SIRS může mít dvě základní formy:
- Neseptický SIRS, kdy se systémový zánět rozvíjí jako odpověď na poškození tělních tkání, které není spojeno s infekcí.
- Septický SIRS (sepse) je SIRS s infekcí.
SIRS z neinfekčních příčin (SIRS nekomplikovaný přítomností infekce) může vzniknout:
- Z lokálního poškození
- Z rozsáhlého, mnohočetného anebo kombinovaného poškození, např.:
- Po těžkém traumatu;
- Po těžkém poškození orgánů (např. při akutní pankreatitidě);
- Hypoxémií a hypoxií;
- Popáleninami;
- Otravou;
- Inkompatibilní transfúzí;
- Celotělovým ozářením;
- Poškozením tlakovou vlnou atd.
Septický SIRS (sepse) je SIRS vyvolaný anebo provázený diseminovanou mikrobiální infekcí. Asi 50 % případů je pravděpodobně způsobeno gram-pozitivními bakteriemi, více než jedna třetina případů gram-negativními bakteriemi, asi 5 % případů je polymikrobiálních, přibližně 5 % případů způsobují kvasinky a houby a 1 % případů anaerobní bakterie. Každý třetí pacient postižený sepsí umírá. Přestože v posledních asi 25 letech incidence sepse soustavně roste a byla vyzkoušena řada nových léčebných strategií, mortalita zůstává nezměněna. Počet úmrtí na sepsi v zemích západního typu tak je v souhrnu větší než počet úmrtí na zhoubné nádory prsu, plic a gastrointestinálního traktu dohromady.
Zdroje sepse:
- Infekce kůže a měkkých tkání;
- GIT a infekce GIT;
- Infekce respirační traktu;
- Infekce v urogenitálním traktu;
- Meningitidy a encefalomeningitidy.
- Iatrogenní infekce:
- Po přijetí na nemocniční oddělení je pacient rychle kolonizován bakteriemi nemocničního prostředí ze vzduchu, nábytku, nádobí atp.
- Tyto bakterie obvykle mají vyšší rezistenci k antibiotikům než původní pacientova mikroflóra.
- Další bakterie se na pacienta přenášejí od odborného perzonálu a od okolních pacientů;
- Pravidelným místem vniknutí baktérií do těla jsou:
- Otvory v kůži, kterými jsou zavedeny infúzní jehly, hadičky anebo katetry;
- Místa zavedení sond (např. nazogastrické sondy, močové katetry);
- Invazivní diagnostické anebo léčebné zákroky (katetrizace, punkce) atd.
- Po přijetí na nemocniční oddělení je pacient rychle kolonizován bakteriemi nemocničního prostředí ze vzduchu, nábytku, nádobí atp.
Při primární sepsi agens proniká přímo do krevního oběhu (dříve často při nelegálních potratech). Při sekundární sepsi se agens šíří do těla z primárního ložiska (infikovaná rána pro traumatu, pyelonefritida, meningitida, peritonitida, pneumonie, tromboflebitida pánevních žil, endomyometritida atd.).
Klinické příznaky a diagnóza SIRS
Klinické příznaky SIRS zahrnují široké spektrum nespecifických symptomů, které běžně spojujeme se zánětem. To je hlavní klinický problém SIRS – jeho diagnózy, a tedy i léčby. V rutinní klinické praxi chybí dostatečně spolehlivé, specifické a hlavně včasné markery, které by dovolily odhalit SIRS anebo sepsi a zahájit jejich adekvátní terapii už v jejich raných fázích. Systémovou zánětovou reakci provázejí těžké změny respiračního, kardiovaskulárního a nervového systému a ledvin. Vážně postižen také bývá gastrointestinální trakt včetně jater anebo slinivky. Další významnou složkou SIRS je rozsáhlá alterace buněčného metabolismu ve tkáních. Všechny tyto změny často vedou k progresi SIRS až do syndromu mnohočetného orgánového selhání (MODS) a ke smrti.
I původně neinfekční (neseptický) SIRS může přejít v sepsi, jakmile se zhroutí funkce střevní slizniční bariéry a střevní mikrobi začnou přestupovat do oběhu. Ne náhodou je střevo považováno za „motor sepse“. Zvrat neinfekčního SIRS v septický SIRS může být navíc podpořen postižením jater, která normálně zajišťují odstranění střevních bakterií z portální krve.
K hlavním symptomům SIRS patří horečka, tachykardie, tachypnoe, arteriální hypotenze, tkáňová hypoxie a acidóza. Klinická diagnóza SIRS se opírá o zjištění přítomnosti alespoň dvou ze 4 následujících kritérií:
- Tělesná teplota > 38 °C, nebo < 36 °C;
- Tepová frekvence > 90/min;
- Frekvence dýchání > 20/min, nebo hyperventilace s PaCO2 < 32 mm Hg;
- Počet leukocytů >12.1012, nebo <4.1012, nebo přítomnost >10 % nezralých forem leukocytů (tyček).
Pokud je navíc přítomna zřejmá, nebo dokonce kultivačně potvrzená systémová infekce (v krvi), jde o sepsi.
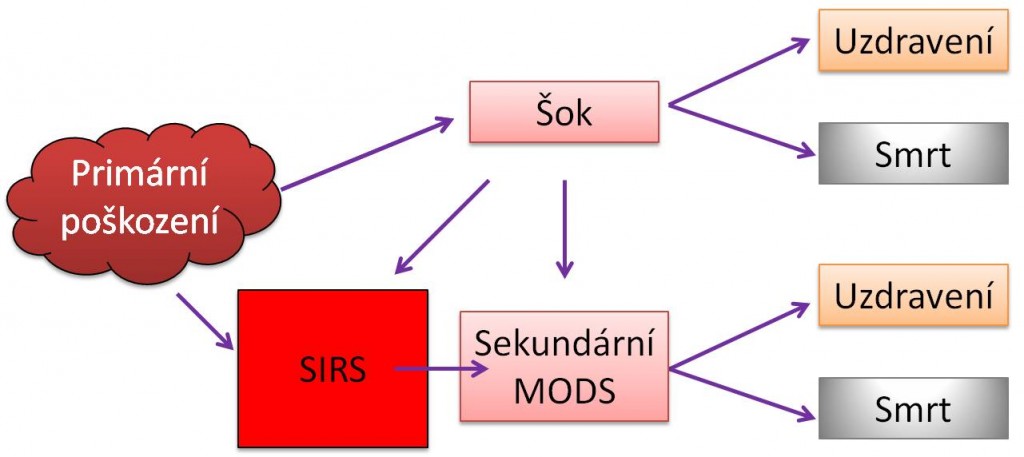
Klinické stavy začínající od SIRS a pokračující přes prohlubující se komplikace až k MODS a případně ke smrti tvoří kontinuum:
- SIRS → těžký SIRS → SIRS šok → MODS/MOF → smrt;
- Sepse → těžká sepse → septický šok → MODS/MOF → smrt.
Jako těžký SIRS (popř. těžkou sepsi) označujeme SIRS s hypotenzí a známkami hypoperfúze anebo orgánové dysfunkce. Pokud těžký SIRS (těžká sepse) s hypotenzí nereaguje na stavu přiměřenou infúzní terapii, a i přes farmakologickou intervenci (např. katecholaminy) trvají známky hypoperfúze a dysfunkce orgánů, jde o SIRS šok (septický šok).
Syndrom mnohočetné orgánové dysfunkce (MODS)
Charakteristika MODS
Syndrom mnohočetné orgánové dysfunkce (MODS, multiple organ dysfunction syndrome; dříve MOF, multiple organ failure) označuje stav dysfunkce dvou a více životně důležitých orgánů. Může začít primárním poškozením orgánů, např. úrazem. Častěji však vyjadřuje klinicky pozorovanou skutečnost, kdy poškození původně jednoho místa v těle může vyvolat těžké sekundární poškození na vzdálených místech. Rozlišuje se tudíž MODS primární a sekundární.
Významné je, že MODS se může rozvinout s odstupem několik dní, nebo dokonce až týdnů po primárním poškození. Statisticky bývají jako první zasaženy plíce (syndrom akutní dechové tísně, ARDS), dále se rozvíjí selhání jater, GIT (ileus, stresový vřed) a ledvin; pořadí však naprosto není uniformní. Krevní změny (DIC) a cirkulační selhání se mnohdy dostavují naposled. CNS může být postižen už v začátcích, nebo v pozdních fázích MODS.
Typickými charakteristikami MODS jsou hyperkinetická cirkulace a hypermetabolismus; i tyto znaky však mohou být modifikovány působícími příčinami a jinými faktory. Vždy je třeba mít na paměti, že postižení GIT, hrozící ztráta bariérových funkcí v něm a přestup bakterií do krve jsou hnacím motorem rozvoje sepse.
Vztahy mezi SIRS a MODS
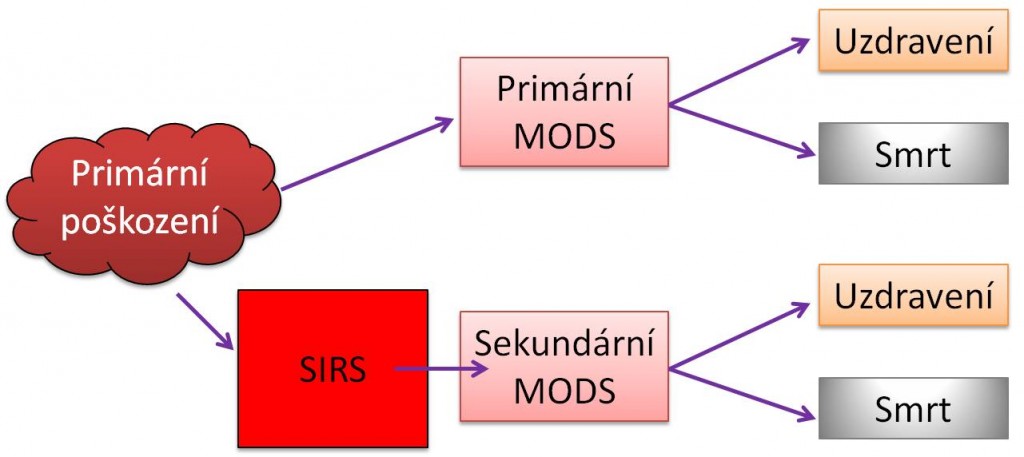
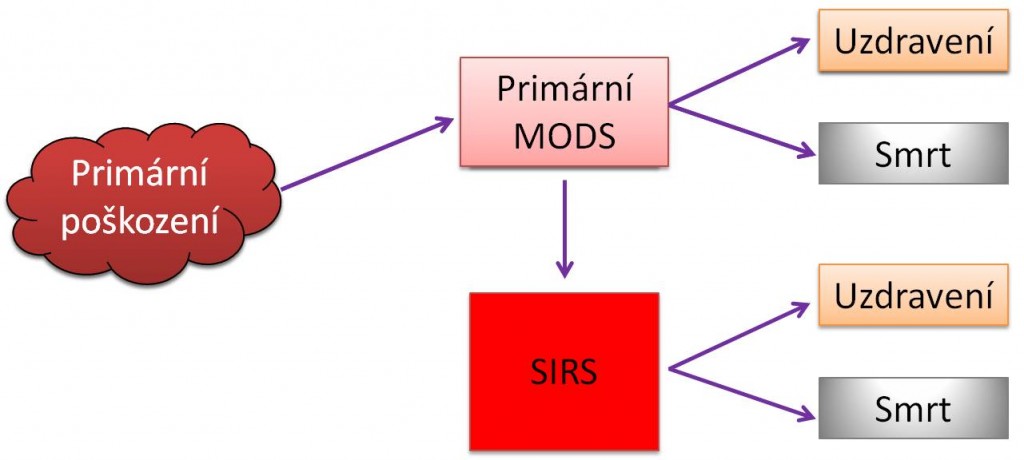
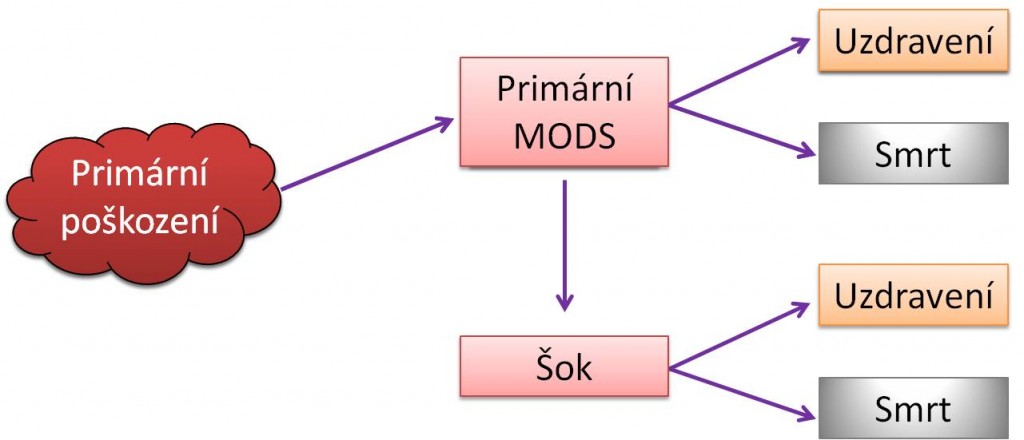
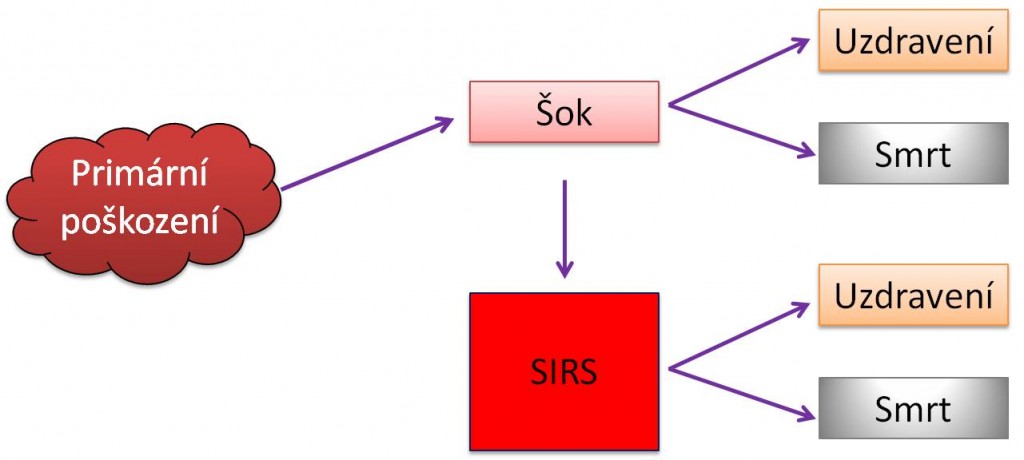
Vztahy mezi SIRS a MODS ukazují následující schémata.
Obr. 1. Vztahy mezi SIRS, šokem a MODS - Varianty vzniku primárního a sekundárního MODS.
Patofyziologie SIRS a MODS
Imunitní systém
Reakce organismu na poškození je obvykle spojena s aktivací rozsáhlého systému zánětových biologických dějů, které primárně mají ochranný charakter. Jsou zcela nezbytným nástrojem pro přežití organismu a hojení poškozených tkání.
V časné fázi běžné zánětové reakce dochází k aktivaci receptorů na povrchu dendritických buněk a makrofágů prostřednictvím obecných molekulárních znaků pocházejících z patogenů (PAMPs; pathogen-associated molecular patterns). Znaky PAMPs mohou být bakteriální lipopolysacharidy (LPS; Gram-negativní bakterie), peptidoglykany, bakteriální RNA, bakteriální flagelin anebo lipoteichoová kyselina z Gram-pozitivních bakterií (např. stafylokoků anebo streptokoků; tzv. MAMPs, microbe-associated molecular patterns).
Většina patogenních bakterií uvolňuje buň exotoxiny, nebo endotoxiny. Exotoxiny jsou mikroorganismy aktivně uvolňovány v jejich růstové fázi anebo ve finálních stádiích jejich života. Podle jejich převažujících účinků v cílových tkáních je dělíme na enterotoxiny (produkty patogenních E. coli, stafylotoxin, shigela-toxin, cholera-toxin), neurotoxiny (např. tetanospasmin, botulotoxin), kardiotoxiny (např. difterický toxin), exfoliativní toxiny (např. stafylotoxin), cytotoxiny (např. difterický toxin), hemolysiny (početná skupina), superantigeny atd. Většinou jsou tepelně nestabilní a svou toxicitu ztrácejí při zahřátí nad 60 °C. To však např. neplatí pro stafylokokový toxin, který snese až 20 minut varu.
Bakteriální endotoxiny jsou naproti tomu strukturními složkami bakterií, takže se uvolňují až po jejich smrti a během jejich rozkládání (např. po lýze komplementem). Hlavním představitelem jsou lipopolysacharidy coby složky bakteriálních stěn (vnější membrány) Gram-negativních baktérií.
Viry obsahující RNA indukují syntézu interferonů v jimi napadených buňkách silněji než DNA-viry. IFN-α produkují hlavně leukocyty, IFN-β hlavně fibroblasty a IFN-γ pouze lymfocyty. Přítomnost interferonů však byla zjištěna i v mozku, kde působí jako důležité neuromodulátory.
PAMPs a Mamps reagují s receptory rozpoznávajícími znaky (PRRs, pattern-reccognition receptors). Představiteli povrchových PRRs jsou receptory podobné receptorům Toll octomilky (TLRs; Toll-like receptors) umístěné na membránách savčích buněk odpovědných za vrozenou imunitu, v první řadě dendritických buněk, monocytů a makrofágů, ale také např. buněk střevního epitelu. Hlavními reprezentanty cytosolických PPRs jsou proteiny pocházející ze dvou odlišných proteinových rodin - NLRs (Nod-like receptors; u člověka celkem 14 genů, u myši 20 genů) a RLHs (RIG-like helicases). Intracelulární (cytosolické) PRRs slouží jako základ pro vytváření složitých proteinových komplexů, tzv. inflamazomů (inflammasomes). Inflamazomy potom zprostředkují produkci cytokinů, a tím další rozvoj zánětu.
PRRs a TLRs buněk nespecifické imunity mohou být aktivovány nejen cizími znaky PAMPs, ale jsou také schopny rozpoznávat a vázat znaky, které pocházejí z poškozených tělních tkání (DAMPs; damage-associated – nebo též danger-associated – molecular patterns). Tak se může stát, že samo progredující poškození tkání může i v nepřítomnosti infekce vyvolat neadekvátní aktivaci anebo dysregulaci imunitního systému, které jsou charakteristické pro SIRS, anebo k nim významně přispět. Znaky DAMPs a jimi zprostředkovaná aktivace inflamazomů významně přispívají k rozvoji SIRS při mnohočetném orgánovém poškození. Specifičnost účinků inflamazomů při tom je určena druhem proteinu PRR, který je v základu inflamazomu.
Signály přenesené aktivovanými TLR do nitra nespecifických imunitních buněk spouštějí syntézu prozánětlivých proteinů časné fáze, jako jsou TNF, IL-1β a interferon γ (IFN-γ). Tyto proteiny dále působí autokrinně, parakrinně a endokrinně s cílem mobilizovat imunitní odpověď. Navozují mimojaterní projevy akutní fáze zánětové odpovědi, jako jsou horečka a tachykardie. Stimulují syntézu a uvolnění dalších cytokinů, zejména IL-6.
IL-6 je regulátorem jaterní složky akutní fáze zánětové odpovědi. Mimo jiné indukuje syntézu proteinů aktuní fáze. Stimuluje proliferaci vývojové řady polymorfonukleárních leukocytů v kostní dřeni. Zvýšené plazmatické koncentrace IL-6 korelují s tíží primárního poškození, např. s rozsahem chirurgického zákroku. Na druhé straně IL-6 zpětnovazebně tlumí TNF a IL-1, takže zároveň působí protizánětlivě.
Dendritické buňky cestují do spádových uzlin. Zde spouštějí odpověď specifického imunitního systému. Jako první se aktivují pomocné T-buňky (TH-buňky, CD4-lymfocyty), které navozují expanzi specifických výkonných buněčných klonů - B-buněk (plazmatických buněk) a cytotoxických buněk (TC-buňky, CD8-lymfocyty).
Součástí zánětové reakce je aktivace kaskády komplementu, která hraje důležitou úlohu ve zprostředkování horečky, v ničení mikrobů a v odstraňování produktů degradace tkání.
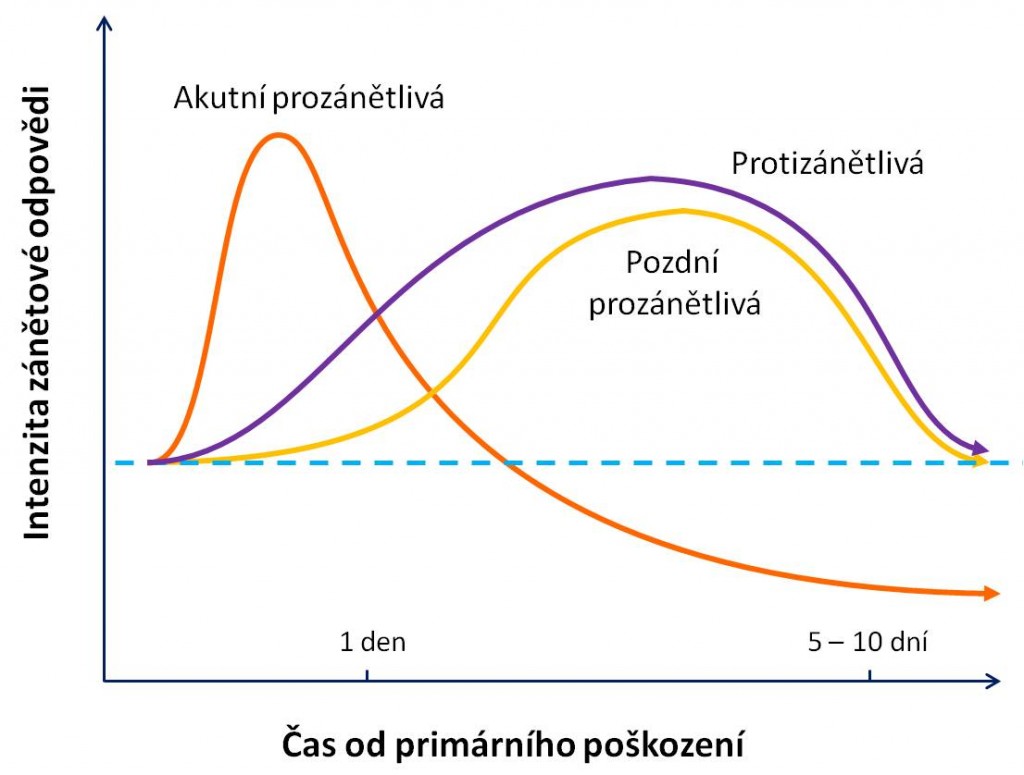
V průběhu imunitní reakce jsou produkovány mediátory s prozánětlivými i protizánětlivými účinky. Jejich vzájemný poměr se udržuje zpětnovazebními regulačními smyčkami s cílem omezit reakci pouze na oblast poškozených tkání. Selhání této regulace, kdy se prohlubuje nerovnováha mezi prozánětlivými a protizánětlivými ději, je spojeno se systémovou propagací agresivní složky zánětu i na původně nepoškozené tkáně. Generalizace a delokalizace zánětlivých pochodů vede k těžkým poruchám orgánových funkcí a k rozvoji syndromu mnohočetného orgánového selhání – MODS. Selhání regulace zánětu při SIRS tak může být dvojí, navzájem protichůdné povahy:
- Nadměrná zánětová odpověď. Excesivní zánět spojený s masívním uvolňováním prozánětlivých cytokinů do systémové cirkulace; výsledkem je generalizovaný systémový prozánětlivý stav. Vede k rozvratu tkáňového metabolismu a cirkulace, stresovému katabolismu a k selhání orgánů.
- Nadměrná protizánětová odpověď. Výsledkem je nadměrná systémová inhibice buněk a mechanismů nespecifické i specifické imunity v lokálním i systémovém měřítku. Imunosuprese umožňuje invazi a nekontrolované množení mikroorganismů, rozvoj sepse, septického šoku a selhání orgánů.
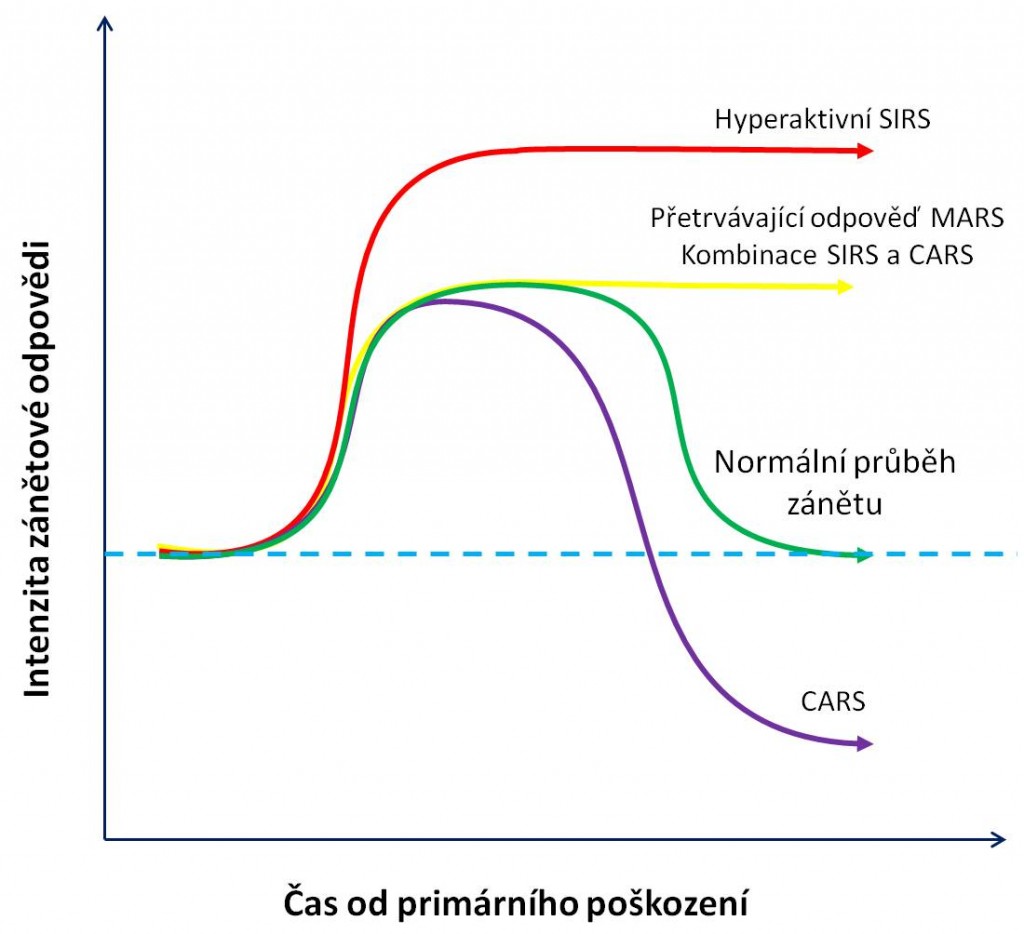
Nové pojetí SIRS proto klade důraz na existenci řady paralelně probíhajících a navzájem se překrývajících dějů, pro jejichž přítomnost zpravidla nelze nijak ostře vymezit jednotlivé fáze v rozvoji SIRS. SIRS není nediferencovaný lineární proces. Výsledný stav většinou je kombinací překrývajících se dějů:
- Lokální zánětlivá odpověď v místě poškození anebo infekce regulovaná pozitivními i negativními zpětnovazebnými smyčkami;
- Uvolňování lokálních regulátorů zánětu do okolí a do cirkulace;
- Převažující nadměrná systémová prozánětlivá fáze, kdy může dojít ke ztrátě kontroly zánětu a rozvinout se hyperaktivní SIRS;
- Převažující nadměrná systémová protizánětlivá fáze, kdy může dojít k nepřiměřené imunosupresi a rozvinout se syndrom kompenzační protizánětlivé odpovědi (CARS, compensatory anti-inflammatory response syndrome)
- Odezva na stimulaci jak ve složce prozánětlivé, tak protizánětlivé; rozvíjí se syndrom smíšené antagonistické odpovědi (MARS, mixed antagonistic response syndrome);
- Sekundární syndrom mnohočetného orgánového selhání (MODS).
Obr 2. Normální a patologický průběh zánětu.
Hyperaktivní SIRS
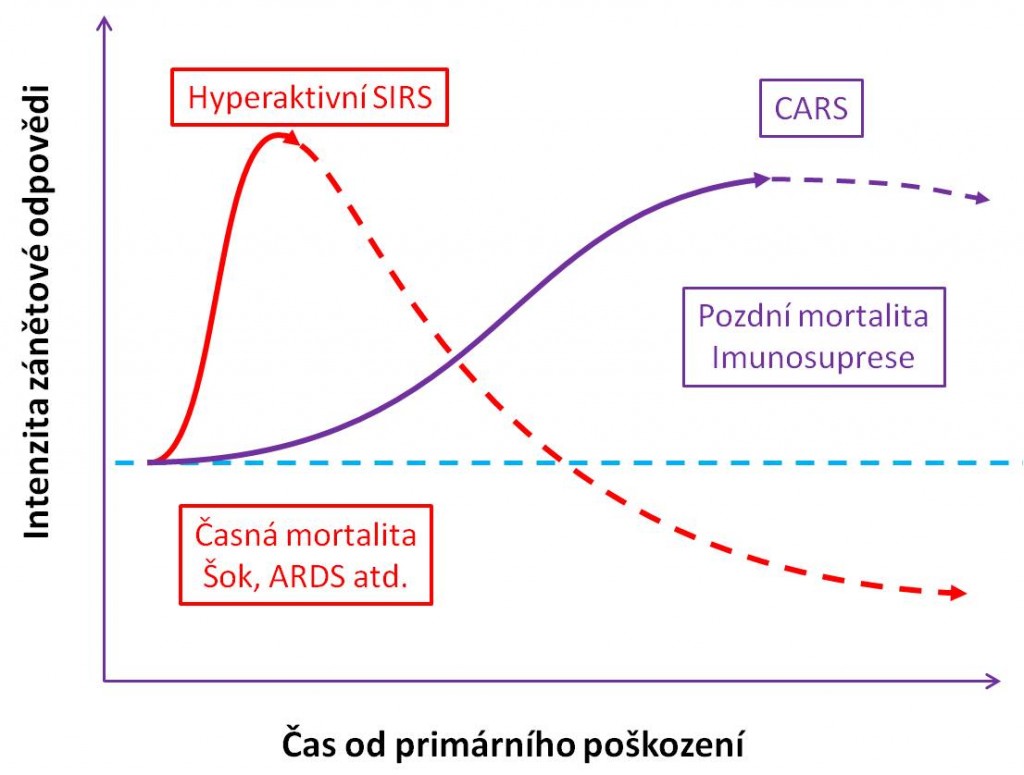
Jestliže převažuje hyperaktivní SIRS, dochází k masívnímu nebalancovanému vzestupu prozánětlivých cytokinů TNF, IL-1, -2, -12, IFN-γ, faktorů stimulujících kolonie (CSF), histaminu, bradykininu atd. Některé z těchto prozánětlivých cytokinů jsou také uvolňovány pomocnými buňkami TH1, které hlavně ovládají buněčnou specifickou imunitu (reakce T8 buněk). IFN-γ a GM-CSF zvyšují expresi HLA-DR, -DP, -DQ a CD80/86, takže stimulují antigen-prezentační kapacitu buněk. Zánět se vymyká zpod kontroly a získává autoagresivní povahu. Aktivaci imunitního systému současně provázejí výrazné defekty. Zatímco jsou určité prvky imunitní odpovědi v průběhu systémového zánětu nadměrně stimulovány, jiné imunitní mechanismy, zejména specifická imunita zprostředkovaná buňkami, mohou být v dalším časovém průběhu doslova paralyzovány. Některé účinné mechanismy cílené imunitní reakce mohou být utlumeny do té míry, že odpověď pozbývá účinnost ve vztahu k odstranění prvotní příčiny zánětu. Stav pacientů s hyperaktivním prozánětlivým SIRS přednostně komplikují ARDS a MODS. Hyperaktivní SIRS je odpovědný za většinu případů časné mortality SIRS.
Syndrom kompenzační protizánětlivé odpovědi (CARS)
Syndrom kompenzační protizánětlivé odpovědi (CARS) je nepřiměřenou protireakcí organismu na vývoj SIRS, kdy se jako odpověď na prozánětlivé mediátory nadměrně uvolňují protizánětlivé mediátory: interleukiny IL-4, -6, -10, -13, TNF-β a protizánětlivé regulační proteiny, jako je antagonista receptoru IL-1 (IL-1RA; IL-1 receptor antagonist) atd. Některé z těchto protizánětlivých cytokinů jsou také uvolňovány pomocnými buňkami TH2, které hlavně ovládají protilátkovou imunitu (reakce B buněk). Protizánětlivé mediátory normálně při zánětu vytvářejí zpětnovazební regulační smyčky, které pomáhají udržet zánětlivý proces v přijatelných mezích. IL-4 je markerem aktivity TH2 lymfocytů. Ve fázi CARS se protizánětlivé mediátory pronikavě zvyšují. IL-6, který byl zmíněn výše, v makrofázích indukuje tvorbu a sekreci prostaglandinu E2 (PGE2), který je významným přirozeným imunosupresorem. PGE2 také stimuluje tvorbu dalších přirozených imunosupresorů, zejména IL-10. Soupeření mezi prozánětlivými a protizánětlivými faktory může vést k nerovnováze, která se může objevit už v průběhu 3 – 5 hodin až několika dnů po primárním poškození. Kromě vysokých hladin protizánětlivých mediátorů je charakterizují nízké hladiny (vypnutí genové exprese) prozánětlivých cytokinů TNF, IL-1β, IL-12 a IFN-γ. Paralelně je provází pokles množství povrchových MHC třídy II (skupiny HLA-DR) a také snížená množství TLR. Tím jsou výrazně ochromeny klíčové prozánětlivé fagocytové a antigen-prezentační funkce makrofágů i neutrofilů. Převaha systému CARS tak vede k těžké imunodepresi. Hovoří se až o smrtící imunologické paralýze, kterou podle dosavadních klinických zkušeností dokázali přežít pouze ti pacienti, u nichž se podařilo obnovit expresi MHC třídy II a funkce antigen-prezentujících buněk. Fáze CARS otevírá cestu k infekci a k sepsi. Je odpovědná za většinu případů pozdní mortality. Zároveň však stojí ha pozornost, že v protizánětlivé fázi se paradoxně zvyšují prozánětlivé faktory 2. sledu, jako jsou faktor inhibující migraci makrofágů (MIF; macrophage migration inhibitory factor) anebo protein HMGB1 (high-mobility group-box protein 1), který se uvolňuje v pozdější fázi progredujícího zánětu.
Syndrom smíšené antagonistické odpovědi (MARS)
Syndrom smíšené antagonistické odezvy (MARS) charakterizuje dynamická rovnováha mezi proti sobě působícími prozánětlivými (SIRS) a protizánětlivými (CARS) procesy. Protizánětlivé cytokiny antagonizují určité hyperaktivní články SIRS. Může tak dojít ke kompenzaci škodlivého vlivu SIRS a syndrom zánětlivé odpovědi zůstane v určité míře regulovaný.Výsledným obrazem MARS je přetrvávající balancovaný zánět anebo spíše kombinace syndromů SIRS a CARS s různým vyjádřením obou těchto komponent.
Obr 3. Vzájemné překrývání hlavních fází SIRS.
Obr. 4. Hlavní časná a pozdní smrtelná rizika SIRS.
Ostatní tkáně v těle při SIRS
Odpověď ostatních tělních buněk na patogeny a zánětlivé stimuly je různorodá. TNF může navodit programovanou buněčnou smrt v řadě tkání. Podobné účinky má i výše uvedený faktor inhibující migraci makrofágů (MIF) anebo protein HMGB1, který může vyvolat poškození epitelu ve střevě a v játrech. Mnoho typů buněk ve tkáních ztrácí odolnost, takže snáze podléhají zániku, jiné typy buněk, např. neutrofily zapojené v prvních liniích obrany, naopak přežívají déle.
Endotelová dysfunkce
Nadměrná aktivace imunitního systému kombinovaná s defekty imunitní reakce, které jsou charakteristické pro SIRS, má svou paralelu v generalizované aktivaci periferního krevního oběhu, která je rovněž provázena výraznými projevy oběhové insuficience.
Aktivace endotelu je fyziologickou složkou zánětu. Zvyšuje se syntéza NO a dalších mediátorů, které způsobují vazodilataci a zlepšují prokrvení bojujících tkání. Zároveň se mění adhezní vlastnosti a permeabilita endotelu. Nadměrně uvolňovavé zánětové mediátory a mediátory aktivovaného endotelu při rozvoji SIRS však mimo jiné mohou způsobit, že vratná aktivace endotelu přejde v generalizovanou endotelovou dysfunkci.
Jedním z projevů generalizované endotelové dysfunkce může paradoxně být periferní vazodilatace a snížení periferního odporu. Následkem je pokles arteriálního krevního tlaku a zvýšení srdečního výdeje. Oběh krve se transformuje do stavu hyperkinetické cirkulace. Při tom bychom očekávali, že zvýšený průtok krve periferií povede ke zlepšené perfúzí a oxygenaci tkání. K tomu ale nedochází, protože tok krve se distribuuje nerovnoměrně. Některé oblasti mohou být hyperperfundované, jiné hypoperfundované. Krev v periferii při rozvinutém SIRS přednostně proudí otevřenými arteriovenózními zkraty. Buňky ve tkáních mohou trpět hypoperfúzí. Zároveň dochází k omezení kapacity buněk zpracovat kyslík. Množství NO, syntetizované aktivovanou inducibilní NO-syntázou (iNOS), soutěží s molekulami O2 o vstup do komplexu III respiračního řetězce v mitochondriích. Kyslík ve tkáních se proto metabolizuje alternativními cestami se vznikem množství volných kyslíkových radikálů, které dále zhoršují stav.
Dalším projevem endotelové dysfunkce je změna adhezních vlastností endotelu. V první fázi se exprimují a reagují selektiny endotelií (E-selektin), leukocytů (L-selektin) a krevních destiček (P-selektin) a způsobují rolování leukocytů. V další fázi se objevují leukocytární integriny (CD11a/CD18 a CD11c/CD18), adhezní molekuly cévních buněk (VCAM) a mezibuněčné adhezní molekuly (ICAM), jejichž prostřednitvím se leukocyty uchycují na povrchu endotelu. Následuje aktivní proces přemístění leukocytů do subendotelového prostoru (diapedeza). Nahromadění leukocytů ulpívajících na povrchu endotelu však může dosáhnout takového stupně, že obturuje mikrocévy. Leukocyty jsou v takovém případě předčasně aktivovány, paralyzovány, nemohou dosáhnout místa poškození a uplatnit se v něm. Naopak devastují cévní složky a způsobují rozsáhlou poruchu mikrocirkulace.
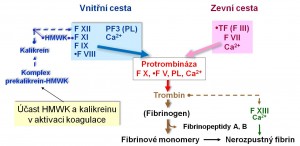
Se změnou adhezních vlastností a smáčivosti endotelu se organicky pojí aktivace koagulační kaskády a tvorba mikrotrombů anebo trombů, které dále limitují krevní zásobení orgánů a tkání. Mohou přispívat k orgánovému poškození až selhání anebo vést k rozvoiji intravaskulární diseminované koagulopatie (DIC). Koagulace a zánět spojují některé společné články, např. kalikrein-kininová kaskáda (viz obrázek 5).
Obr. 5. Aktivace koagulační kaskády kalikrein-kininovým systémem.
Neoddělitelnou složkou endotelové dysfunkce je alterace permeability kapilár. Zatímco např. kontraktilitu myokardu v kritických stavech je možné ovlivnit farmakologicky, poruchu permeability cévních stěn příliš ovlivnit nedokážeme. Pokud se rozvine do patologických rozměrů, přetrvává řadu hodin až několik dnů. Způsobuje značný únik tekutiny a plazmatických proteinů z cirkulace. K tomu přistupuje patologický útlum syntetických pochodů v játrech, který je dalším důležitým faktorem podílejícím se na poklesu koncentrace plazmatických proteinů. Schéma je možno zhlédnout i v animované podobě.
Poruchy myokardu
Systémový zánět vyvolává poruchu kontraktility myokardu. Příčiny jsou komplexní. Soudí se, že v popředí poruch jsou účinky faktorů TNF, IL-1 a reaktivních radikálů. V rozvoji poškození myokardu při SIRS anebo MODS způsobených periferním cirkulačním šokem mohou hrát úlohu i další, tzv. myokard-depresivní faktory, např. pankreatický depresivní faktor.
Poruchy plic
Postižení plic se rozvíjí pod obrazem akutního respiračního distresového syndromu (ARDS).
Poruchy GIT
Hypoperfúze spojená s hypoxií žaludeční sliznice bývá příčinou vzniku stresových vředů, které vážným způsobem komplikují stav nemocného.
Systémový zánět je dále provázen poruchami střevní bariéry, pokud už ony samy nebyly příčinou SIRS a sepse. Porušení bariéry vede k průniku toxinů a bakterií do portální krve a do systémového oběhu. Střevo se nikoliv nadarmo označuje jako „motor sepse“. Za vznik SIRS, sepse a MODS, u kterých se nedaří identifikovat původní zdroj toxinů a bakterií, je často odpovědná alterace střeva, např. po zákrocích v břišní dutině. Sepsí střevního původu jsou mimořádně ohroženi pacienti s jaterními onemocněními anebo rozvinutým kolaterálním oběhem, kdy krev obchází játra.
Játra mohou být při sepsi postižena hypoperfúzí s obrazem centrilobulární nekrózy. Ischemická ložiska se mohou rovněž objevit v pankreatu.
Poruchy ledvin
Poruchy ledvin se typicky manifestují obrazem akutního prerenálního ledvinového selhání.
Stresový katabolismus
Působení silných stresorů anebo jejich kombinací (příkladem může být i větší chirurgický zákrok) může vést k přechodné redukci rychlosti metabolismu v délce asi 24 – 48 hodin, která ovšem nemusí být příliš vyjádřena. Po ní typicky následuje katabolická fáze v délce několika dní až dvou týdnů. Závěrečná fáze je anabolická (reparační). Systémový zánět provázený aktivací TNF naproti tomu provází překotný katabolismus. Stresový hypermetabolický syndrom při SIRS (stresové hladovění) charakterizuje hyperglykémie, kterou se nedaří dostatečně ovlivnit inzulínem. Hlavním důvodem je výrazná inzulínová rezistence. Při alteraci jater se naopak může objevit hypoglykémie.
Diagnostika a terapie SIRS
Mortalita vyvolaná sepsí a neseptickým SIRS se už po několik desetiletí nemění, a to i přes četná nově zaváděná léčebná opatření. Praxe ukázala, že izolované ovlivnění jednotlivých článků ve složité síti rozvinutého SIRS nemá naději na úspěch a že léčba musí být komplexní. Pokusy terapeuticky ovlivnit imunologickou utlumit těžké zánětlivé stavy novými imunomodulačními přípravky zatím selhávají. Protizánětlivá léčba rozvinutého SIRS je neúčinná. Snad první výjimkou by mohlo být podání aktivovaného rekombinantního lidského proteinu C, který má zároveň antikoagulační, protizánětlivé a další účinky.
Léčba musí být včasná. Zde spočívá hlavní problém současné klinické praxe diagnózy a léčby SIRS: Citelně chybí spolehlivé včasné klinické markery nástupu SIRS a sepse. Nejsou k dispozici klinické laboratorní ukazatele, které by umožnily jasně vymezit SIRS, sepsi, septický šok a případně MODS. Diagnóza a následná léčba uvedených stavů se opírá o klinicky pozorovatelné symptomy a vyšetření dosud známých biomarkerů, typicky proteinů akutní fáze (CRP) anebo cytokinů, přispívá ke klinické diagnóze anebo monitorování systémové zánětové reakce jen velice omezeně. Nové studie ukazují, že zvýšení prokalcitoninu (PCT) by mohlo být spojeno se zvratem původně neseptického procesu do SIRS septické povahy. Větší spolehlivost mají vyšetření, která poskytují negativní výpověď: Normální hodnoty prokalcitoninu (PCT), fibrinových degradačních produktů (FDP) anebo doby aktivovaného parciálního tromboplastinu (aPTT) nejsou v souladu s diagózou sepse. Nové biomarkery se intenzivně hledají s využitím proteomiky a panelové analýzy exprese mRNA.
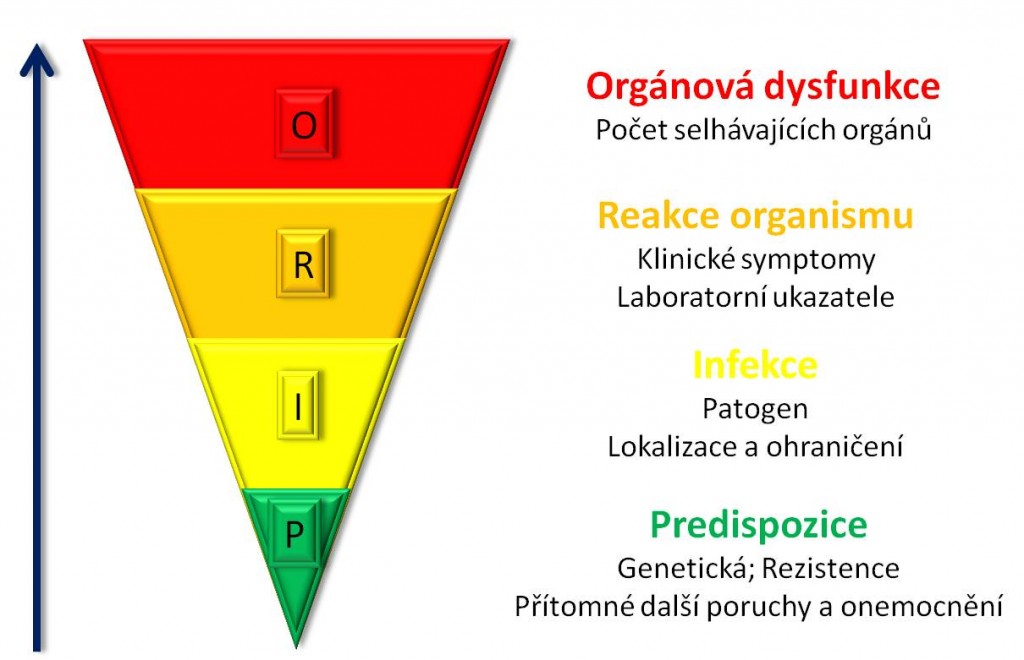
Snaha o podrobnější klasifikaci SIRS s cílem zlepšit terapii vedla k přijetí systému označovaného jako PIRO, založeného na zvážení 4 hledisek (Predisposition – Infection – Response – Organ dysfunction). Schematicky je znázorněn níže na obrázku 6.
Obr. 6. Klasifikační systém PIRO.
Terapeutické přístupy se musí lišit v závislosti na tom, jestli se zasahuje ve fázi SIRS anebo CARS.
Zpracoval: Jaroslav Veselý, Ústav patologické fyziologie LF UP v Olomouci