autor: Doc. MUDr. Květoslava Dostálová, CSc.
pracoviště: Ústav patologické fyziologie LF UP Olomouc
Metabolická rovnováha – Katabolismus a anabolismus
U zdravého dospělého člověka jsou katabolické ( destruktivní) a anabolické ( konstruktivní) procesy v rovnováze.
Když chybí zevní přívod potravy ( energie), rozbíhají se katabolické procesy, které štěpí komplexní molekuly (glykogen,bílkoviny, lipidy) pro zajištění energetických potřeb organismu. Katabolismus se může objevit kdykoliv během života jedince a má různé příčiny. Známkami katabolismu je zvýšené štěpení bílkovin a tuků, negativní dusíková a energetická bilance, hyperglykemie a inzulinorezistence
Klinické stavy spojené se změnami metabolické rovnováhy
Katabolismus: zánět, infekce, trauma ,krvácení, operace, popáleniny, akutní i chronická onemocnění, léky (kortikoidy, noradrenalin), nádory ( nádorová kachexie),podvýživa.
Anabolismus: rekonvalescence ( zvyšování hmotnosti), hojení poranění,regenerace tkání, léky ( růstový hormon, inzulin,androgeny), přiměřené cvičení, fyzioterapie, nutriční podpora.
Malnutrice : je porucha výživy. Rozumíme tím každou poruchu výživy ve smyslu plus (nadvýživa, nadváha, obezita) nebo mínus (podvýživa).I při deficitu pouze jednoho prvku ( např. železa,jódu, atd) nebo vitaminu v lidském organismu, mluvíme o malnutrici.
Podvýživa: podvýživa má řadu příčin, které působí samostatně nebo častěji ve vzájemné kombinaci. Je vždy spojena se snížením tělesné hmotnosti. Tedy s úbytkem tělesného tuku a aktivní buněčné hmoty, zejména svalové, s nízkým BMI. Dochází ke ztrátám buněčných bílkovin, k poruchám fyziologických funkcí a v konečném důsledku k různým orgánovým dysfunkcím. Hlavními typy podvýživy jsou marasmus a kwashiorkor
Marasmus = prosté hladovění
Příčinou je dlouhodobé prosté hladovění, dlouhodobý nedostatek nebo chybění bílkovin a energie. Člověk musí využívat své vnitřní zásoby energie ( tukové zásoby, svalovou hmotu), jejichž postupným spotřebováním klesá tělesná hmotnost.. Marasmus se vyvíjí delší dobu (měsíce , roky) a dosahuje různého stupně.Při klinickém vyšetření je nemocný vyhublý ( kost a kůže) s nízkým BMI pod 19 kg/m2.Dochází k proporcionálnímu poklesu tělesné hmotnosti a ztrátě aktivní buněčné hmoty. Chybějí zásoby tuku v podkoží. Svalová hmota je zmenšená, a svalová síla snížená. Biochemicky je normální hladina sérových proteinů. Pokles tělesné hmotnosti o více než 24 – 40 % může být příčinou smrti nemocného.Úplné hladovění usmrtí zdravého a předtím dobře živeného dospělého jedince vážícího 70 kg asi během 50 – 70 dnů.
Kwashiorkor = stresové hladovění, hypalbuminemická malnutrice, kwashiorkor-like malnutrition
Je těžký deficit bílkovin za stresových situací při dostatečném přísunu energie.Vzniká dny až týdny,v klinickém obrazu jsou viditelné otoky a výpotky, jsou viditelné změny na kůži a vlasech, hepatomegalie se snížením albuminu a transferinu v plazmě, je snížen počet lymfocytů, je špatné hojení ran, snížená imunita, vysoké riziko infekcí a jejich komplikací, vysoká úmrtnost.
V našich podmínkách se s tímto typem podvýživy setkáme u hladovějících nemocných s akutním těžkým onemocněním, úrazem nebo popáleninou. Hmotnost nemocného se nemění, nebo se někdy paradoxně zvyšuje tvorbou otoků a hromaděním tekutiny v tělních dutinách. Příčinou je akumulace vody a soli v extracelulárním prostoru a jeho expanze, typický následek stresového hladovění.
Proteino- energetická malnutrice (PEM)
Marasmus a kwashiorkor jsou dva extrémy podvýživy. Na jedné straně nedostatečný přísun energie a na druhé nedostatek aminokyselin ve formě bílkovin. Mezi těmito dvěma krajními póly existuje široké spektrum stavů, kde různou mírou chybí energie, bílkoviny, vitaminy, minerály a stopové prvky.Tento stav je považován za nedostatečnou výživu nejčastěji.
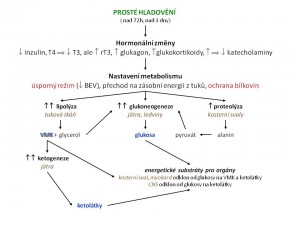
Patobiochemické a patofyziologické změny při prostém krátkodobém a dlouhodobém hladovění
Krátkodobému hladovění je vystaven každý člověk mezi jednotlivými jídly a zejména během nočního lačnění. Když ustane přívod živin z trávicího traktu, začne se látková přeměna postupně orientovat na štěpení zásobních látek v těle. Významnou roli při tom hrají hormony. Změna jejich produkce je vyvolána především poklesem glykemie. Jde o neurohumorální stresové odpovědi na hypoglykemii, při které klesá tvorba a uvolňování inzulinu a stoupá sekrece glukagonu, adrenalinu, ACTH,glukokortikoidů a v menší míře vazopresinu a angiotensinu II.
Glykémie je zpočátku udržována glykogenolýzou v játrech.Tento proces je spouštěn poklesem inzulinemie a vzestupem hladiny glukagonu a katecholaminů v krvi. Snížením hladiny inzulinu v krvi klesá vstup glukózy do inzulin -senzitivních tkání, a tím i její celková spotřeba, a naopak v tukové tkáni stoupá katabolismus triacylglycerolů. Glukagon stimuluje glykogenolýzu, glukoneogenezu, ihibuje proteosyntézu a zvyšuje svalovou proteolýzu.Glukóza je přednostně využívána mozkem a erytrocyty. Během jednoho dne hladovění spotřebuje mozek přibližně 150g glukózy, zatímco všechny ostatní orgány dohromady pouze asi 36g.Celková denní spotřeba glukózy během hladovění se tedy pohybuje kolem 186 g/ den.
Pokud hladovění trvá delší dobu, jaterní glykogen se nejdéle do 24 hodin vyčerpá a jediným zdrojem glukózy se stává glukoneogeneze. Pro glukoneogenezu je zpočátku mobilizováno denně asi 75 g svalové bílkoviny (tj. 300 g svalové tkáně). S postupujícím hladověním však proteolýza klesá a glukoneogeneza je zásobována laktátem (Coriho cyklus) a glycerolem ( viz metabolismus tuků).
V tukové tkáni naopak stoupá lipolýza. Denně je rozštěpeno asi 160 g neutrálních tuků na mastné kyseliny a glycerol.. V krvi stoupá koncentrace mastných kyselin, které jsou zdrojem energie pro řadu orgánů ( kosterní sval,myokard, játra). Játra energeticky využívají pouze malou část přiváděných mastných kyselin ( oxidace na vodu a CO2) a z přebytku syntetizují v procesu beta- oxidace ketolátky.
Při dlouhodobém hladovění jsou energetické potřeby většiny tkání kryty mastnými kyselinami a ketolátkami, tedy z tukových zásob.Také mozek postupně snižuje svou spotřebu glukózy a přechází na utilizaci ketolátek.Pouze erytrocyty jsou zcela závislé na přísunu glukózy, protože nemají mitochondrie a jsou odkázány na glykolýzu v cytosolu.
Cílem všech metabolických změn, které probíhají u zdravého člověka během hladovění, je redukovat ztráty tělesných bílkovin na nejnižší možnou míru, protože ztráta bílkovin znamená poruchu funkce orgánů a orgánová dysfunkce znamená nemoc, nebo smrt.
Odpad dusíku se během totálního hladovění po třech týdnech snižuje z 10 g / den na 4-5g/ den. Klesá celkový metabolismus a glukoneogeneza, naopak zvyšuje se lipolýza a zásoby tuku jsou rychle využívány jako zdroj energie.
Výsledkem dlouhodobého výrazného nedostatku nebo úplného chybění potravy je marasmus, tj. ztráta tělesné hmotnosti na vrub tělesného tuku a aktivní buněčné hmoty (kosterní sval, parenchym jater a ledvin, myokard, atd.).
Teoreticky by zdravý člověk, disponující 15 kg tukové tkáně, tj. energetickou zásobou 585 200 kJ (140 ooo) kcal), který má energetickou potřebu 7500 kJ/ den, mohl při úplném hladovění přežít asi 75 dní. Prakticky však většinou umírá po 50-60 dnech, protože tyto energetické zdroje nemohou být zcela využity. Během hladovění se vždy současně ztrácí také funkční, tkáňové proteiny a fungování jednotlivých orgánů se po určité době začíná hroutit.
Organismus se tedy na dlouhodobý nedostatek nebo úplné chybění potravy dokáže do značné míry adaptovat:
- Využívá zásoby glykogenu v játrech a kosterním svalu a z 1 gramu získá 16,7 kJ (4 kcal)
- Využívá zásoby tuku v tukové tkáni a z 1 gramu získá 29,3 kJ (7 kcal)
- Využívá bílkoviny kosterního svalu a z 1 gramu získá pouze 4,18 kJ (1 kcal), protože svalová bílkovina na sebe váže určité množství vody a minerálů
- Snižuje svou energetickou potřebu o více než 40 %
Fáze prostého hladovění
- Fáze = krátkodobé hladovění – organismus se snaží dostatečně zásobovat glukózou CNS, erytrocyty, leukocyty a kůru ledvin. Rozpadem jaterního glykogenu se uvolní do krve glukóza (glykogenolýza). Pro syntézu další glukózy v játrech ( glukoneogeneza) produkují svaly alanin a laktát, který vzniká také v hemopoetických buňkách. Z tukové tkáně se uvolňuje glycerol. Totální hladovění tak u zdravého člověka vede v prvních 2-3 dnech zejména ke ztrátě glykogenu a vody (-2kg, 2,3 % tělesné hmotnosti) a nemá prakticky žádný vliv na funkce jednotlivých orgánů.
- Fáze = dlouhodobé hladovění - dochází k metabolické adaptaci, při které hlavním zdrojem energie pro organismus se stává lipolýza v tukové tkáni, dodávající organismu dva energetické substráty – volné mastné kyseliny a ketolátky. Volné mastné kyseliny uvolňované z tukové tkáně lipolytickým štěpením triacylglycerolů ( neutrálních tuků) spolu s glycerolem , jsou zdrojem energie pro jaterní parenchym, kosterní sval a myokard . V procesu beta –oxidace vzniká v játrech z volných mastných kyselin další energetický substrát, ketolátky. Nyní jsou glukoneogeneza a proteolýza utlumeny. Pro buňky CNS se zdrojem energie stávají místo glukózy ketolátky. Tato biochemická změna v neuronech umožňuje hladovějícímu organizmu dlouhodobější přežití.
- Fáze = hormonální odpověď na hladovění, která je koordinována hypotalamem, ovlivňujícím funkci štítné žlázy, nadledvin a endokrinního pankreatu. K nejvýznamnějším změnám patří syntéza metabolicky inertního trijodtyroninu z tyroxinu (T4), tzv. reverzního trijodtyroninu (rT3) a pokles syntézy katecholaminů. U hladovějících nemocných ( např. mentální anorexie) zjišťujeme snížené plazmatické hladiny T3 a T4 při normální hodnotě TSH. Snižuje se spotřeba kyslíku. Klesá tvorba tepla, objevuje se hypotenze a bradykardie. Cílem všech těchto hormonálních změn je poskytnout tělu energii (tuky) a zároveň chránit tělesné bílkoviny a orgány a umožnit tak přežití jedince.
Počátkem 20. století se u člověka za smrtelnou považovala ztráta asi 40% tělesné hmotnosti u akutního a úplného hladovění a ztráta 50% původní hmotnosti během částečného hladovění ( 50% dietní příjem). Tato hranice je však velmi individuální. Přežití při hladovění závisí na ztrátě aktivní, netukové tělesné tkáně, ne na celkovém poklesu hmotnosti. Touto hranicí je ztráta 25-50% aktivní tělesné hmoty. Klíčovou roli zde hraje regulace oxidace tuků a bílkovin.Zatímco štíhlí lidé umírají po 40-70 dnech úplné hladovky, obézní vydrží hladovět mnohem déle ( až 200 dní). Metabolická odpověď na hladovění není tedy stereotypní. Pro delší přežití je důležitá nejenom celková zásoba energetických látek ve formě tukové tkáně, ale poměr získávání energie oxidací tuků a bílkovin.. Obézní lidé mají větší zásoby tělesných bílkovin ( netukové tělesné hmoty) než štíhlí lidé a v průběhu hladovění jsou jejich kumulativní ztráty dusíku menší a pokračováním hladovění se stále snižují. Obézní tak ( proti štíhlým) ztrácejí v průběhu hladovění méně aktivní, netukové tělesné hmoty a to jim prodlouží nebo zachrání život.
Biochemické procesy, které kontrolují výběr živin pro oxidaci a získávání energie při totálním hladovění nejsou zatím přesně známé, víme však, že:
1. U štíhlých probíhá glukoneogeneza z aminokyselin v játrech za vzniku urey, zatímco u obézních se glukóza tvoří hlavně v ledvinách za vzniku amoniaku.
2.Nárůst koncentrace sérových ketolátek, zejména v průběhu prvních 3 – 4 dnů hladovění, je až dvojnásobně vyšší u štíhlých než u obézních.
3. Snížení glukózové tolerance během hladovění je větší u štíhlých než u obézních.
Stresové hladovění (kwashiorkor-like syndrom, hypoalbuminemická malnutrice)
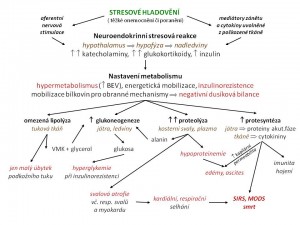
Tento typ hladovění se objevuje u do té doby zdravých, normálně živených lidí, náhle vystavených těžkému stresu, nejčastěji polytraumatu, rozsáhlým popáleninám či operaci, viceorgánovému selhání, nebo jakémukoliv těžkému onemocnění. Každé takové tělesné poškození vyvolá bezprostřední neuroendokrinní stresovou odpověď organismu spouštěnou mozkem, která je uniformní , nezávislá na typu poškození a je proporcionální intenzitě ( závažnosti ) poškození. Různé stresory tedy vedou ke stejné odpovědi organismu, která je tím větší, čím větší je působící stres.
Stresová odpověď může být modifikována věkem nemocného, fyziologickými rezervami, stavem výživy a latentními chorobami. Cílem stresové odpovědi je rychle mobilizovat endogenní zdroje, poskytnout dostatek energie a aminokyselin z těchto zdrojů pro obranné mechanismy (syntéza protilátek, cytokinů, proteinů akutní fáze, hojení poranění, atd.) a umožnit tak přežití jedince.
Neuroendokrinní reakce ovlivňuje rovnováhu vody a elektrolytů ( ADH, aldosteron) a stimuluje jak katabolismus ( katabolické hormony – adrenalin, noradrenalin, glukagon, glukokortikoidy) tak anabolismus ( anabolické hormony – STH, inzulin.
Na samém začátku stresové odpovědi stojí aktivace osy hypotalamus – hypofýza – nadledviny aferentní nervovou stimulací a/nebo ovlivněním mediátory zánětu ( IL-1, TNF- alfa, IL-6, eikosanoidy) v místě poškození. Z hypofýzy se uvolňují anabolické a katabolické hormony, které se prostřednictvím ACTH ( adrenokortikotropní hormon) vyplavují také z nadledvin. Přestože současně stoupá anabolismus i katabolismus, katabolické děje vždy převládnou a výsledkem je celková katabolická odpovědˇ organismu na stres, charakterizována hypermetabolismem, tedy zvýšenou spotřebou energie a kyslíku.
V kosterních svalech probíhá proteolýza, inzulin – dependentní periferní tkáně se stávají inzulinorezistentními a v extracelulárním prostoru je zadržována tekutina. Organismus je tekutinou přetížený a dochází k otokům.
Fáze odpovědi organismu na stres
Všeobecný adaptační syndrom je fylogeneticky stará, uniformní či stereotypní obranná reakce organismu na stres a tedy i stresové hladovění.
- Fáze odlivu - šoková fáze, trvající asi 24 hodin od začátku působení traumatu, ale může přetrvávat i několik dní. Je charakterizována významným snížením krevního průtoku většinou orgánů ( kromě mozku a myokardu) a poklesem metabolismu.. Výsledkem je snížení tělesné teploty, spotřeby kyslíku a energie.. Klesá srdeční výdej, stoupá periferní cévní rezistence a dochází k centralizaci krevního oběhu.Prudce narůstají hladiny stresových hormonů v krvi ( ACTH, katecholaminy, glukokortikoidy, STH). V této fázi je nejdůležitější přežití organismu jako celku,výživa je nepodstatná.Prioritu má zachování životních funkcí ( resuscitace).
- Fáze přílivu – hypermetabolická fáze, která trvá minimálně další 2-3 dny. Zvyšuje se metabolismus a ztráty dusíku, stoupá spotřeba kyslíku a energie. Organismus mobilizuje všechny své prostředky a rezervy k překonání následků poškození. Tato fáze představuje vlastní stresovou (zánětlivou) odpovědˇorganismu charakterizovanou hyperkatabolismem. Klíčovým katabolickým hormonem je kortizol, který mobilizuje aminokyseliny z kosterního svalu, aby tak poskytl substrát pro hojení poranění, syntézu proteinů akutní fáze v játrech a glukoneogenezu. S kortizolem se zde uplatňují také katecholaminy vyplavované zvýšeným tonem sympatiku dření nadledvin. Spolu s kortizolem a glukagonem stimulují katecholaminy glykogenolýzu a glukoneogenezu v játrech a lipolýzu v tukové tkáni. Stresová odpověď je stimulována a udržována probíhající sepsí, krvácením, hypoxií, nekrotickými tkáněmi, šokovým stavem, hypovolemií a bolestí.
- Fáze uzdravování – rekonvalescence, pro kterou je charakteristický anabolismus a pozitivní dusíková bilance.
Neuroendokrinní reakce organismu na stres:
Neuroendokrinní reakce je pro navození hyperkatabolického (hypermetabolického) stavu v organismu stěžejní, neboť je prokázána těsná provázanost neuroendokrinní reakce s imunitním systémem. Imunitní buňky mají na svém povrchu receptory pro různé neuroendokrinní peptidy, hormony a neurotransmittery ( CRH- corticotropin –releazing hormon, ACTH, kortikosteroidy, prolaktin, růstový hormon, endorfiny, enkefaliny).
Stresový metabolismus navozený endokrinními mediátory je zřejmě provázen také stresovými změnami imunitního systému. Imunocyty nejenže nesou receptory pro působení neuroendokrinních hormonů a neurotransmitterů, ale samotné jsou schopné také tyto látky syntetizovat. Imunitní systém produkuje peptidové hormony a současně pro ně vytváří receptory, které obvykle jsou v hypotalamo- hypofyzárním – nadledvinovém systému. Neuroendokrinní systém syntetizuje cytokiny ( IL- 1 beta, IL-2, IL-6, IFN- gama, TNF – alfa), které hrají významnou roli při regulaci metabolismu svou schopností navodit negativní dusíkovou bilanci, hubnutí a anorexii.
Změny metabolismu během stresového hladovění
Velkým pokrokem v oblasti objasnění energetických potřeb kriticky nemocných bylo objevení metabolických účinků mediátorů zánětu. Poraněná a hojící se tkáň produkuje tak významné množství biologicky aktivních látek, zejména z řad cytokinů, že lze mluvit o zvláštním, metabolicky aktivním orgánu. Ovlivnění tělesného metabolismu tímto „novým „ orgánem je tak veliké, že může vyčerpat zbytek organismu i na úkor jeho funkčnosti.
Vliv poraněné a hojící se tkáně na metabolismus lze shrnout do těchto bodů:
- Zvýšení bazálního metabolismu ( hypermetabolismus)
- Inzulinová rezistence – hyperglykemie
- Úbytek proteinů – otoky.
Při posuzování energetických potřeb organismu je proto třeba mít na zřeteli, že poškozená hojící se tkáň výrazně zasahuje do metabolismu postiženého jedince.
Charakteristickými známkami stresového hladovění jsou nízká hladina albuminu v séru a tvorba otoků. Na rozdíl od prostého hladovění nemocní neztrácejí tělesnou hmotnost, naopak mohou být i obézní, mají kožní defekty, otoky, často ascites a anasarku.
Každé těžké onemocnění vede ke zvýšení syntézy a uvolňování cytokinů a katabolických hormonů do organismu. Cytokiny navozenou zvýšenou cévní permeabilitou dochází k úniku vody, elektrolytů a proteinů s malou molekulou ( např. albuminu) do extravaskulárního prostoru. Tím klesá sérová hladina těchto látek ( hypalbuminémie) a objem intravaskulární tekutiny. Dochází k oběhové nestabilitě nemocného, která může vyústit až v hypovolemický šok. Organismus reaguje vyplavováním aldosteronu a antidiuretického hormonu. Voda a soli se v těle dále zadržují, prohlubují se otoky, a hypalbuminémie. Intravenózně podané solné roztoky unikají do intersticia, hypalbuminémie a otoky se ještě více zhoršují.
Stresový metabolismus = hladovění + stres ( trauma..) – maladaptace
Příčiny maladaptace:
- Zvýšení cévní permeability – hypalbuminémie, otoky
- Imunomodulátory
- Mediátory stresové odpovědi – syntéza proteinů akutní fáze
- Inzulinová rezistence ( IL-6)
- Glykogenolýza, glukoneogeneze, lipolýza
- Proteolýza-glutamin
- Inzulinorezistence – hyperglykemie
3. Sympatický nervový systém
4. Hypotalamo –hypofyzární- nadledvinkový systém
5. katabolická ( stresová odpověď organismu)
Systémová zánětlivá reakce je součástí každé těžké a chronické stresové reakce
Aktivní účast mají v tomto směru především cytokiny ( TNF-alfa, IL-1, IL-6) – především také aktivací imunitního systému, produkované především makrofágy a lymfocyty:
- Především regulují imunitní reakce, ovlivňují tonus autonomního nervového systému i tvorbu hormonů
- Mají i přímé metabolické účinky: aktivují rozpad strukturálních proteinů kosterního svalstva, transport aminokyselin ze svalů do viscerálních tkání, stimulují syntézu RAF v játrech, lipomobilizaci, glukoneogenezu, rozvoj inzulinorezistence.
- Zvyšují metabolický obrat – pro efektivní obnovu a reparaci poškozených struktur a syntézu látek potřebných pro obranu organismu.
- V organismu jako celku vyvolávají katabolické reakce.
- Aktivuje se glukoneogeneze- hyperglykemie : až 50g glukózy /den (běžně 100-200g) – kortizol, katecholaminy
- Zvýšená nabídka substrátů vede k výrazné aktivaci alaninového a laktátového cyklu
- Kontraregulační hormony a cytokiny stimulují inzulinorezistenci
- Aktivuje se hormon-senzitivní lipáza, inhibuje se lipoproteinová lipáza
- Dochází ke zvýšené plazmatické koncentraci MK – ty pak mají podíl na hyperglykemii a inzulinorezistenci
- Dochází k poklesu ketonemie ( MK v játrech jsou používány na syntézu TAG-VLDL-což vede ke steatóze jater, akumulaci TAG ve svalech, dojde ke vzestupu TAG v plazmě = což zase odpovídá působení cytokinů
- Dochází k aktivaci proteolýzy v kosterním svalu ( kortizol, cytokiny) – to vede ke zvýšení metylhistidinu v plazmě a moči
- AMK uvolněné do krve jsou použity k syntéze komplementu, RAF, protilátek, dále k reparaci poškozených struktur, ke glukoneogeneze, slouží i jako energetický substrát
- U závažných stavů dojde ke zvýšení utilizace glutaminu imunitním systémem. Syntéza nukleotidů, energetický substrát
- Hlavní energetickým substrátem pro kosterní sval jsou větvené AMK (BCAA) – zdroj NH2 skupiny pro syntézu glutaminu a alaninu
- U systémových zánětlivých reakcí je deficit argininu ( sepse) – což vede k omezení produkce NO
- Aktivace proteolýzy a zvýšení utilizace BCAA je pro organismus rizikovou záležitostí – vede k rychlé kachektizaci a narušení homeostázy.
Vliv nedostatečné výživy na fyziologické funkce
1. Mentální funkce ( deficit vit B12, Ca, Mg ,P) – anxieta, deprese
2. Kardiovaskulární funkce ( deficit proteinů, vit. B6, minerálů)
- ztráta asi 30% hmoty srdce ( redukce myokardu, zmenšení objemu dutin) → snížení srdečního objemu → hypotenze → kolaps/ oběhové selhání
3. Plíce (respirační funkce → deficit proteinů → oslabení dýchacích svalů → snížená odpověď na hypoxii a hyperkapnii
4. Trávicí trakt
- deficit potravy ve střevním lumen – zpomalení rychlého obratu enterocytů a kolonocytů- atrofie střevní sliznice ( zmenšení klků a krypt)- porucha funkce střevní bariéry+ malabsorpce
- deficit trávicích enzymů ( snížení gastrické, pankreatické a biliární sekrece)- malabsorpce
- změny střevní mikroflóry – malabsorpce, průjem
- hladovění a velká ztráta tělesné hmotnosti- hypotermie, porucha vasokonstrikce – snížení teploty tělesného jádra o 1-2 stupně- zhoršení kognitivních funkcí, diskoordinace, zmatenost, svalová slabost
- Hladovění – porucha funkce T-lymfocytů, snížení syntézy komplementu ( porucha fagocytózy, chemotaxe a intracelulární destrukce bakterií) a cytokinů ( IL-1)
- správná dieta zlepší hojení ran během týdne
- zhoršení- zpomalení a růstu, kostního vyzrávání a pohlavního dospívání