Definice ischemické choroby srdeční (ICHS)
Ischemická choroba srdeční je projevem lokální tkáňové hypoxie až ischémie na podkladě patologického zúžení průsvitu věnčitých tepen přivádějících krev k postižené oblasti myokardu. Pro označení ICHS se používají i jiné termíny, jako jsou koronární nemoc, nemoc věnčitých tepen nebo kardiovaskulární nemocnění, které jsou významově širší, a proto méně přesné.
Epidemiologie
ICHS odpovídá za téměř za polovinu všech úmrtí v rozvinutých zemích západního typu. Postihují více než 85 % osob nad 50 let.
Fyziologické a patofyziologické základy
Strukturním podkladem funkce svalového vlákna myokardu jsou cytoplazmatická myofilamenta. Tlustá myofilamenta jsou tvořena těžkými a lehkými řetězci myosinu. Jejich hlavičky (lehké řetězce) mají ATPázovou aktivitu. Tenká myofilamenta jsou z molekul aktinu, tropomyosinu a troponinu (TN). Troponinové molekuly jsou dvojího typu, TN-I a TN-C. Vytvářejí spolu komplex. Dokud se na TN-C nenavážou ionty Ca2+, TN-I brání interakci mezi aktinem a myosinem. Vazba Ca2+ na TN-C na začátku svalového stahu odblokuje inhibici interakce mezi myosinovými a aktinovými filamenty a umožní jejich klouzání po sobě navzájem. Myosin a troponiny se ze svalových vláken vyplavují při jejich poškození. Slouží jako významné klinické markery zániku myocytů.
Nástrojem přeměny chemické energie v energii mechanickou je koordinovaná fosforylace a defosforylace v aktivním místě lehkých řetězců myosinu. Zdrojem fosforečné skupiny pro fosforylaci je ATP. Navázání ATP do aktivního místa provází relaxace vláken (výchozí stav). Po příchodu impulsu na začátku stahu se za přispění komplexu kalmodulin-Ca2+ aktivuje myosinová kináza a lehké řetězce se fosforylují. Fosforylace vyvolá konformační změnu lehkých řetězců. Tato změna je vlastním podkladem mechanické práce (stahu). Odštěpení fosforečné skupiny z myosinu (defosforylaci myosinu) po dokončení stahu, a tím uvolnění vazebného místa pro vazbu další molekuly ATP a relaxaci svalu, zprostředkuje fosfatáza. Pohotovostní zásobu vysokoenergetických fosforečných skupin tvoří kreatinfosfát. Srdeční kreatinkináza (izoenzym CK-MB), spojená s tvorbou kreatinfosfátu, je dalším významným klinickým markerem fatálního poškození myocytů.
Bezprostřední fyziologický impuls k fosforylaci myofibril, a tím stahu svalového vlákna, přichází od elektricky polarizované plazmatické membrány myocytu. Membránové procesy, které provázejí stah a jeho opětovné uvolnění, spočívají v depolarizaci a opětovné repolarizaci svalového vlákna. Projevují se elektrickým akčním potenciálem. Podkladem akčního potenciálu jsou mohutné iontové toky a změny nerovnoměrného rozdělení iontů, především Na+, K+ a Ca2+, napříč plazmatickou membránou. Obnovení polarizace vyžaduje mimořádné množství energie, jejímž primárním zdrojem je ATP.
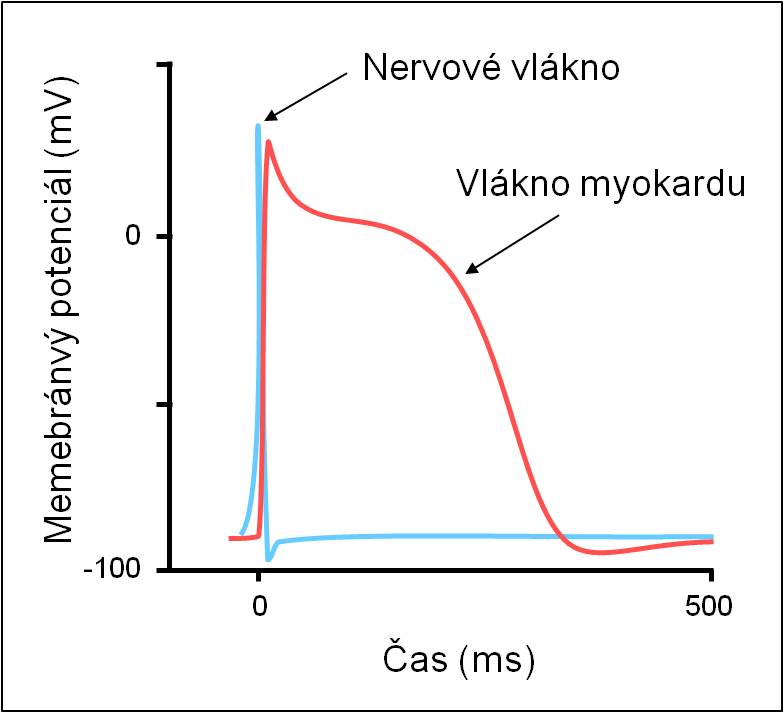
Tvorba akčních potenciálů není jen výsadou myokardu. Je zřetelně vyjádřena i u jiných buněk. Akční potecniály srdečního svalu nicméně mají svou specifičnost. Významně se odlišují svou dlouhou dobou trvání. Tento charakteristický rys stahu srdečních vláken je hlavně způsoben odlišnou dynamikou iontů Ca2+.
Obr. 1. Akční potenciál srdečního svalového vlákna. Prodloužené plató akčního potenciálu vláken srdečníhosvalu ve srovnání s akčním potenciálem nervových vláken je způsobeno odlišnou dynamikou trasnportu iontů Ca2+.
Ionty Ca2+, potřebné pro svalový stah, vstupují v depolarizační fázi do vláken myokardu jednak zvnějšku (malá část, „startovací dávka“), jednak z interní zásobárny v endoplazmatickém (sarkoplazmatickém) retikulu (hlavní část):
- Pro přestup iontů z extracelulárního prostředí slouží:
- Kalciové kanály typu L;
- V závislosti na velikosti gradientů ho může obstarat i Na+/Ca2+-antiport.
- Přestup iontů kalcia z cisteren endoplazmatického retikula zprostředkují:
- Kanály řízené ryanodinovými receptory;
- Kanály stimulované inositoltrisfosfátem.
V repolarizační fázi pak je nezbytné ionty Ca2+ z cytoplazmy odčerpat. Hlavními transportními systémy pro odstraňování Ca2+ z cytoplazmy svalového vlákna myokardu jsou:
- Membránová transportní Ca2+-dependentní ATPáza plazmatické membrány(primární aktivní transport z cytoplazmy do extracelulárního prostedí);
- Na+/Ca2+-antiport (sekundární aktivní transport);
- Membránová transportní Ca2+-dependentní ATPáza sarkoplazmatického retikula (primární aktivní transport z cytoplazmy do cisteren sarkoplazmatického retikula).
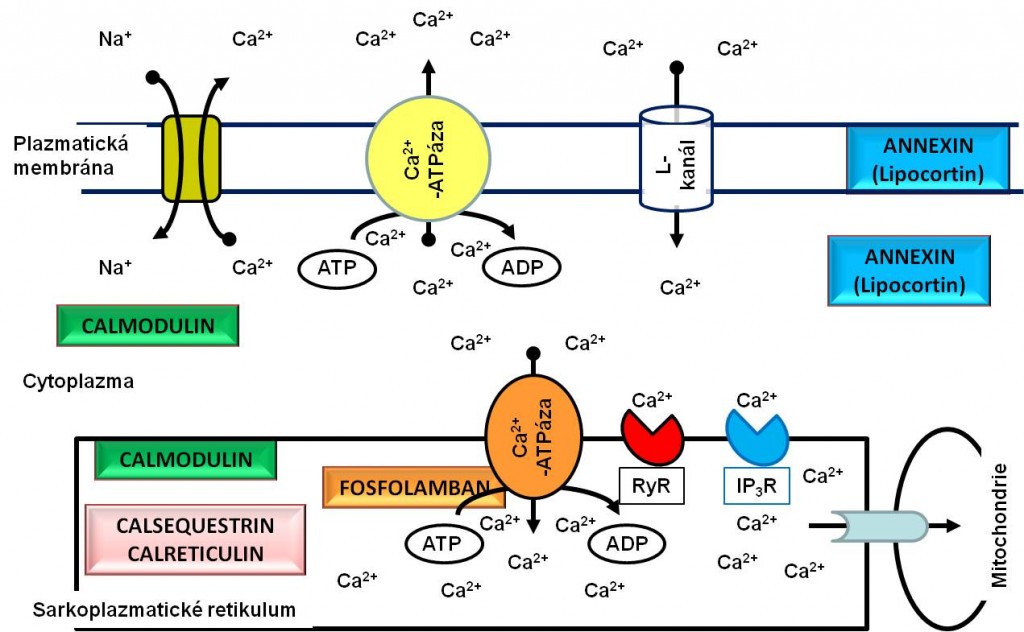
Koloběh kalciových iontů v cytoplazmě znázorňuje níže uvedené schéma.
Obr. 2. Cesty vstupu a eliminace vápenatých iontů v buňce srdečního svalu. RyR – ryanodinový receptor; IP3R – inositoltrisfosfátový receptor.
Vstup kalciových iontů do buněk je možno farmakologicky inhibovat blokátory kalciových kanálů. Jejich aplikace vede ke snížení vzrušivosti a dráždivosti myokardu. Pro tyto účinky se inhibitory využívají jako antiarytmika. Blokátory kalciových kanálů také snižují riziko přetížení buněk kalciovými ionty, a tím zranitelnost myokardu ve fázi reperfúze (viz reperfúzní fenomény, kalciový paradox, kalciová hypotéza).
| Ca2+ (mol/l) | Buňka |
| 10-4 | Smrt |
| 10-5 | Poškození |
| 10-6 | Výkon funkcí |
| Stimulace buňky | |
| 10-7 | Klidová koncentrace |
Tabulka 1. Přehled závislosti stavu buňky na cytoplazmatické koncentraci kalcia.
Srdeční sval má v přepočtu na jednotku hmotnosti jednu z nejvyšších spotřeb kyslíku mezi ostatními tkáněmi a orgány. Zároveň má nejvyšší arteriovenózní diferenci koncentrací kyslíku. Tyto vlastnosti jsou dány zvláštnostmi metabolismu v srdečním svalu, zejména vysokým podílem substrátů s vysokým respiračním kvocientem (mastných kyselin a ketolátek) na hrazení jeho energetických potřeb.
| Orgán | Spotřeba O2 (ml O2/min/100 g tkáně) |
| Mozek | 3 |
| Ledviny | 5 |
| Střevo v klidu | 2,5 |
| Kůže | 0,2 |
| Kosterní sval | |
| V klidu | 1 |
| Při námaze | 50 |
| Srdce | |
| Při zástavě | 2 |
| Klidový srdeční výdej | 8 |
| Těžká námaha | 70 |
Tabulka 2. Srovnání spotřeby kyslíku v orgánech.
| Orgán | A-V diference O2 (obj. % O2; ml O2/100 ml krve) |
| Mozek | 4 – 6 |
| Ledviny | 2 – 3 |
| Kůže | 1 – 2 |
| Střevo v klidu | 4 – 6 |
| Kosterní sval v klidu | 2 – 5 |
| Srdce (klidový srdeční výdej) | 10 – 12 |
Tabulka 3. Srovnání kyslíkové A-V diference v různých orgánech.
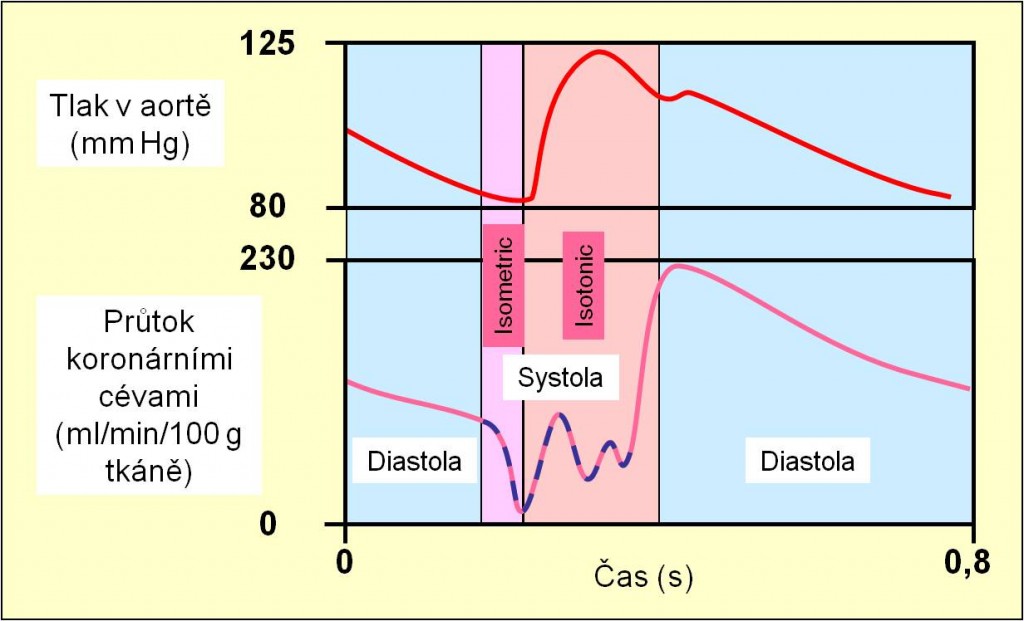
Koronární artérie se zanořují do myokardu z vnějšího povrchu a míři k vrstvám pod endokardem. Čím jsou jejich větve jemnější, tím jsou snáze stlačitelné. V izometrické fázi systoly v nich může krevní průtok klesat až k nule. Zásobení myokardu kyslíkem proto v průběhu cyklu značně kolísá. Z této skutečnosti vyplývá, jakou důležitost má pro funkci srdce přiměřené trvání fáze relaxace (diastoly). Jen tak může být zajištěna rovnováha mezi spotřebou a přívodem O2.
Obr. 3. Průtok krve myokardem v průběhu srdečního cyklu. Schéma je možno zhlédnout i v animované podobě.
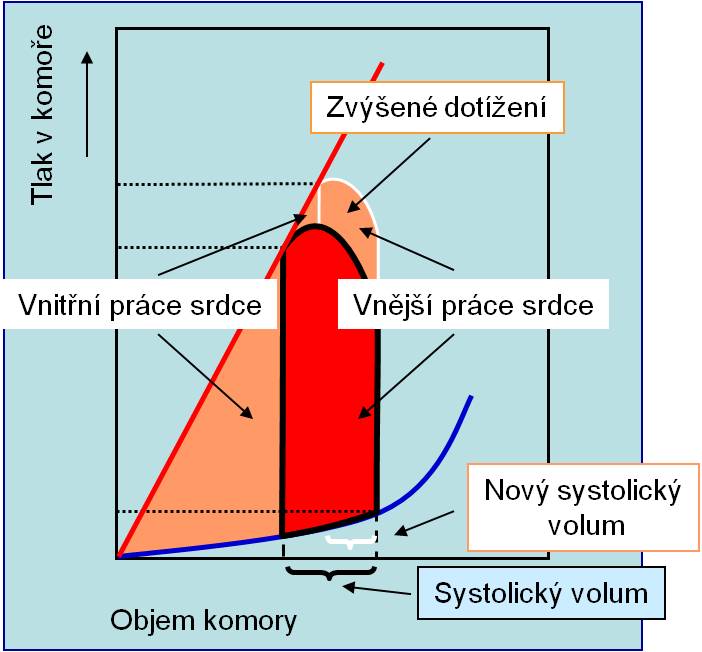
Spotřeba kyslíku v myokardu koreluje s celkovou prací srdce vyjádřenou plochou pod křivkou „systolický objem-tlak“. Tento ukazatel roste při zvýšeném dotížení. Je za to odpovědný nárůst vnitřní práce. Vnější práce naproti tomu může při zvýšeném dotížení klesat. Spotřeba kyslíku tak nejtěsněji koreluje s napětím svalu ve fázi izometrické kontrakce. Spotřeba kyslíku také roste se zvýšením kontraktility.
Obr. 4. Vnitřní práce jako ukazatel spotřeby kyslíku v srdci.
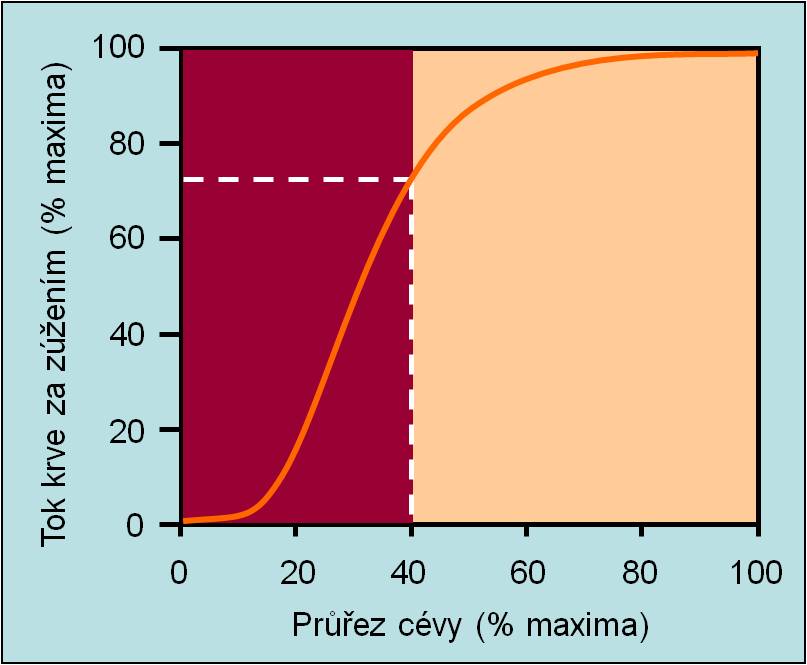
Fyziologická rezerva průtoku krve koronárními cévami je asi 6násobná (3 – 9násobná) ve srovnání s klidovým stavem. Při stenóze klesá. Je namístě mít na paměti, že průtok krve je znatelně redukován (o více než 25 %) teprve při zúžení průsvitu cévy větším než 60% (tj. téměř o 2/3). Omezení krevního průtoku v závislosti na zůstatkovém průsvitu cévy ilustruje následující obrázek.
Obr. 5. Průtok krve cévou v závislosti na zúžení průsvitu. Klinicky významné zúžení je větší než o 60 % původního průsvitu.
Dodávka krve a kyslíku do myokardu je řízena jednak lokálně, jednak centrálně. Lokání autoregulaci zajišťují následující mediátory:
- Vazodilatační:
- Adenosin;
- NO;
- Eikosanoidy – PGI2, PGE2;
- Vazoaktivní peptidy.
- Vazokonstrikční:
- Endotelin;
- Eikosanoidy – TXA2;
- Vazoaktivní peptidy.
Lokální autoregulace může být modifikována centrálními mechanismy:
- Nervovými vlivy;
- Humorálními vlivy (katecholaminy).
Příčiny a rizikové faktory ICHS
Přehled příčin ICHS:
- Ateroskleróza:
- Vůbec nejčastější bezprostřední příčinou akutní ischémie je vznik trombu na aterosklerotickém podkladě;
- Ateroskleróza tak je příčinou zúžení a ischémie v 95 % všech případů ICHS;
- Může způsobovat až nekrózu (infarkt).
- Vzácně:
- Spasmy koronárních cév;
- Embolie;
- Arteritis;
- Velice vzácně – trombóza v koronární tepně bez aterosklerózy.
Obr. 6. Příčiny ICHS.
Rizikové faktory ICHS tudíž korelují s rizikovými faktory aterosklerózy a arteriální trombózy:
- Kouření – zvyšuje riziko onemocnění asi 3 – 6krát;
- Diabetes mellitus – zvyšuje riziko onemocnění asi 2 – 4krát;
- Dyslipidémie – zvyšují riziko onemocnění asi 2krát;
- Arteriální hypertenze – výrazně zvyšuje riziko cerebrovaskulárních a kardiovaskulárních příhod, v menší míře způsobuje postižení tepen dolních končetin;
- Nízká tělesná aktivita;
- Věk.
Na zvýšené riziko aterosklerózy a periferního arteriálního onemocnění lze usuzovat z hodnot biomarkerů. Hlavní klinické markery rizika aterosklerózy jsou:
- Lipidové a lipoproteinové markery:
- LDL cholesterol a HDL/LDL cholesterol
- Lipoprotein(a) (Lp(a))
- Zánětlivé markery: C-reaktivní protein (CRP)
- Hemostatické faktory: Zejména fibrinogen (mnohé zdroje ho považují za dosud jediný hemostatický faktor se skutečně potvrzeným vlivem na výskyt cévních komplikací)
- Protilátky: Antifosfolipidové protilátky (APA)
- Hyperhomocysteinémie a některé jiné
Změny v myokardu po okluzi cévy
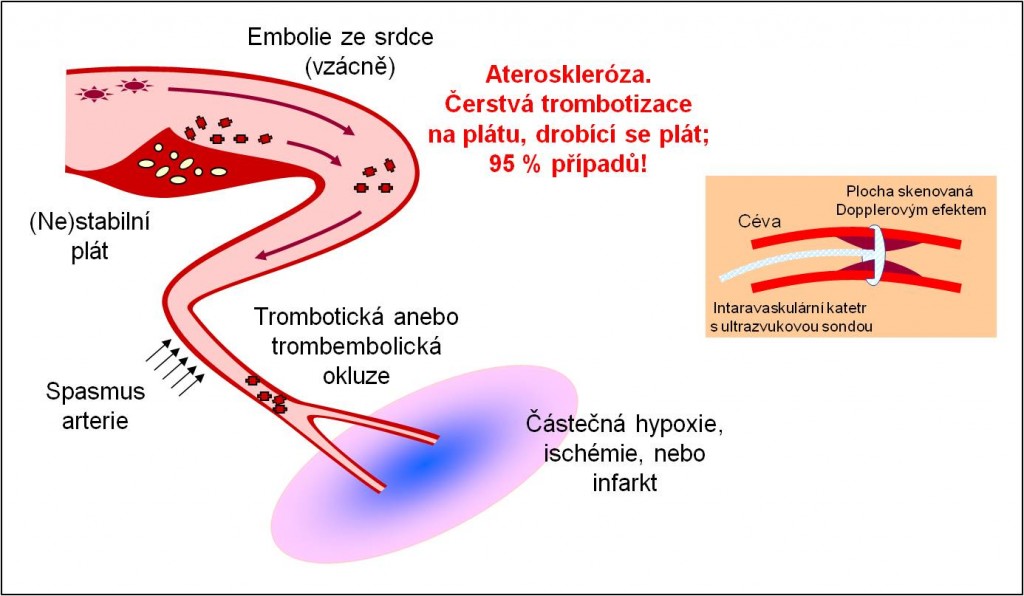
Postup akutní okluze koronární arterie lze popsat následovně:
- Aktivace trombózy:
- Lokální dysbalance faktorů přítomných v lumen cévy anebo v její stěně;
- Podíl endotelové dysfunkce (snížení NO, PGI2);
- Podíl zánětu (v aterosklerotickém ložisku);
- Mikroskopická fisura, ruptura nebo exulcerace plátu;
- Aktivace destiček; agregace destiček (zvýšení TxA2, vazba fibrinu na glykoproteinový receptor GP IIb/IIIa trombocytů); primární zátka;
- Koagulace; fibrinová zátka;
- Neúplně obturující trombus;
- Lokální dysbalance faktorů přítomných v lumen cévy anebo v její stěně;
- Úplně obturující trombus;
- Pamatovat na účast spasmu postižené artérie.
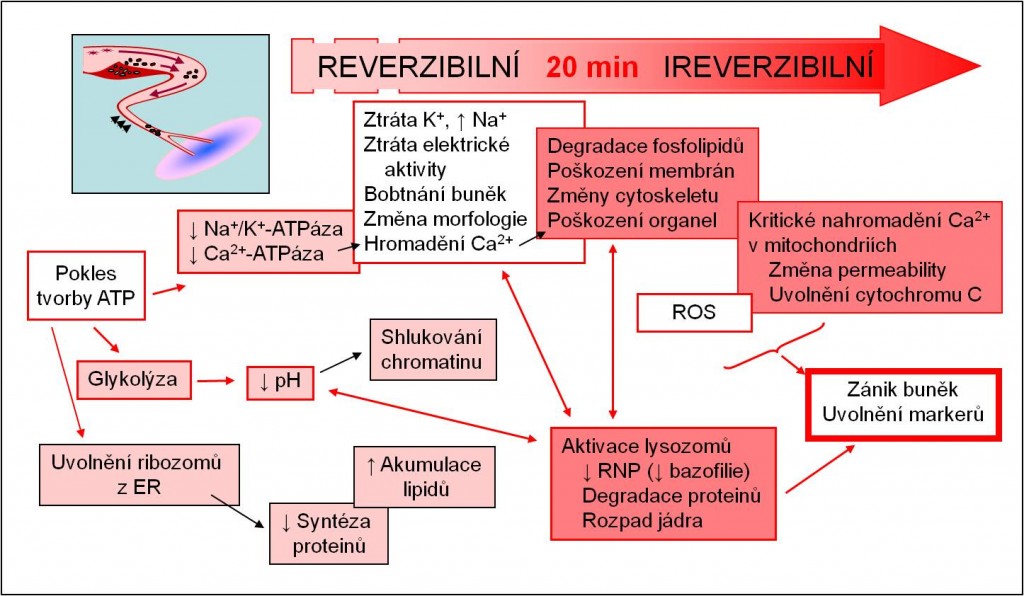
Hlavní nitrobuněčné změny po kritickém omezení přívodu krve a kyslíku:
- Pokles ATP
- Nedostává se ATP pro udržení iontových gradientů na plazmatické membráně;
- Výstup K+ z buněk, vstup Na+ do cytoplazmy
- Je trvale přítomna částečná až úplná depolarizace srdečních svalových vláken v místě ischémie, je vysoká koncentrace iontů kalia extracelulárně v místě ischémie, iontové dysbalance zasahují i okolí ložiska; vliv na vzrušivost a drážpost vláken přímo nezasažených ischémií;
- Vstup Ca2+ do cytoplasmy
- Přetížení buněk kalciem;
- Hromadění laktátu z anaerobních pochodů;
- Intra- a extracelulární acidóza v místě ischémie, šíří se i do okolí ložiska; vliv na vzrušivost a drážpost vláken přímo nezasažených ischémií;
- Při dosažení kritické hranice ischémie dochází po 20 minutách k nevratnému rozpadu (nekróze) svalových vláken.
Obr. 7. Schematické zobrazení postupu ischemického poškození buněk myokardu.
Doba přežívání svalových buněk a postup alterace stěny komory
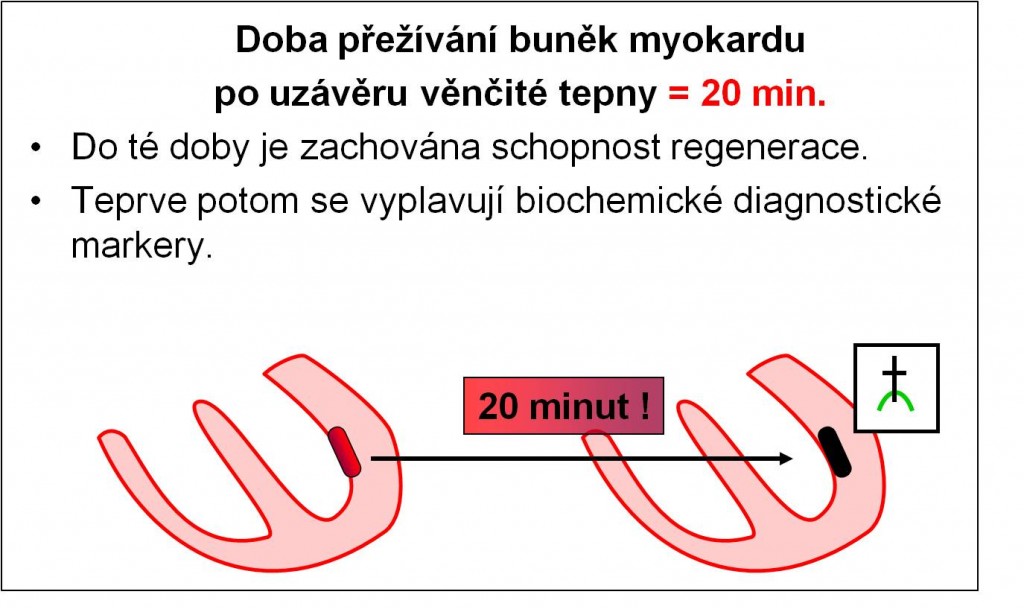
Srdeční svalová vlákna nemohou při nedostatku kyslíku tvořit dostatečné množství ATP. Váznou iontové membránové děje, mizí akční potenciály, vlákno ztrácí své stažlivé a relaxační schopnosti. Doba přežití buněk myokardu při dosažení kritické ischémie po úplném uzávěru věnčité tepny je 20 minut. V tomto intervalu je poškození reverzibilní – je zachována schopnost regenerace, a pokud se obnoví dodávka kyslíku, obnoví se i funkce vlákna. Tato skutečnost má prvořadý klinický význam. Ukazuje, jak důležité je co nejdříve poskytnout postižené osobě odpovídající kvalifikovanou pomoc.
Obr. 8. Doba přežití svalových buněk myokardu po dosažení kritické ischémie.
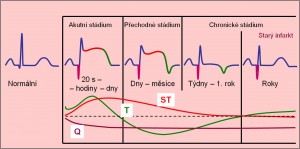
Pokud se pomoci nedostane, pak poté, co dojde k rozpadu buněk, se spolu s ostatními cytoplazmatickými složkami vyplavují z vláken biochemické diagnostické markery. Nejprve, tzn. nejdříve po 20 minutách, jsou zjistitelné jen v koronárním venózním splavu, později, jak jejich koncentrace postupně narůstá, je lze detekovat i v periferní krvi. Zde je lze stanovit nejdříve po 2 – 4 hodinách.
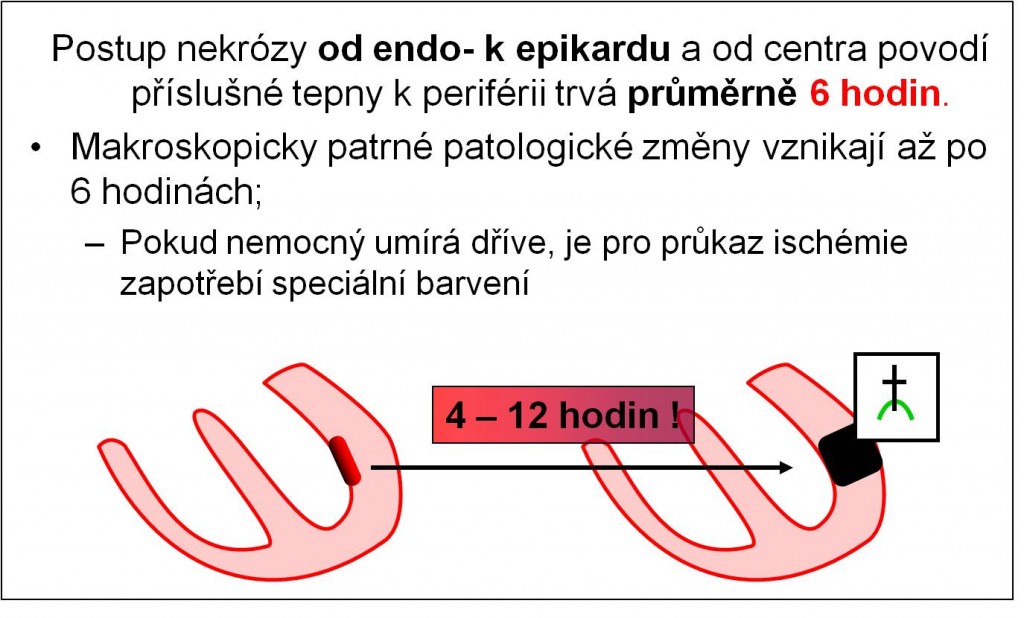
Další klinicky důležitá skutečnost spočívá v tom, že nekróza obvykle nezasahuje celé ložisko a celou tloušťku myokardu najednou. Obvykle se šíří od endokardu k epikardu a od centra povodí příslušné tepny k periférii. Průměrně trvá 6 hodin, než nekróza prostoupí od endokardu tloušťkou celé stěny (4-12, výjimečně 24 hodin). Velká část vláken tak může být včasnou léčbou zachována. I tato okolnost ukazuje na mimořádnou důležitost včasné odborné pomoci.
Obr. 9. Postup nekrózy stěnou myokardu.
Šance na přežití co největšího počtu vláken jsou tím větší, čím dříve se obnoví průchodnost koronární cévy a dodávka kyslíku. To zmenšuje rozsah následné nepříznivé remodelace postižené komory. Makroskopicky patrné patologické změny provázející ischémii myokardu vznikají až po 6 hodinách; pokud nemocný umírá dříve, je pro histologický průkaz ischémie zapotřebí speciální barvení.
| Čas | Změny |
| 20 s | Pokles ejekční frakce, pokles arteriálního tlaku, bolest, úzkostAktivace sympatiku: studený pot, tachykardie, bledostPočáteční změny v EKG |
| 20 min | Doba přežívání buněk: Smrt buněk |
| 2 – 4 hod | Vzestup markerů v periferní krvi |
| 6 – 12 hod | Prostup nekrózy stěnou myokardu |
Tabulka 4: Shrnutí hlavních klinicko-patologických změn v ischemizovaném myokardu.
| Čas | Změny |
| 0 | Uzávěr tepny |
| 5 s | Porucha relaxace stěny komory (= porucha repolarizace; chybí ATP!) |
| 6 s | Porucha kontraktility stěny komory |
| 15 s | Pokles ejekční frakce |
| 20 s | Počáteční změny v EKG |
| 25 s | Klinické příznaky ischémie v podobě anginy pectoris |
| 6 min | Růst laktátu v koronárním sinu |
| 20 min | Rozpad buněk (nastává růst troponinů a myoglobinu v koronárním sinu) |
| 2 – 4 hod | Začátek růstu troponinů, myoglobinu, CK-MB v periferní krvi |
| 4 – 6 hod | Pozitivní tetrazoliová reakce v myokardu |
Tabulka 5: Podrobnější postup klinicko-patologických a patofyziologických změn v čase po uzavření koronární tepny.
Dysfunkce myokardu
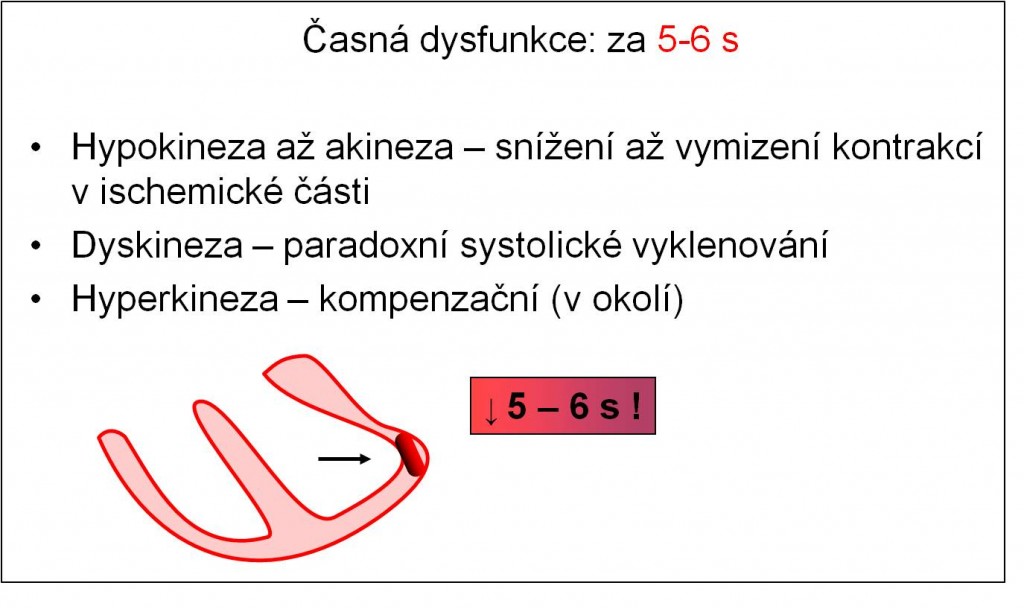
Časná dysfunkce komory se rozvíjí za 5 – 6 s po uzavření koronární cévy a projevuje se následovně:
- Hypokineza až akineza – snížení až vymizení kontrakcí v ischemickém ložisku;
- Dyskineza – paradoxní systolické vyklenování v postižené části myokardu;
- Hyperkineza – kompenzační zesílení kontrakcí svaloviny v okolí postižené části myokardu.
Obr. 10. Následky časné dysfunkce.
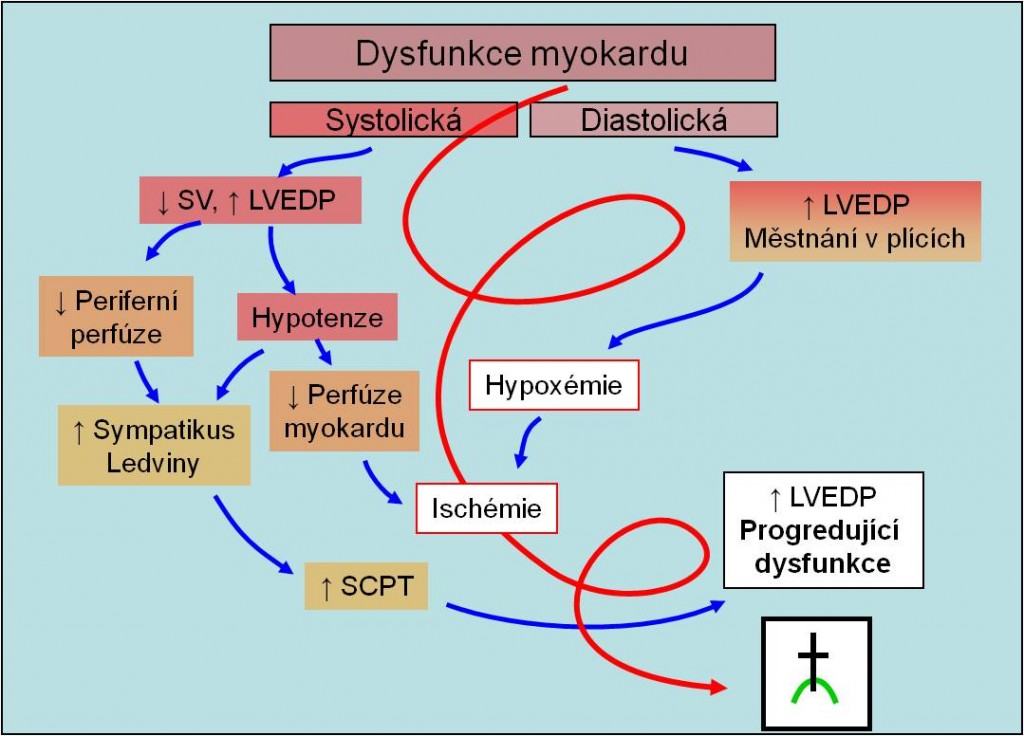
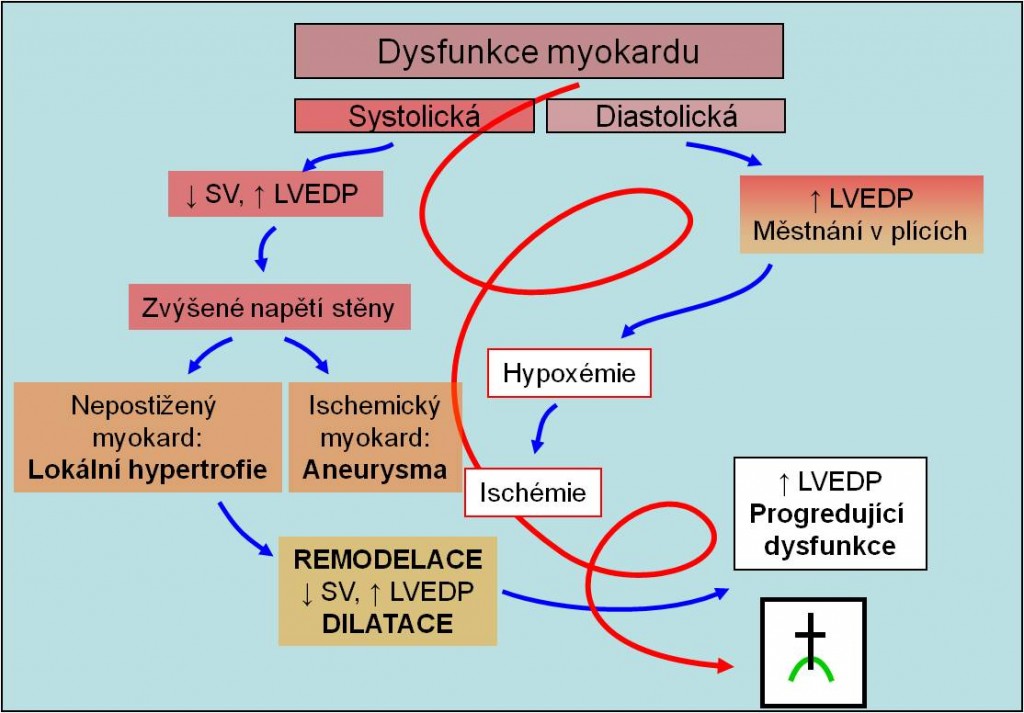
Hlavním následkem časné dysfunkce je pokles ejekční frakce (EF) a srdečního výdeje. K poklesu ejekční frakce dochází už za 15 s po uzavření koronární arterie. Klasifikuje se následovně:
- EF > 55 % = normální;
- EF 45-55 % = lehce snížená;
- EF 35-45 % = výrazně snížená;
- EF < 35 % = velký rozsah infarktu, špatná prognóza;
- EF 15-20 % = hodnoty typické pro kardiogenní šok.
Obr. 11. Časná dysfunkce a spirála kardiálního šoku. Podle: Harrison’s Principles of Medicine, 15th Ed. McGraw-Hill, 2001.
Remodelace myokardu
Nekróza se hojí jizvou. Remodelace komory po prodělaném infarktu má kompenzovat výpadek zjizvené tkáně. Při velkých anebo nevhodně umístěných jizvách je obtížné dosáhnout efektivní kompenzace. Přítomnost remodelace je prognosticky nepříznivým jevem. Zvyšuje práci zachovaných oblastí srdeční svaloviny a ztěžuje vyprazdňování srdce. V dlouhodobém horizontu může podporovat anebo způsobit selhání srdce. Její dvě hlavní formy jsou:
- Ložisková dilatace (aneurysma) komory
- Celková dilatace komory
Nejdůležitější preventivní opatření spočívají ve:
- Včasné rekanalizaci cévy – umožňuje zachránit co nejvíce svaloviny
- Snížení nitrokomorového (hl. systolického) tlaku
Obr. 12. Remodelace a spirála kardiálního šoku. Podle: Harrison’s Principles of Medicine, 15th Ed. McGraw-Hill, 2001.
Formy ICHS
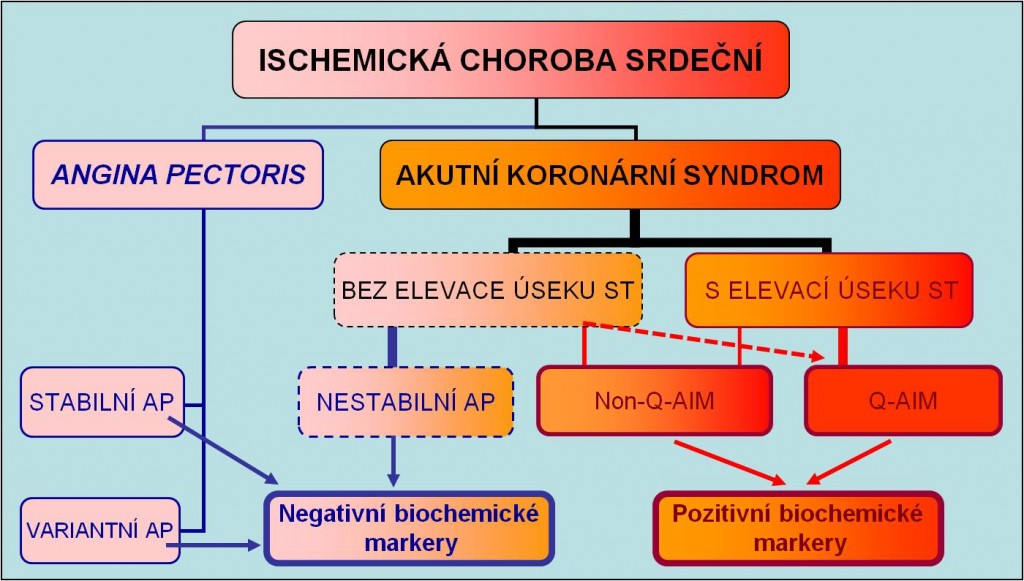
Ischemická choroba srdeční se projevuje několika formami. Existuje určitá korelace mezi povahou aterosklerotických plátů a jejich klinickými projevy. Rovněž existuje korelace mezi neúplnou, popř. úplnou okluzí přívodní tepny a nepřítomností, poř. přítomností ST elevací. Tyto vztahy je možno popsat následovně:
- Stabilní plát anebo stabilní fibrotizovaný nástěnný trombus jsou častou příčinou následující formy ICHS:
- Stabilní angina pectoris;
- Nestabilní plát a nástup trombózy na něm, která neúplně obturuje přívodní tepnu, jsou častou příčinou následujících forem ICHS:
- Akutní koronární syndrom:
- Nestabilní angina pectoris (non-STE stav);
- Non-STE-AIM:
- Non-Q-AIM;
- Q-AIM (zřídka).
- Akutní koronární syndrom:
- Masivní trombóza a úplná okluze tepny jsou v kardiologii spojovány pouze s následující formou ICHS:
- Akutní koronární syndrom:
- STE-AIM
- Q-AIM (většinou);
- non-Q-AIM (méně často).
- STE-AIM
- Akutní koronární syndrom:
Klasifikace forem ICHS
Potřeba klasifikace forem ICHS vyplývá z potřeb klinické diagnostiky, z níž zase vychází léčba srdečních ischemických stavů. Přijaté klasifikační schéma ICHS je nuto chápat tak, že spíše popisuje vývojová stadia nemoci než izolované anebo na sobě nezávislé klinické formy. Následující přehled seřazuje ischemické formy od méně těžkých k těžkým stavům a uvádí také zvláštní formy ICHS:
- Angina pectoris (AP):
- Stabilní;
- Ponámahová angina s non-STE projevy v záznamu EKG.
- Spastická (variantní neboli Prinzmetalova)
- Je na pomezí mezi stabilní a nestabilní anginou pectoris. Harrisonovy Základy interní medicíny ji zařazují jako formu nestabilní anginy. V záznamu EKG může překvapivě mít i STE projevy (Harrison’s Principles of Medicine, 15th Ed. McGraw-Hill, 2001).
- Stabilní;
- Akutní koronární syndrom (ACS):
- Nestabilní angina pectoris (non-STE projevy);
- Akutní infarkt myokardu (AIM) (non-STE i STE projevy):
- Non-STE-AIM;
- STE-AIM.
- Zvláštní formy ICHS:
- Koronární syndrom X;
- Němá (tichá) ischémie (neplést s němým AIM);
- Stavy po akutní ischémii a revaskularizační terapii:
- Omráčený myokard;
- Stavy po opakovaných epizodách přechodné vratné ischémie:
- Myokard částečně adaptovaný na ischémii.
- Stavy po chronické ischémii a revaskularizační terapii:
- Hibernovaný myokard
Obr. 13. Zařazení akutního koronárního syndromu, nestabilní anginy pectoris a AIM v klasifikačním schématu ICHS. S použitím Harrison’s Principles of Medicine, 15th Ed. McGraw-Hill, 2001.
Klasifikační schéma a diagnostika ICHS se opírají o tři základní hlediska:
- Anamnestické údaje a klinickou symptomatologii;
- Diagnostické známky ischémie myokardu pozorovatelné na záznamu EKG;
- O vyšetření biochemických laboratorních markerů ischémie myokardu v plazmě.
Známky ischémie na záznamu EKG
Citlivost EKG záznamu v průběhu každého srdečního cyklu klesá odzadu dopředu. Normální vlna T odráží skutečnost, že fyziologická repolarizace komorové svaloviny převážně probíhá od zevních vrstev k vnitřním vrstvám myokardu, takže začíná od míst, která se při aktivaci komor depolarizovala naposled. Repolarizační vlna T je nejcitlivější částí každého cyklu EKG záznamu. Vyplývá to z mimořádných nároků na množství ATP potřebné pro repolarizaci myokardu.
- Přítomnost hypoxie (úbytek ATP, porucha repolarizace) se na EKG záznamu nejdříve zobrazí ve vlně T.
- Teprve hypoxie těžšího stupně se zobrazí v úseku ST (přítomnost proudu z poranění).
- Až nejtěžší změny (nekróza a zánik svalových vláken) se zobrazí na začátku záznamu srdečního cyklu jako patologické Q.
Hlavními EKG známkami ischémie jsou:
- Změny vlny T:
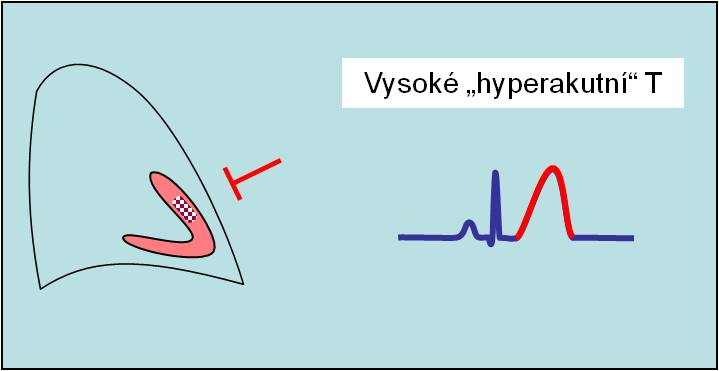
- Vysoké hyperakutní T v samém začátku ischémie;
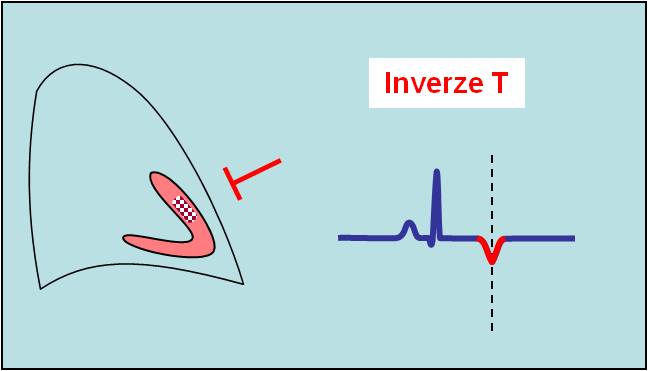
- Symetrické invertované T jako akutní změna;
- Symetrické invertované T jako dlouhodobě přetrvávající známka abnormální repolarizace.
- Změny v úseku ST:
- Deprese ST (STD);
- Elevace ST (STE).
- Patologické Q.
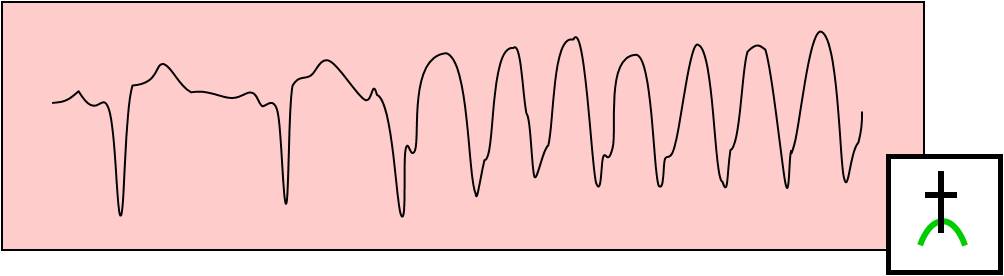
Vysoké hrotnaté T
Může se objevit v samém začátku ischemické ataky. Jde o přechodnou, rychle se měnící známku ischémie („hyperakutní T“). Obvykle trvá jen několik desítek minut a ohlašuje nadcházející elevaci ST.
Obr. 14. Vysoké hrotnaté („hyperakutní“) T.
Inverze T
Osamocené symetrické inverze vlny T, neprovázené jinými změnami, mohou být jedinou známkou ischémie. Jde o vratnou změnu. Nález chronické symetrické invertované vlny T svědčí o přetrvávajícím nepravidelném průběhu repolarizace myokardu. Autority varují, že izolované abnormality vlny T nelze automaticky považovat za známku ischémie.
Obr. 15. Symetrické invertované T.
Změny úseku ST (elevace ST, deprese ST)
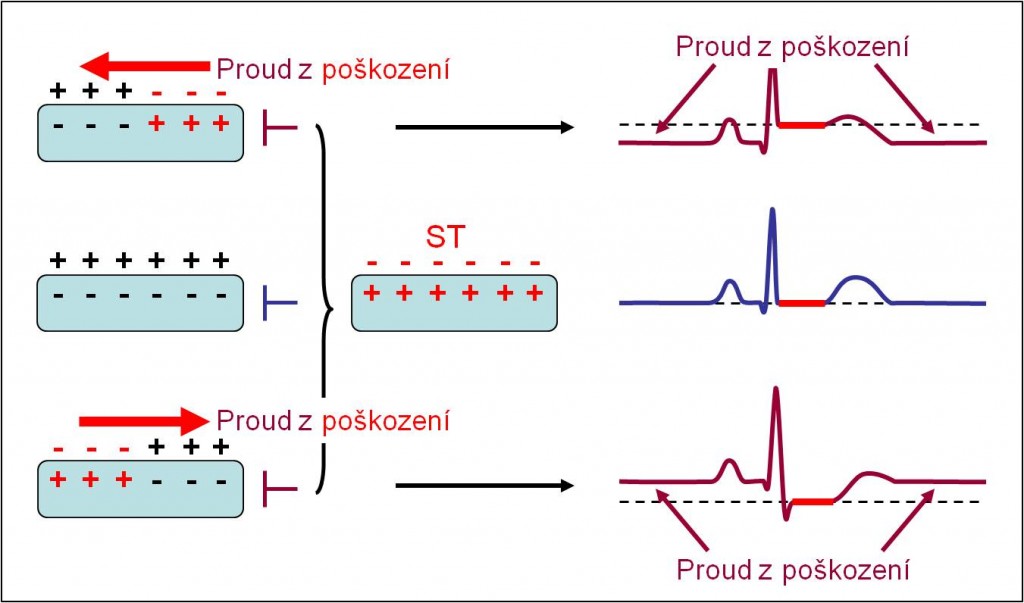
Podkladem vzniku deformací EKG záznamu v úseku ST je přítomnost jevu označovaného jako proud z poškození. Nověji se navíc zdůrazňují poruchy mobility postižené části myokardu.
Obr. 16. Proud z poškození. Projevuje se v úsecích křivek EKG zapisovaných mezi dvěma systolami.
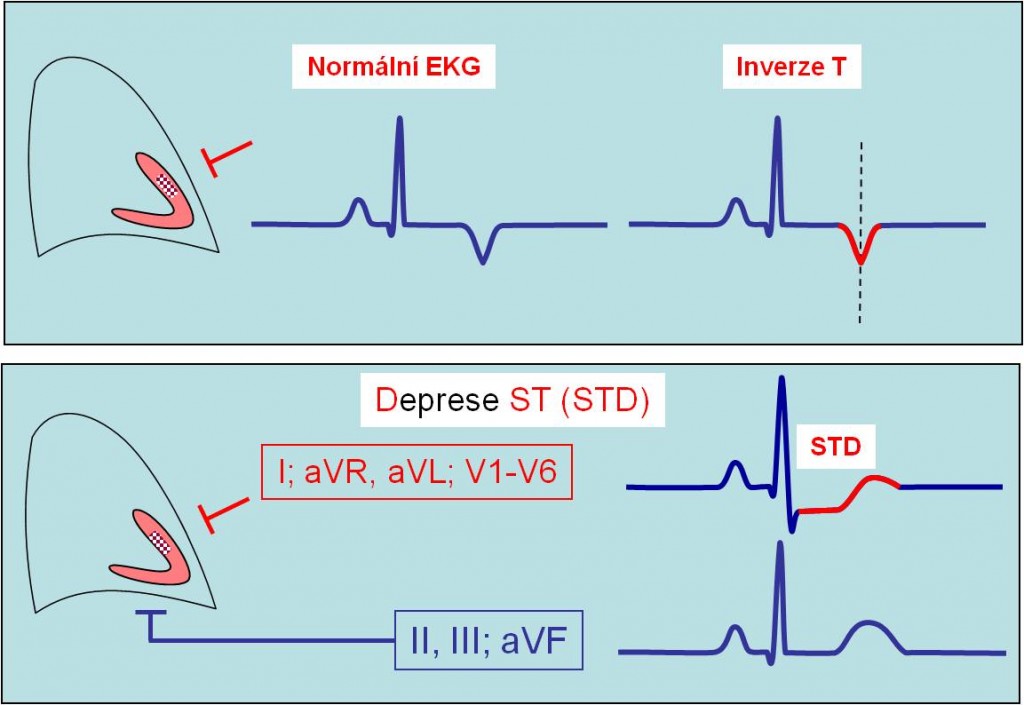
Non-STE stavy a deprese úseku ST (STD)
Ischemické stavy myokardu, které neprovázejíí elevace úseků ST, statisticky převažují nad stavy s ST elevacemi. Při non-STE-stavech se v úseku ST nezobrazují žádné změny, nebo jen změny vlny T, nebo jsou přítomny deprese ST ve svodech monitorujících postiženou oblast myokardu (tzn. část myokardu přivrácenou ke kladným (+) pólům svodů) současně se změnami vlny T anebo bez nich. Ve svodech, které jsou protilehlé (reciproční) k umístění ložiska v myokardu, nejsou v záznamu žádné změny.
Deformace úseků ST jsou přechodnými, vratnými změnami křivek. Kardiologové spojují non-STE-stavy s částečnými, tzn. neúplnými anebo přechodnými uzávěry přívodních tepen. Mohou být součástí projevů jak anginy, tak akutního koronárního syndromu a infarktu myokardu (srovnej obr. 13 a obr. 22):
- Součástí EKG známek anginy:
- Stabilní anginy pectoris;
- Spastické (variantní) anginy pectoris;
- Součástí EKG známek akutního koronárního syndromu:
- Nestabilní anginy pectoris;
- Non-STE non-Q-AIM;
- Non-STE Q-AIM (výjimečně).
Pokud se obnoví dodávka kyslíku k postiženým vláknům, jejich funkce se mohou vrátit k normě a nepravidelnosti v úseku ST mohou vymizet. Pokud se podmínky zcela neupraví, změny úseku ST anebo vlny T se budou manifestovat tak dlouho, dokud v dané oblasti bude přítomen proud z poškození, neobvyklá repolarizace anebo porucha mobility části myokardu (přetrvávající aneurysma, remodelace komory apod.).
Obr. 17. Non-STE-stavy.
Elevace úseku ST (STE)
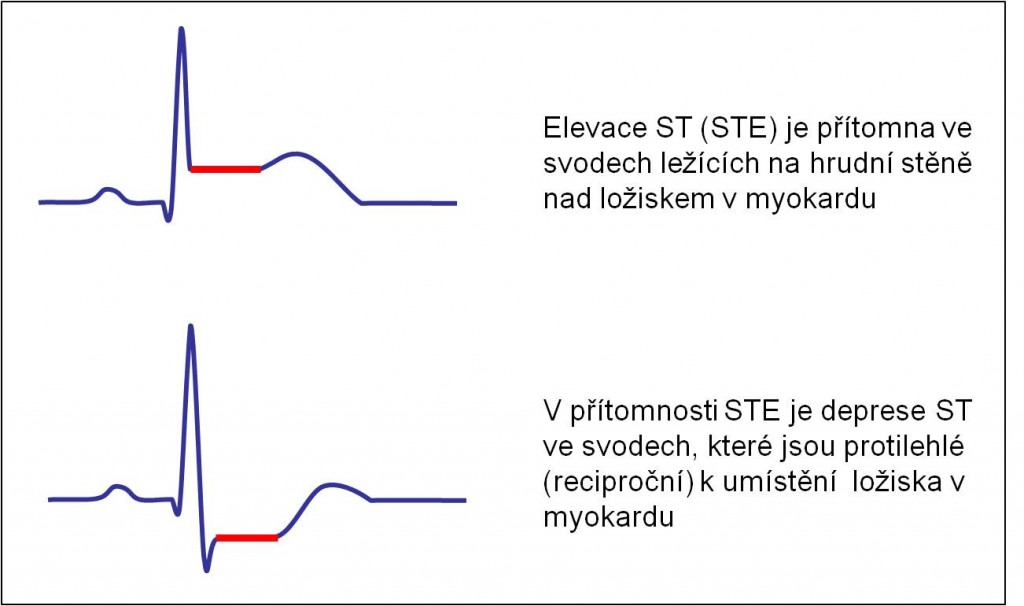
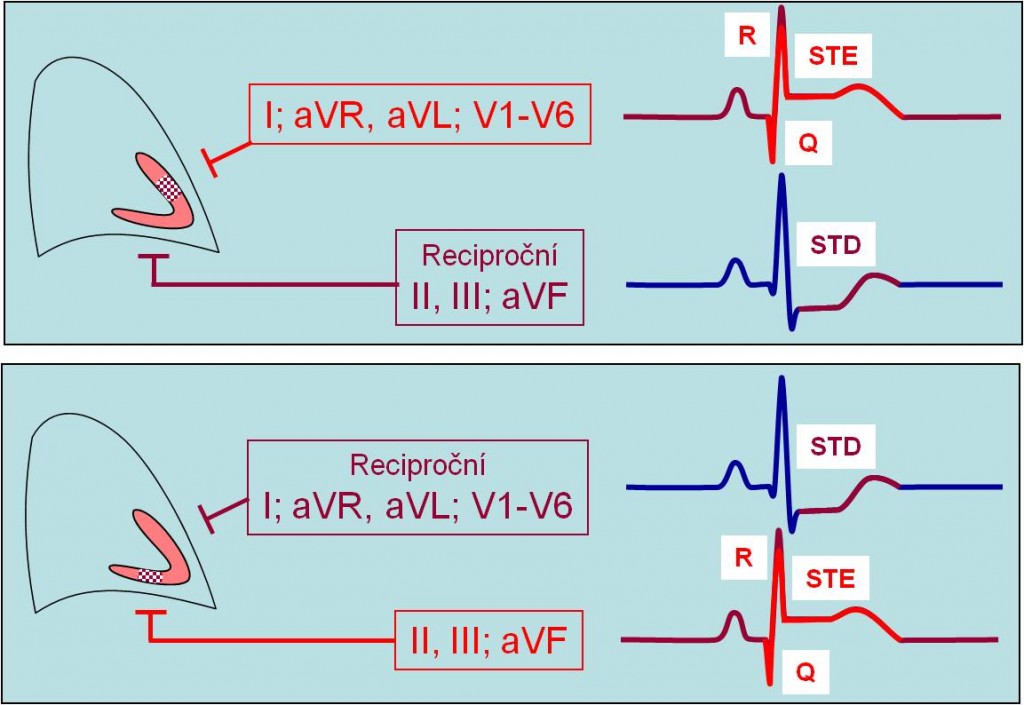
Elevace úseku ST (Pardeeho vlny) se zobrazují v těch svodech, které monitorují poškozenou oblast myokardu. Záznam se dynamicky vyvíjí v čase. V akutním stavu elevace ST mnohdy časově navazují na vysoká hrotnatá T. Elevovaný úsek ST Pardeeho vlny typicky odstupuje ze sestupného ramene kmitu R, krátce poté, co kmit R dosáhl vrcholu, a jeho konec jakoby splývá se sestupným raménkem vlny T. Vlna T je zavzata do vyvýšeného ST úseku. V jiných svodech záznamu EKG můžeme paralelně pozorovat současný výskyt depresí úseku ST. Vidíme je ve svodech, které jsou protilehlé (reciproční) k umístění ložiska v myokardu. Mohou anebo nemusí být patrné průvodní změny vlny T.
Obr. 18. STE stavy. Současný výskyt ST elevace a a k ní reciproční ST deprese.
Obr. 19. STE stavy. Současný výskyt elevace a reciproční deprese při ischémii přední stěny (horní část obrázku) a spodní stěny myokardu (dolní část obrázku).
Kardiologové jednoznačně spojují výskyt elevací úseku ST v EKG záznamu s úplnou obstrukcí přívodní artérie a úplnou ischémií, která, pokud se průchod cévou do 20 minut neobnoví, přerůstá v nekrózu. Pro klinika proto ST-elevace znamená (srovnej obr. 13 a obr. 22):
- Q-AIM (daleko největší počet případů);
- Non-Q-AIM.
Proto je pacient s elevacemi ST neprodleně indikován k zákroku s cílem zprůchodnit ucpanou koronární cévu.
Elevace i reciproční deprese v EKG záznamech STE-stavů jsou přechodné, vratné změny. Jsou součástí projevů vyvíjejících se STE-AIM, ale pokud se obnoví dodávka kyslíku, funkce vláken se může vrátit k normě a změny mohou ze záznamu EKG vymizet. Pokud se podmínky zcela neupraví (vznik aneurysmatu, remodelace komory apod.), změny ST úseku budou v záznamu tak dlouho, dokud v dané oblasti bude přítomen proud z poškození anebo abnormální repolarizace.
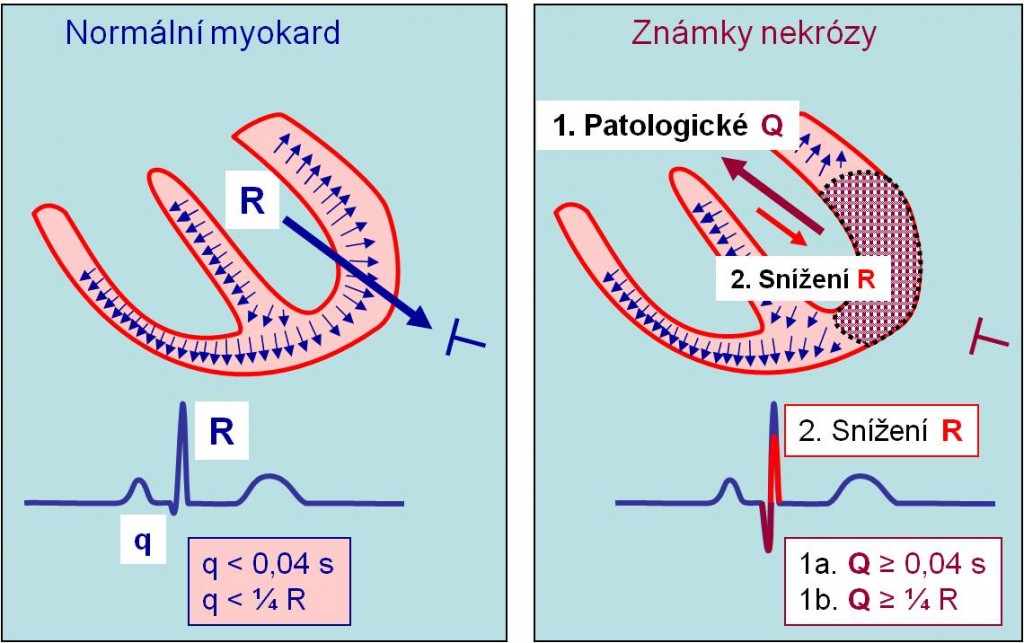
Patologické Q
Patologické Q se zobrazuje jen při nejtěžším poškození myokardu. Jeho vývoj časově zpravidla navazuje na deformace úseků ST. Výskyt patologického Q vypovídá o těžkém úbytku anebo o nepřítomnosti elektrické aktivity (tj. o zániku vláken) v oblasti myokardu, která je monitorována svody, v nichž se patologické Q zobrazuje. Ze stejných příčin dochází ke snížení voltáže kmitů R nad postiženým ložiskem (se současně možným zvýšením amplitudy R v recipročních svodech). Daleko nejčastější příčinou patologického Q je akutní nekróza myokardu anebo chronická jizva po ní, která přetrvává do konce života. Vzácněji může jít o ložisko infiltrace (amyloidóza, nádor atd.).
Obr. 20. Vznik patologického Q a jeho parametry.
Plazmatické biochemické markery akutního infarktu myokardu
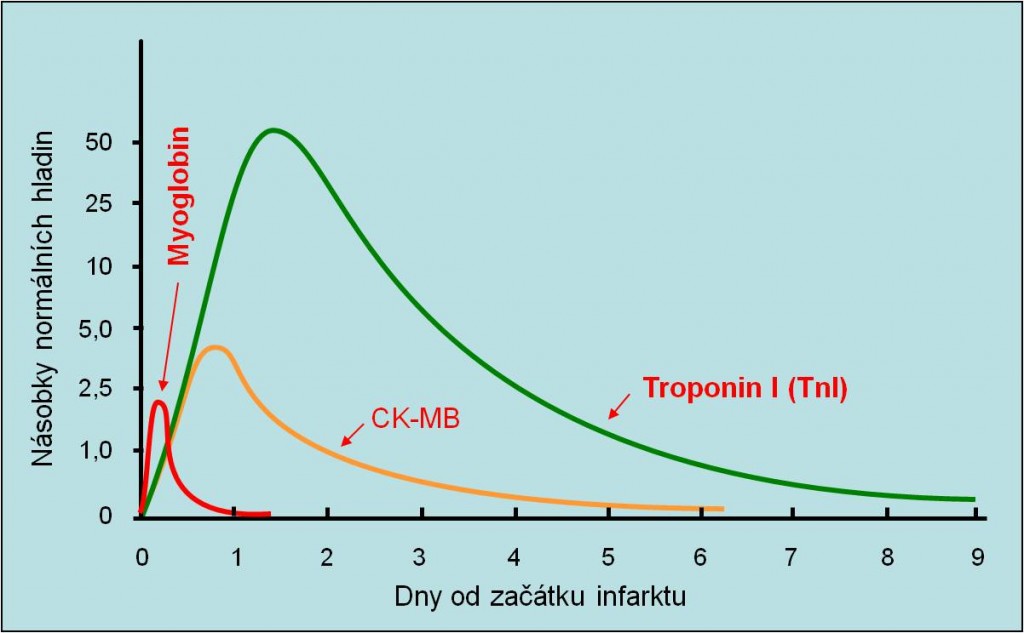
Myoglobin
- Jeho koncentrace v periferní krvi se zvyšuje za 2 – 4 hod. po uzavření cévy. Negativita tohoto markeru ještě po 4 hodinách od vzniku bolestí svědčí spíše pro záchvat angíny než AIM . Zvýšení myoglobinu (diagnostické okno) přetrvává poměrně krátce, asi 24 hodin, pak se jeho hladina vrací k normě. Myoglobin není zcela specifický marker (jeho zdrojem může být svalová tkáň kdekoliv v těle). Zvyšuje se rovněž po fyzické zátěži.
Troponin (TP-I, TP-C)
- Je pozitivní v periferní krvi po 3 – 4 hodinách od vzniku bolestí, dosahuje vrcholu za 12 – 24 hodin. Vzestup hladin přetrvává nesrovnatelně déle než je tomu u myoglobinu. Vrací se k normě za 7 – 14 dní. Jde o daleko více specifický marker poškození myokardu, než je myoglobin, ani zde však specifičnost není naprostá (zvyšuje se při poškození ledvin aj.). Zvyšuje se rovněž po mimořádné fyzické zátěži (naměřeno u vytrvalostních běžců). Vzestup troponinu (nebo lépe, plocha pod křivkou vzestupu) koreluje s tíží poškození a s prognózou choroby.
CK-MB
- Je pozitivní po 3 – 4 hodinách od vzniku bolestí, diagnostické okno trvá asi 7 dní, takže tento marker je blízký troponinu. Nevýhodou oproti troponinu je jeho menší specifičnost. Stanovením troponinu je vytěsňován.
Obr. 21. Diagnostická okna biochemických markerů AIM. Schéma je méžnmo zhlédnout i v animované podobě.
Angina pectoris
Rozllišují se tři klinické formy anginy pectoris:
- Stabilní námahová angina pectoris. Je chronickou formou ischemické choroby srdeční.
- Spastická (Prinzmetalova) angina pectoris. Stojí na rozhraní mezi akutními a chronickými formami ischemické choroby srdeční. Harrisonovy Základy interní medicíny ji zařazují jako formu nestabilní anginy. V záznamu EKG může překvapivě mít i STE projevy (Harrison’s Principles of Medicine, 15th Ed. McGraw-Hill, 2001).
- Nestabilní angina pectoris. Je akutní manifestací ischemické choroby srdeční. Z diagnostických a terapeutických důvodů se řadí do klinického rámce vymezeného jako akutní koronární syndrom.
Stabilní námahová angina pectoris
Projevuje se ischemickými bolestmi na prsou (tzv. stenokardiemi) vázanými na zvýšenou námahu (při fyzických výkonech, citovém vzrušení apod). Záchvaty vyvolává nedostatečná dodávka kyslíku způsobená zúžením (omezením funkční rezervy) přívodní arterie, která nemůže uspokojit nárůst spotřeby a poptávky po kyslíku vyvolané námahou.
Záchvat je přechodný, ustupuje po přerušení námahy a odpočinku. Přechodná hypoxie nevede k nekróze vláken. Proto – navzdory přítomnostï známek ischémie na EKG – nenacházíme zvýšené biochemické markery.
Diagnóza se opírá o anamnézu a zátěžová vyšetření (zátěžové EKG, zátěžová echokardiografie, popř. zátěžová scintigrafie myokardu). Zátěžový test má vyprovokovat pozitivní nález. Vyšetření doplňuje koronarografie. Umožňuje zpřesnit obraz před rozhodnutím o volbě léčby.
Léčba může být:
- Medikamentózní;
- Revaskularizační:
- PCI (percutaenous coronary intervention);
- Kardiochirurgický bypass.
| Stupeň | Omezení činností |
| Stupeň 1 | Bolest pouze při usilovné námaze, ne při chůzi a chůzi do schodů |
| Stupeň 2 | Bolest při rychlé chůzi do schodů, do kopce, chůzi do schodů krátce po jídle, při chladném počasí nebo větru, při emočním vypětí |
| Stupeň 3 | Bolest při chůzi normální rychlostí po rovině po 100 – 200 m, při stoupání do schodů z jednoho odpočívadla na druhé |
| Stupeň 4 | Bolest při jakékoliv běžné námaze, bolest i v klidu |
Tabulka 6. Stupně angina pectoris
| Riziko AIM | Příznaky |
| Zvýšené | Bolest nastupuje při menší námaze, nebo dříve; Zvyšují se frekvence, trvání, nebo intenzita záchvatů bolesti; Záchvaty bolesti jsou nové, poprvé se objevily v době < 2 měsíce |
| Vysoké | Omezení stupně 3 – 4 podle tabulky uvedené výše; Bolesti v klidu, bolesti v noci; Deprese ST ≤ 1 mm v několika svodech; Věk > 65 let |
| Velmi vysoké | Dlouhotrvající (> 10 min) klidová bolest; Příznaky srdečního selhání: hypotenze, nový systolický šelest, S3; Dynamické změny EKG: Nové hluboké inverze T, ST ≥ 1mm. |
Tabulka 7. Riziko zvratu do AIM při onemocnění angina pectoris
Spastická (variantní, Prinzmetalova) angina pectoris
Spastická angina je vzácnou formou ischemické nemoci srdeční. Harrisonovy Základy interní medicíny ji zařazují jako formu nestabilní anginy (Harrison’s Principles of Medicine, 15th Ed. McGraw-Hill, 2001). Projevuje se přechodnými záchvaty bolestí, které nejsou vázány na námahu a objevují se v klidu. Za příčinu záchvatů se považují spasmy přívodné koronární tepny. Spasmy postihují epikardiální úseky tepny. Faktory, provokující spasmy, nejsou jasné.
Podmínkou diagózy je přítomnost změn úseků ST na záznamech EKG pořízených v době záchvatu (může pomoci 24hodinové EKG) anebo koronarografický průkaz spasmů v době záchvatů. V záznamu EKG může překvapivě mít i STE projevy. Biochemické markery se nezvyšují.
Léčba je farmakologická.
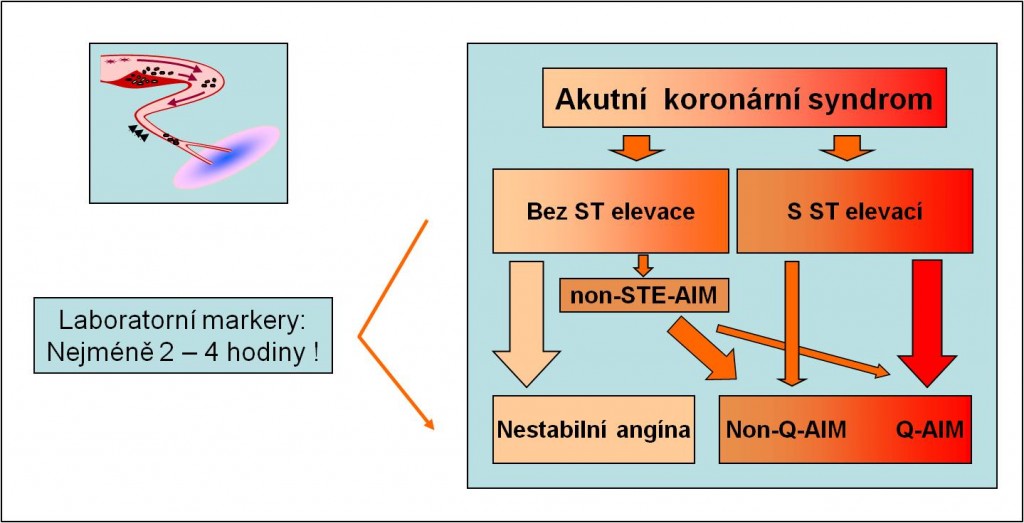
Akutní koronární syndrom (ACS)
Akutní koronární syndrom je pracovní, provizorní (dočasnou) diagnostickou kategorií, pod kterou se sdružuje nestabilní angina pectoris a akutní infarkt myokardu v prvních hodinách po vzniku obtíží. Pokud jsou přítomny klinické symptomy ischémie a v záznamu EKG se objeví STE anebo patologické Q (známky úplné obturace přívodní cévy), pacient je neprodleně indikován zákroku s cílem odstranit cévní okluzi. Pokud se tyto jasné EKG známky nastupující nekrózy nevyvinou, jako tomu je v případě non-STE stavů, třeba na potvrzení, nebo vyloučení AIM počkat až do doby vyšetření biochemických markerů. Biochemické markery se však na rozdíl od známek EKG, které se mohu objevit už velice záhy (Tabulka 5), zvyšují až po několika hodinách od začátku obtíží. Pokud se markery nakonec nezvýší, bude stav v konečné diagnóze překlasifikován jako nestabilní angina. Pokud markery dosáhnou patologických hodnot, pak i přes nepřítomnost jednoznačných známek nekrózy na EKG půjde v konečné diagnóze o AIM. Následující přehled tří diagnóz je sestaven od méně závažných k nejtěžším stavům.
Obr. 22. Akutní koronární syndrom jako pracovní diagnóza. Podle: Harrison’s Principles of Medicine, 15th Ed. McGraw-Hill, 2001.
Anamnéza a symptomy při ACS:
- Výskyt > 10min epizody stenokardií v posledních 24 hodinách;
- Bolest (nemusí být vždy; zejména může chybět u osob s diabetes mellitus !);
- Studený pot;
- Tachykardie;
- Slabost, nevolnost, nauzea, zvracení;
- Úzkost.
1. Nestabilní angina pectoris
Nestabilní angina pectoris zahrnuje stavy, které se nově objevily anebo u nichž v posledním měsíci došlo k výraznému vystupňování symptomů. Může jít jak o symptomy vázané na námahu, tak klidové. Ataky nestabilní anginy jsou typicky vyvolány neúplně obturujícími překážkami (tromby), které se tvoří na nestabilních aterosklerotických plátech.
Záchvaty jsou obvykle kratší než záchvaty provázející AIM. Od AIM se především odlišují absencí nekrózy. Proto na záznamu EKG nikdy není přítomno patologické Q a ani se nezvyšují biochemické markery (jedno anebo druhé by bylo jasnou známkou infarktu). Na EKG ovšem mohou být během záchvatu patrné jiné (reverzibilní) ischemické změny (změny vlny T a úseku ST).
Diagnóza nestabilní anginy se opírá o anamnézu a o přítomnost změn na EKG zaznamenaných během záchvatu anebo o echokardiograficky prokázanou abnormální dynamiku části komory postižené během záchvatu. Biochemické markery zůstávají negativní, čímž vylučují přítomnost nekrózy.
2. Akutní infarkt myokardu bez elevací úseku ST (non-STE-AIM)
Non-STE-AIM zahrnuje následující stavy:
- Non-Q-AIM
- EKG němý AIM;
- AIM s inverzí vln T;
- AIM s depresí úseku ST;
- Q-AIM (velmi zřídka).
Diagnóza non-STE AIM se opírá o zjištění zvýšených hladin biochemických markerů při výskytu dalších klinických symptomů ischemického poškození, tzn. anamnézy, subjektivních příznaků a dynamiky biochemických markerů, a o výsledky ostatních vyšetření včetně echokardiografie a případně koronarografie. Koronarografie se provádí na pracovištích, kde je na ni možno navázat zákrokem PCI. Na rozdíl od STE-stavů se u non-STE stavů jen velmi výjimečně vyvíjí patologické Q (Q-AIM).
3. Akutní infarkt myokardu s elevacemi ST úseku (STE-AIM)
STE-AIM se podle dalšího vývoje a přítomnosti, nebo nepřítomnosti patologického Q manifestuje jako:
- Non-Q-AIM (jen v malém počtu případů);
- Q-AIM (v daleko převažujícím počtu případů).
Diagnóza STE-AIM se opírá o evidentní EKG známky perzistujících STE-elevací vyvíjejících se v čase při výskytu dalších klinických symptomů ischemického poškození (anamnéza, subjektivní příznaky). Echografické vyšetření může zjistit úplné a nevratné vymizení kontrakční aktivity v postižené oblasti. Koronarografie může lokalizovat kritické zúžení až úplnou obstrukci koronární arterie. Provádí se na pracovištích, kde je na ni možno navázat zákrokem PCI. Pacienti se neprodleně podrobují zákrokům, které mají za cíl co nejrychleji rekanalzovat cévu, aniž se čeká na vyšetření laboratorních markerů. Dynamika markerů může potvrdit diagnózu i později po provedeném zákroku.
Existují klinicky němé infarkty s náhodným dodatečným záchytem chronických změn (invertované T, deformace ST, patologické Q) v EKG záznamu (neplést s diagnózou němé ischémie myokardu – viz níže).
Obr. 23. Postupný vývoj záznamu Q-AIM v čase. Schéma je možno zhlédnout i v animované podobě.
Shrnutí:
EKG: Non-STE-stavy probíhající pod obrazem ACS (konečná diagnóza podle laboratorních markerů):
- EKG němá ischémie (často při postižení v povodí ramus circumflexus levé věnčité tepny);
- Inverze T > 3 mm;
- Často při izolované stenóze věnčité tepny.
- Deprese anebo jen přechodné elevace ST > 1 mm;
- Krátkodobá trombotická okluze věnčité tepny;
- Nestabilní angina pectoris Prinzmetallova typu.
EKG: STE-stavy probíhající pod obrazem ACS (laboratorní markery mohou potvrdit diagnózu později):
- STE-AIM
- Q-AIM (v daleko převažujícím počtu případů).
- Non-Q-AIM.
Význam vyšetření biochemických laboratorních markerů pro konečnou diagnózu forem ICHS při ACS
Stanovení biochemických laboratorních ukazatelů má zásadní význam pro diagnózu i terapii:
- Umožňuje odlišit non-STE-AIM a non-Q-AIM od nestabilní anginy pectoris.
- Umožňují zpřesnit progózu AIM – vzestup markerů a délka jeho trvání korelují s velikostí ložiska, a jsou v reciproční korelaci s prognózou.
- Umožňuje diagnózu EKG-němých AIM.
Nevýhodou oproti EKG známkám, které se objevují už v prvních 20 s po začátku ischémie, je, že měřitelný vzestup biochemických markerů v periferní krvi nejdříve nastává až po po 2 – 4 hodinách. Proto se adekvátní terapeutický zásah při non-STE AIM oproti přijatému postupu při STE-AIM může opozdit.
Smrticí komplikace AIM
Akutní infarkt myokardu provázejí četné komplikace, z nichž mnohé jsou smrticí. Lze je seřadit podle jejich prevalence:
- Arytmie;
- Srdeční selhání (s edémem plic, pokud postiženou částí je levá komora);
- Dysfunkce papilárních svalů:
- Ruptura papilárního svalu;
- Insuficience chlopně (ECHO a chirurgie !);
- Kardiogenní šok;
- Ruptura myokardu:
- Ruptura volné stěny;
- Srdeční tamponáda;
- Ruptura septa;
- Pravolevý zkrat (ECHO a chirurgie !);
- Ruptura volné stěny;
- Pseudoaneurysma;
- Nitrosrdeční tromby a systémová embolizace;
- Žilní trombóza.
Arytmie
- Primární maligní arytmie v prehospitalizační fázi jsou nejčastější příčinou úmrtí pacientů s AIM. Jsou způsobeny elektrickou nestabilitou postiženého myokardu. Rychlá lékařská pomoc, lékařská ambulance a nemocniční oddělení musí být kdykoliv připraveny okamžitě provést kardioverzi anebo kardiostimulaci.
- Sekundární arytmie jsou terminálním vyvrcholením těžkého srdečního selhání, kardiogenního šoku, ruptury myokardu apod.
Obr. 24. Schematické znázornění záznamu komorové fibrilace.
Srdeční selhání
- Ischemické postižení vždy vede k výpadku funkce v místě ložiska. Výpadek části svaloviny snižuje srdeční výdej. Ke kritickému snížení dochází při postižení asi 30 % hmoty komory. Při tak velkém ložisku je výpadek komory fatální. Selhání srdce se pak manifestuje obvyklými symptomy:
- Zpětným (městnavým) selháním; pokud je postiženou komorou levá komora, rozvíjí se kardiogenní plicní edém (tlak v zaklínění > 25 mm Hg);
- Dopředným selháním – těžká hypotenze, šok.
Reperfúzní jevy
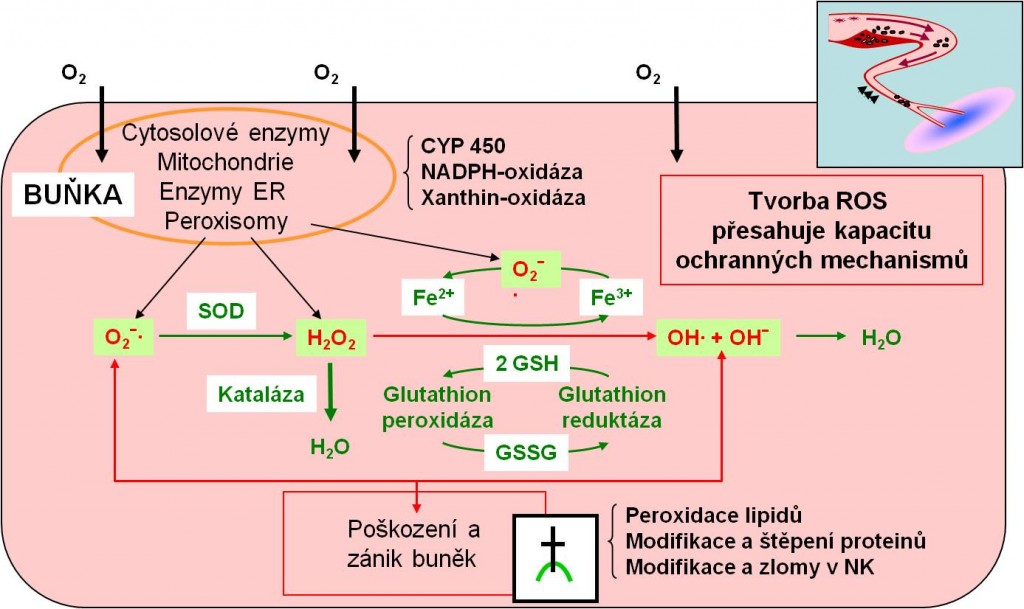
- Kyslíkový paradox
- Vyplývá ze zvýšené tvorby volných reaktivních částic a radikálů. Funkce enzymových systému, které reaktivní částice produkují, se po reperfúzi obnovují rychleji než protektivní mechanismy bránící jejich účinkům.
Obr. 25. Reaktivní částice kyslíku při ischémii a následné reperfúzi.
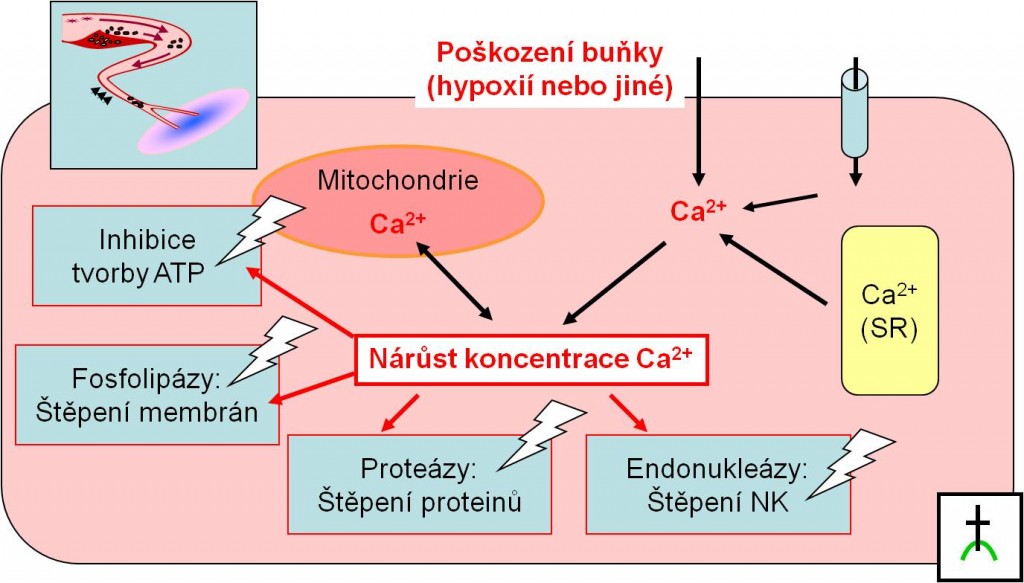
- Kalciový paradox
- I v tomto případě předchází obnova kanálů umožňujících vstup Ca2+ do buněk restituci pump aktivního transportu, které by zajistily odstranění kalciových iontů z cytoplazmy. Dochází k přetížení buněk kalciem. Protektivně lze zasáhnout podáním farmakologických blokátorů kalciových kanálů.
Obr. 26. Přetížení buňky ionty kalcia při ischémii a následné reperfúzi.
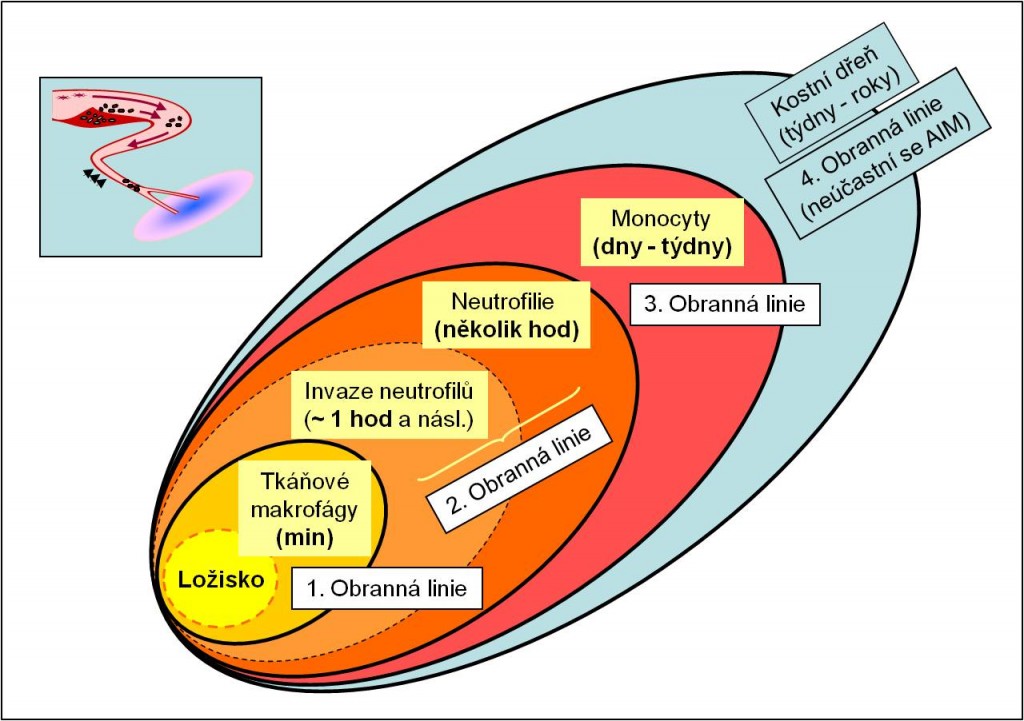
Zánět při AIM
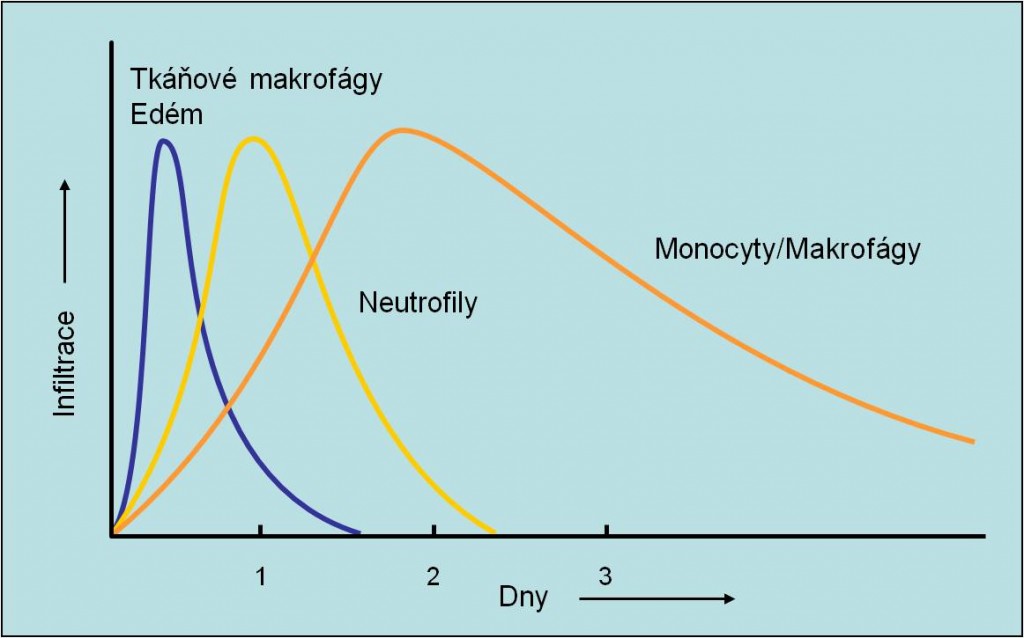
Hlavní etapy a komponenty zánětu se připomínají v následujících schematech bez dalšího komentáře.
Obr. 27. Etapy rozvoje zánětu
Obr. 28. Zánětlivá infiltrace ischemického ložiska.
Zvláštní formy ischemické choroby srdeční
Koronární syndrom X
Koronární syndrom X (neplést s metabolickým syndromem X) je variantou chronické stabilní angina pectoris. Je charakterizován dvojitě pozitivním zátěžovým testem, tzn. námahově vyvolanou bolestí na hrudi provázenou pozitivním EKG obrazem s depresí úseku ST. Při angiografickém vyšetření však paradoxně chybí detekovatelné známky zúžení v koronárním řečišti a zátěžová echokardiografie je často negativní.
Etiopatologicky se předpokládá přítomnost poruch malých arteriol aterosklerotické nebo funkční povahy, které významně snižují možnost dilatace cév, a tím funkční rezervu koronárního průtoku pro případ zátěže (koronární mikrovaskulární dysfunkce; odtud označení mikrovaskulární angína). Přítomná porucha limituje účinnost rutinní farmakologické léčby (běžná antianginózní léčba neúčinná u téměř 50 % osob s koronárním syndromem X).
Kromě námahových stenokardií jsou často přítomné myalgie a snadná únavnost. Nemocní mají dobrou prognózu, pokud jde o případnou mortalitu, přesto syndrom přináší zhoršenou kvalitu života.
Němá ischémie myokardu
Němá angina pectoris je subjektivně němá, ale ne klinicky němá. Hovoří se o ní, když zátěžový test anebo 24hodinové EKG sledování objektivně zjistí známky ischémie, ale bez subjektivní odezvy (bolesti). Jde tedy o klinicky prokázanou, ale subjektivně nevnímanou variantu angina pectoris. Příčinou chybění bolesti může být inpiduální variace prahu bolesti, vegetativní aferentní neuropatie apod. S vegetativní aferentní neuropatií, a proto i s němou ischémií myokardu, se zejména často setkáváme u osob trpících diabetes mellitus.
Němý infarkt myokardu se dodatečně zjistí na základě stop dříve prodělaného AIM náhodně zachycených při kardiologickém vyšetření (EKG, echokardiografie). Nejsou jakéhokoliv pozitivní údaje o prodělaném AIM v anamnéze. Tato okolnost podtrhuje, že pokud chybí bolest, může být mnohem spolehlivějším vodítkem pro podezření na AIM náhle vzniklá dušnost, studený pot anebo slabost.
Omráčený myokard
Termín omráčený myokard (stunned myocardium) označuje přechodnou poruchu kontraktility po odeznění krátkodobé akutní ischémie (postischemická dysfunkce). Po ischémii, která ještě nezpůsobila nekrózu, zůstane zachována mikroskopická struktura vláken, ale může dojít k výpadku jejich funkcí. Po obnovení krevního průtoku dochází v průběhu několika hodin až dvou dnů k úpravě funkcí k normě. S omráčeným myokardem se setkáváme například:
- Po atace tiché ischémie;
- Po atace aniny pectoris;
- V periinfarktových hypoxických zónách hlavního nekrotického ložiska (netransmurálního anebo transmurálního infarktu);
- Po ischémii vyvolané zátěžovým testem;
- Po zákroku perkutánní koronární intervence (PCI), kdy inflace balónku trvá 1 – 2 minuty;
- Po kardiochirurgických operacích anebo po transplantaci srdce.
Myokard částečně adaptovaný na ischémii (ischemicky předtrénovaný myokard)
Ložisko srdečního svalu opakovaně vystavené epizodám přechodné vratné hypoxie (ischemic preconditioning), jak se to např. děje při angině pectoris, vzdoruje po přerušení dodávky kyslíku nekróze déle než oblasti myokardu, které takové zkušenosti vystaveny nebyly. Jde o metabolický jev odlišný od adaptace cévního zásobení, která by spočívala v tvorbě krevních kolaterál směřujících do ložiska.
Hibernovaný myokard
Termín hibernovaný myokard (hibernated myocardium) označuje dlouhodobou ale vratnou změnu myokardu, která se projevuje snížením až vymizením stažlivých funkcí následkem chronického omezení krevního zásobení. Koronární průtok může být v klidu zachován, ale pro sníženou průtokovou rezervu dochází k často opakovaným ischémiím při každé námaze (opakované omráčení). Nastávají strukturní změny myocytů, ubývá množství kontraktilních bílkovin v nich, mezi myocyty se hromadí vazivo. Po obnovení přísunu krve bypassem nebo PCI se funkce vláken postupně vrací k normě.
Klinické diagnostické odlišení viabilního (vratně poškozeného) dysfunkčního myokardu od nevratného poškození anebo náhrady svalové masy jizvou
- Dobutaminová echokardiografie
- Kontrastní echokardiografie
- Tkáňový Doppler
- Nukleární kardiologie (scintigrafie srdce)
- Magnetická rezonance s použitím kontrastního gadolinia
Terapie AIM
Akutní opatření
- Zklidnění pacienta
- Odstranění bolesti
- Antikoagulancia
- Kys. acetylsalicylová – rozžvýkat; heparin
- Kyslík po dobu trvání dušnosti anebo bolesti
- Atropin při bradykardii
- Beta-blokátor při tachykardii
- Nitráty
Farmakoterapie
| Faktor | Opatření |
| Bolest | Tišení bolesti: analgetika |
| Příčina | Dnes má jednoznačně přednost intervenční terapie; antikoagulancia; dříve trombolýza; |
| Komplikace | Léčba arytmií, léčba srdečního selhání |
| Prevence zhoršení | Prevence náhlé smrti; Prevence remodelace komory |
| Další faktory | Prevence reperfúzního poškození; Stabilizace plátů; Podpora intervenční léčby |
Tabulka 8. Přehled hlavních farmakoterapeutických opatření při léčbě AIM.
Intervenční terapie
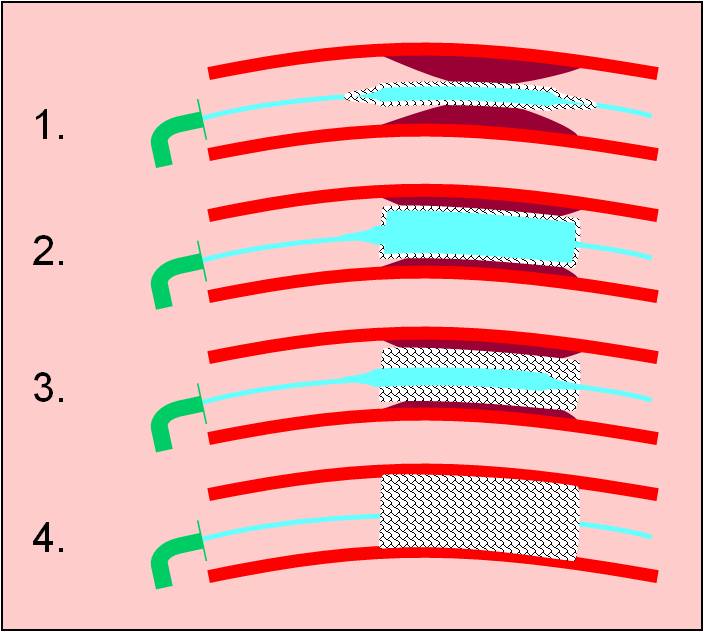
Z omezené doby přežívání vláken myokardu vystavených nedostatku kyslíku a z nutnosti zachovat co nejvíce vláken, které mohou po odstranění ischémie plně obnovit svou funkci, vyplývá, že terapie AIM je závodem s časem. Obnovení dodávky kyslíku nejlépe zajistí rekanalizační terapie. Je několik rekanalizačních technik:
- Trombolýza. Opírá se o použití enzymů vykazujících proteolytickou aktivitu plazminu (streptokináza apod.). V dnešní době je na ústupu. V ČR se aplikuje zřídka. Nedosahuje účinnosti následujích metod.
- PCI = Perkutánní koronární intervence (percutaneous coronary intervention). Nejúčinnější a také nejčastější způsob terapie AIM v ČR!
- Koronární výztuž (stent), aplikace pomocí dilatačního balónku.
- CABG = Koronární arteriální náhradní štěp (coronary arterial bypass grafting). Výjimečně ve velmi časné fázi AIM.
Obr. 29. Schéma aplikace výztuže (stentu). Schéma je možno zhlédnout i v animované podobě.
Zásady prevence AIM
- Režimová opatření (životní styl – kouření, redukce hmotnosti, dieta, pohybová aktivita atd.).
- Farmakologická:
- Léčba dylipidémie (zejména statiny);
- β-blokátory;
- ACE/ARB inhïbitory; jde jeden z nejvíce užívaných přístupů v prevenci vzniku a vývoje aterosklerotických lézí.
- Kyselina acetylsalicylová v nízkých dávkách;
- Léčba diabetu; Léčba hypertenze.
Zpracovali: Jaroslav Veselý, Ústav patologické fyziologie LF UP; a Roman Štípal, I. interní klinika LF UP a FN v Olomouci