Proces hemostázy se rozděluje do tří fází:
- cévní
- hemokoagulační
- fibrinolytické
V tomto oddíle se podrobněji zabýváme hlavně druhou (hemokoagulační) a třetí (fibrinolytickou) fází.
První fáze hemostázy: Primární hemostáza
V jejím rámci dochází nejprve k vazokonstrikci, potom k aktivaci trombocytů a tvorbě provizorního, labilního destičkového trombu.
Poškození cévní stěny a uvolnění kolagenu má za následek uvolnění adenozin-difosfátu, což způsobí adhezi destiček k cévní stěně za spoluúčasti von Willebrandova faktoru. Z fosfolipidů membrány trombocytů je pak uvolněna kyselina arachidonová a dojde zde k tvorbě tromboxanu A2 s následnou trombocytární agregací a další vazokonstrikcí. Z endoteliálních buněk je současně uvolněn prostacyklin, který naproti tomu agregaci brzdí a způsobuje vazodilataci. Tvorbě tromboxanu mimo jiné může bránit podaný aspirin.
Druhá fáze hemostázy: Koagulace – sekundární hemostáza
Základní schéma
Hemokoagulace navazuje na první, cévní fázi hemostázy. Vede k tvorbě stabilní krevní sraženiny. Základní schéma koagulace má podobu kaskády sestavené do podoby písmene Y.
Samotné srážení krve pak probíhá ve třech fázích:
- Tvorba protrombinového aktivátoru;
- Tvorba trombinu;
- Tvorba fibrinu.
Aktivaci faktorů vyjadřujeme doplněním písmene „a“ za příslušnou římskou číslici. Horní branže písmene Y znázorňují tzv. zevní a vnitřní cestu. Spojují se spolu v nožku Y – společnou dráhu koagulace. Místo spojení obou branží odpovídá vzniku aktivního faktoru X, který tvoří hlavní složku protrombinového aktivátoru. Proces se zakončuje vznikem fibrinu (pata Y). Faktor XIII tvoří nerozpustný fibrin. Nerozpustný fibrin tvoří osnovu pro stabilní neboli sekundární krevní zátku. Vznikem fibrinu končí druhá a začíná třetí, fibrinolytická fáze hemostázy.
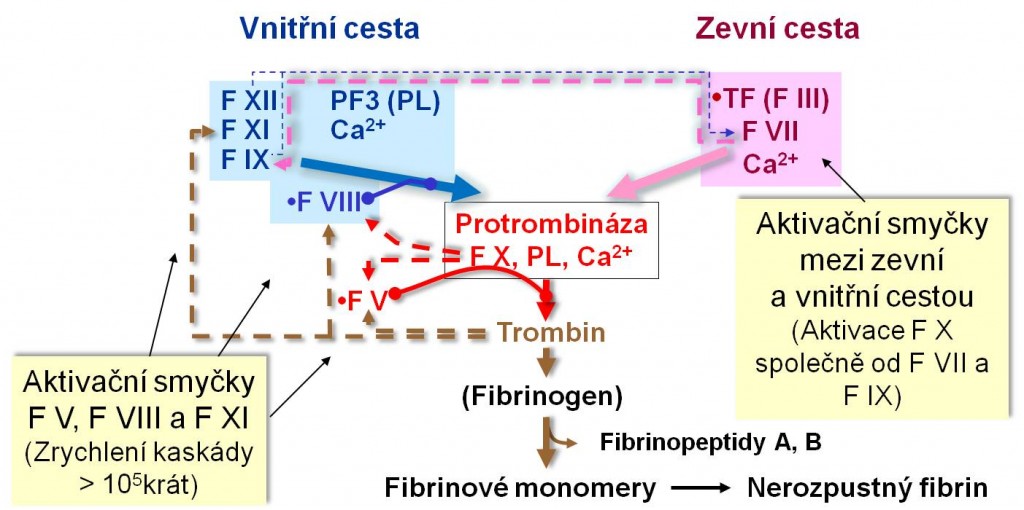
Obr. 1. Aktivační smyčky koagulační kaskády. Schéma je možno zhlédnout i v animované podobě – za prvé, aktivační smyčky mezi zevní a vnitřní cestou, a za druhé, aktivační smyčky FV, FVIII a FXI spolu s funkcí FXIII a účastí kalikrein-kininového systému.
Celkem koagulační kaskáda obsahuje 6 koagulačních faktorů s proteolytickou enzymovou aktivitou (faktory XII, XI, IX, VII, X a II) a 3 kofaktory mající vazebnou a aktivační úlohu bez proteolytické funkce (tkáňový faktor, faktory VIII a V). Posledním článkem kaskády je fibrinogen/fibrin. Speciální katalytickou funkci má faktor XIII, který zabezpečuje tvorbu nerozpustné fibrinové sítě.
Zevní cesta
Pro přirozený proces koagulace je rozhodující aktivace zevní cesty. Začíná kontaktem krve s tkáňovým faktorem (TF, faktor III, trombokináza a ne zcela přesně tromboplastin, protože tromboplastin = TF + fosfolipidy). Tkáňový faktor normálně není v kontaktu s krví, je integrálním glykoproteinem cytoplazmatických membrán buněk subendotelu. Nemá enzymovou aktivitu, nýbrž slouží jako kofaktor. Jestliže po poškození endotelu dojde k jeho uvolnění, váže se k faktoru VII (F VII) a aktivuje ho. Aktivní komplex TF-F VII následně aktivuje jednak faktor IX, jednak faktor X. Všechny další stupně až po tvorbu trombinu se potom odehrávají na površích negativně nabitých fosfolipidových membrán (PL), které k tomuto účelu poskytují aktivované trombocyty.
Vnitřní cesta
Faktor IX se tradičně řadí k tzv. vnitřní cestě. Vnitřní cestu schematicky představuje druhá branže Y. Začíná kontaktní aktivací faktoru XII prostřednictvím jeho styku s negativně nabitým povrchem fosfolipidových membrán (PL, parciální tromboplastin). Aktivovaný faktor XII aktivuje faktor XI (F XI) a ten zase aktivuje faktor IX. Aktivace F IX tak probíhá jak vnější tak vnitřní cestou. Aktivace vnitřní cestou je však mnohem slabší a méně významná. Faktor IX poté přibírá svůj kofaktor, faktor VIII, který opět sám není enzymově aktivní. Aktivovaný komplex F IX-F VIII (tzv. tenáza) napomáhá komplexu TF-F VII v aktivaci F X.
Protrombinázový komplex a trombin
Obě cesty se spojují při aktivaci faktoru X. Aktivovaný F X vytvoří komplex se svým kofaktorem – faktorem V. Komplex F X-F V je znám pod názvem protrombináza. Protrombináza proteolyticky mění protrombin (faktor II) na aktivní trombin. Vznikající trombin aktivuje pozitivní zpětněvazební smyčkou další molekuly kofaktorů F VIII a F V, a tak posiluje tvorbu protrombinázy. Účast tkáňového faktoru, kofaktoru VIII a kofaktoru V v aktivaci protrombinázy je kritická. Neméně důležitá je lokalizace popsaných pochodů na fosfolipidových membránách. Bez splnění těchto podmínek by zůstala aktivita enzymů F VII, F IX a F X nízká.
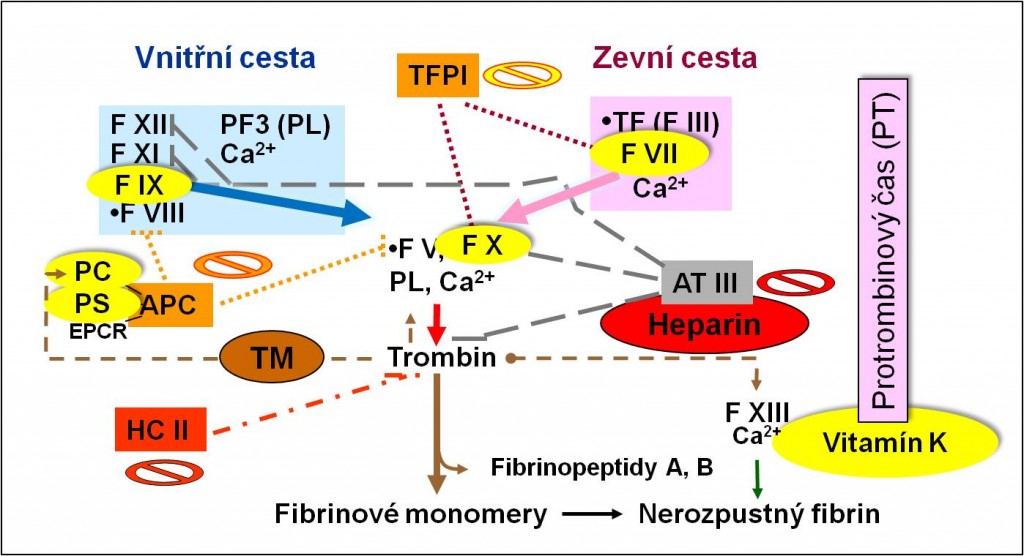
Dále stojí za zmínku, že faktory VII, IX a X jsou spolu s trombinem vitamin K-dependentní faktory. Kofaktory V a VIII jsou cílem působení přirozených inhibitorů koagulace – proteinu C a proteinu S, které rovněž jsou K-dependentní. Vitamin K působí jako enzymový koenzym. Zajišťuje unikátní postranslační karboxylaci vedlejšího řetězce kyseliny glutamové v cílových polypeptidových řetězcích; výsledkem je přítomnost kyseliny γ-karboxyglutamové v cílových proteinech.
Obr. 2. Vybrané složky koagulační kaskády a přirozené inhibitory, jejichž syntéza je závislá na vitamínu K, jsou vyznačeny žlutě; patří k nim ovšem i trombin, který není žlutě vyznačen. Znázorněn je rovněž skupinový PT test používaný pro monitorování zevní cesty a kontrolu účinnosti terapie antagonisty vitamínu K. Schéma je možno zhlédnout i v animované podobě.
Přirozené inhibitory koagulace
Za fyziologických podmínek je proces koagulace v rovnováze s jeho inhibicí protikoagulačními faktory.
Základem kontroly hemokoagulace je nesmáčivý povrch endotellií. Normální cévní endotel je vysoce antitrombogenní. Jeho účinek doplňuje jednak systém přirozených inhibitorů hemokoagulace, jednak třetí hemostatická fáze, tzn. fibrinolýza.
Systém přirozených inhibitorů koagulace má tři hlavní složky:
1. Inhibitor cesty zevního faktoru (TFPI)
První ze složek systému přirozených inhibitorů koagulace brání nepřiměřené aktivaci zevní cesty, která je pro proces koagulace rozhodující. Reprezentuje ji inhibitor cesty zevního faktoru (TFPI, tissue factor pathway inhibitor). Inhibitor TFPI se váže na aktivní komplex TF-F VII a potlačuje jeho aktivitu.
2. Antitrombin (AT III), komplex AT III+heparin
Druhou ze složek systému přirozených inhibitorů koagulace tvoří antitrombin (AT III). Účinně inhibuje nejen trombin, ale také všechny ostatní aktivované koagulační enzymy, a dokonce i další serinové proteázy, zejména pokud nejsou chráněny svými kofaktory. Antitrombin je produkován játry a funguje ukotvený na povrchových membránách. Základnou pro jeho uchycení je heparansulfát syntetizovaný intaktními endotelovými buňkami. Inhibiční působení antitrombinu významně stimuluje heparin, strukturou příbuzný heparansulfátu. Zatímco vrozený částečný deficit antitrombinu se zjišťuje asi u 1 – 2 % případů trombofilií, úplný (homozygotní) deficit antitrombinu není slučitelný se životem.
Heparin je významný přirozený inhibitor hemokoagulace, působí hlavně v komplexu s antitrombinem III.
Nedostatek AT vede ke zvýšenému riziku výskytu trombóz (trombofilie). V těchto případech je nutná substituce AT. Existují 2 typy této poruchy:
- Vrozená, z poruchy molekuly AT; asi u 0,5 ‰ obyvatelstva.
- Získaná, způsobená defektem syntézy (jaterní cirhóza), zvýšenou spotřebou (v rámci DIC – diseminované intravaskulární koagulace) a také ze zvýšených ztrát (nefrotický syndrom, exsudativní enteropatie).
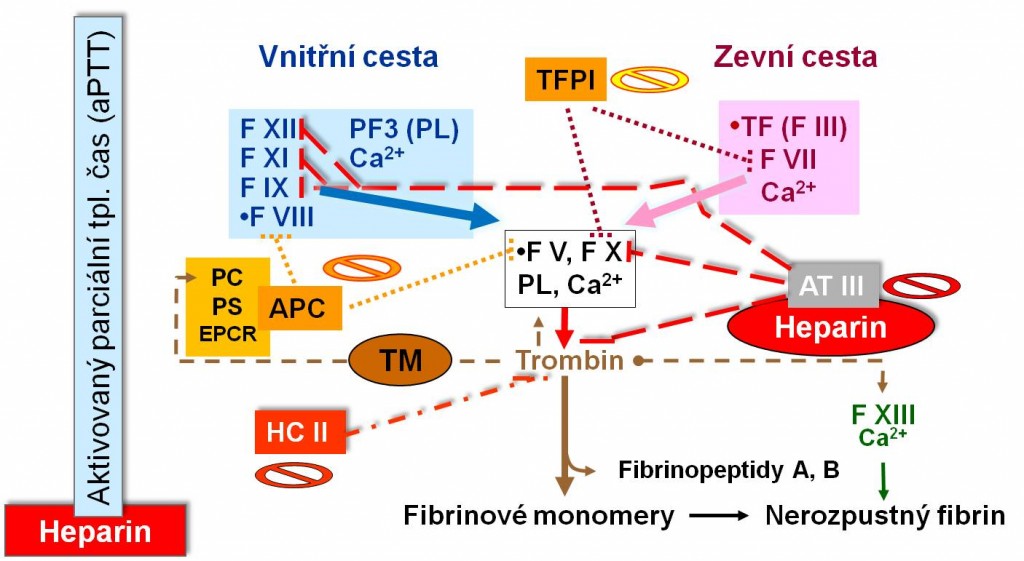
Obr. 3. Přirozené inhibitory koagulace: TFPI, antitrombin AT III, APC, heparin a heparinový kofaktor HC II. Znázorněn je rovněž skupinový aPTT test monitorující vnitřní cestu a používaný pro rutinní kontrolu účinnosti terapie heparinem. Schéma je možno zhlédnout i v animované podobě – jednak jako schéma přirozených inhibitorů koagulace, jednak jako schéma účinků heparinu a jejich monitorování skupinovýmtestem aPTT.
3. Aktivovaný protein C (APC)
Třetí ze složek systému je zaměřena na kontrolu kofaktorů F V a F VIII. Zajišťuje ji aktivovaný protein C (APC, activated protein C). Jeho složkami jsou protein C, protein S a specifický endotelový receptor. Protein C a S představují vitamin K-dependentní inhibitory systému koagulace. Protein C je aktivován účinkem trombinu (APC). APC inaktivuje faktory Va a VIIIa a současně podporuje i uvolňování tkáňového aktivátoru plazminogenu (t-PA), tím že inhibuje inhibitor aktivátoru plazminogenu (PAI). Účinek proteinu C mimo to zvyšuje i jeho tvorba komplexu s proteinem S.
Na povrchu endotelových buněk se nachází trombomodulin. Má vysokou afinitu k trombinu, který při aktivaci koagulační kaskády vzniká v jeho okolí. Naprosto největší hustota trombomodulinu je v kapilárách. Trombin přestává po vazbě na trombomodulin působit v koagulační kaskádě a štěpit fibrinogen, naopak získává schopnost aktivovat přirozený inhibitor koagulace protein C. Protein C se vystavuje působení trombinu po své vazbě na specifický povrchový endotelový protein EPCR (endothelial cell protein C receptor). Protein C aktivovaný trombinem a podporovaný svým kofaktorem proteinem S potom blokuje koagulační kofaktory V a VIII. Zasahuje tím kritická místa aktivace faktorů F IX a F X (tenázy a protrombinázy). K interakci mezi zúčastněnými proteiny jsou zapotřebí negativně nabité fosfolipidové povrchy. Protein C a protein S patří spolu s F VII, F IX, F X a trombinem k vitamin K-dependentním složkám koagulačního systému. Koplex APC se pomalu inaktivuje α1-antitrypsinem anebo inhibitorem proteinu C (PCI). Poločas působení APC je asi 20 minut.
Deficit proteinu C event. S má opět za následek zvýšený výskyt trombóz (trombofilie). Příčiny nedostatku proteinu C či S jsou následující: a) vrozený (homozygot 1: 600.000; heterozygot 1: 250 obyvatel), b) získaný (léčba antagonisty vitaminu K – Warfarin, jaterní cirhóza, autoimunitní choroby, těžší infekce a.j.).
Třetí fáze hemostázy: Fibrinolýza
Podobně ve třech fázích probíhá degradace (dissoluce) fibrinu plazminem – fibrinolýza:
- Tvorba aktivátorů plazminogenu;
- Tvorba plazminu;
- Vlastní fibrinolýza.
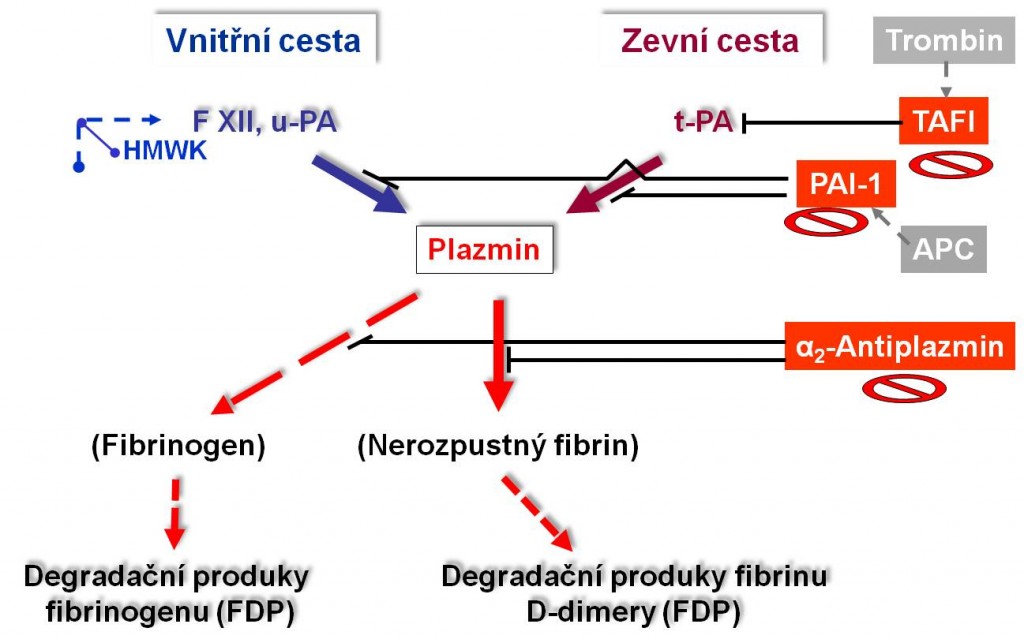
V celém cévním řečišti probíhá trvale vytváření malých množství fibrinu, který je současně stále odstraňován fibrinolytickým procesem. Hemokoagulační systém tak za normálních okolností zůstává permanentně v rovnováze. Pokud jde o bližší vztah mezi endotelem a třetí hemostatickou fází, fibrinolýzou, je vhodné mít na paměti, že endotelové buňky syntetizují jak tkáňový aktivátor plazminogenu (tPA), tak jeho inhibitor (PAI-1). Fyziologickými inhibitory firinolýzy jsou α2- antiplazmin, inhibitor aktivátoru plazminogenu (PAI) a trombinem aktivovaný inhibitor fibrinolýzy (TAFI).
Obr. 4. Schéma fibrinolýzy. Schéma je možno zhlédnout i v animované formě – jednak jako schéma aktivace a účinků plazminu, jednak jako schéma inhibitorů fibrinolýzy.
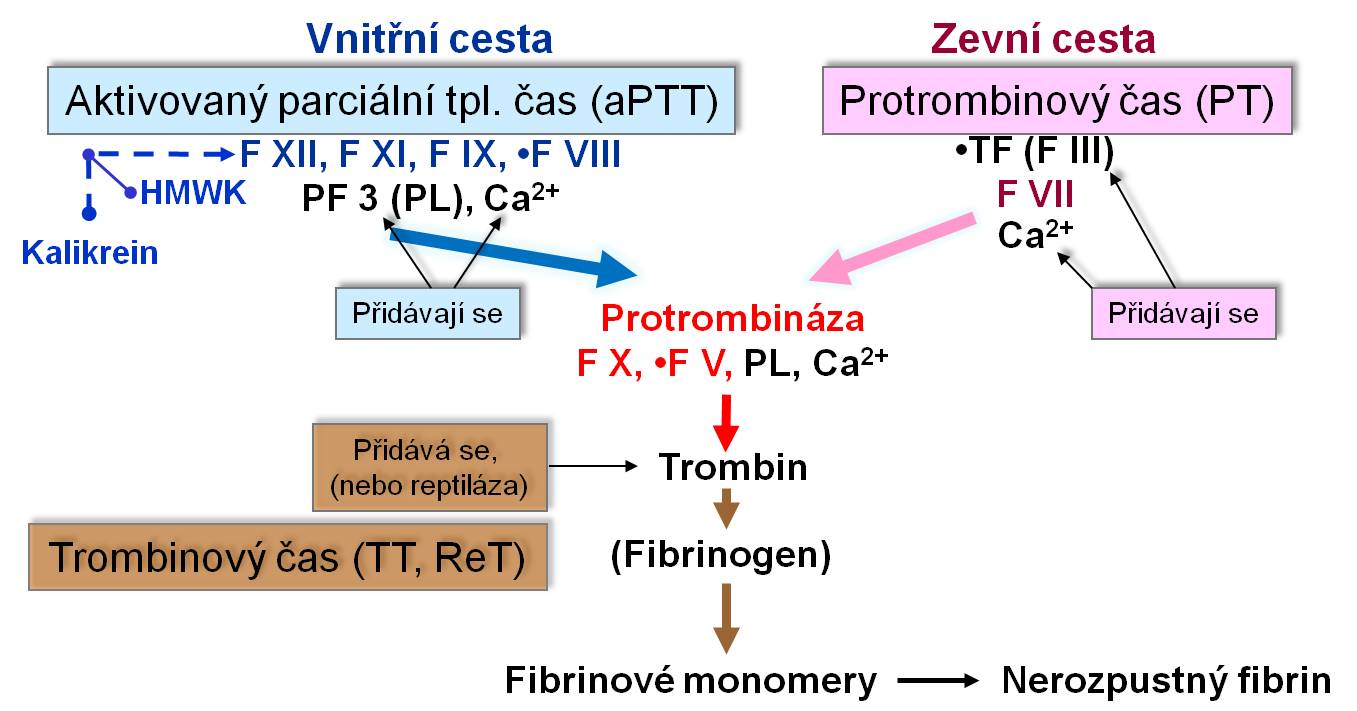
Rutinní testy koagulace
Testem zevní cesty je Quickův protrombinový čas (PT), který nám monitoruje f. VII, X V, trombin a a fibrinogen. Hodnotu Quickova testu udáváme mezinárodně normalizovanými jednotkami INR (international normalized ratio). Norma: INR mezi 0,8 – 1,2.
Testem vnitřní cesty je aktivovaný parciální tromboplastinový čas (aPTT). Monitoruje faktory VIII až XII, f. V, trombin a fibrinogen. Norma aPTT: 20 – 35 sec.
Třetím rutinním skupinovým testem je trombinový (nověji reptilázový) čas.
Obr. 5. Hlavní skupinové testy hemokoagulace. Schéma je možno zhlédnout i v animované formě.
Rychlé a efektivní monitorování hemostázy umožňuje trombelastografie.
Farmakologické inhibitory koagulace (antikoagulancia)
Hepariny (nefrakcionovaný, nebo nízkomolekulární) blokují trombin nepřímo, aktivací fyziologického antitrombinu. Při nedostatku antitrombinu je proto nutno počítat se sníženým účinkem léku. Antidotem heparinu je protamin. Pozor na trombocytopenii navozenou heparinem.
Přímé inhibitory trombinu (např. Lepirudin). Tyto mají na trombin přímý účinek, není však k dispozici jejich antidotum. Význam těchto léků je v terapii heparinem indukované trombocytopenie (HIT).
Kumariny (Warfarin, Marcumar) jsou antagonisty vitaminu K. Tento vitamin má výzmam při aktivaci faktorů protrombinového komplexu (II, VII, IX, X) a také proteinů C a S. Při nedostatku vitaminu K játra vytvářejí jen funkčně neúčinné prekurzory výše uvedených faktorů (tzv. PIVKA fenomén).
Farmakologické aktivátory fibrinolýzy (fibrinolytika)
SK: streptokináza. Spolu s plazminogenem vytváří aktivátorový komplex, pomocí něhož vzniká z plazminogenu plazmin.
tPA: tkáňový aktivátor plazminogenu (Altepláza). Aktivuje převážně na fibrin vázaný plazminogen, a vede tudíž hlavně k lokální fibrinolýze. Genovou technologií lze vytvořit preparáty podobné tPA, které mají výhodu delšího poločasu (např. Retepláza – rPA, event. Lanotepláza – lPA, s poločasem až 25 minut).
Farmakologické inhibitory fibrinolýzy (antifibrinolytika)
Látky používané v terapii: Kyselina paraaminobenzoová (PAMBA) a kyselina tranexamová. Jejich indikací je primární hyperfibrinolýza. Používají se také jako antidota při léčbě fibrinolytiky. Kontraindikací naopak je ledvinová insuficience, těhotenství, trombózy a diseminovaná intravaskulární koagulace (DIC).
Zpracovali: Jaroslav Veselý, Ústav patologické fyziologie LF UP; Lucie Lukešová, II. interní klinika LF UP a FN v Olomouci