Zpracoval: MUDr. Martin Dobiaš, Ústav patologické fyzioogie LF UP v Olomouci
Definice
Anémie, nebo také chudokrevnost, je chorobný stav vyznačující se zejména sníženou koncentrací hemoglobinu (Hb) v krvi pod fyziologickou hodnotu v daném věku a vzhledem k pohlaví. Dalším diagnostickým prostředkem pro určení anémie je hematokrit (Hct) a množství červených krvinek (RBC). Tyto prostředky (Htc a RBC) však v porovnání s koncentrací Hb nejsou spolehlivými indikátory, neboť hodnota Htc se např. nemění při sníženém počtu erytrocytů, které jsou však v krvi přítomny jako makrocyty (makrocytární anémie). Také počet erytrocytů není směrodatný, neboť i normální množství erytrocytů může obsahovat méně hemoglobinu (hypochromní anémie).
O anémii hovoříme, pokud je koncentrace hemoglobinu u mužů nižší než 135 g/l. U žen se za patologickou považuje koncentrace pod 120 g/l. Nejsložitější situace je u dětí, kdy dochází ke kolísání normálních hodnot hemoglobinu v závislosti na jejich věku (patologické hodnoty: od 1/2 roku do 5 let pod 110 g/l, od 5 let do 12 let pod 115 g/l, od 12 let do 15 let pod 120 g/l) .
V praxi se můžeme setkat s tím, že každé pracoviště má stanoveny své individuální hodnoty hemoglobinu i celého krevního obrazu.
Je také nutné myslet na situace, kdy anémie není absolutní ale jenom relativní. Hodnoty hemoglobinu a hematokritu mohou být relativně snížené při nadbytku intravaskulární tekutiny. Příkladem je gravidita nebo splenomegalie. Naopak, při poklesu intravaskulárního volumu (dehydratace), dochází k tzv. „maskované“ anémii (hematokrit vykazuje normální hodnoty).
Parciální tlak kyslíku je v krvi se sníženým množstvím Hb normální, avšak celkový objem (celková koncentrace) kyslíku v krvi je nižší a do tkání je ho transportováno méně. Vytváří se hypoxický stav.
Snížená saturace tkání kyslíkem stimuluje kyslíkové senzory v proximálních tubulech ledvin a dochází k značné produkci HIF-1 (hypoxií indukovaný faktor), který se významně podílí na expresi genu pro erytropoetin (Epo). Jedná se o stabilní heterodimér složený ze dvou podjednotek - HIF-1α a HIF-1β. HIF-1α je labilní faktor, který je v případě nehypoxického stavu degradován proteolytickým enzymem a v hypoxickém stavu spojován s HIF-1β za vytvoření stabilního HIF-1, který zprostředkovává tvorbu Epo. Epo je krví transportován do kostní dřeně, kde se váže na erytropoetinové receptory (EpoR) umístěných na erytroidních progenitorech a stimuluje proliferaci, maturaci a inhibuje apoptózu erytroidních progenitorů.
Klasifikace anémií
Klasifikace anémií vychází z morfologických znaků červených krvinek a z etiopatogeneze. Diagnóza je umožněna díky moderním a citlivým automatických analyzátorů v laboratorní diagnostice.
Morfologická klasifikace vychází ze stanovení:
- MCV (mean corpuscular volume) – tzv. střední objem erytrocytů. Umožňuje anémie rozdělit dle velikosti objemu erytrocytů, a to na mikro-, normo- a makrocytové. Objem normocytů je 80 – 100 fl.
- MCH (mean corpuscular hemoglobin) – tzv. průměrná hmotnost hemoglobinu v erytrocytu. Umožňuje anémie rozdělit dle průměrné hmotnosti hemoglobinu v erytrocytech na hypo-, normo- a hyperchromní anémie. Hmotnost normochromů je 27 – 32 pg.
- MCHC (mean cell hemoglobin concentration) – tzv. průměrná koncentrace hemoglobinu v erytrocytu.
- RDW (red cell distribution width) – tzv. distribuční šíře erytrocytů zachycující stupeň jejich anizocytózy (podává přehled o variabilitě ve velikosti erytrocytů). Norma by měla být mezi 13 až 15 %.
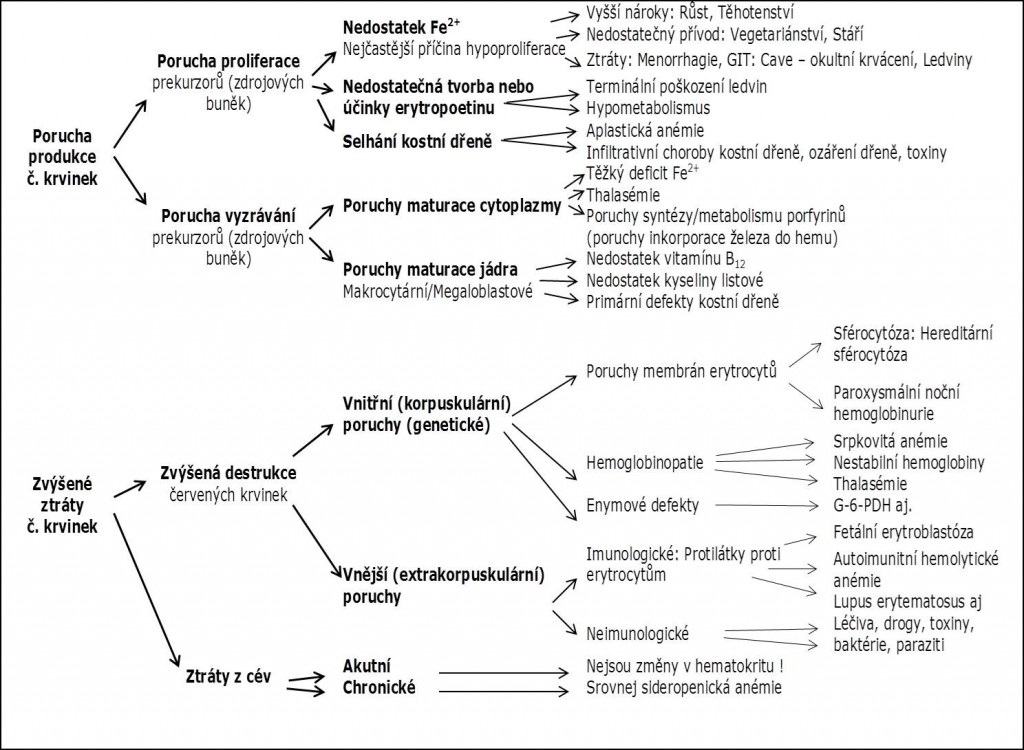
Etiopatogenetická klasifikace rozlišuje anémie (obr. 1 a 2):
- Z poruch produkce;
- Ze zvýšených ztrát erytrocytů.
Obr. 1. Etiopatogenetická klasifikace anémií. Podle V Seidlová, K Indrák a I Krč: Vnitřní lékařství VI. (Semináře z anemie a hematologie). VUP Olomouc, 1987.
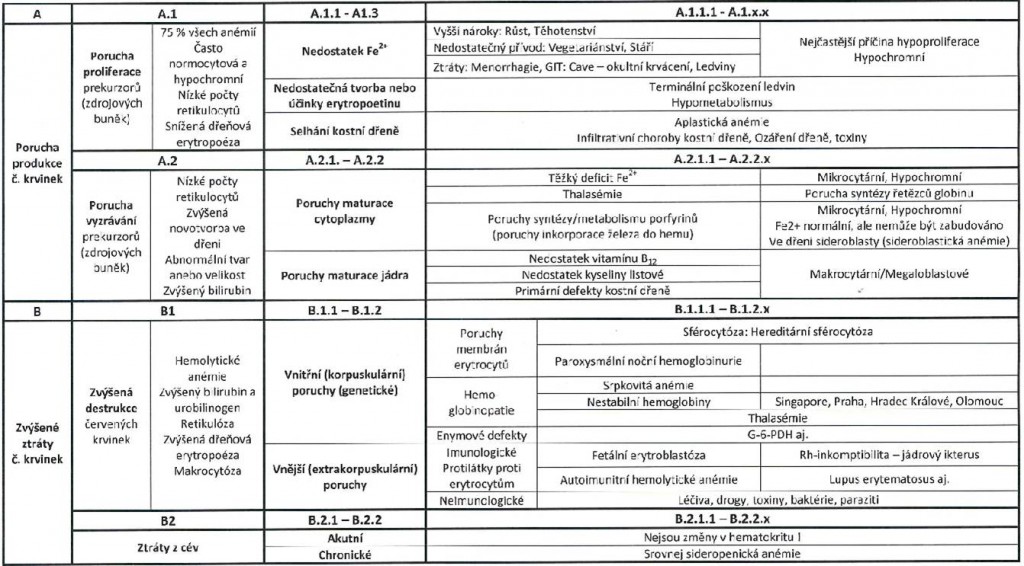
Obr. 2. Přehled rozdělení anémií v tabulce.
Anemický syndrom
Anémie se projevují klinickými příznaky, které se souhrnně nazývají anemický syndrom.
Symptom = příznak. Soubor symptomů (příznaků) = syndrom. Anemický syndrom je označení jak pro subjektivní, tak objektivní klinické příznaky, které doprovázejí sníženou hladinu hemoglobinu, tedy anémii. Tento syndrom se rozvíjí na základě sníženého přísunu kyslíku do tkání a doprovází většinu anémií.
- Symptomy subjektivní - zjišťují se anamnesticky a nejsou specifické:
- Slabost, únava, snížení výkonu, emoční labilita, bolest hlavy, dušnost při námaze, stenokardie, poruchy spánku, zhoršení paměti, zpomalené psychomotorické tempo, pocit chladných aker, snížení libida…
- Symptomy objektivní - závislé na etiologii, patogenezi a dělí se dle orgánových systémů:
- Kůže/sliznice - bledost, ikterus, koilonychie (lžičkovité nehty), petechie (tečkovité krvácení do kůže), hematomy, ragády (praskliny v kůži – koutky), Hunterova glositida, bledost spojivek…;
- Urogenitální systém - albuminurie, poruchy menses…;
- Nervový systém - parestézie;
- GIT - dyspeptické potíže;
- Kardiovaskulární systém - systolické šelesty, otoky dolních končetin, ischémie myokardu, srdeční slabost, palpitace.
Kompenzační mechanismy se snaží zabránit rozvíjení anemického syndromu a potlačit proces anémie. Mezi nejvýznamnější mechanismy patří:
Pokles periferní rezistence, zvýšení srdečního výdeje a snížení viskozity krve – soubor těchto procesů se označuje jako hyperkinetická cirkulace, která je i objektivním příznakem anemického syndromu;
- Zvýšená tvorba erytropoetinu;
- Zvýšení respiračního úsilí – tachypnoe;
- Zvýšení srdeční frekvence – tachykardie;
- Snížení afinity krve ke kyslíku, která je zprostředkovaná zvýšenou tvorbou 2,3-DPG (2,3-difosfoglycerátu) tvořící se v erytrocytech.
Charakteristika vybraných anémií
Sideropenická anémie
Je nejčastějším typem anémie na celém světě (500 miliónů postižených obyvatel, v ČR představuje zhruba 80 % všech anémií). Tento typ anémie vzniká z deficitu železa. Metabolismus Fe v lidském organismu představuje uzavřený systém, kdy většina odpadního Fe je reutilizována a jeho malé ztráty jsou doplněny složkami potravy. V lidském těle je obsaženo zhruba 3,5 až 5 g Fe. Vhodným ukazatelem zásob Fe v organismu je míra sérového Fe ve formě sérového ferritinu, která se pohybuje kolem 50 µg v 1 litru krve. Jakmile je metabolismus Fe a jeho fyziologické hodnoty narušeny, vzniká sideropenická anémie.
Příčiny narušení metabolismu a fyziologických hodnot Fe jsou následující:
- Krvácení, v jehož důsledku dochází ke ztrátám Fe. Nejčastěji se jedná o patologické krvácení:
- Do gastrointestinálního traktu (vředová choroba žaludku a duodena, hiátová hernie, jícnové varixy, malignity jako jsou karcinomy žaludku a kolorektální karcinomy…)
- Děložní (menoragie)
- Uropoetického systému (hematurie, hemoglobinurie)
- Epistaxe
- Přílišné odběry krve a jiné…
- Nenadekvátní přísun a zpracování Fe:
- Malnutrice (nedostatečný přísun Fe při nekvalitním, nebo specifickém stravování – vegetriánství);
- Maldigesce (nedostatečné uvolňování Fe z myoglobinu/hemoglobinu z přijaté potravy zapříčiněné atrofickou gastritidou, zvýšenou vazbou Fe na fosfáty a fytáty při převaze rostlinné stravy…).
- Malabsorpce (dochází k ní při porušení slizničního epitelu odpovědného za vstřebávání Fe a to především duodena a ilea → glutenová enteropatie).
- Zvýšené nároky organismu na Fe:
- Při růstu;
- V těhotenství.
Následkem působení uvedených příčin je snížený přísun Fe dozrávajícím prekurzorům červených krvinek, tzv. erytroblastům. V kostní dřeni dochází ke zpomalenému dozrávání erytrocytů a ke stagnaci erytroblastů, na které při delším setrvání v kostní dřeni déle působí mitotická aktivita a dělí se více, než při kratším setrvání díky dostatečného přísunu Fe. Z toho vyplývá, že retikulocyty v periferní krvi budou zastoupeny v menším počtu a vzhledem k déletrvajícímu působení mitotických faktorů dojde k maturaci erytrocytů s menším objemem a průměrem, tzv. mikrocytů. Nedostatečný přísun Fe do erytroblastů vede i ke snížené hemoglobinizaci a vznikají tzv. hypochromní erytrocyty. V kostní dřeni se snižuje počet sideroblastů, v periferní krvi se snižuje hladina sérového ferritinu pod 20 µg/l a saturace transferinu železem klesá pod 16 % (normálně se saturace transferinu pohybuje v rozemzí 30 – 50 %).
Klinický obraz
Pacienti k lékaři nejčastěji přicházejí se subjektivními symptomy, jako jsou zvýšená únavnost, snížená schopnost koncentrace a výkonnost. Mezi objektivní symptomy patří pálení jazyka, lomivost nehtů a ragády ústních koutků, Kellyho-Patersonův syndrom. Ojediněle, byť velice typická pro sideropenickou anémii je tzv. pika (pojídání hlíny, omítky, hřebíku), ale také pagofagie, vyznačující se pojídáním ledu. Bledost kůže a sliznic, namodralé skléry, vyhlazený jazyk a koilonychie (ploché, až lžičkovité nehty).
Terapie
Léčba sideropenické anémie spočívá v substituci železa, která nejprve vede k normalizaci krevního obrazu a posléze k doplnění zásobních forem železa v organismu – zvyšuje se hladina sérového ferritinu a stoupá i saturace transferinu. Železo se užívá per os ve formě potahovaných tablet v denní dávce 100 – 200 mg 2x denně nalačno. Při nežádoucích dyspeptických účincích a nesnášenlivosti tablety podáváme po jídle. Primárním účinkem substituce je zvýšení hladin hemoglobinu alespoň o 20 g/l během 3 týdnů. Cílem terapie je nejenom zvýšení množství hemoglobinu, ale také zvýšení saturace hemoglobinu a normalizace koncentrace sérového feritinu. Jakmile hladina sérového feritinu stoupne na fyziologickou hodnotu (50 µg/l), podávání léku se zastaví.
Megaloblastové anémie
Megaloblastové anémie vznikají v souvislosti s porušeným metabolismem kyseliny listové a vitamínem B12. Kyselina listová (též vitamín B9, kyselina pteroylglutamová, folát) a kobalamin (vitamín B12) jsou ve vodě rozpustné vitamíny ze skupiny B-komplexu, esenciálně důležité pro syntézu DNA. Vitamín B12 je kofaktorem při konverzi homocysteinu na methionin za vzniku aktivované kyseliny listové (tetrahydrofolát) z metyl-tetrahydrofolátu. Aktivovaná kyselina tetrahydrolistová je nezbytná pro syntézu tymidinu, který je dále využíván pro syntézu DNA a purinů.
Erytropoéza je děj závislý na správně probíhající syntéze DNA. Při nedostatku kobalaminu a kyseliny listové dochází k narušení syntézy DNA, což vede k poruše buněčného dělení. Vedle erytropoézy dochází i k narušení granulocytopoézy a trombocytopoézy (až vzniku pancytopenie). Zpomalená syntéze DNA vede k časově delšímu dozrávání jádra, přičemž cytoplazma dozrává obvyklým tempem. Mluvíme o tzv. jádro-plazmové maturační asynchronii. Tento proces způsobuje megaloblastovou přestavbu krvetvorby a dochází k tvorbě tzv. megaloblastů (makroovalocyty/makrocyty s MCV > 100 fl). Většina takto zvětšených prekurzorů erytrocytů zaniká již v kostní dřeni dříve než dosáhnou stádia retikulocytů. Rozvíjí se tzv. neefektivní erytropoéza, která má za následek snížení počtu retikulocytů v krvi. Hemoglobin a jeho degradační produkty z takto zaniknuvších prekurzorů jsou uvolňovány do periferní krve, ve které stoupá hladina nekonjugovaného bilirubinu a izoenzymu-1 laktát-dehydrogenázy. V periferní krvi se také mohou vyskytovat erytroidní a myeloidní prekurzory. Zpomalené vyzrávání jádra granulocytů způsobuje jeho hypersegmentaci.
Megaloblastové anémie dělíme na anémie:
- Z nedostatku vitamínu B12 – tzv. perniciózní anémie.
- Ostatní anémie z nedostatku vitamínu B12.
- Z nedostatku kyseliny listové.
Perniciózní anémie
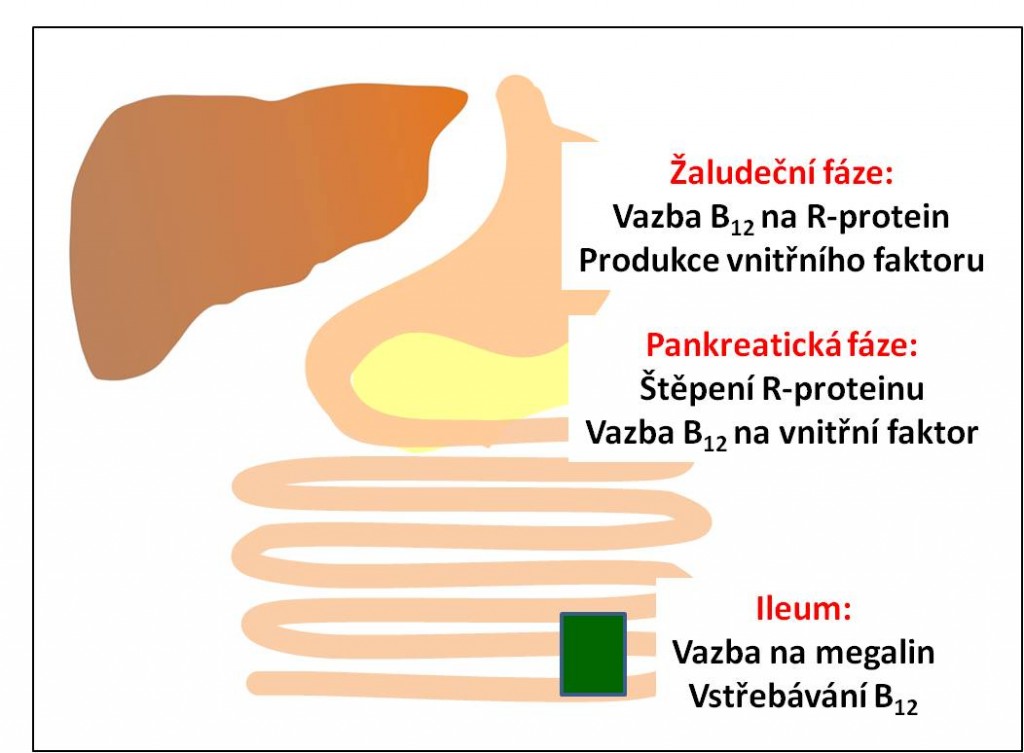
Tento typ anémie vzniká při nedostatku vitamínu B12 v organismu. Nejvíce vitamínu B12 přijímáme při konzumaci vajec, mléčných výrobků a masa. V žaludku je uvolněný vitamín navázán na R-nosič (R-binding protein) (obr. 3) a v této podobě je transportován do duodena, ve kterém dochází k rozpadu vazby mezi vitamínem a nosičem. Na uvolněný vitamín je navázán vnitřní faktor (IF – intrinsic factor) produkovaný parietálními buňkami především ve fundu žaludku. Vzniká komplex B12-IF, který odolává trávicím enzymům a je transportován do koncové části ilea, které je opatřeno velkým množstvím receptorů pro komplex B12-IF. Receptor se nazývá megalin; megalin je rovněž lokalizován na kartáčovém lemu v tubulech ledvin, kde zprostředkovává reabsorpci proteinů (např. apoproteinu-A z HDL). Jeho prostřednictvím, pravděpodobně s účastí receptoru liporoteinové receptorové rodiny cubilinu, dochází k internalizaci celého komplexu, v buňce enterocytu pak k rozvolnění vazby a vstřebání vitamínu B12 do krve (vazba na transportní protein transkobalamin). Komplex B12-transkobalamin je krví transportován do kostní dřeně a jater. Podrobnější informace o vstřebávání vitamínu B12 jsou rovněž uvedeny v kapitole Patofyziologie vstřebávání Vitamínu B12 a Schillingův test.
Obr. 3. Hlavní stupně vstřebávání vitamínu B12.
Perniciózní anémie je tedy způsobená nedostatečným vstřebáváním vitamínu B12. Příčinou může být chybění vnitřního faktoru anebo přítomnost autoprotilátek. Vzácně se vyskytuje mutace receptoru megalinu.
Antigen způsobující tvorbu autoprotilátek představuje enzym, který se ve fundu žaludku podílí na tvorbě HCl – autoprotilátky jsou tedy přítomny už v žaludeční šťávě. Jde o tzv. blokující protilátky, které zabraňují nejenom vzniku komplexu B12-IF (1. typ protilátek), ale zabraňují i navázání tohoto komplexu na receptory pro vnitřní faktor v ileu (2. typ protilátek). Rozvíjí se megaloblastová přestavba kostní dřeně a rozvoj neurologických poruch. Perniciózní anémie má dlouhou latenci, projeví se až za několik let. To z toho důvodu, že lidské tělo má v zásobě přibližně 4000 µg vitamínu B12 a jeho denní spotřeba činní pouze 3 µg.
Klinický obraz
Pacient přichází pro klasické příznaky anemického syndromu, trpí nevolností, nechutenstvím a hubne. Provází ho průjem, obtížné polykání, pálení jazyka, parestézie, slabost dolních končetin s narušenou chůzí, zhoršení čichu, chuti a zraku. Dále šedivění vlasů u mladých dospělých, modré zbarvení rohovky, hyperpigmentace kůže, vitiligo, ulecerace koutků. Ztráta hlubokého i jemného čití v důsledku postižení zadních provazců míšních. Může být přítomna také spastická paraparéza dolních končetin díky postižení postranních provazců míšních.
Terapie
V podobě nasycovací dávky v množství 300 µg vitamínu B12 i.m. denně po dobu až 10 dnů (při neurologických potížích až 1000 µg/den po dobu 14 dnů). Mělo by dojít ke zmnožení retikulocytů v krvi během 4. dne léčby. Poté 1x týdně po dobu několika měsíců do úpravy krevního obrazu a normalizace parametrů v séru (S-bilirubin, S-LDH…). Pokud terapie nezabírá, je nutné pátrat po dalších přidružených onemocněních (zánět, nádor).
Ostatní megaloblastové anémie (MA) z nedostatku B12
- Nutriční MAB12 – vzniká při sníženém příjmu vitamínu B12 dietou (výjimečně vzácná).
- Postresekční MAB12 – vzniká po gastrektomii, jejímž následkem je omezená tvorba vnitřního faktoru; obdobná anémie vzniká při resekci terminálního ilea (10 – 15 cm), při které dochází ke ztrátě velkého množství receptorů pro komplex B12-IF.
- MAB12 u primární malabsorpce (celiakální sprue) – nutná léčba pomocí všech tří složek (B12,kyselina listová, Fe).
- Selektivní malabsorpce vitamínu B12 s proteinurií (geneticky determinovaná). Způsobená mutací megalinu; proteiny přecházejí do moči.
- MAB12 způsobené nadměrnou spotřebou vit. B12 bakteriemi při syndromu stagnující kličky.
Megaloblastová anémie z nedostatku kyseliny listové
V lidském organismu je uskladněno zhruba 5 – 20 mg kyseliny listové, která do těla přichází zeleninovou dietou. Její denní spotřeba činí přibližně 0,10 mg/den, a její deficit se tak projeví během pár měsíců. Nedostatečné zásobování těla kyselinou listovou se nejprve projevuje její sníženou koncentrací nejprve v krevním séru, později v erytrocytech a následně megaloblastovou přestavbou kostní dřeně. Ve vnitru buněk dochází ke tvorbě defektní DNA, což vede k narušení růstu a diferenciaci buněk.
- Nutriční MA kys. listová – vyskytuje se u sociálně slabších jedinců a u nemocných s proteino-kalorickou malnutricí.
- MA kys. listové při zvýšené potřebě folátů – např. v těhotenství, v období růstu, nádorovém onemocnění, hemolytické anémii…
- Malabsorpce kyseliny listové při celiakální, tropické, glutenové sprue.
Terapie
Po dobu několika týdnů podávání kyseliny listové v dávce 10 mg/den per os. Změna jídelníčku, případné injekční podávání.
Hemolytické anémie
Hemolytické anémie jsou způsobené zkráceným přežíváním erytrocytů, tedy jejich sníženou stabilitou a následnou hemolýzou. Jedná se různorodou skupinu onemocnění, které však mohou mít společné patofyziologické znaky. K hemolýze erytrocytů může dojít jak v prostředí extravaskulárním, tak v intravaskulárním.
Při hemolýze v extravaskulárním prostředí (ve slezině, játrech, kostní dřeni) za přítomnosti makrofágů dochází k recyklaci uvolněného globinu a železa, zatímco hem je degradován na bilirubin, který při zvýšené hemolýze může vyústit v ikterus. Díky recyklaci hemoglobinu a jeho dalších složek nedochází k tzv. hemoglobinurii a k hemosiderinurii.
Při hemolýze v intravaskulárním prostředí je uvolněný hemoglobin okamžitě navázán na haptoglobin a v komplexu haptoglobin-hemoglobin transportován do monocyto-makrofágového systému. Tímto způsobem je zabráněno prostupu hemoglobinu přes glomerulární membránu a jeho ztrátám močí. Krev však obsahuje omezené množství haptoglobinu (1 g/l; jeho syntéza v játrech je pomalá). Při značné hemolýze dojde k uvolnění velkého množství hemoglobinu a tím pádem k úplnému nasycení haptoglobinu hemoglobinem. Zbylý nevyvázaný hemoglobin prostupuje filtrační membránou ledvin do tubulů a objevuje se hemoglobinurie. Část se ho v tubulárním systému přeměňuje na hemosiderin a postupem času (3 – 4 dny) nastává hemosiderinurie. V krevní plazmě dochází k významnému snížení koncentrace haptoglobinu a ke zvýšení koncentrace laktátdehydrogenázy – tyto hodnoty jsou diagnostickými znaky intravaskulární hemolýzy.
Mimo výše uvedené znaky je dalším společným patofyziologickým rysem hemolytických anémií velká kompenzační schopnost krvetvorné tkáně. Krvetvorná tkáň je v těchto případech schopná zvýšit efektivitu proliferace a diferenciace erytropoetických buněk až na osminásobek normální produkce. Zkrácená doba přežívání erytrocytů tedy vede ke zvýšené produkci těchto krevních elementů. Při tomto průběhu je anemie asymptomatická a označuje se jako hemolytický syndrom.
Dělení hemolytických anémií podává schéma na obr. 1.