Úvod
Hemoglobin (Hb) dospělých osob je tetramer α2β2 složený ze dvou druhů homologníoh podjednotek, α a β.
Podjednotka α má sedm a podjednotka β osm šroubovicových segmentů označovaných písmeny A až H, které jsou spojeny nešroubovicovými úseky AB až GH. Krátký nešroubovicový segment před šroubovicí A se označuje NA (N-konec řetězce) a jiný, následující za šroubovicí H, se označuje HC (C-konec řetězce). Podjednotky α se liší od podjednotek β delecí 1 aminokyseliny v segmentu NA, přidáním 2 aminokyselin v části AB, delecí 6 aminokyselin v části CD a substitucemi přibližně na 80 místech z celkového počtu více než 140 aminokyselin. Přes tyto četné rozdíly v primární struktuře jsou terciární struktury podjednotek téměř shodné. Proto se rozdíly mezi podjednotkami často zanedbávají a molekula Hb se považuje za tetraedrický tetramer s diedrickou symetrií (obr. 1). Terciární struktura podjednotek Hb je stejná jako terciární struktura homologního myoglobinu (Mb), přestože se jejich řetězce shoduji v méně než 0,2 všech aminokyselinových zbytků. Tento fakt je potvrzením poznatku o degenerovaném „svinovacím kódu“ proteinů.
Každá z podjednotek obsahuje prostetickou skupinu – hem.
Spojení podjednotek
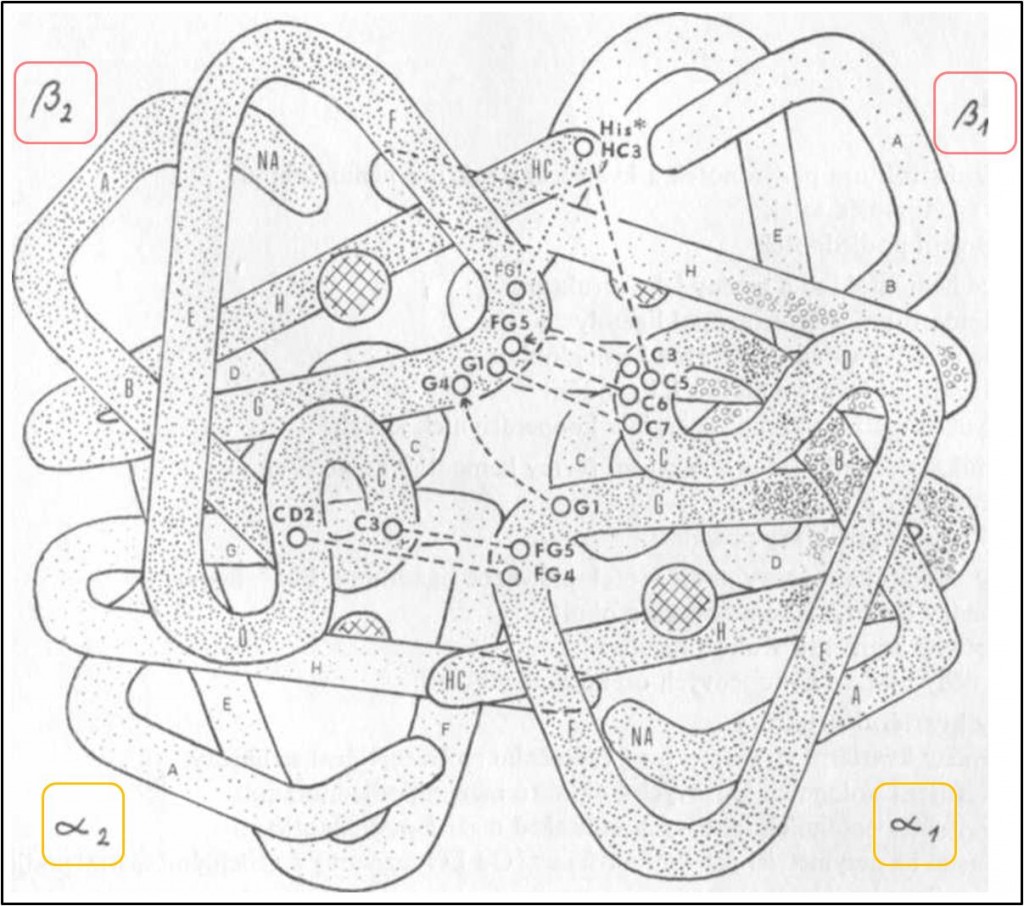
Tetraedrický tetramer Hb má jednu pravou dvojčetnou osu symetrie, která prochází dutinou mezi pod jednotkami, a dvě nepravé (pseudo)osy symetrie. Podjednotky, rozmístěné ve vrcholech tetraedru, spolu sousedí na šesti místech – na každé ze šesti hran tetraedru. Vzhledem k dvojčetné symetrii jsou dvě z těchto míst symetrická. Čtyři nesymetrická místa jsou reprezentována dvěma identickými dvojicemi (obr. 1 – 3).
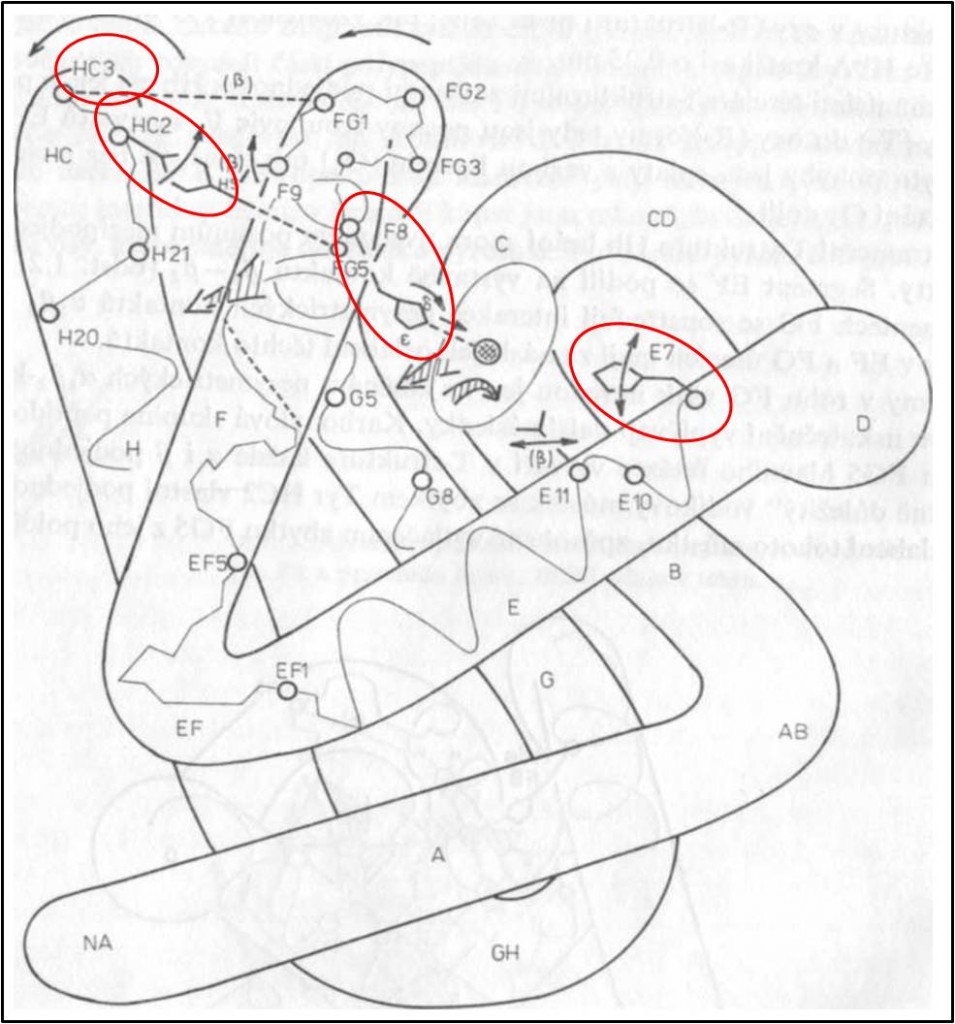
Obr. 1. Tetraedrické uspořádáni podjednotek v deoxy-T-struktuře Hb a nesymetrické vazby mezi podjednotkami. Velká písmena abecedy označují jednotlivé segmenty podjednotek. Drobnými kroužky jsou vyznačeny oblasti kontaktu α1β1. Většími kroužky spojenými přerušovanými čarami jsou označena některá místa v kontaktu α1β2. Přerušované zahnuté šipky znázorňují vazby vytvářející se v oxy-(R-)struktuře. Tečkovaná čára představuje vnitřní interakci v podjednotce α (T-struktura). Hvězdičkou je označena aminokyselina podílející se na Bohrově efektu. Pravá dvojčetná osa symetrie by byla znázorněna v rovině stránky, jak prochází svisle mezi podjednotkami středem molekuly.
Symetrická spojení
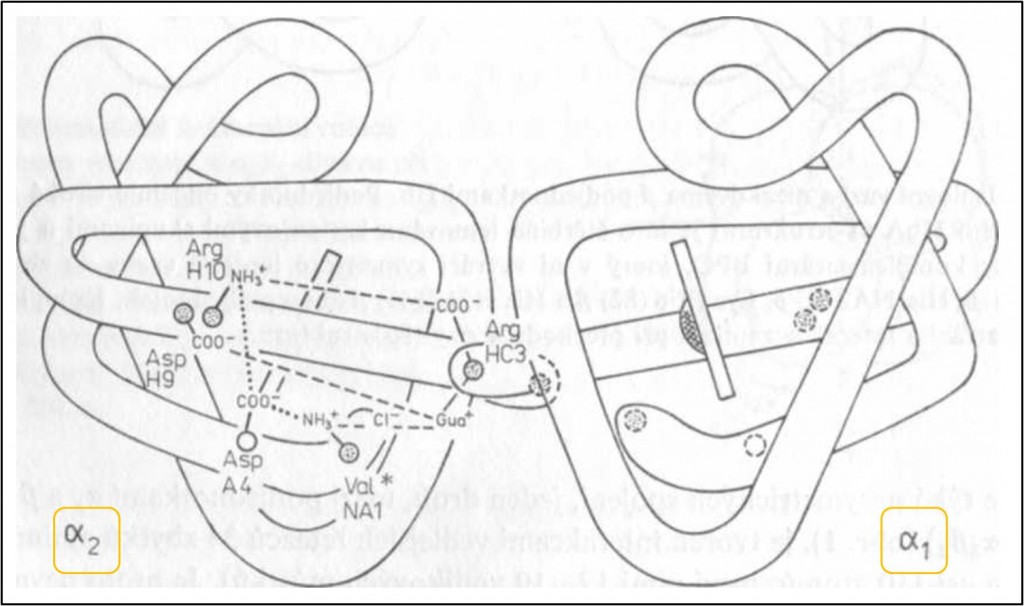
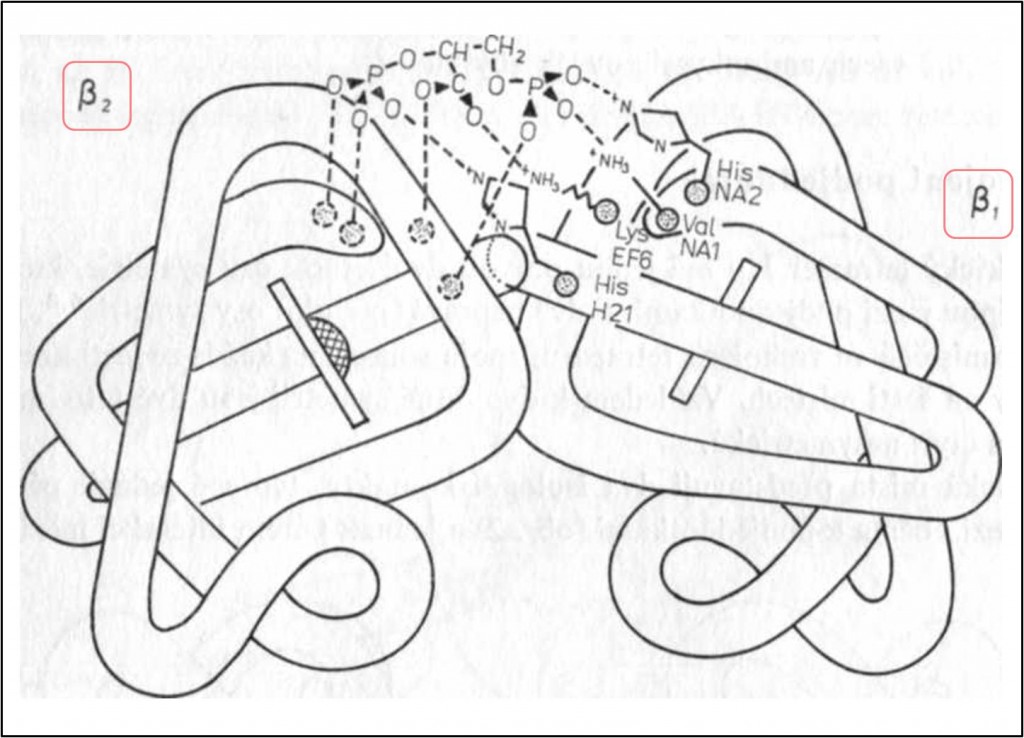
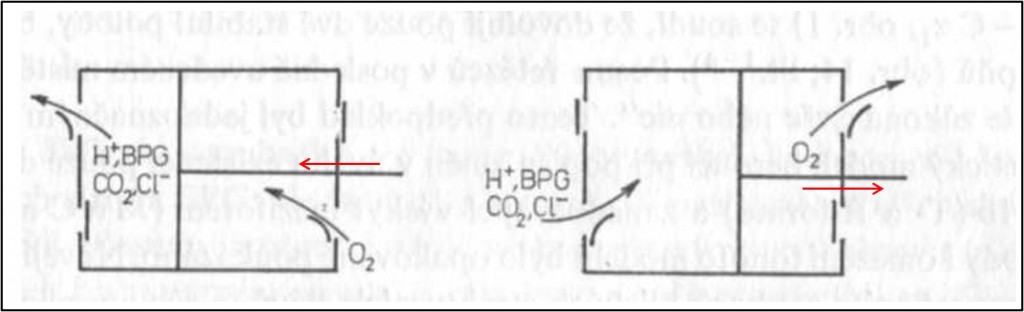
Symetrická místa představuji dva izologní kontakty tvořené jednak párem interakcí mezi oběma α-podjednotkami (obr. 2) a jednak párem interakcí mezi β-podjednotkami (obr. 3). Na rozdíl od α-podjednotek nevytváření podjednotky β izologní vazbu přímou interakcí mezi sebou, nýbrž prostřednictvím vazby organických aniontů (2,3-bis-fosfoglycerátu, BPS). Malé anorganické anionty jsou přítomny i v některých místech kontaktu mezi α-podjednotkami (obr. 2). Protože plochy dotyku identických podjednotek nejsou mimo body izologních kontaktů komplementární, izologní vazby nejsou příliš pevné.
Obr. 2. Izologní vazba dvou α-podjednotek Hb (T-struktura). Pro přehlednost je znázorněn pouze jeden kontakt, druhý by byl jeho symetrickým obrazem (čárkované kroužky). Přerušované čáry představují iontové interakce mezi skupinami příslušejícími různým podjednotkám (případně zprostředkované ionty Cl-). Tečkovaně je znázorněna jedna z interakcí uvnitř podjednotky α. Gua+ je guanidinová skupina Arg HC3α. Hvězdička označuje skupinu, která se podílí na Bohrově efektu. Mřížkovaná struktura uprostřed každé podjednotky představuje dvojmocný iont železa hemu.
Obr. 3. Izologní vazba mezi dvěma β-podjednotkami Hb (T-struktura). Podjednotky odděluje široká štěrbina. Je lemována kationtovými skupinami. Je stereochemicky komplementární BPG, který v ní vytváří symetrické iontové vazby s Val NA1 (1)β, His NA2 (2)β, Lys EF6 (82)β a His H21 (143)β obou β-podjednotek. Komplementárnost se ztrácí – a interakce proto zanikají – při přechodu v oxy-(R-) strukturu. (Srovnej obr. 11.)
Nesymetrická spojení
Co se týká nesymetrických spojení, to mezi podjednotkami α1 a β1 (popř. totéž α2β2) (obr. 1) je tvořeno interakcemi postranních řetězců 34 aminokyselin (celkem asi 110 atomů, mezi nimi 17 – 19 vodíkových můstků). Je proto pevnější než druhé, kontakt α1β2 (popř. α2β1), ve kterém interaguje pouze 19 aminokyselin (asi 80 atomů) (obr. 1).
Z důvodů rozdílné pevnosti vazeb mezi podjednotkami hemoglobin poměrně snadno disociuje na α1β1 dimery. To se projevuje i v průběhu funkčních procesů v Hb. Zjednodušeně řečeno, Hb tetramer lze považovat za spojení dvou dimerů αβ.
Deoxy-(T-) a oxy-(R-) forma hemoglobinu
Z funkčního hlediska je Hb vazebná a transportní bílkovina, která přenáší O2 z plic do tkání. Vedle toho se podílí na transportu CO2 z tkání do plic. Ve fyziologickém prostředí váže a uvolňuje také ionty H+ a Cl- a organické fosforečnany (BPG).
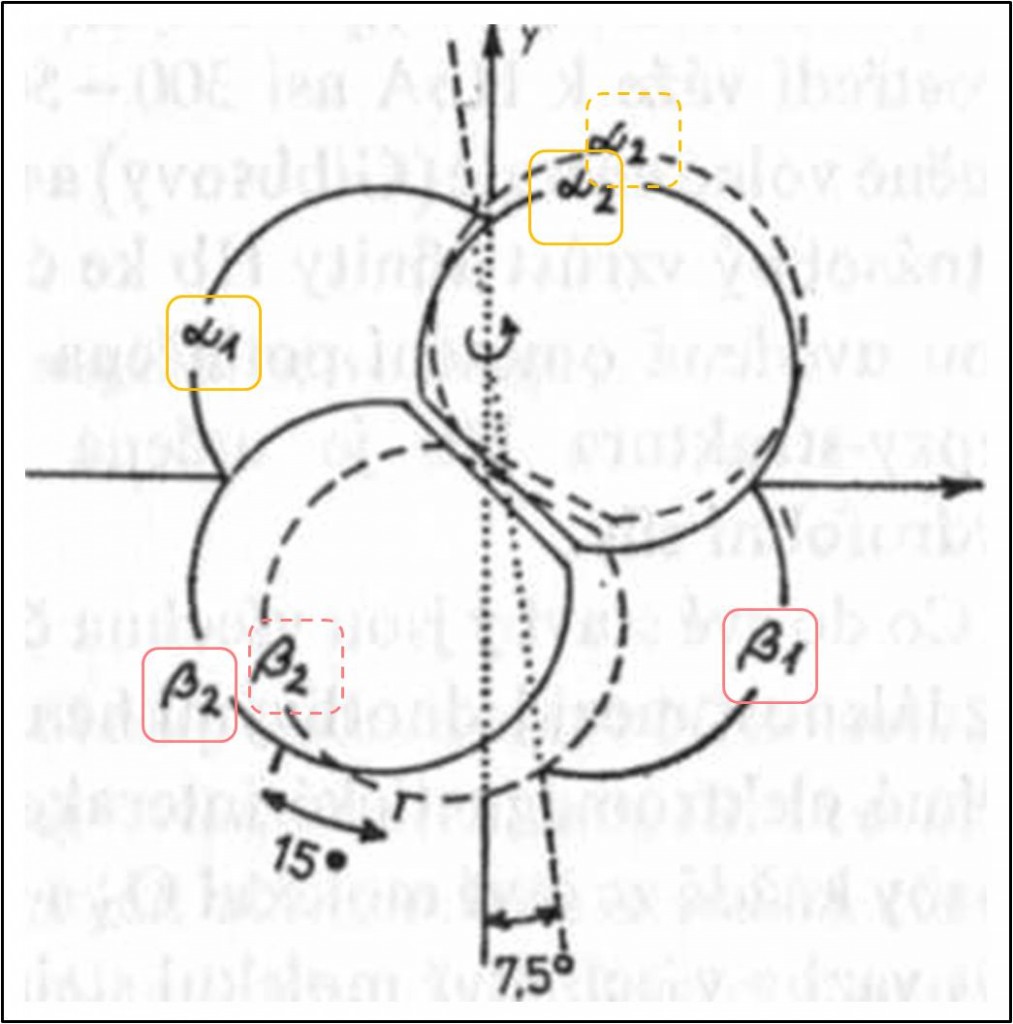
Vazba molekuly O2 na Hb a zpětné uvolněni O2 z oxyhemoglobinu (HbO2) jsou doprovázeny jednak změnami terciární struktury podjednotek Hb a jednak změnami kvartérní struktury celé hemoglobinové molekuly. Změny kvartérní struktury zahrnuji rotaci dimeru α1β1 vzhledem k dimeru α2β2 asi o 15° a zároveň posun obou dimerů k sobě (při vazbě O2) a od sebe (při jeho odpoutání) asi o 0,08 nm (obr. 4). Dvě krajní formy Hb se označují jako deoxy- neboli T-(„tense“ – napjatá, strnulá; obecně forma s nižší afinitou k ligandu) struktura a struktura oxy- neboli R-(„relaxed“ – uvolněná) s vyšší afinitou k ligandu.
Obr. 4. Schematické znázornění vzájemné rotace αβ dimerů při přechodu T-formy Hb v R-formu. Dimer α1β1 se zároveň posunuje o 0,08 nm blíže k dimeru α2β2. Dvojčetná osa symetrie rotuje asi o 7,5°. Rovina, určená oběma pseudoosami symetrie, kolmými k pravé ose, by v tomto znázornění protínala rovinu stránky pod úhlem.
Strukturní změny Hb se odrážejí v jeho afinitě k ligandům. V oxy-(R-) struktuře mají podjednotky přibližně stejnou konformaci a přibližně stejnou afinitu ke kyslíku jako volné podjednotky α a β anebo molekula Mb. V deoxy-(T-)struktuře je konformace podjednotek pozměněna a jejich afinita ke kyslíku je několiksetkrát nižší.
Využití vnitřní vazebné energie v kooperativní přestavbě hemoglobinu
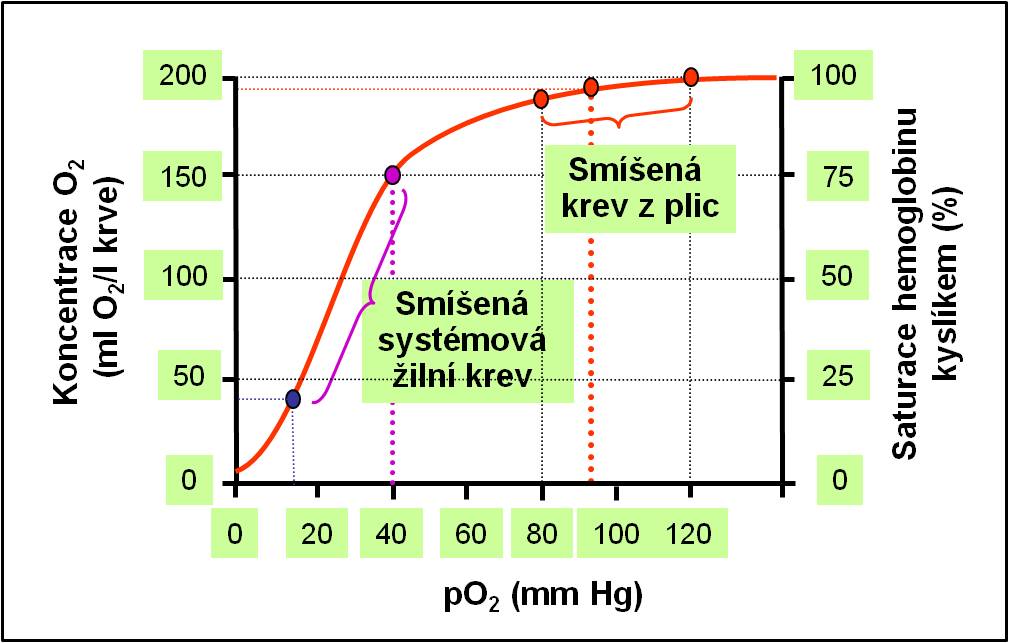
V tetramerním Hb není oproti podjednotkám zvýšena afinita k O2. Naopak, rovnováha mezi O2 a Hb je posunuta, srovnáme-li ji s afinitou Mb ebo volných disociovaných podjednotek Hb k O2, do vyšších hodnot pO2. Význam tetraramerního uspořádáni nespočívá v tom, že usnadňuje vazbu O2, nýbrž v tom, že zabezpečuje prudkou změnu afinity ve vhodném (úzkém) rozpětí pO2. Ukazuje to průběh saturační křivky Hb (obr. 5).
Obr. 5. Saturační křivka hemoglobinu. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.)
Omezení, která jsou odpovědná za nízkou afinitu vazebných míst deoxy-formy Hb ke kyslíku mají podobu iontových interakcí mezi podjednotkami, jež tetramer udržují v deoxy-(T-) konformaci. Čtvrtá molekula O2 se ve fyziologickém prostředí váže k Hb asi 300 – 500krát pevněji než molekula první. Několikasetnásobný vzrůst afinity ukazuje, že v oxy-(R-) formě Hb jsou uvedená omezení potlačena anebo chybí. Zatímco deoxy-struktura Hb je udržována iontovými interakcemi, oxy-strukturu stabilizují hydrofobní sily.
Co do své stavby jsou všechna čtyři vazebná centra O2 v molekule Hb téměř stejná. Vzdálenost mezi jednotlivými herny v Hb (2,5-4,0 nm) je příliš velká pro efektivní přímé elektromagnetické interakce mezi nimi. Proto pokud by se veškerá energie vazby každé ze čtyř molekul O2 s Hb realizovala jako vazebná volná energie, měly by být vazby všech čtyř molekul stejně pevné. To ale neodpovídá skutečnosti.
Část vazebné energie každé molekuly O2 se spotřebovává na překonání faktorů, které v deoxy-struktuře ztěžují vazbu ligandu do vazebného místa. Výsledná „pozorovaná“ vazebná energie je o tuto část menší.
Z termodynamického hlediska je oxy-(R-) struktura Hb méně výhodná. Přechod do ní musí být „zaplacen“ částí vnitřní energie vazby ligandu. Jak ovšem ukazuje esovitý průběh disociační křivky Hb. jednotlivé molekuly O2 nepřispívají k přeměně v oxy-(R-) strukturu stejně. Při interakci první molekuly O2 s Hb se spotřebuje velká část vnitřní vazebné energie na změny terciární struktury první podjednotky a na destabilizaci T-struktury tetrameru cestou přerušení jejích interakcí se sousedními podjednotkami. Tendence ostatních (neobsazených) podjednotek Hb obnovit interakce s první podjednotkou vypuzují molekulu O2 z hemové kapsy a způsobují, že pozorovaná vazba první vázané molekuly O2 je poměrně nepevná.
Při vazbě druhé a dalších molekul O2 na Hb pak je ta část vnitřní vazebné energie, která se potřebovává na překonáni sil stabilizujících deoxy-(T-) strukturu, menší a menší. Každé přerušení interakce mezi podjednotkami zmenšuje práci, kterou je třeba vykonat k převedení dalších podjednotek z T- do R-struktury. Ta část vnitřní vazebné energie, kterou je třeba „zaplatit“ za konformační změny při vazbě druhé až čtvrté molekuly O2, se postupně zmenšuje a ve srovnání s vazbou první molekuly O2 se tudíž více vnitřní vazebné energie realizuje jako vazebná energie pozorovaná, tedy jako pevnější vazba molekul O2 k Hb.
Dynamika přechodu jedné strukturní formy hemoglobinu ve druhou
Přístup ligandu k vazebnému místu
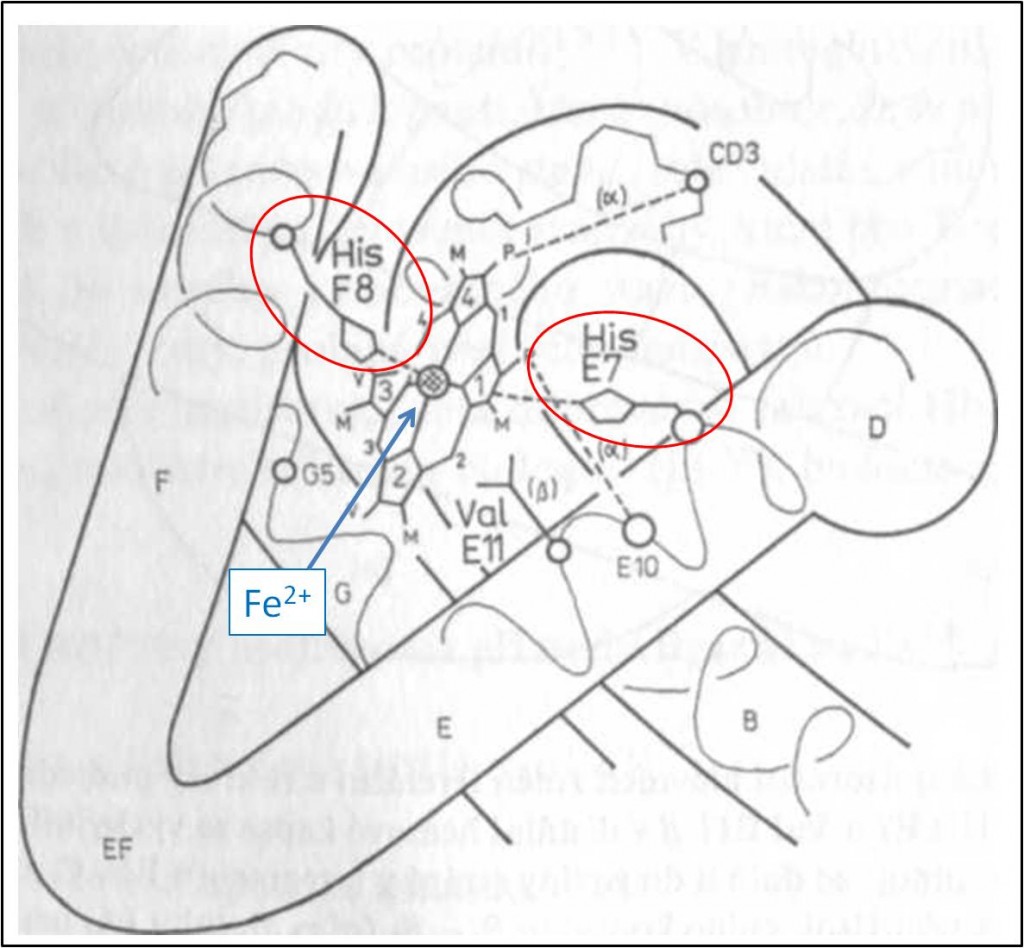
Na krystalografických obrazech T-struktury Hb není vidět žádná volná cesta, po níž by ligand mohl bez překážek vniknout do distální kapsy některé podjednotky, kde má dojít k jeho navázání na hem. Ligand pronikající do distální hemové kapsy se nejprve setkává s povrchovými útvary. Nejdříve pravděpodobně naráží na tzv. distální histidin His E7 (je více vzdálený od hemu než tzv. proximální His F8). U Mb tvoří His E7 jakási povrchová „dvířka“, kterými musí být ligand propuštěn. Na základě tohoto zjištění se usuzuje, že i reaktivita aktivních (vazebných) míst dalších proteinů může být kontrolována frekvencí pohybů postranních řetězců aminokyselin umístěných v klíčových pozicích na přístupových cestách k aktivnímu centru (obr. 6).
Obr. 6. Uložení hemu v podjednotce Hb. Tučné větší číslice 1 – 4 označuji pyrolová jádra hemu, menší číslice označují methinové můstky hemu. M, V a P jsou metylové, vinylové, popř. propionylové skupiny hemu. Jsou znázorněny proximální His F8 v proximální hemové kapse a šroubovice F, distální His E7 v distální hemové kapse a šroubovice E, aminokyselina Val E11β a také iontové vazby hemu s aminokyselinami CD3 a E10 přítomnými v podjednotkách α. Písmena B, D, EF a G označují příslušné segmenty polypeptidového řetězce.
Změny spinu a polohy iontů železa
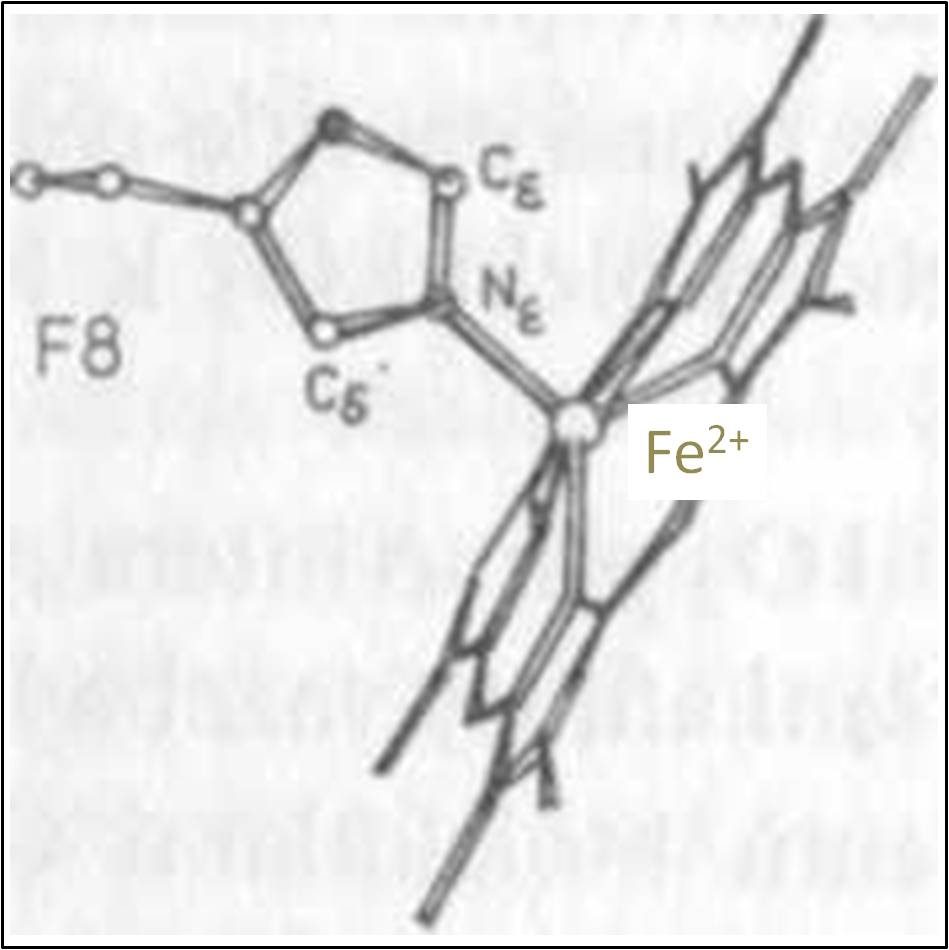
Dvojmocný iont Fe2+ je v každé podjednotce deoxy-Hb vázán čtyřmi dusíky pyrolů porfyrinového kruhu a dusíkem Nε proximálního histidinu His F8 (obr. 6,7). Pole těchto pěti ligandů štěpí d orbitaly Fe2+, na nichž je umístěno 6 valenčních elektronů, na nízko- (dxy, dyz a dzx) a vysoko- (dz2, dx2-y2) energetické. Dva z valenčních elektronů jsou nuceny obsadit i vysokoenergetické orbitaly, a komplex deoxy-hemu je proto vysokospinový, s objemným centrálním paramagnetickým atomem Fe2+. Odpudivé působení mezi elektrony Fe2+ a π-elektrony porfyrinového kruhu brání železnatému iontu zaujmout polohu v rovině hemu, takže komplex má tvar pyramidy mířící svým vrcholem, v němž je iont železa, k proximálnímu His F8 (obr. 6, 7). Vzdálenost Fe2+ od roviny porfyrinu je v α- i β-podjednotkách T-struktury Hb asi 0,06 nm.
Obr. 7. Proximální His F8 a pyramida hemu s iontem Fe2+ v jejím vrcholu.
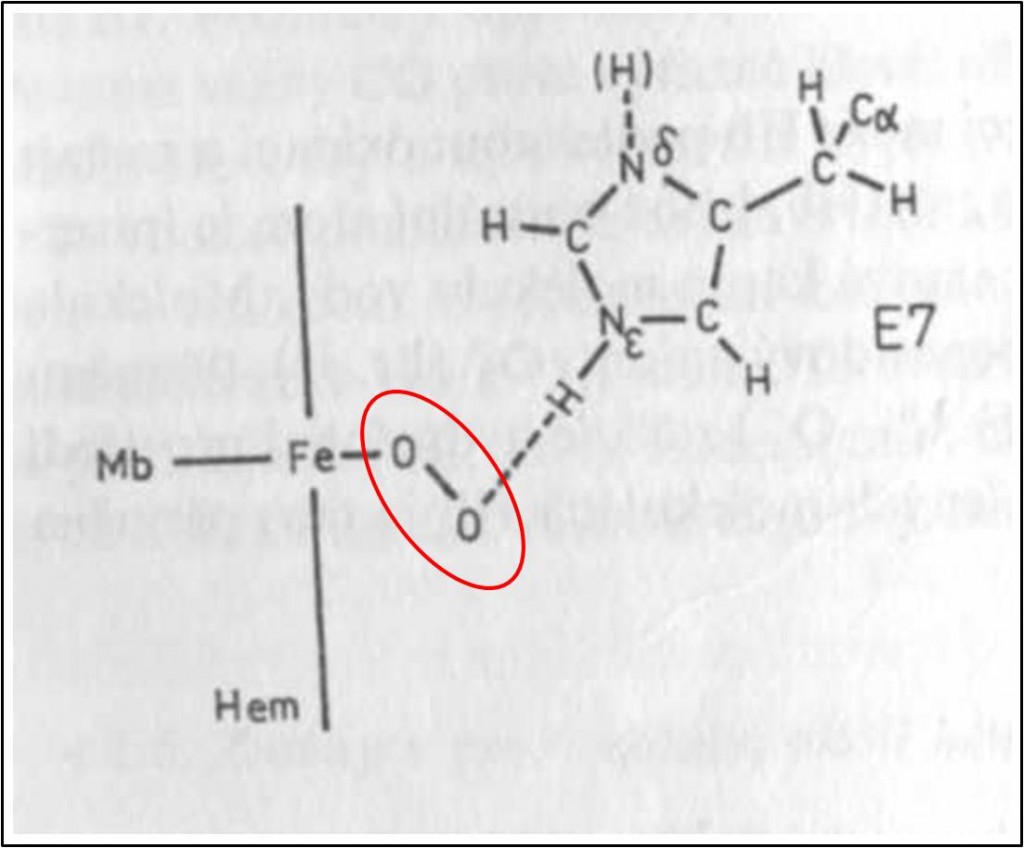
Vazba O2 na Fe2+ je doprovázena velkou negativní změnou volné energie. Ta je dostatečná k tomu, aby se komplex změnil z vysokospinového na nízkospinový. Komplex zároveň ztrácí paramagnetismus a stává se diamagnetickým. Nízkospinový Fe2+ má asi o 0,1 původní hodnoty menší poloměr než vysokospinový. Snížený objem dovoluje iontu železa, aby se po vazbě O2 poněkud posunul směrem k rovině porfyrinového kruhu, blíže k (šestému) ligandu (obr. 8, 9).
Obr. 8. Detail vazby molekuly O2 na hemové železo hemoglobinu.
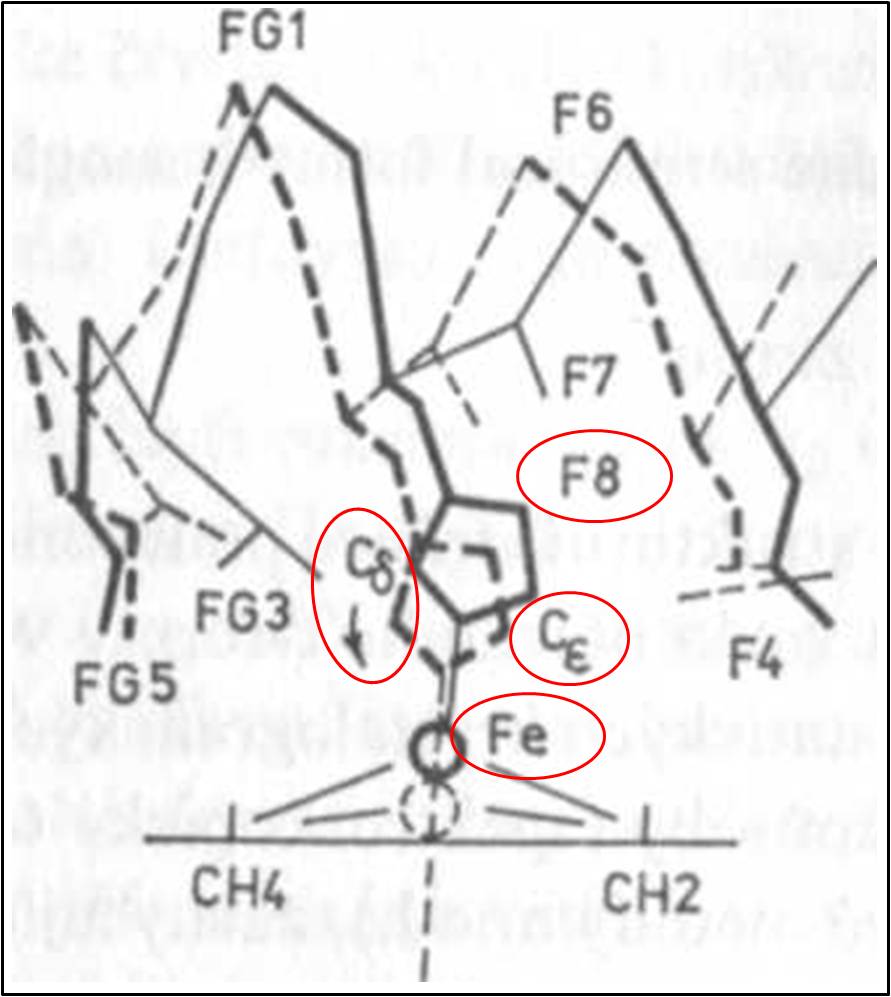
Obr. 9. Schéma postavení His F8 a přilehlých částí segmentu F vzhledem k hemu. Změny při přechodu deoxy-(T-) struktury (plná čára) v oxy- (R-) strukturu (přerušovaná čára). CH2, CH4 – methinové můstky č. 2 a 4. Průmět roviny imidazolového kruhu His F8 svírá s osou spojující dusíky pyrolových jader č. 1 a 3 úhel asi 20°; osa jdoucí methinovými můstky č. 1 a 3 je přibližně kolmá k rovině stránky. Rovina imidazolového kruhu His F8 je téměř kolmá k rovině hemu. V T-struktuře Hb není imidazol postaven symetricky na vrcholu svého dusíku Nε .Vzdálenost Fe2+ od roviny porfyrinu, která se při oxygenaci zmenšuje, je ve schématu přehnaně velká. Imidazolový kruh His F8 se s přechodem do R-struktury pootáčí kolem osy procházející kolmo rovinou kruhu a staví se do poněkud symetričtější polohy vzhledem k hemu. Tento pohyb je pevně spřažen s pohybem šroubovice F, segmentů EF a FG a pohybem celého hemu.
Tomu, aby Fe2+ zaujal místo přímo v rovině porfyrinu, zčásti brání přetrvávající interakce železa s porfyrinem, ale hlavně vystupňované van der Waalsovy sily, které odpuzují axiální imidazolové jádro His P8 od pyrolu č. 1 porfyrinového kruhu (obr. 6, 7).
Změna polohy iontu železa je velmi rychlá – proběhne v intervalu kratším než 5 ps. Difúze ligandu (O2) k hemu z okolí Hb trvá mnohem déle, řádově snad 102 ns.
Změny hemu a jeho nejbližšího okolí
Následkem přestavby pyramidové struktury deoxy-fromy hemu do plošší oxy-struktury dochází k narušeni komplementárnosti mezi hemem a jeho okolím. V hemové kapse polypeptidu vzniká pnutí.
Klíčovým místem, v němž se pnutí soustřeďuje, je proximální histidin His F8, jehož imidazolové jádro je kovalentní vazbou spojeno s hemovým železem (obr. 6 – 9). Imidazolové jádro F8 je vzhledem k rovině hemu postaveno asymetricky. Je nakloněno tak, že jeho Cε je rovině hemu (pyrolovému jádru č. 1 a methinovému můstku č. 2) blíže než jeho Cδ (pyrolovému jádru č. 3 a methinovému můstku č. 4) (obr. 6,7 a 9). Tah, kterému je po navázání ligandu toto jádro podrobeno ze strany Fe2+, vede k silnému odpuzování jeho uhlíku Cε od hemového pyrolového jádra č. 1. Imidazolové jádro je tak nuceno zaujmout symetričtější pozici. Atom Cδ imidazolu F8 se přiblíží rovině hemu relativně více než Cε (obr. 9).
To však není možné bez současných přesunů částí polypeptidového řetězce, které se zbytkem F8 bezprostředně sousedí. Pnutí soustředěné na His F8 se tak přenáší do okolních částí polypeptidového řetězce, především na šroubovici F a jejím prostřednictvím pak dále, hlavně do úseků EF a FG (obr. 7,8). Posunem segmentu F se původně nepatrná změna objemu iontu Fe2+ znásobuje natolik, že způsobí přestavbu nejen terciární (obr. 10), ale i kvartérní struktury (Obr. 3) celé molekuly Hb. Segment F tak působí jako výkonný amplifikátor.
Tažená aminokyselina His F8 zároveň vyvíjí zpětný tlak proti hemu. Hem uhýbá dovnitř hemové kapsy, posunuje se ve směru osy, která míří od dusíku pyrolu č. 1 k dusíku pyrolu č. 3 (Obr. 9, 10). Pyrolové jádro č. 3 hemu (se svým vinylovým řetězcem) přitom odtlačuje zbytek Val FG5, s nímž interaguje, a vychyluje ho asi o 0,1 nm z jeho polohy. Šroubovice F vcelku sleduje pohyb hemu ve směru osy dusíků pyrolu 1 a 3 a poněkud tento pohyb přehání. Hemy, šroubovice F a segmenty FG se v každém z dimerů α1β1 a α2β2 pohybují při přechodu deoxy-(T-) struktury v oxy-(R-) strukturu proti sobě – vzdálenost FGα1-FGβ1 se v R-struktuře Hb zkrátila asi o 0,25 nm. Šroubovice F navíc zužuje prostor mezi sebou a šroubovicí H vlastní podjednotky.
Obr. 10. Schematické znázornění hlavních změn terciární struktury podjednotek Hb při přechodu T- v R-strukturu. His E7 a Val E11 v distální hemové kapse se vychylují ze své polohy. Hem se poněkud otáčí a posunuje se více do středu molekuly Hb (dolů a do roviny stránky) k segmentům EF, G a H. Posuny v rohu EF mají za následek narušení izologního kontaktu β1β2 (obr. 2) a rohu FG – nesymetrického kontaktu α1β2 (obr. 2). Posunem šroubovice F se zmenšuje prostor mezi šroubovicí F a H. Vypuzení Tyr HC2 z tohoto prostoru má u α-podjednotky za následek narušení izologní interakce s druhou α-podjednotkou (obr. 2), u β-podjednotek zpřístupnění -SH skupiny aminokyseliny F9, přerušení nesymetrické interakce HC3 β a C5 α-podjednotky a přerušení vnitřní interakce HC3 s FG1 (obr. 1). Všechny tyto změny mají svůj původ v napětí, které je vyvoláno tahem hemového železa za proximální His F8 při vazbě O2 (obecně šestého ligandu).
Pohyby segmentů v okolí hemu
Dominujícími terciárně-strukturními změnami podjednotek Hb při jejich přechodu z deoxy-(T-) do oxy-(R-) formy tedy jsou posuny šroubovic F, segmentů EF a rohů FG. Tyto pohyby jsou spjaty s vazbou ligandů (O2) tak těsně, že bez nich nemůže k navázání O2 dojít. Energetické požadavky na tyto přestavby jdou na úkor vnitřní vazebné energie ligandů.
V tetramerní T-struktuře Hb brání shora uvedeným posunům kromě už popsaných interakcí také kontakty mezi podjednotkami. Segment EF se podílí na výstavbě kontaktu β1β2 (Obr. 3). V segmentech FG se soustřeďují interakce nesymetrických kontaktů α1β2 (obr. 1). Změny v EF a FG úsecích mají za následek oslabení těchto kontaktů.
Změny uložení C-koncových úseků podjednotek
Posuny v rohu FG nevedou jen ke změnám nesymetrických α1β2 kontaktů. Jejich uskutečnění má ještě další následky.
Karbonylová skupina peptidové vazby aminokyseliny FG5 hlavního řetězce vytváří v T-struktuře každé α- i β-podjednotky životně důležitý vodíkový můstek s aminokyselinou Tyr HC2 své vlastní podjednotky (obr. 10). Oslabení tohoto můstku, způsobené vytlačením aminokyseliny FG5 z její polohy oxygenujícím se hemem, a zúžení prostoru mezi F a H šroubovicí vede k uvolnění aromatického jádra aminokyseliny Tyr HC2, která byla do té doby fixována mezi F a H šroubovicí, a k odklonění koncových HC a H úseků řetězců. To má za následek nejen doslova rozmetání zbývající části asymetrických kontaktů mezi podjednotkami α1 a β2 (především vazeb Lys C5 α1-His HC3 β2) (obr. 1) ale i zbývajících interakcí izologního kontaktu β1β2 a také izologního kontaktu α1α2 (obr. 2, 3) a úplnou ztrátu stability deoxy-(T-) tetrameru.
C-Koncové úseky α-podjednotek
C-Konec řetězců α-podjednotek je uložen tak, že po vytlačení Tyr HC2 α z kapsy mezi F a H nemůže zachovat svou původní konformaci a aminokyselina Arg HC3 α1 musí přerušit interakci s podjednotkou α2 (obr. 2, 10). Toto narušení izologního kontaktu α1α2 vede k podstatnému oslabení stability deoxy-tetrameru. Průvodním jevem přerušení izologního kontaktu α1α2 je uvolnění protonů – tzv. Bohrův efekt.
C-Koncové úseky β-podjednotek
Také u β-podjednotek dochází vypuzením Tyr HC2 β k přerušeni vazeb C-terminálních částí β-řetězců k okolí a k destabilizaoi T-struktury. Mechanismus destabilizace je však poněkud odlišný od mechanismu popsaného u α-pod jednotek.
C-Koncový His HC3 (146) β svými interakcemi (obr. 1, 10) zpevňuje jak vnitřní terciární strukturu deoxy-(T-) formy β-podjednotky, tak i – jako součást asymetrického kontaktu α1β2 – kvartérní strukturu deoxy-Hb. Změna polohy C-β-konce, vyvolaná vypuzením Tyr HC2 (145) β, způsobí přerušení jednak vnitřní iontové vazby (His HC3 β…Asp PG1 (94) β) a jednak přerušení vazby His HC3 β2 s Lys C5 (40) α1 (obr. 1). Tím se oslabí stabilita jak deoxy-struktury samotné podjednotky, tak i stabilita celého T-tetrameru.
Oddálení negativního náboje Asp PG1 β od His HC3 β způsobí pokles pK imidazolové skupiny His HC3 β provázený odštěpením protonu. Tímto mechanismem se vysvětluje největší část Bohrova efektu.
Další komponenta mechanismu ztráty stability C-konoe T-struktury β-podjednotky, rovněž způsobená vyklánějícím se Tyr HC2 β, spočívá ve změně polohy aminokyseliny His H21 (143) β. Posunem aminokyseliny His H21 se ruší izologní vazba mezi β-podjednotkami (obr. 3).
Změny Hb při uvolnění O2 z HbO2
Uvolnění ligandu (O2) z vazby na Fe2+ vyvolá změny terciární a kvartérní struktury hemoglobinového tetrameru orientované opačně, než je tomu při vazbě ligandu. Oxy-(R-) struktura se při uvolnění ligandu mění v deoxy-(T-) strukturu. Obecně platí, že postup změn není přísně reciproční. Celý cyklus přestavby proteinu zpět do výchozí formy zpravidla probíhá po hysteretické křivce.
Změny kvartérní struktury hemoglobinu
Změny kvartérní struktury jsou vyústěním změn terciární struktury. Při vazbě ligandu dochází k rozrušení vazeb mezi podjednotkami v deoxy-(T-) tetrameru a vytvářejí se některé nové vazby (obr. 3). Celý tetramer přechází do oxy-(R-) formy. Úplný přechod jedné kvartérní struktury ve druhou může trvat kolem 10 μs a více.
Přerušení izologních iontových kontaktů mezi α-podjednotkami
Přerušení α1α2 kontaktu je bezprostředně vyvoláno vypuzením úseku HC2 α šroubovicí Fα z kapsy mezi F- a H-šroubovicemi (obr. 2,8). Je provázeno Bohrovým efektem.
Přerušení izologních iontových kontaktů mezi β-podjednotkami
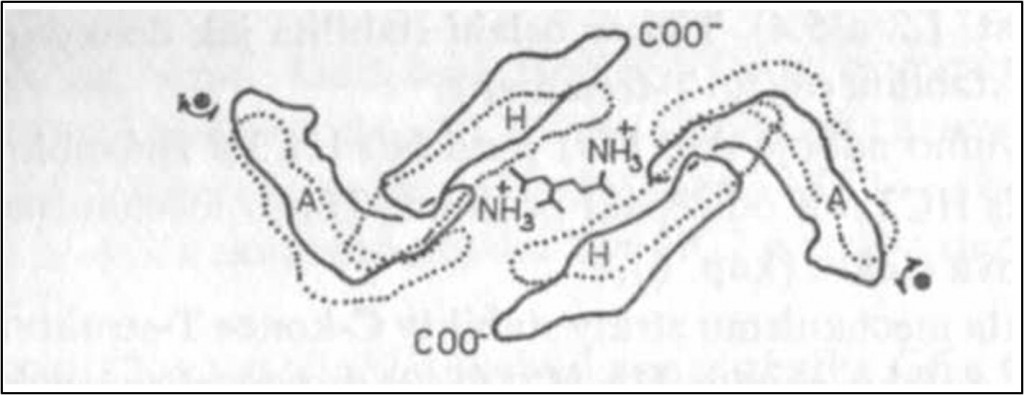
Následkem přestavby podjednotek a vypuzení Tyr HC2 β se k sobě přibližují segmenty EF a H obou β-podjednotek (obr. 3,9). Vzdálenost mezi N-konci obou β-podjednotek naopak vzrůstá (obr. 11).
Obr. 11. Schematické znázornění uložení N- a C-terminálních segmentů (šroubovice A a NH3-konec a šroubovice H a COOH-konec) β-podjednotek a štěrbiny s BPG mezi nimi. Pohled na molekulu Hb směřuje shora podél pravé dvojčetné osy symetrie (srovnej obr. 1 a 3). Schéma ukazuje fosforečné skupiny molekuly BPG orientované k N-koncům podjednotek. Oba N-konce se při přechodu z deoxy-(T-) struktury (souvislá linie) v oxy-(R-) strukturu (tečkované linie) od sebe vzdalují a štěrbina se zužuje (dimery α1β1 a α2β2 se posunují k sobě; srovnej obr. 4). Šipky ukazují směr rotace při vazbě O2.
Tím se ruší komplementárnost štěrbiny mezi podjednotkami β k organickému fosfátu a fosfát je z ní vypuzen.
Přestavba nesymetrických kontaktů mezi C- a FG-segmenty (a přilehlými částmi) podjednotek α1 a β2
V α1β2 kontaktu jsou pozoruhodné zejména následující změny:
- Posun Val FG5 (93) α oproti Trp C3 (37) β. Trp C3 se vysunuje ze „žlábku“ postranního řetězce Val (obr. 1).
- Posun Thr C6 (41) α oproti Val PG5 (98) β. Má za následek přerušení vazby mezi uvedenými aminokyselinami (obr. 1).
- Posun Thr C3 (38) α oproti témuž Val PG5 β. Thr C3 nahrazuje ve „žlábku“ aminokyseliny PG5 β aminokyselinu Thr C6 α (obr. 1).
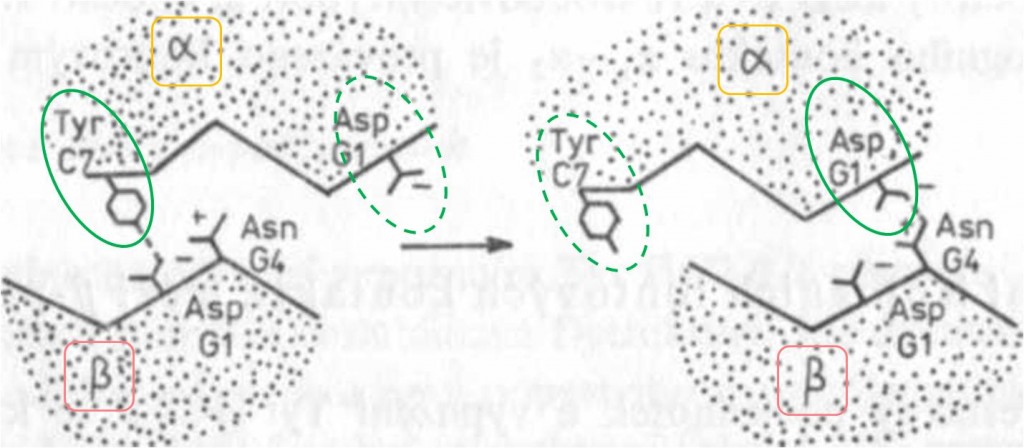
- Posun Tyr C7 (42) α oproti Asp G1 (99) β. Má za následek přerušení vodíkového můstku mezi oběma aminokyselinami (obr. 1, 12).
- Posun Asp G1 (94) α oproti Asn G4 (102) β. Mezi těmito aminokyselinami se vytváří nová vodíková vazba (obr. 1, 12).
- Přerušení vazby Lys C5 (40) α – His HC3 (146) β … FG1 β (obr. 1). Výše už byla zmínka o podílu této změny na ztrátě stability T-struktury a na Bohrově efektu.
- Interakce rohu FG α-podjednotky se šroubovicí C podjednotky β (FG α1 – Cβ2) (obr. 1) jsou velmi přizpůsobivé. Dovolují, aby se dimery α1β1 a α2β2 navzájem plynule pohybovaly jeden vůči druhému.
- Naproti tomu interakce rohu FG β se šroubovicí C podjednotky α (FG β2 – C α1; jde část α1β2 kontaktu) (obr. 1) dovolují pouze dvě stabilní polohy, bez plynulých mezistupňů (obr. 10). Posun částí řetězců v této oblasti pravděpodobně probíhá podle pravidla s „vše nebo nic“.
Obr. 12. Schematické znázorněni přestavby v části α1β2 kontaktu. Vlevo je deoxy-(T-) struktura, vpravo oxy-(R-) struktura. Mezi oběma krajními formami chybí stabilní mezipolohy. Bližší údaje v textu.
Změny v oblasti α1β1 kontaktů jsou relativně malé.
Přenos a transformace energie polypeptidovým řetězcem
Bohrův efekt
Bohrův efekt je příkladem změny reaktivnosti skupin polypeptidového řetězce v místě vzdáleném od místa vazby ligandu na protein. Označení Bohrův efekt obvykle vyjadřuje poznatek, že mezi vazbou O2 na Hb a koncentrací H+ iontů v prostředí je vzájemná souvislost. Všechny Bohrovy protony, vázané v molekule Hb, stabilizují deoxy-(T-) strukturu Hb.
Oxygenace jednoho hemu v Hb je provázena uvolněním průměrně 0,5 – 0,7 protonu. Bohrovy protony se uvolňují z několika skupin Hb. O dvou z nich, α-aminoskupině aminokyseliny Val NA1 (1) α, a imidazolové skupině aminokyseliny His HC3 (146) β, už byly zmínky výše (obr. 1,2). Jejich uplatnění v Bohrově efektu vyplývá ze skutečnosti, že se v T-struktuře Hb nacházejí v blízkosti negativně nabitých skupin, které stabilizují přítomnost (zvyšují pravděpodobnost výskytu) H+ iontů na jejich bazických centrech, a tak způsobují vzrůst jejich pK. Při přechodu Hb v oxy-(R-) strukturu, kdy dochází k přerušení iontových interakcí a oddálení aniontových skupin, nastává pokles pK zmíněné α-amino- a imidazolové skupiny a jejich H+ ionty disociují do prostředí. Zpětně, při uvolnění O2 z HbO2, se obnovuji iontové vazby a Bohrovy protony se znovu vážou k uvedeným místům. Změna koncentrace H+ iontů v okolí hemoglobinové molekuly zase zpětně působí na vazbu O2 (obr. 13).
Třetí skupinou, která přispívá k Bohrovu efektu, je His H5 (122) α. Zbývající část asi 0,2 Bohrova efektu pravděpodobně souvisí s vazbou anorganických aniontů na Hb.
Z molekulového mechanismu Bohrova efektu vyplývá, že pro jeho vznik je naprosto nezbytná hetero-oligomerní stavba tetrameru.
Haldaneův efekt
Haldaneův efekt je ilustrován na obrázku 13 a na obrázku 14.
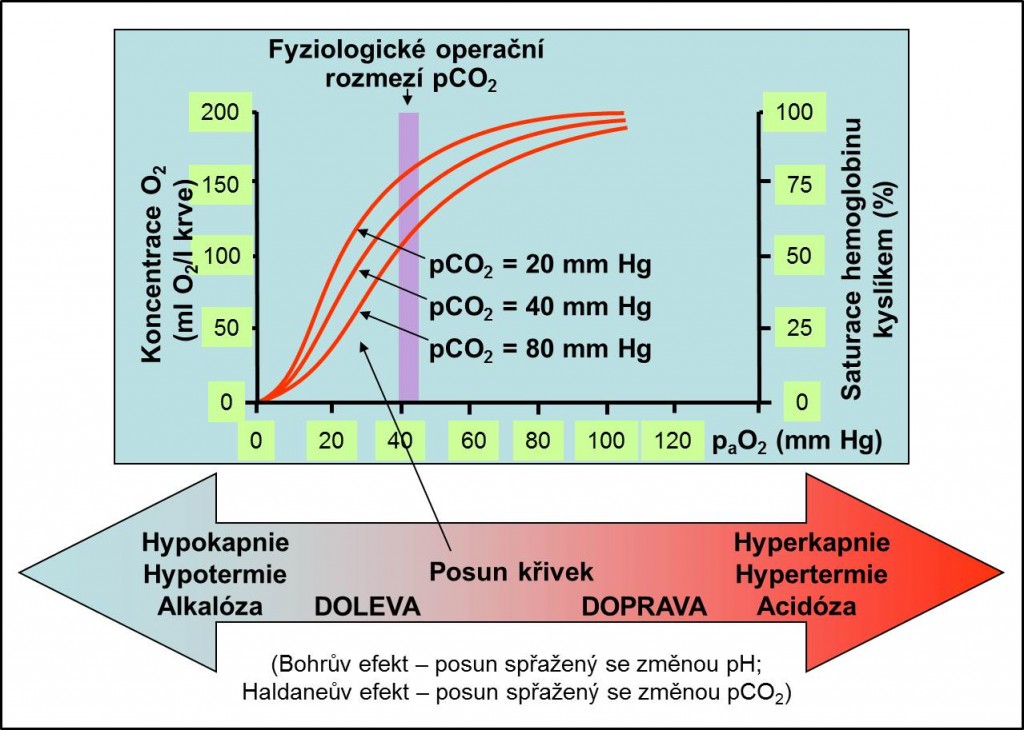
Obr. 13. Bohrův efekt (pH – acidóza, alkalóza), Haldaneův efekt (CO2 – hyperkapnie, hypokapnie) a vliv teploty na disociační křivku HbO2.
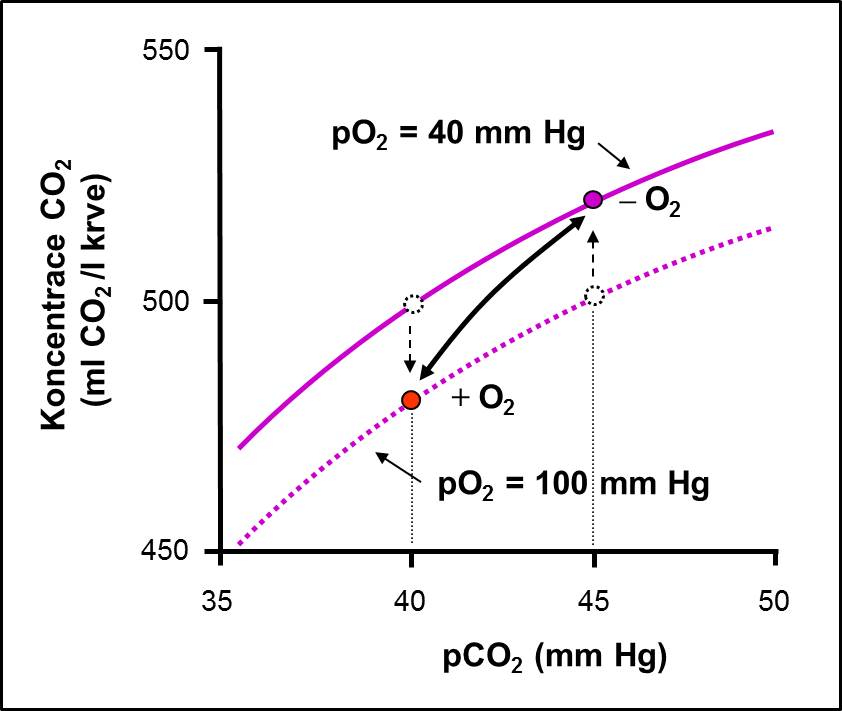
Obr. 14. Vazba O2 posunuje křivku CO2 doprava (Haldaneův efekt), tj. ve stejném směru, jako CO2 posunuje křivku O2. Každý z plynů tedy usnadňuje uvolňování toho druhého z Hb.
Přenos a transformace energie polypeptidovým řetězcem
Při Bohrově efektu dochází na několika různých a od sebe vzdálených vazebných (reakčních) centrech velké molekuly Hb ke vzájemně spřaženým sterickým a elektronovým posunům doprovázeným chemickými procesy. Při Bohrově efektu ovlivňuje vazba O2 disociaci H+, tj. oxygenace řídí acidobazický děj, a naopak. Oba typy změn jsou na sobě závislé. Při Haldaneově efekut ovlivňuje vazba O2 disociaci CO2, a naopak. Zvláštnost je v tom, že v obou typech procesů zprostředkovává spřažení polypeptidový řetězec. Energie vazby O2 a energie vazby H+ iontů anebo CO2 se vzájemně přeměňují jedna v druhou. Nejde o pouhý přenos, ale zároveň i o transformaci chemické energie (obr. 15).
Obr. 15. Alosterické jevy v hemoglobinu ilustrované modelem s pohyblivým pístem.
Zvláštní zmínku v této souvislosti zasluhuje rovněž změna reaktivnosti aminokyseliny Cys P9 (93) v Fβ šroubovici (podjednotka α má v poloze F9 Val). Chemická reaktivnost aminokyseliny Fβ vzrůstá při přechodu T-struktury v R-strukturu. Vysvětlení vyplývá ze změn C-terminálního konce β-globinu – vypuzení aminokyseliny Tyr HC2 (145) β z kapsy mezi F a H šroubovicí a následný odklon C-koncové částipolypeptidového řetězce β-podjednotky otevírá přístup reagencií k thiolové skupině Cys F9 β (obr. 10). V tomto případě hovoříme spíše o přenosu a ne o transformaci energie (informace) polypeptidovým řetězcem.
Objasnění molekulového podkladu Bohrova a Haldaneova efektu – spřažení (blo)chemických procesů prostřednictvím polypeptidového řetězce – se stalo podkladem pro vysvětlení činnosti některých komplexních makromolekulových systémů v bioenergetioe. Model, který odtud vycházel, je znám pod označením „nepřímý chemiosmotický model“ přenosu energie.
Zpracoval: Jaroslav Veselý, Ústav patologické fyziologie LF UP v Olomouci, a Katedra fyziologie a patofyziologie LF OU v Ostravě.