Úvod
Proteiny mají vynikající schopnosti zprostředkovat, tedy katalyzovat, (bio)chemické reakce. I když výkonnost uměle připravených chemických katalyzátorů je pozoruhodná, ve srovnání s aktivitou přirozených proteinových katalyzátorů, enzymů neboli fermentů, se často jeví nicotná.
Všechny enzymy jsou proteiny, ale katalytické vlastnosti mají i jiné molekuly (a případně ionty) obsažené v živých tělech.
Působení enzymů se od působení chemických katalyzátorů liší dvěma základními rysy.
- Za prvé, enzymové reakce jsou mimořádně rychlé. Odhaduje se, že probíhají rychlostí 108-1020krát větší než odpovídájicí reakce nekatalyzované.
- Přesněji ocenit zrychlení, k němuž dochází působením enzymu, je většinou nemožné, protože nekatalyzované reakce mohou být tak pomalé, že nejsou měřitelné.
- Enzymová reakce kromě toho probíhá jiným mechanismem.
- Umělé katalyzátory urychlují reakce asi až do 1010krát a zpravidla probíhají v extrémních podmínkách (pH, teplota, tlak atp.).
- Za druhé, enzymy jsou vysoce speoifické. Specifičností se rozumí jejich schopnost rozpoznat substráty (reaktanty) katalyzované reakce a odlišit je od jiných složek přítomných v prostředí.
Specifičnost katalyzátorů k reaktantům se často popisuje oděleně od účinků odpovídajících za urychlení reakcí. Obě vlastnosti enzymů se mylně od sebe oddělují. Z dalšího popisu bude zřejmé, že specifičnost je s katalytickým mechanismem úzce spjatá a je od něho neoddělitelná. Dokonce je ve vztahu ke katalytickému (urychlujícímu) účinku určující. Specifičnost katalyzátoru je funkcí jak pevnosti vazby substrátu ke katalyzátoru, tak i efektivnosti katalýzy (tj. urychlení reakce). Rozdílný stupeň specifičnosti chemických a biologických katalyzátorů postačuje k vysvětlení vysoké aktivity enzymů.
(Bio)chemické reakce
Aktivační energie
(Bio)chemická reakce je přeskupením funkčních skupin mezi jednotlivými sloučeninami (reaktanty) anebo uvnitř sloučenin. Přeskupení je provázeno štěpením a tvorbou pevných, tzv. primárních (tj. kovalentních) chemických vazeb.
V obecně zapsané reakci
DF + A → D + FA
jsou dvě výchozí látky, z nichž jedna, DF, vystupuje jako donor skupiny F, a druhá, A, jako její akceptor. Kovalentní vazba D-F se v reakci ruší a formuje se nová vazba F-A. Výsledkem je vznik dvou nových produktů, tj. D a F-A. Funkční skupinou může být atom, skupina atomů, fragment molekuly, iont, nebo také elektron.
Směr reakoe, popř. její rovnováha, jsou určeny změnou, popř. extrémem, příslušného termodynamického potenciálu (obr. 1). Nejčastěji se k popisu biochemických reakcí používá Gibbsovy volné energie, G:
(ΔG)T,p,n = ∑G(prod) – ∑(vých) = ∑Gi = Δξ . ∑ μi . νi => (ΔG)T,p,n/Δξ = ∑ μ°i . νi + RT ∑ νi . ln ci = – RT ln K + RT ∑ νi . ln ci = ΔG°/ξ + RT ∑ νi . ln ci.
V této rovnici jsou R, T a p konvenční označení, n je látkové množství látky i v soustavě, μi je chemický potenciál látky i, ξ je stupeň pokročilosti reakce, ci je látková koncentrace látky i, K je rovnovážná konstanta reakce, μ° je standardní chemický potenciál, ΔG° je standardní změna volné energie a νi jsou stechiometrické koeficienty – podle konvence mají koeficienty νi výchozích látek (vých) záporné hodnoty a produktů (prod) kladné.
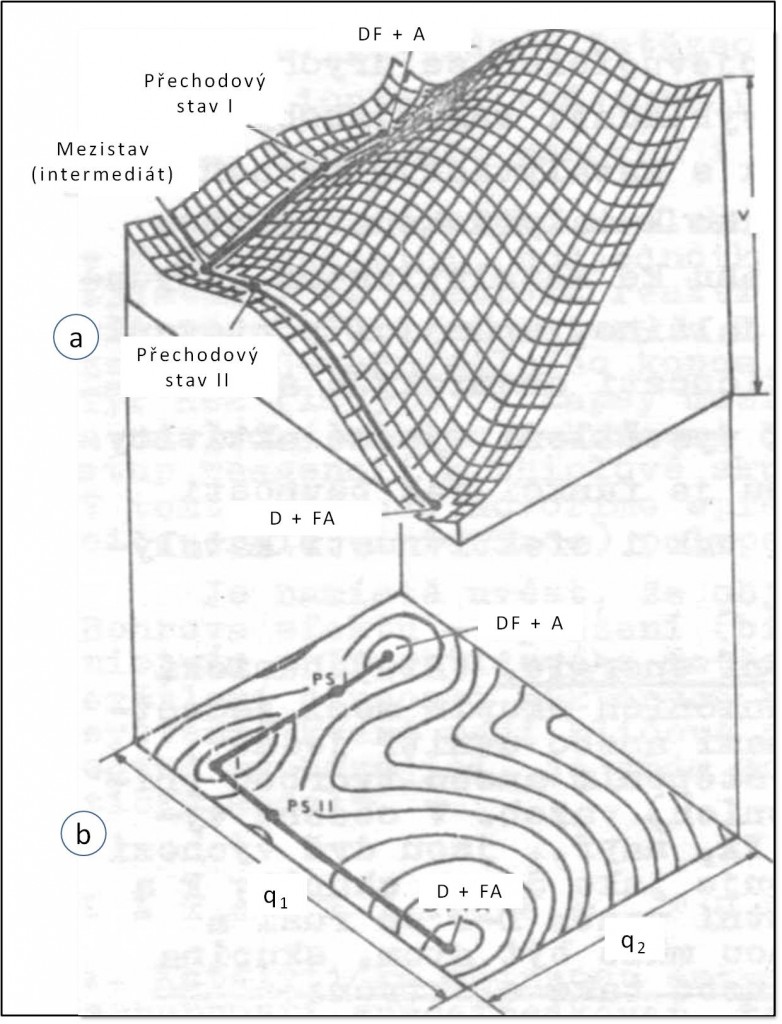
Obr. 1. Znázornění plochy potenciální energie chemické reakce. Energie je vynesena jako funkce poloh atomů v systému se dvěma stupni volnosti q1 a q2 – jde např. o reakci DF + A → D + FA za předpokladu, že reaktanty jsou uloženy lineárně a mění se pouze vzdálenosti D-F (koordináta q1) a F-A (koordináta q2). Pro více stupňů volnosti by bylo zapotřebí vícerozměrného znázornění. a. Řez reakční plochou. Energie je dána výškou nad rovinou definovanu q1q2. Silná čára, spojující výchozí látky a produkty, představuje reakční cestu, která vede po dně energetického „údolí“ v ploše. Přechodové stavy se nacházejí na vrcholech sedel ve zvlněné reakční ploše. Konfigurace atomů v těchto bodech jsou aktivovanými komplexy, b. Vrstevnicové mapa reakční plochy. Křivky spojují body o stejné energii. Silná čára je průmětem reakční cesty. Vynesením potenciální energie podle vzdálenosti, měřené podél reakční cesty od výchozích látek k produktům, se získá diagram typu grafu na obr. 2.
Funkční skupiny jsou v každé sloučenině poutány silami kovalentních chemických vazeb. Přestože přechodem skupin z výchozích látek (donorů) do produktů (k akceptorům) se chemické potenciály skupin snižují, v normálních podmínkách většinou nedochází k pozorovatelnému samovolnému toku skupin od donorů k akceptorům, protože výchozí a konečné stavy od sebe odděluje aktivační bariéra popsaná teorií absolutních reakčních rychlostí. Skupiny obvykle postrádají potřebnou energii k dosažení přechodového stavu a k překonání aktivační bariéry (přechodových stavů může být více). Aktivační bariéru určuje energie, kterou musí reagující částice mít, aby dosáhly přechodového stavu. Je zpravidla mnohem větší, než je tepelná energie částic kBT (kB je Boltzmannova konstanta) (obr. 1, 2).
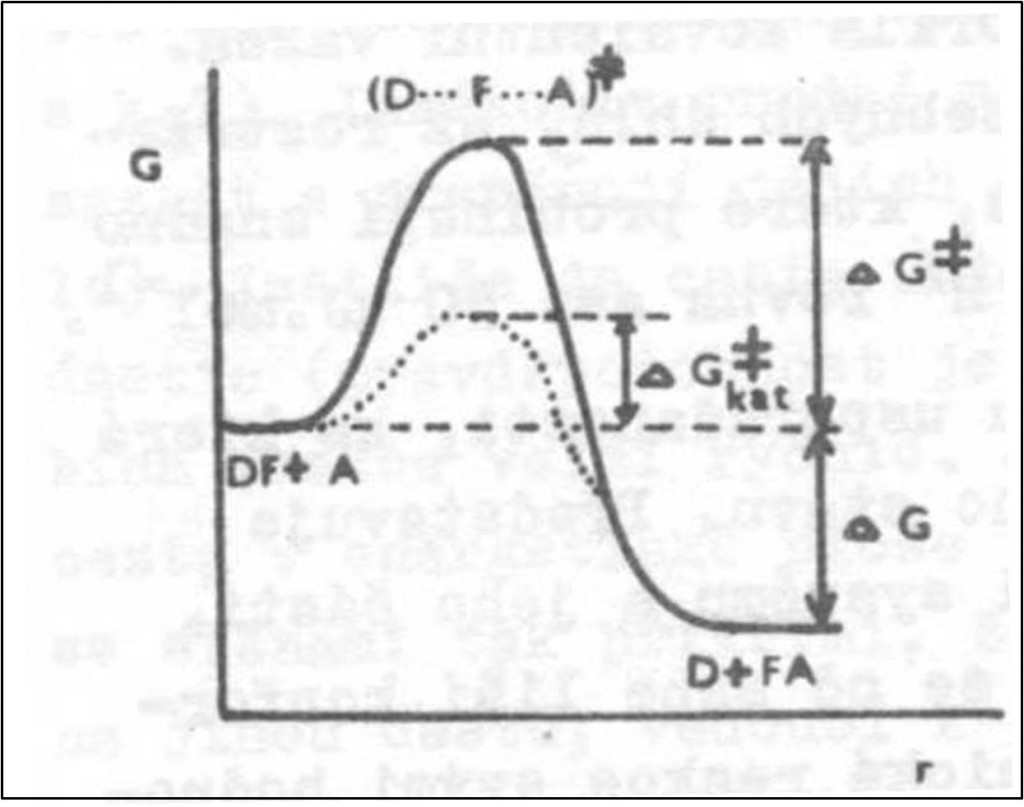
Obr. 2. Profil potenciální energie podél reakční cesty (tzv. diagram reakční koordináty). Tvorba případného intermediátu, odpovídajícího obr. 1, by byla znázorněna zářezem na vrcholu aktivační bariéry (rozdělení přechodového stavu na dva). Tečkovaně je naznačen průběh katalyzované reakce. Je patrné, že aktivační energie katalyzované reakce je mnohem nižší, a její překonání je tedy daleko pravděpodobnější – projeví se to rychlejším hromaděním produktů. DF, A – výchozí látky, D, FA – produkty, ΔG – změna Gibbsovy volné energie reakce, ΔG# – aktivační volná energie nekatalyzované reakce, ΔG#kat – aktivační volná energie katalyzované reakce, r – reakční koordináta. ΔG určuje rovnovážnou koncentraci reaktantů (výchozích látek a produktů), ΔG# rozhoduje o rychlosti reakce.
Podstata působení katalyzátoru
Katalyzátor umožní, aby chemická reakce probíhala mechanismem, který má nižší aktivační energii než mechanismus nekatalyzovaný. Katalyzátor neurčuje směr reakce, ani nemění její rovnováhu, protože ve stejné míře snižuje aktivační energii pro přímou i zpětnou reakci, takže reakci urychluje v obou směrech stejně.
Rychlostní konstanty přímé (k→) a zpětné (←k) reakce se zvětšují proporcionálně jedna druhé a jejioh podíl k→/←k zůstává roven rovnovážné konstantě K.
Přechodový stav i elementární stupně jsou však u katalyzované reakce jiné než u reakce nekatalyzované - pro dosaženi přeohodového stavu je v katalyzované reakci zapotřebí menší Gibbsovy volné aktivační energie ΔG# (Obr. 2).
Aktivační enthalpie a aktivační entropie
Podle teorie absolutních reakčních rychlostí souvisí rychlostní konstanta k chemické reakce s Gibbsovou volnou aktivační energií vztahem:
k = (kBT/h) . e-(ΔG#/RT) = (kBT/h) . e-(ΔH#/RT – TΔS#)/RT
(kB je Boltzmannova konstanta, h je Planckova konstanta, ΔG#, ΔH# a ΔS# jsou po řadě aktivační volná energie, aktivační enthalpie a aktivační entropie reakce).
Enthalpijní složka aktivační energie představuje práci, která se vykoná při oddálení anebo sblížení atomů potřebném k tomu, aby se přerušila, nebo vytvořila kovalentní vazba. Zahrnuje deformaci délek vazeb a vazebných úhlů až roztrženi, nebo vznik vazeb nutných k dosažení přechodového stavu. Pro reakce, které snadno probíhají při pokojové teplotě, je hodnota ΔH# rovna asi 50 kJ.mol-1.
Enthalpijní složku vyjadřuje převýšení (strmost) reakční cesty vedoucí k přechodovému stavu v sedle na vrcholu aktivační bariéry.
Entropijní složka odráží změnu uspořádanosti, ke které dochází při přechodu do přechodového stavu. Představuje omezení, nebo naopak vzrůst volnosti systému a jeho části. Molekuly různého stupně složitosti se od sebe liší konformační pohyblivostí, a proto se chemické reakce svými hodnotami ΔS# od sebe navzájem výrazně liší. Molekuly účastnící se metabolických přeměn jsou často poměrně velké a pohyblivé. Proto jsou nekatalyzované specifické reakce mezi nimi anebo uvnitř jejich struktury málo pravděpodobné, tj. ΔS# je obvykle záporné.
Aktivační entropii vyjadřuje šířka reakční cesty v sedle na vrcholu aktivační bariéry (Obr. 1). Sedlo je široké, jestliže je entropie přechodového stavu velká, a proto má relativně velký počet molekul konformace, které jsou příhodné pro překonání aktivační bariéry. Sedlo je úzké, jestliže molekuly při překonávání bariéry musí zaujmout zvláštní konfiguraci – u takových reakcí je změna aktivační entropie zpravidla negativní.
Enzymy jako zařízení vymezující reakční cesty
Ze závislosti kinetické konstanty na aktivační energii ΔG# vyplývá, že rychlost reakce je určena koncentrací částic, které mají dostatečnou energii (enthalpii) k tomu, aby v energetické ploše mohly projít cestu vyznačenou dovolenými stupni volnosti (obr. 1 a 2). Částic, jejichž energie k překonání aktivační bariéry musí dosáhnout velkých hodnost ve srovnání s kBT, je – jak vyplývá z Boltzmannova zákona – časově i místně relativně málo. Enzym ale zajistí, že cesta podél reakční koordináty, kterou musí reagující funkční skupiny projit od jednoho reaktantu k druhému, povede pouze nevysoko nad úrovni kBT a bude pozvolná, zbavena všech příkrých výstupů a nerovností (ve srovnání s kBT). Jakékoliv prudké stupně a překážky v reakční cestě obracejí částice (tření, frikční pohyby) nazpět a přeměňují jejich energii v neuspořádané kmity sem a tam (teplo). Jestliže je cesta uhlazená a koncentraci přecházejících částic (tj. pravděpodobnost jejich přechodu) nic nesnižuje, probíhá reakce velmi rychle. Jestliže, kromě toho, vede reakční cesta v energetické ploše po dně hlubokého údolí („kaňonu“) se stěnami tak příkrými, že brání vstupu jiných částic, a úniku reagujících částic na jinou cestu, která by mohla vést k jiným produktům, jsou vyloučeny vedlejší reakce a reakce probíhá specificky.
Změna reakční cesty a výběr jiného přechodového stavu s nižší aktivační energii, k níž dochází v katalyzované reakci, je výsledkem vazby reagujících látek na katalyzátor. Při katalýze enzymem se vytváří komplex enzym-substrát.
V metabolismu jsou jednotlivé cesty každé chemické skupiny vymezeny zvláštnostmi center biokatalyzátorů. Pouze katalytická místa enzymů, kudy vedou v energetické ploše průsmyky a stezky v úrovni srovnatelné s kBT, poskytuji funkčním skupinám možnost přejít v relativně krátké době od jednoho reaktantu ke druhému (obr. 3). Anglický biochemik, nositel Nobelovy ceny (1978) P. D. Mitchell proto přirovnával enzymy k zařízením, která pozvedávají „západky“ primárních chemických vazeb a „propouštějí“ chemické funkční skupiny na cestu, na níž mohou (v produktech) dosáhnout snížení svého chemického potenciálu.
Neideálnost vymezení, tedy skutečnost, že pohyb skupin není determinován s pravděpodobností 1,0 („kaňony“ nejsou dostatečně hluboké a jejich stěny dostatečně příkré), má za následek únik skupin a reaktantů na vedlejší cesty, kde mohou reagovat nespecificky a dát vznik alternativním produktům.
Obr. 3. Reakční cesty látek DF a A v energetickém pohoří. Ne příliš rigorózním stylem je znázorněna nekatalytická (horní) a katalytická (nejnižší) cesta vedoucí k týmž produktům D + FA. Střední cesta naproti tomu vede k produktům D + F + A.
Dílčí mechanismy katalytického působení enzymů
Některé mechanismy katalytického působeni enzymů jsou v elementárních formách zřetelné už u chemických katalyzátorů.
Katalytické skupiny v aktivních centrech enzymů
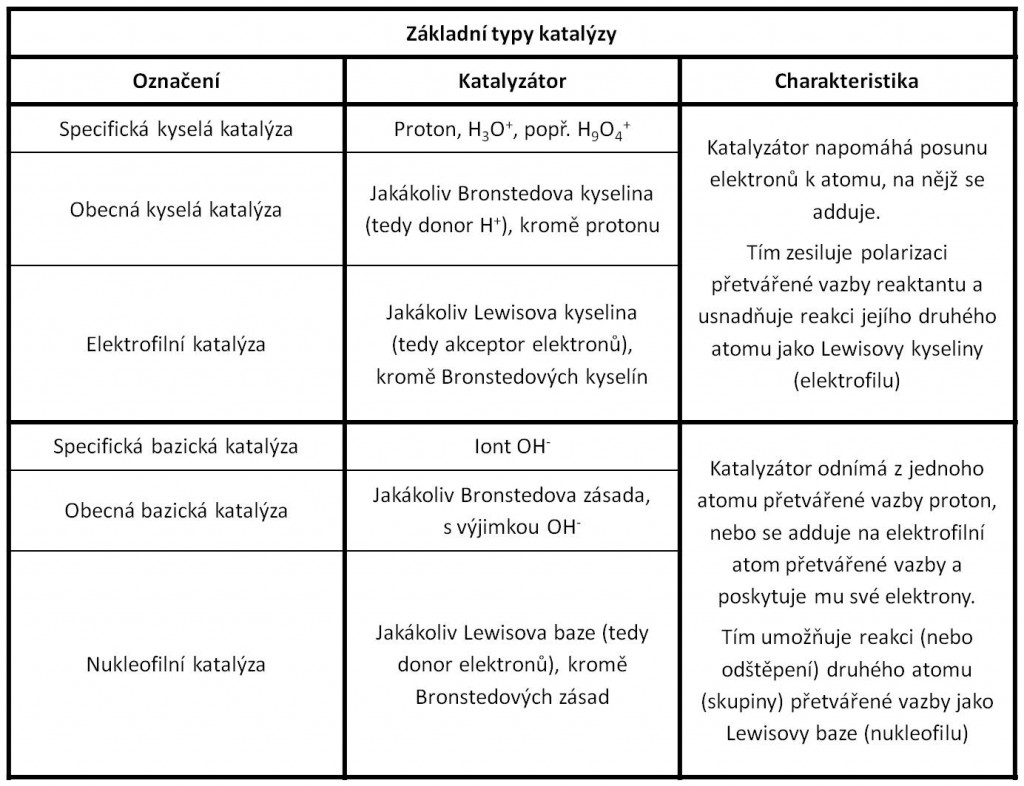
Chemické funkční skupiny v aktivních centrech enzymů mají samy o sobě vlastnosti běžných chemických katalyzátorů. Maji schopnost vstupovat do těsných kontaktů – až kovalentníoh vazeb – s částmi substrátu, v jejichž bezprostřední blízkosti dojde k vlastní chemické reakci. Tím mohou napomáhat přesunům valenčních elektronů podél kritickýoh vazeb, které povedou k přeměně substrátů v produkty. Funkční skupiny při své katalytické činnosti uplatňuji rozmanité typy chemické katalýzy (Tab. 1 a 2). V aktivních centrech enzymů však uvedené skupiny působí nesrovnatelně efektivněji než v chemických katalyzátorech. Důvody budou patrné z dalšího textu.
Tabulka 1. Základní typy katalýzy.
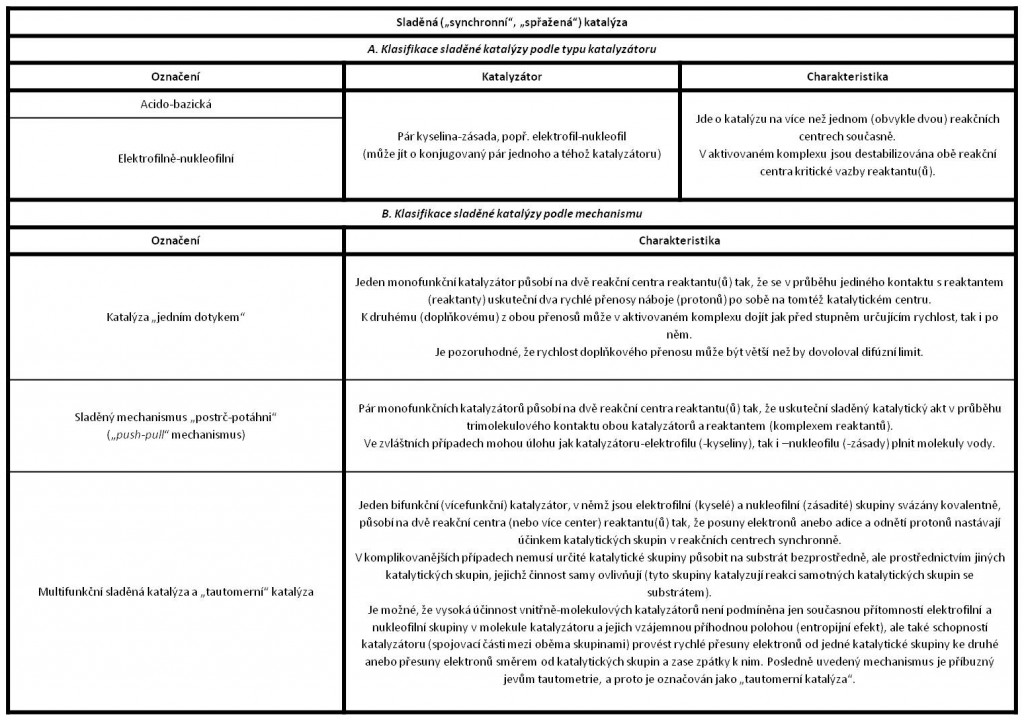
Tabulka 2. Sladěná katalýza.
Sladěná vnitřně-molekulová katalýza
Na rozdíl od chemickýoh katalyzátorů, které jsou často monofunkční, se v aktivnioh oentrech enzymů obvykle vyskytuje větší počet (soubor) katalytických skupin, které koordinovaně působí na kritická místa struktury substrátu(ů), v nichž má dojit k přeměnám(multifunkění sladěná katalýza; srovnej Tab. 2). Příkladem je katalýza hydrolytického štěpeni substrátů proteinázami (Obr. 4 a 5). K tomuto koordinovanému působení většího počtu katalytických skupin navíc dochází v komplexu enzym-substrát, a jde tudíž zároveň o vnitřně-molekulovou sladěnou katalýzu. Podíl většího počtu skupin a účast sladěné vnitřní molekulové katalýzy v katalytickém působení má velký podíl na tzv. sbližovacím (entropijním) efektu v katalytickém enzymovém procesu (viz níže). Skupiny už jsou přítomny v potřebné konstelaci, a jejich postavení se nemusí vytvářet náhodnými entropijními procesy.
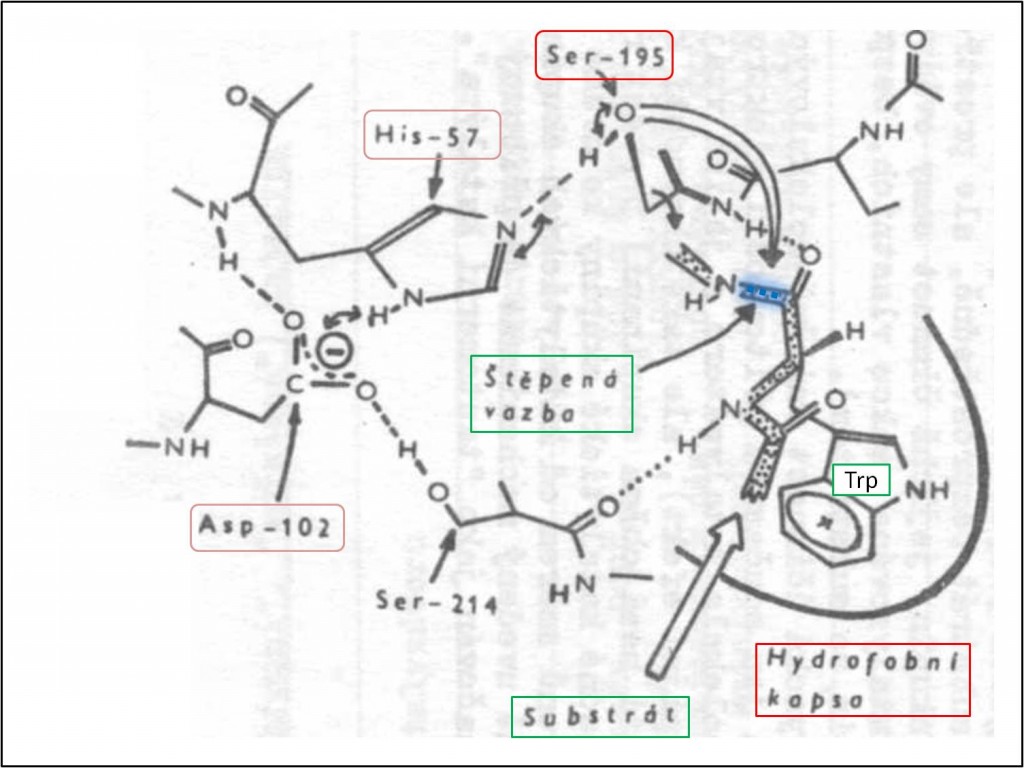
Obr. 4. Aktivní centrum chymotrypsinu s částí substrátu. Enzym přednostně štěpí peptidové vazby, jejichž C=O skupina pochází z aminokyseliny s hydrofobním postranním řetězcem. Postranní hydrofobní řetězec – v obrázku Trp – substrátu se ukládá do hydrofobní kapsy aktivního místa. (Naproti tomu enzym trypsin má v místě označeném křížkem záporně nabitý karboxyl Asp, a proto přednostně štěpí ty vazby, na nichž se podílejí C=O skupiny aminokyselin s postranními řetězci obahujícími kladný náboj.) Klíčovou katalytickou skupinou je hydroxyl Ser-195, který jako nukleofilní katalyzátor napadá uhlík štěpené peptidové vazby a kovalentně se s ním váže za vzniku intermediátu acyl-enzym. Intermediát se v další fázi hydrolyzuje (neukázáno). Předpokládá se, že této katalýze napomáhá systém nábojové štafety, na němž se podílí His-57 a Asp-102. His-57 vystupuje jako protonový akceptor, který zvyšuje nukleofilnost atomu kyslíku Ser-195 (jako obecný bazický katalyzátor reakce -OH skupiny). Asp-102 tvoří s imidazolem His-57 vodíkový můstek. Celý systém zajišťuje synchronní přemístění protonu od Ser-195 k imidazolu a od imidazolu k Asp-102 – a zpět. Nábojovou štafetu je možno chápat jako příklad tautomerní katalýzy (srovnej tab. 2).
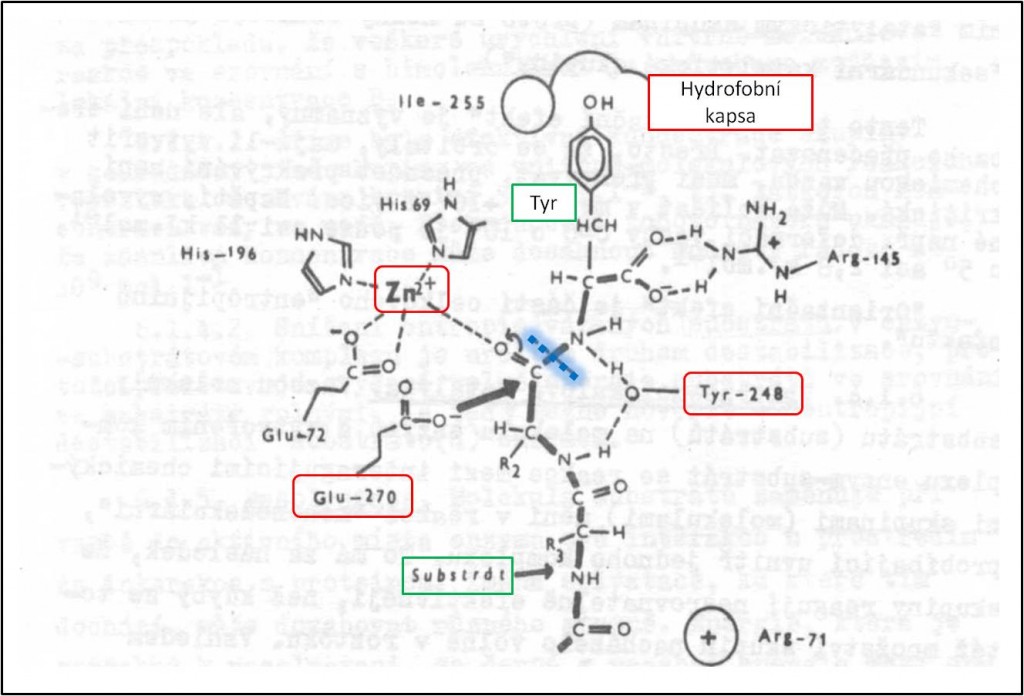
Obr. 5. Aktivní centrum karboxypeptidázy A s částí substrátu. Enzym přednostně odštěpuje hydrofobní C-koncové aminokyseliny (v obrázku Tyr), které se ukládají do hydrofobní kapsy jeho aktivního místa. Štěpení peptidové vazby je znázorněno příčnou přerušovanou čarou (karboxypeptidáza B má v místě Ile-255 aminokyselinu Asp, a proto přednostně váže substráty s bazickou C-koncovou skupinou). Zn2+ v aktivním místě se zapojuje jako elektrofilní katalyzátor stabilizující polarizaci skupiny C=O štěpené peptidové vazby. Uhlíkový atom této vazby je vystaven nukleofilní atace (tlustá šipka). Tu může zprostředkovat molekula vody, a pak tedy dojde k hydrolýze bez tvorby meziproduktu (karboxyl Glu-270 by interagoval s H2O a měl by úlohu obecného bazického katalyzátoru). Nebo může uhlíkový atom C=O vazby nejprve reagovat s karboxylovou skupinou Glu-270, takže dojde k vytvoření kovalentního intermediátu, tj. acylenzymu – anhydridu …Glu-COO—CO-CHR…, který teprve následně bude štěpen molekulou vody. Koncový Tyr-248 pravděpodobně vystupuje jako obecný kyselý katalyzátor. Poskytuje proton aminoskupině substrátu, která se po rozštěpení peptidové vazby vzdaluje. V průběhu katalytického aktu se přemístí asi o 1,0 nm.
Spoluúčast vazebných skupin v blízkosti katalytických skupin
Účinek katalytických skupin v aktivních místech enzymů může být znásoben zapojením dalších skupin, které přispívají tím, že vážou určité části substrátu vzdálené od přetvářené vazby. Napomáhají tak správné orientaci kritické kovalentní vazby vzhledem k vlastním katalytickým skupinám, a proto se někdy označuji jako sekundární katalytické skupiny. Tento tzv. „orientační efekt“ je významný, protože využívá energii vazby substrátu ke snížení entropie. Orientační efekt je součástí celkového entropijního efektu katalyzátoru.
Vnitřně-molekulová katalýza
Vazbou molekuly substrátu (substrátů) na molekulu enzymu a vytvořením komplexu enzym-substrát se reakce mezi interagujícími chemickými entitami a jejich skupinami mění v reakci „monomolekulární“, probíhající uvnitř jednoho komplexu. To má za následek, že skupiny reagují nesrovnatelně efektivněji, než kdyby se totéž množství skupin nacházelo volně v roztoku. Omezení pohybů katalytických skupin nastává při syntéze enzymu a následně se dolaďuje při vazbě substrátu – v tomto případě jde o tzv. indukované přizpůsobení (viz níže). Tvorbou enzym-substrátového komplexu (v průběhu tzv. „zakotvení substrátu“) se omezují i pohyby substrátu. Tímto způsobem dochází už ve vazebné, tzn. „předchemické“ fázi reakce k omezení četných nežádoucích pohybů reagujících skupin.
Vytvoření komplexu zajišťuje, že ještě před vlastním chemickým dějem, a nikoliv až při reakci, jak tomu je např. v bimolekulárni reakci bez účasti katalyzátoru, nastává snížení entropie reaktantů. Snížení entropie je umožněno využitím vazebné energie mezi enzymem a substrátem (substráty) pro immobilizacl substrátu. Tento tzv. sbližovaci efekt („entropijní předstih“ – opět jde součást celkového „entropijního efektu“) se projeví zdánlivou extrémně vysokou koncentrací, tj. vysokou tzv. efektivní koncentrací, skupin v kritickém místě reakční soustavy.
Přesnější určeni „efektivní koncentrace“ je následující. Jestliže je rychlost monomolekulární reakce popsána rovnicí vmono = kmono . [A͡B] a rychlost bimolekulární reakce rovnicí Vbi = kbi . [A] . [B], pak poměr kmono/kbi má formálně rozměr koncentrace a představuje teoretickou koncentraci reagentů, při níž by bimolekulární reakce probíhala pseudo-monomolekulárně s konstantou kbi rovnou kmono. „Efektivní koncentrace“ reaktantů (skupiny) B tak představuje průměrnou koncentraci B v okoli A v molekule (v komplexu) AB číselně danou poměrem kmono/kbi za předpokladu, že veškeré urychlení vnitřně-molekulové reakce ve srovnání s bimolekulární je způsobeno zvýšením lokální koncentrace B.
Dříve byla efektivní koncentrace skupiny v sousedství jiné skupiny ve vnitřně-molekulových reakcích v roztoku omezována hranicí 55 mol.l-1, tj. látkovou koncentrací vody ve vodě. Přehodnocení tohoto názoru ukazuje, že zdánlivá koncentrace může dosáhnout hodnoty řádově až 109 mol.l-1.
Sníženi entropie substrátů vázaných v enzym-substrátovém komplexu je určitým druhem destabilizace, protože představuje zvýšení volné energie substrátů ve srovnání se substráty nevázanými. Je tedy možno hovořit o „entropijní destabilizaoi“ substrátu(ů) enzymem.
Desolvatace
Molekula substrátu při vazbě do aktivního místa enzymu zaměňuje své interakce s prostředím za interakce s proteinem. Změna solvatace, ke které tím dochází, může dosahovat různého stupně. Energie, která je potřebná k desolvataci, se čerpá z energie umožňující navázání substrátu k enzymu.
Dehydratace polární nebo iontové skupiny, patřící enzymu anebo substrátu, a její přemístění do špatně hydratujícího hydrofobního prostředí aktivního místa, má za následek destabilizaci nábojů, a tím významnou změnu reaktivnosti (stability) celé struktury. Zrychlení reakce, dosažené tímto způsobem, může dosahovat násobků řádu 108.
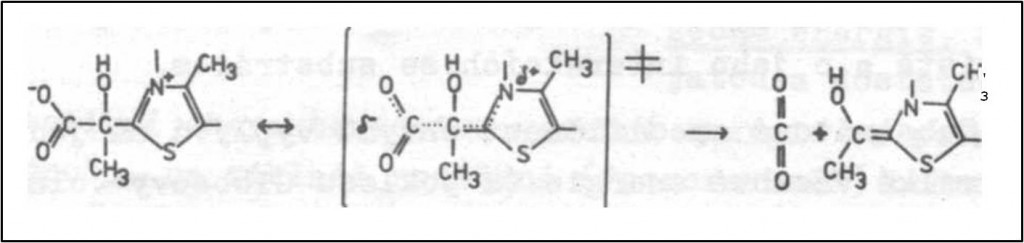
Příkladem může být dekarboxylace α-ketokyselin. Dochází k ní po vytvoření adduktů α-ketokyselin s koenzymem thiamindifosfátem v hydrofobních aktivních místech dekarboxyláz (obr. 6). Ke zrychlení reakce pravděpodobně rozhodujícím způsobem přispívá delokalizace náboje, která je vynucen hydrofobním prostředím a vede ke snazší tvorbě přechodového stavu (obr. 6).
Obr. 6. Příklad urychlení reakce delokalizací náboje vynucenou přechodem do hydrofobního prostředí. Delokalizace náboje usnadňuje dekarboxylaci adduktu pyorhroznanu s thiamindifosfátem. Struktura thiamindifosfátu je v obrázku zastoupena pouze fragmentem. Dvojitý křížek označuje přechodový stav.
Jiným příkladem uplatnění desolvatačního efektu je tzv. elektrostatická destabilizace. Vytěsnění molekul vody, solvatujících skupiny v aktivním místě enzymu, navazujícím se substrátem může snížením dielektrické konstanty prostředí zesílit dalekodosažné (≈1/r2) elektrostatické působení skupin (obr. 7).
Obr. 7. Příklad elektrostatické destabilizace. Elektricky nabitá skupina v hydrofobním prostředí.
Tak např. v karboxypeptidáze A vzrůstá odstraněním vody schopnost atomu Zn2+ polarizovat –C=O skupinu substrátu (obr. 5). Jindy nemusí být nabitá anebo polární skupina maskována vodou, ale může být ukryta v hloubi aktivního centra a vynořit se až při vazbě substrátu.
Komplexní mechanismy katalytického působení enzymů – efekt Kirké
Dosud vyjmenované mechanismy nepostihují vztah mezi specifičností a účinkem enzymů v celé šíři. Ucelený výklad enzymové katalýzy dovolilo teprve zobecnění poznatků o tom, jakou úlohu v katalytickém ději plní vazebná energie mezi enzymem a substrátem.
Katalytická a vazebná oblast aktivního místa
Substrátová specifičnost enzymů je na jedné straně dána velkou vazebnou energií (poklesem Gibbsovy volné energie) interakce aktivního místa se specifickým substrátem a na druhé straně nevýhodnou anebo až nepříznivou změnou energie vazby nespecifických substrátů. Velká vazebná energie je důsledkem velkého počtu interakcí substrátu s komplementárními skupinami v aktivním centru (model „zámku a klíče“). Substrát se váže do široké oblasti proteinu, v níž zůstává zachováno velmi těsné uspořádání masy proteinu. Pojem „aktivní centrum“ enzymu tak označuje rozsáhlou vazebnou, a ne pouze bezprostřední katalytickou oblast.
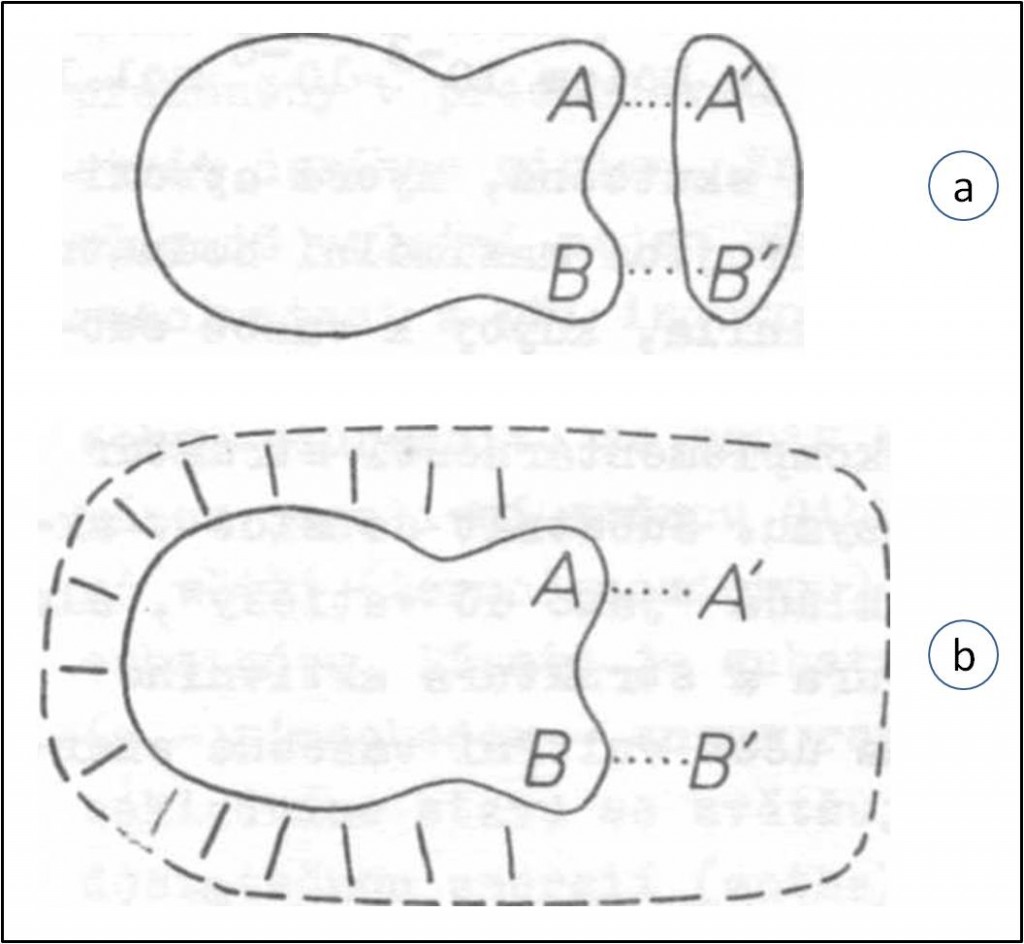
Zatímco chemické katalyzátory využívají pro tvorbu komplexu katalyzátor-reaktant pouze anebo především energii interakcí mezi katalytickými skupinami katalyzátoru a bezprostředně reagujícími funkčními skupinami reaktantů, enzymy jsou navíc schopny využít pro katalytický děj velkou část energie interakce katalyzátoru s těmi funkčními skupinami substrátu, které jsou od místa chemické přeměny vzdáleny. Právě ve využití vzdálených interakcí spočívá hlavní rozdíl mezi chemickými a biologickými katalyzátory (obr. 8). Částečně se tím osvětluje výhoda enzymů coby velkých proteinových molekul.
Obr. 8. Ilustrace rozdílu mezi neenzymovou a enzymovou katalýzou. a. Chemický katalyzátor využívá energii interakce mezi reagujícími (A,B) a katalytickými (A’, B’) skupinami. b. Enzymy navíc využívají i energii interakce s nereagujícími skupinami. Velká část vnitřní energie interakce se pak nemusí vyjádřit jako vazebná, ale použije se k destabilizaci substrátů, tj. ke katalýze.
Vnitřní vazebná energie
Ke kvantitativnímu ocenění vazebné energie slouží její výpočet na základě bezprostředně naměřené („pozorované“) hodnoty disociační konstanty komplexu enzym-substrát. Vznik komplexu enzym-substrát je provázen negativní změnou Gibbsovy energie. „Pozorovaná“ vazebná energie ale je jen částí mnohem větší, teoretické celkové neboli tzv. vnitřní vazebné energie mezi enzymem a substrátem. „Pozorovaná“ vazebná energie pak je takový díl z celkové vazebné energie, který se nespotřeboval pro destabilizaci substrátů, a mohl se proto projevit jako bezprostředně pozorovaná vazebná energie.
Velká část vnitřní vazebné energie je vazebnou energií jen potenciálně – ve výsledku odvozovaném z disociační konstanty se jako vazebná neprojeví. Spotřebovává se na překonání entropijních vlivů, na resolvataoi a na dodatečné úpravy struktury substrátu a aktivního centra do podoby, která zaručí co nejefektivnější katalytický účinek v enzym-substrátovém komplexu. Tuto část vnitřní vazebné energie už pozorovatelná rovnovážná disociační konstanta nepostihuje.
Teoretickou celkovou vnitřní vazebnou energii skupin lze zjistit aproximativně. Lze to provést měřením pevnosti vazby modifikovaných substrátů. Odhaduje se, že kdyby se vazebné schopnosti skupin realizovaly beze zbytku, dosahovaly by běžně konstanty disociace enzym substrátových komplexů velkosti kolem 10-20 mol.l-1. Ve skutečnosti však zřídka dosahují 10-12-10-15 mol.l-1. Typická velikost disociačních konstant komplexů enzym-substrát je kolem 10-3 – 10-6 mol.l-1.
Vnitřní vazebná energie tudíž není skutečná, nýbrž aproximovaná teoretická veličina. Vyjadřující maximální hodnotu vazebné energie, která by se uvolnila, kdyby k vazbě substrátu na enzym došlo ideálně, bez nutnosti překonávat vlivy entropie, solvataoe a nekomplementárnosti struktur substrátu a aktivního místa enzymu. Substrát se sice v aktivním centru enzymu nakonec ukládá „jako do vatičky“, ale teprve poté, oo se jeho struktura a struktura aktivního místa přizpůsobí jedna druhé na účet vnitřní vazebné energie.
Komplementárnost aktivního místa přechodovému stavu substrátu v reakci.
Kdyby aktivní místo enzymu bylo komplementární substrátu v jeho základním energetickém stavu, pak by se – vzhledem k počtu jeho možných interakcí – substrát vázal na enzym velmi snadno, velmi pevně a už při nízkých koncentracích. Enzym by pak chemickými mechanismy katalyzoval jeho přeměnu. S přeměnou substrátů v produkty by se komplementárnost rušila. Vazba substrátu by se oslabovala a produkty by se snadno uvolňovaly do okolí.
Enzymy ovšem katalyzují reakce v obou směreoh. Enzym s aktivním místem komplementárním substrátu by velmi špatně vázal produkty. Vazba produktů do takového místa by se zlepšovala tím, že by se jejioh struktura v průběhu vazby připodobňovala struktuře substrátů; znamenalo by to, že energie vazby by byla hybnou silou pro přeměnu produktů v substráty. Soutěžily by zde tudíž dvě hybné síly – jedna, vyplývající ze změny volné energie (bio)chemické reakce, by žádala přeměnu substrátu v produkty, druhá, vazebná energie mezi substrátem a enzymem, by preferovala přítomnost nezměněného substrátu (vázaného v komplexu enzym-substrát).
V případě, že by aktivní místo bylo komplementární produktům, dojdeme k podobným závěrům – pro vazbu substrátů budou nezbytné vyšší koncentrace, substráty sice budou v průběhu vazby vystaveny působení, které je bude deformovat v produkty, ale produkty se budou velmi obtížně uvolňovat z vazby na enzym.
Uvedené obtíže odpadají v situaci, kdy struktura aktivního místa je komplementární přechodovému stavu. V takovém případě využijí reaktanty všechny možnosti vazby k enzymu teprve tehdy, když budou ze svých základních stavů vyvedeny ve stavy přechodové. Tehdy energie komplexu enzym-substrát dosáhne minima. Vnitřní vazebná energie se v tomto případě uplatní nejen při překonávání entropijních vlivů, resolvataci a při indukovaném přizpůsobení, ale také při deformaci reaktantů (výchozích látek i produktů) do podoby přechodového stavu.
Komplex enzym-substrát má větší (termodynamickou) stabilitu než směs enzymu a substrátu. Přesto je substrát sám v komplexu destabilizován (enzym rovněž). Strukturní destabilizací základního stavu se zvětšuje počet částic, které mají dostatečnou energii (enthalpii) k tomu, aby prošly reakční cestu vymezenou dovolenými stupni volnosti. Vnitřní vazebná energie se tak využívá pro snížení volné energie aktivace a rychlost reakce vzrůstá.
V teorii enzymové katalýzy se jakýkoliv projev destabilizace reaktantů enzymem, na který se spotřebuje část vnitřní vazebné energie, označuje jako efekt Kirké. Základním článkem výkladu enzymové katalýzy efektem Kirké tedy je stanovisko o využití vnitřní vazebné energie pro katalytioké účely.
Koncepce efektu Kirké zahrnuje všechny výše uvedené dílčí katalytické mechanismy. Navíc zdůrazňuje některé další, komplexní stránky katalytického aktu. Jsou uvedeny níže.
Efekt Prokrustova lože
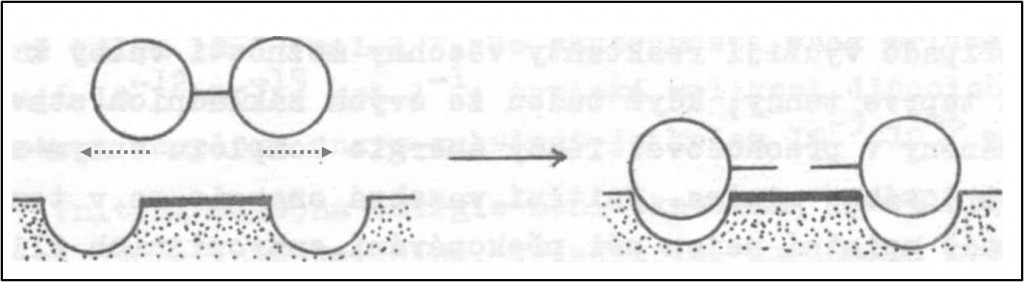
Mechanismus Prokrustova lože představuje aktivní místo enzymu v rigidní a nepoddajné podobě, komplementární přechodovému stavu. Substrát naopak považuje za poddajný. Aby mohlo dojit k uložení substrátu (v mýtu poutníka) do aktivního místa (v mýtu do lože), doohází k deformaci substrátu a k destabilizaci jeho kritioké vazby (obr. 9). „Pozorovaná“ vazebná energie je menší o část spotřebovanou na destabilizaci substrátu, a tím urychlení reakce. Pokud je zapotřebí zdůraznit, že k destabilizaci přispívá zvláště vazebná energie těch částí substrátu, které jsou vzdálené od místa podléhajícího přeměně, hovoří se o tzv. „indukované destabilizaci“ (obr. 11); část substrátu, odpovědná za destabilizaci, se pak označuje jako „rukojeť „.
Obr. 9. Ilustrace efektu Prokrustova lože.
Efekt Sinidových borovic neboli efekt skřipce
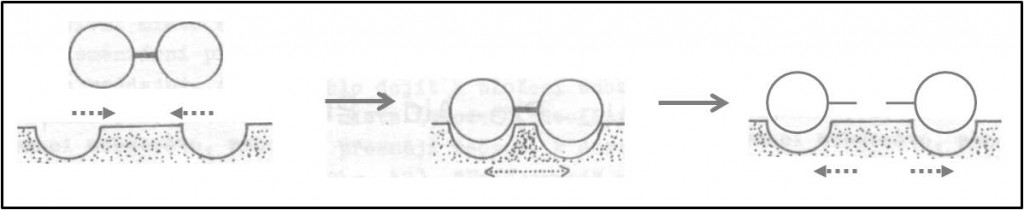
Mechanismus Sinidových borovic představuje substrát rigidní, a nyní je to aktivní místo enzymu – opět komplementární přechodovému stavu – jako poddajné. Substrát (v mýtu poutník, popř. mučedník na skřipci) deformuje aktivní místo při svém ukládání se do něho. Pružně deformovaný protein (v mýtu borovice, popř. skřipec) se vrací do svého původního nízkoenergetického stavu a při tom destabilizuje kritickou vazbu substrátu. Tím přispívá k urychlení reakce (obr. 11). Molekula proteinu se účastní katalýzy jako celek. Její velikost usnadňuje uchování energie pružné deformace.
Obr. 10. Ilustrace efektu Sinidových borovic neboli efektu skřipce.
Efekt Prokrustova lože se spolu s efektem skřipce označují jako mechanismy geometrické destabilizace.
Indukované přizpůsobeni
Efekt skřipce má společný rys s hypotézou indukovaného přizpůsobení. Oba mechanismy spotřebovávají část vnitřní vazebné energie na deformaci proteinu. Hypotéza indukovaného přizpůsobení však – na rozdíl od efektu skřipce – předpokládá aktivní místo, které není komplementární přechodovému stavu; a není komplementární ani základnímu stavu reaktantů. Zatímco v efektu skřipce se pružná deformaoe využívá na převedení substrátu do přechodového stavu, v indukovaném přizpůsobení se ještě v přechodovém stavu spotřebovává část energie vazby substrátu v enzymu na orientaci katalytických skupin do náležitých poloh. „Na skřipci“ je podobně jako v „Prokrustově loži“ objektem destabilizačního působení substrát, avšak v indukovaném přizpůsobení se musí pro výkon katalytického aktu „připravit“ i aktivní místo — a to i tehdy, když už je substrát sám v přechodovém stavu. Tím se sice i v indukovaném přizpůsobení zmenšuje „pozorovaná“ vazebná energie, ale zároveň se snižuje, a to je nežádoucí, koncentrace aktivovaných komplexů.
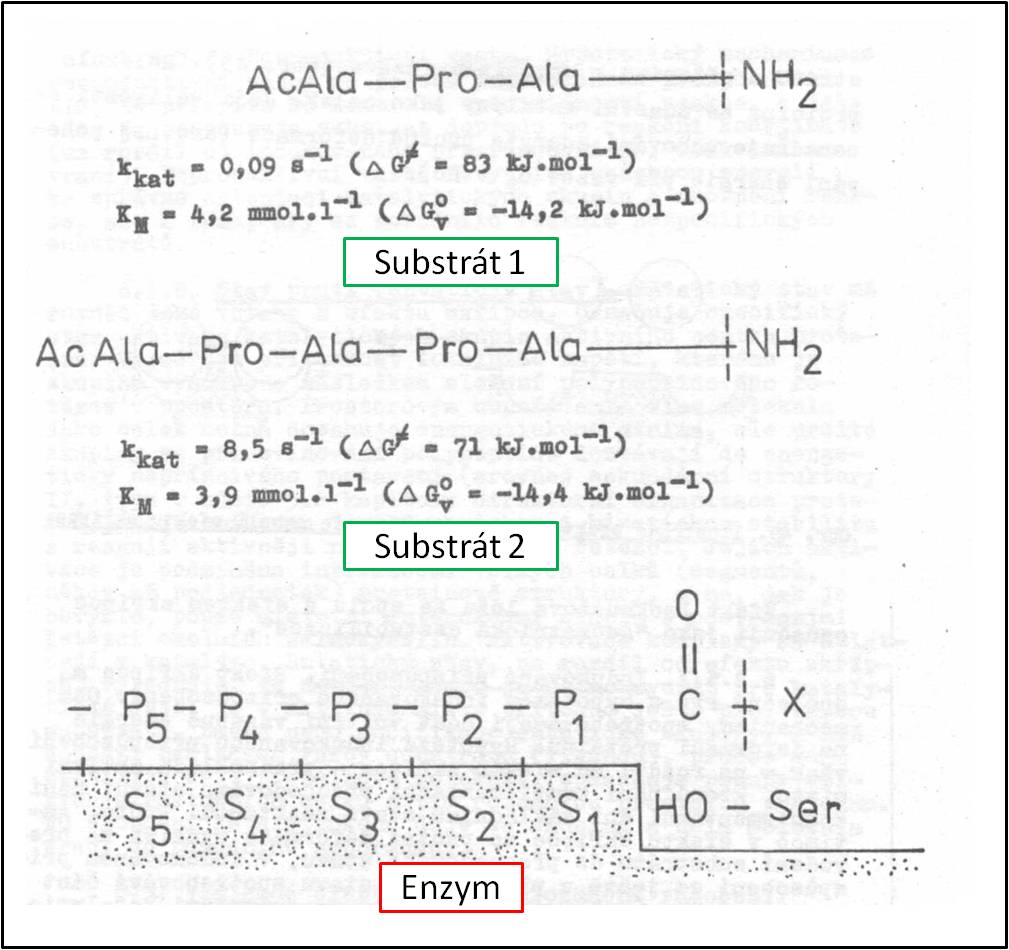
Obr. 11. Příklad indukované destabilizace peptidové vazby v reakci katalyzované elastázou. S1-S5 jsou vazebné oblasti (subcentra) aktivního místa; S1 se Ser-OH je katalytickou oblastí. P1 je aminokyselina substrátu, jejíž acylová skupina je štěpena, P2-P5 jsou aminokyseliny navazující na P1 a vytvářejí tzv. „rukojeť“. Zdánlivá (celková) rychlostní konstanta katalyzované reakce je kkat, KM je Michaelisova konstanta, ΔGv° je vypočtená změna standardní volné energie vazby substrátu odpovídající KM, ΔG# je vypočtená aktivační energie odpovídající kkat. Interakce v S4-5 subcentru, umožněná prodloužením peptidového řetězce (u druhého ze dvou uvedených substrátů), zvýší při přibližně stejné „pozorované“ energii vazby rychlost reakce téměř 102krát, což odpovídá snížení aktivační bariéry asi o 12 kJ.mol-1. Podobný příklad destabilizace s použitím „rukojeti“ poskytuje např. působení lysozomu aj.
Neproduktivní vazba
Hypotetický mechanismus neproduktivní vazby se podobá indukovanému přizpůsobení tím, že přispívá ke kontrole specifičnosti reakce, a dále tím, že neposunuje substrát dopředu po reakční koordinátě (na rozdíl od indukovaného přizpůsobeni jej však ani nevrací). Neproduktivní vazba nevyužívá vazebnou energii ke správné orientaci katalytických skupin a umožnění reakce, ale k tomu, aby se zabránilo reakcím nespecifických substrátů.
Stav pnutí (entatický stav)
Entatický stav má rovněž úzké vztahy k efektu skřipce. Označuje specifický stav aktivace katalytických skupin aktivního centra proteinu. Vyjadřuje přítomnost lokálního napětí, kterému je skupina vystavena následkem uspořádání polypeptidového řetězce v prostoru. Prostorovým uspořádáním sice molekula jako celek možná dosahuje energetického minima, ale určité skupiny se při svinování polypeptidu dostávají do energeticky nepříznivého postavení. Mají sníženou termodynamickou i kinetickou stabilitu, a proto reagují aktivněji než v nesvinutém řetězci. Jejich aktivace je podmíněna interakcemi velkých celků (segmentů, někdy až podjednotek) proteinové struktury, a ne, jak je obvyklé, pouze místními interakcemi skupin s postranními řetězci okolních aminokyselin.
Entaticky aktivované komplexy se uplatňují i v katalýze. Entatický stav na rozdíl od efektu skřipce vyjadřuje, že napětí, které je možno využít pro katalytické děje, je v aktivním místě přítomno ještě před vazbou substrátu. Změna nebo modifikace entatické skupiny, k níž dochází následkem vazby substrátu (ligandu), prudce mění stabilitu celé proteinové molekuly, způsobuje posuny velkých strukturních celků, a tím rozsáhlou přestavbu proteinu. Po skončení katalytického děje se skupina a celá molekula vrací do původního uspořádání.
Spřažení elektronových a konformačních procesů
Katalytické působení proteinu se podobně jako ostatní účinky proteinů zakládají na jejich konformační pohyblivosti. Vzhledem k lineární paměti a kooperativnímu chování polypeptidové struktury dochází vlivem chemických interakcí v určitých oblastech (např. v aktivním anebo regulačním centru enzymu) k tomu, že původně lokalizovaná událost, jakou je např. posun valenčních elektronů vazebných a katalytických skupin v odpověď na vazbu ligandu, způsobuje přestavbu celé terciární anebo i kvartérní struktury proteinu. Zpráva o posunu valenčnieh elektronů se rozšiřuje na celou molekulu. Elektronové (fyzikálně-chemioké) procesy jsou spřaženy s procesy konformačními. Změny v rozložení elektronových hustot ve vazebnýoh (katalytických) centrech mají za následek konformační přestavby. V průběhu katalytického působeni se tak uskutečňují specifická vzájemná elektronově-konformační působení.
Zpracoval: Jaroslav Veselý, Ústav patologické fyziologie LF UP v Olomouci a Katedra fyziologie a patofyziologie LF OU v Ostravě.