Charakteristika
Umělá výživa je podání směsí s přesně určeným složením. Je indikována u pacientů, kteří mají zvýšené nároky na přísun některých složek potravy (prevence malnutrice), trpí některou z forem malnutrice anebo vůbec nejsou schopni přijímat potravu. Může jít o krátkodobou umělou alimentaci (< 2 týdny), nebo dlouhodobou (> 2 týdny).
Umělá výživa se dělí na:
- Doplňkovou, kdy se podávají doplňky stravy;
- Částečnou (parciální), kdy se zčásti hradí energie a dále hlavně tekutiny, elektrolyty a některé esenciální složky potravy;
- Úplnou (totální), kdy se zcela hradí potřeba energie a esenciálních složek;
Kromě doplňkové, částečné nebo úplné výživymůže jít i o specifickou orgánovou nutriční podporu.
Nutriční podpora anebo náhrada stravy se může podávat cestou enterální nebo parenterální.
Plánování umělé výživy
Plánování umělé výživy je komplexní. Zahrnuje následující stupně:
- Stanovení denní potřeby (dávky) energie;
- Stanovení denní dávky N, tzn. proteinů anebo aminokyselin;
- Stanovení poměru frakce energie, kryté z proteinů anebo aminokyselin, k celkové denní dávce energie (energii ostatních živin);
- Stanovení vzájemného poměru N, sacharidů a lipidů v hrazení celkové denní dávky energie;
- Stanovení denní dávky esenciálních složek živin (esenciální aminokyseliny a mastné kyseliny)
- Stanovení denní dávky, složení a rychlosti podávání tekutin (vody a elektrolytů);
- Stanovení denní dávky stopových prvků a vitaminů.
Výdej energie, potřeba energie, přívod energie
Normální denní výdej energie = potřeba energie = asi 100 kJ/kg tělesné hmotnosti/den (25 kcal/kg/den). Tato dávka už zahrnuje krytí energetických potřeb pro běžnou denní aktivitu a případně růst. Podrobnější algoritmus je popsán v následujících odstavcích.
Denní energetická potřeba
- 100 – 125 kJ/kg/den (25 – 30 kcal/kg/den) u stabilizovaných;
- 150 – 168 kJ/kg/den (35 – 40 kcal/kg/den) při stresové zátěži.
Stanovení potřeby proteinů (N)
- 0,75 – 1,5 g proteinů/kg/den (0,12 – 0,25 g N/kg/den).
- Sledovat a upravit potřebu podle odpadu v moči;
- Dávky nad 0,25 g N/kg/den (nad 1,5 g proteinů/kg/den) jsou neúčelné a rizikové.
Platí důležité pravidlo, že využití proteinů nebo směsi aminokyselin se řídí nejméně zastoupenou nepostradatelnou (esenciální) aminokyselinou.
Stanovení proporce mezi energií pokrytou příjmem proteinů (N) a energii pokrytou jinými zdroji
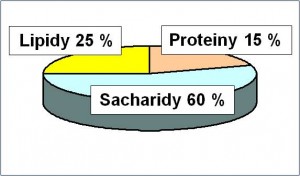
Východiskem pro stanovení proporce je složení běžné diety, v níž proteiny mají krýt asi 15 % energetické potřeby.
Obr. 1. Doporučené složení stravy
Po příslušných přepočtech (1 g N ≈ 6,25 g proteinů ≈ 100 kJ neboli 25 kcal) vychází:
- Dávka 800 – 1200 kJ non-N energie/1 g N (neboli asi 200 – 300 kcal non-N energie/1 g N), u stabilizovaných nemocných.
Stanovení potřeby tekutin, vody a iontů
- Základní potřeba je obvykle 30 – 40 ml vody/kg/den; někdy se podává až 100 ml vody/kg/den, dokonce i více.
- Nutno pamatovat na krytí extrarenálních ztrát, k nimž dochází kůží, respirací, zvracenim, střevem, píštělemi, drény, krvácením a tvorbou otoků ve zhmožděných tkáních atd.
- Bereme v úvahu metabolickou vodu.
- Doplňujme ionty s ohledem na objem tekutin, koncetnrace iontů, osmolalitu a acidobazickou rovnováhu!!!
Stanovení cesty a způsobu podání umělé výživy
Umělou výživu je možno podávat cestou enterální nebo parenterální.
Enterální výživa
Pokud z nějakého důvodu pacient přechodně nemohl přijímat stravu, začíná se s enterální výživou co nejdříve. Existují pro to závažné důvody. Enterální výživa má přednost vždy, když je možná a když je tolerována. I při polytraumatech anebo šoku, pokud není poraněna trávicí trubice, se s enterální výživou začíná už po 24 – 48 hodinách od stabilizace pacienta.
- Nejjednodušší způsobem aplikace enterální výživy je popíjení roztoků anebo polykání tablet (granulí) o přesně definovaném složení (doplňková výživa).
- V závažnějších případech se umělá enterální výživa podává naso/orogastrickou nebo naso/orojejunální sondou. Střevní peristaltika se obvykle obnoví dříve než žaludeční. Proto se dává přednost používáné dvojité cévky, která umožňuje současné odsávání žaludečního obsahu. V případě akutní pankreatitidy je možno začít s malými dávkami do tenkého střeva za papila Vateri.
- Alternativou je podání dávek enterální výživy břišní stěnou - perkutnánní endoskopickou gastrostomií nebo chirurgicky založenou jejunostomií.
Dlouhodobé vyřazení enterální výživy hrozí:
- Atrofií sliznice a svalové stěny střeva;
- Úbytkem lymfatické tkáně střeva;
- Poruchou integrity střevní bariéry;
- Pronikáním bakterií do cirkulace;
- Pronikáním bakterií do nekrotických hmot pankreatu v případě akutní pankreatitidy.
K upřednostňování enterální výživy před parenterální tudíž především vedou nenutriční důvody:
- Podpora zachování digestivní a absorpční funkce sliznice, uchování klků a kartáčového lemu;
- Uchování svalové masy trávicí trubice, nervově-svalové koordinace, endokrinní regulace, obnovení peristaltiky, prevence aspirační pneumonie atd.;
- Stimulace perfúze;
- Uchování imunologické bariéry (včetně IgA);
- Drenáž lymfy;
- Prevence pneumonie dolních laloků plic;
- Redukce rizika SIRS/Sepse a MOF.
Parenterální výživa
Parenterální výživa se podává přímo do krevního oběhu. Při periferní parenterální výživě se roztoky aplikují do některé dostupné periferní žíly. Centrální parenterální výživa naproti tomu vyžaduje zajištěný vstup do centrálního žilního řečiště. Lze to provést buď starší metodou kanylace některé centrální vény (v. subclavia, v. jugularis interna apod.), nebo novějším postupem cestou periferní žíly s využitím tzv. plovoucího katetru (swimming catheter). Výhodou centrální cesty je možnost podávat vysoce koncentrované nebo vysokoosmolální roztoky.
Při aplikaci roztoků se nejčastěji používají systémy „vše v jednom zásobníku“ („all-in-one„) nebo „více zásobníků“ („multi bottle„).
Parenterální výživa je jediným způsobem výživy při:
- Akutní pankreatitidě;
- Nekrotizují enterokolitidě;
- Déletrvající neprůchodnosti (ileu;)
- Obstrukci distálního střeva;
- Poranění střeva.
Potřeba a hrazení ztrát energie v hypermetabolických (katabolických) stavech
Hypermetabolické stavy charakterizuje zvýčený výdej energie v klidu. Potřeba energie v hypermetabolických stavech je vyšší než kolik činí jen součet klidové potřeby energie a energie zajišťující běžnou denní aktivitu a růst. Navíc musí pokrýt energii potřebnou pro obnovu tkání (předchozí deficit energie).
Mohou nastat dvě odlišné situace:
- Denní výdej energie může být nižší než denní energetická potřeba a než možnosti dodávky energie do těla zvenčí. S takovým stavem se setkáváme u pacientů dlouhodobě adaptovaných na nedostatečný přívod potravy při částečném anebo úplném hladovění. Výdej energie adaptovaných pacietů může být 85 kJ/kg/den (20 kcal/kg/den) a je převážně hrazen z lipidů. Potřeba hrazení energie a z toho plynoucí výše jejích denních dávek ovšem musí zarnout nejen udržení, ale i obnovu tkání – potřeba energie je tedy daleko větší než jen výdej!
- Při umělé výživě se potom energie pro obnovu tkání hradí hlavně sacharidy při udržování pozitivní bilance dusíku.
- Denní výdej energie může být vyšší než denní energetická potřeba a než možnosti dodávky energie do těla zvenčí. Setkáváme se s tím u pacientů ve stavu stresového katabolismu (SIRS, polytrama, sepse apod.), kdy energetický výdej může převyšovat i 170 kJ/kg/den (40 kcal/kg/den). Energetický výdej je v hyperkatabolických-hypoanabolických stavech hrazen hlavně z proteinů (glukoneogeneze; katecholaminy, glukokortikoidy) a z lipidů (aktivovaná lipolýza, katecholaminy, glukokortikoidy).
- Hrazení ztrát energie v hyperkatabolických stavech představuje závažný problém. Oxidace exogenní glukózy má plató kolem 100 kJ/kg/den a úroveň plató se v hyperkatabolických stavech snižuje. Přívod další glukózy neutlumí proteolýzu a lipolýzu a hrozí hyperalimentací. Rovněž přívod exogenních lipidů je při vystupňované lipolýze rizikový (lipotoxicita). Lipidy potřebují apolipoproteiny, které nejsou k dispozici. Tkáně nedokážou efektivně využívat kyslík.
- Proto v takové situaci může přívod energie stěží dosáhnout potřeby diktované výdejem. Bude nižší, protože se musí přizpůsobit kapacitě a limitům tkáňového metabolismu.
- Ani vyrovnané, a tím spíše ani potřebné pozitivní energetické bilance se nedosáhne, dokud se nepodaří zvládnout primární příčinu, která vyvolala hyperkatabolický stav.
Hrazení nutričních potřeb – proteiny
Hrazení běžných ztrát dusíku (proteinů) je 0,75 g proteinů/kg/den (0,12 g N/kg/den). V nepříliš komplikovaných stavech se dávky upravují podle denního odpadu N v moči.
Potřeba proteinů (aminokyselin) u pacientů v hyperkatabolickém stavu (akutní chirurgické trauma, popáleniny, infekce) je mnohem vyšší:
- Asi 1,2 – 1,5 g proteinů/kg tělesné hmotnosti/den (0,20 – 0,25 g N/kg tělesné hmotnosti/den), tzn. že je podobná jako u rostoucích dětí;
- Potřeba však může být i více než dvojnásobná.
- Přesto dávky umělé výživy obasahující nad 1,5 g proteinů/kg/den (nad 0,25 g N/kg/den) nelze v hypermetavbolických stavech podat. Jsou neúčelné a rizikové. Hrozí hyperalimentace.
Hrazení nutričních potřeb – sacharidy
Exogenní sacharidy:
- Výrazně šetří tělní proteiny:
- Redukují potřebu aminokyselin pro glukoneogenezu;
- Poskytují energii pro proteosyntézu.
- Výrazně omezují tvorbu ketolátek a acidózu.
Zastoupení frakce sacharidů z hlediska potřeb, tolerance a rychlosti jejich podání:
- Obvyklé dávkování je 3 – 4 mg glukózy/kg/minutu u stabilizovaných osob;
- Maximální dávkování je 1,5 – 2 mg glukózy/kg/minutu při stresové zátěži. Nad touto hranicí hrozí hyperalimentace.
Hrazení nutričních potřeb – lipidy:
Exogenní lipidové emulze šetří tělní proteiny.
Zastoupení frakce lipidů z hlediska potřeb, tolerance a rychlosti jejich podání:
- Obvyklé dávkování je 0,5 – 1,5 g tukové emulze/kg hmotnosti/den;
- Maximální dávkování je 2 g tukové emulze/kg hmotnosti/den; tzn. maximálně 2,5 mg lipidů/kg hmotnosti/minutu. Nad touto hranicí hrozí hyperalimentace.
Zařazení specifických nutričních a esenciálních substrátů:
- Glutamin, arginin, rozvětvené aminokyseliny;
- Nenasycené mastné kyseliny;
- Vitamíny;
- Stopové prvky;
- Nukleotidy.
Hypoalimentace vs. hyperalimentace
Kriticky nemocného ohrožuje nejen malnutrice ve smyslu hypoalimentace, ale také hyperalimentace. Organismus obtížně toleruje přívod energie vyšší než 50 % nad bazální hladinou potřeby energie. Při nerespektování tohoto pravidla hrozí u kriticky nemocných pacientů hyperalimentace.
Hyperalimentace: Aminokyseliny
Potřebu a rychlost přívodu proteinů (aminokyselin) udává následující tabulka.
| Dávka proteinů (g/kg/den) | Dávka N (mg/kg/den) | Rychlost přívodu N (mg/kg/min) | |
| Stabilizovaný stav | 0,6 – 1,0 | 100 – 150 | < 1 |
| Akutní stav | 1,0 – 1,5 | 150 – 250 | < 1,3 |
| Kritický stav | 1,5 – 2,0 | 250 – 300 | < 1,7 |
Tabulka 1. Dávky a rychlost přívodu aminokyselin v různých stavech.
Limit přívodu dusíku
Vyšší dávky než 150 – 250 mg N/kg tělesné hmotnosti/den (nad 1,5 – 2 g proteinů/kg/den) nezlepšují rovnováhu dusíku. Asi 30 % energie aminokyselin se přímo mění v teplo. Přívod vysokých dávek aminokyselin proto může vyvolat horečku, která může být mylně považována za známku infekce. Vysoké dávky aminokyselin zatěžují tkáně hypermetabolismem a nadbytečnou tvorbou katabolitů obsahujících dusík.Vylučování katabolitů je provázeno hyperfiltrací v ledvinách.
Poměr přívodu energie k přívodu dusíku
Vyrovnaná dusíková bilance u stabilizovaných osob odpovídá přívodu 800 – 1200 non-N kJ/g N (200 – 300 kcal/g N). Maximum proteinů-šetřícího účinku nastupuje už při přívodu 625 non-N kJ/g N. Pokud se nejedná o hrazení předchozí deplece energie, hojení nebo růst, další zvyšování příjmu energie ani dusíku už prakticky dusíkovou bilanci neovlivňuje.
Při stresové metabolické zátěži a při akutních hypermetabolických a kritických katabolických stavech se poměr přívodu energie k přívodu kyslíku udržuje kolem 400 – 600 non-N kJ/g N (100 – 150 non-N kcal/g N).
Spektrum aminokyselin
Játra za fyziologických okolností udržují nejen stálou koncentraci, ale i poměrné zastoupení jednotlivých aminokyselinv plazmě. Podobně upravují plazmatické spektrum aminokyselin mobilizovaných ze tkání kriticky nemocných, takže spektrum se nemění, i když koncentrace aminokyselin v plazmě jsou v těchto případech až 3x vyšší.
Zároveň se v hyperkatabolických stavech výrazně mění intracelulární spektrum aminokyselin ve tkáních (ve svalu). Např. koncentrace Gln v kritických stavech klesá na 1/4 – 1/10 svých normálních hodnot. Proto se některé aminokyseliny a jejich produkty, které normálně nejsou esenciání, stávají esenciálními. Jde zejména o glutamin, arginin a methionin.
- Glutamin má ve výživě významné postavení:
- Je aminokyselinou, jejíž koncentrace v plazmě a tělních tekutinách je nejvyšší;
- Má významné trofické (anabolické) účinky;
- Je substrátem pro glukoneogenezu, stimuluje syntézu glykogenu v játrech;
- Je donorem N pro syntézu purinů, pyrimidinů a aminosacharidů, takže je nezbytný pro rychle se dělící buňky (enterocyty, lymfocyty aj.) ;
- Je významný pro imunitní funkce;
- Účastní se detoxikace N;
- Účastní se regulace acidobazické rovnováhy.
- Methionin sám je transaminován v periferii a není transsulfurován na metabolicky důležité metabolity;
- Proto se vyvíjí deplece S-adenosylmethioninu a dalších produktů metabolismu methioninu, jako jsou karnitin, taurin, glutathion apod.
Hyperalimentace: Sacharidy
Glukóza přiváděná exogenně se oxiduje rychlostí přibližně 2 mg/kg tělesné hmotnosti/minutu. Horní limit oxidace glukózy je asi 3 – 4 mg/kg/minutu, tzn. kolem 100 kJ/kg/den. V těle osoby s tělesnou hmotností 70 kg se oxiduje asi 200 g glukózy/24 hodin.
Vzhledem k existenci horního limitu (plató) v oxidaci exogenní glukózy existuje i nebezpečí sacharidové hyperalimentace. Pokud se zvyšuje dávka glukózy až na 7,5 mg/kg/min, procento CO2 vzniklého z přímé oxidace glukózy dosahuje horní hranice asi při 60 % celkem produkovaného CO2. Zbytek (40 – 50 % CO2) vždy vzniká z jiných zdrojů. Podíl oxidované glukózy se nezvýší ani po podání inzulínu. Inzulín by měl zajistit, že nad hranicí plató se podstatná část glukózy změní na glykogen; po naplnění glykogenových zásob se ale glukóza vydává do oběhu, takže vzniká hyperglykémie s následnou glukosurií, anebo se mění na tuk.
Plató oxidace glukózy se v hyperkatabolických stavech snižuje, takže tolerance glukózy se u kriticky nemocných zhoršuje. Využitelnost glukózy (maximální rychlost oxidace glukózy v těle) klesá z limitních 3 – 4 mg/kg/minutu na 2,0 – 2,5 mg glukózy/kg/minutu (tj. asi na 1/2 dávky stabilizovaného pacienta). Maximální bezpečná suprese glukoneogenezy (maximální protein-šetřící účinek při prevenci nadměrné lipogenezy) u nestabilizovaného pacienta se tak dosahuje při přívodu glukózy kolem 2 mg glukózy/kg/minutu.
Glykémie se primárně reguluje produkcí glukózy v játrech, ne exogenní glukózou. Vzhledem k přítomnosti inzulinové rezistence je u pacientů v kritických stavech pravidlem přítomnost hyperglykémie. Hyperglykémie nad 10 mmol/l zvyšuje riziko infekcí. U kriticky nemocných s postižením jater naopak hrozí hypopglykémie s rizikem poškození centrálního nervového systému.
Tvorba tuku z glukózy je provázena zvýšenou tvorbou CO2. U pacienta se závažným respiračním postižením může hromadění CO2 vést k nezbytné umělé ventilaci.
Hyperalimentace: Lipidy
Maximální rychlost oxidace lipidů v těle, kde probíhá hlavně v játrech, myokardu a kosterním svalstvu, je 1,2 – 1,7 mg lipidů/kg tělesné hmotnosti/min. Podobně jako využitelnost glukózy i využitelnost lipidů u kriticky nemocných klesá, a to asi na 1,0 mg/kg/minutu.
Při distresu anebo sepsi může být aktivována lipolýza v tukových zásobách na troj- až čtyřnásobek. Přitom aktivace lipolýzy není provázena úměrným zvýšením oxidace mastných kyselin. Může být tlumena oxidací sacharidů. Více než 80 % uvolněných mastných kyselin se pak znovu reesterifikuje v játrech (normálně se reesterifikuje asi 20 – 30 % uvolněných mastných kyselin) a v plazmě roste koncentrace triacylglyceridů. To znemožňuje další parenterální podání lipidových emulzí. Při neuváženém přívodu exogenních lipidů dochází ke steatóze v játrech, ledvinách, svalech a jiných tkáních, které jsou za fyziologických okolností tuku prosté. Tkáně tak jsou zároveň poškozovány deplecí proteinů a aminokyselin a lipotoxickým působením tuku.
Nenasycené mastné kyseliny se oxidují rychleji, ale při jejich metabolismu vzniká velké množství reaktivních částic kyslíku (ROS). Proto v nutričních emulzích musí být dostatečně zastoupeny antioxidanty (vitamín E aj.). Nenasycené mastné kyseliny také poskytují četné účinné prozánětlivé metabolity, jejichž účinek je v kritických stavech nežádoucí.
Mastné kyseliny o středně dlouhém řetězci, které se rovněž dobře metabolizují, mohou být zastoupeny jen v určité proporci. Ve vysokých dávkách jsou nežádoucí pro svůj termogenní efekt; podobně jako aminokyseliny mohu i ony způsobit horečku a vést k mylné diagnóze infekce, nebo dokonce sepse.
Zpracoval: Jaroslav Veselý, Ústav patologické fyziologie LF UP