autor: Doc. MUDr. Květoslava Dostálová, CSc.
pracoviště: Ústav patologické fyziologie LF UP Olomouc
Úvod
I když neznáme přesně epidemiologické údaje u stárnoucí populace, lze říci, že v současné době téměř každý 10. člověk má některou z forem ledvinného postižení ( tj. 500 000 lidí v ČR) a má glomerulární filtraci (GF) nižší než 50 % normy. To odpovídá středně závažnému až závažnému snížení glomerulární filtrace až selhání ledvin, tedy chronickému onemocnění ledvin ve stadiu III-V podle nové klasifikace z roku 2008.Část z nich o svém onemocnění neví.Rozhodování je v rukou nejen nefrologů, ale především také internistů a praktických lékařů.
I když ne u všech nemocných dojde časem k selhání ledvin, je nutno vědět, že i při tomto poklesu renální funkce dochází také k výrazným celkovým metabolickým změnám, které ovlivňují i funkci dalších orgánů a systémů a v konečné fázi pak morbiditu i mortalitu pacientů .
Snížení (GF) přibližně do 75% hodnoty fyziologické glomerulární filtrace nevede ke změnám ve složení vnitřního prostředí, ale jen ke změnám krátkodobým, při vysokých nárocích na organismus.Toto stadium se nazývá snížená funkce ledvin.
Chronické onemocnění ledvin znamená nejen určitý stupeň morfologické léze renálního parenchymu, ale zejména postupnou, ireverzibilní ztrátu schopnosti ledvin plnit svou mnohočetnou roli v udržení stálosti vnitřního prostředí. Důsledky, které z toho vyplývají jsou také mnohočetné a nejsou bez klinických projevů.
Výsledný metabolický a klinický obraz pacienta se selháním ledvin pak zahrnuje multiorgánová postižení, která ve svém důsledku jsou prognosticky významnější než vlastní onemocnění ledvin.
Pacienti léčení některou z metod náhrady funkce ledvin mají výrazně horší prognózu a příčinou kratší délky a horší kvality jejich života není samo, selhání ledvin ale právě postižení ostatních orgánů, zejména srdce a cév, ale i porušená funkce imunitních mechanismů, a mnoha dalších fyziologických funkcí a regulačních mechanismů. Nepochybně se podílí i malnutrice a chronický zánět. Vliv snížené funkce ledvin na určité základní změny v jiných orgánech je evidentní.
Principy metabolických a orgánových změn při selhávání ledvin
Při onemocnění ledvin a ztrátě jejich funkce nastává komplexní metabolická porucha, postihující celý organismus. Spektrum biochemických změn je dáno nejen sníženou eliminací ( glomerulární i tubulární), ale i poklesem intrarenálního metabolismu mnoha látek a změnou regulací (acidobazická rovnováha, fosfokalciový metabolismus, chybění renálního glykogenu, prodloužený biologický poločas inzulinu apod.), což vše je jen funkční důsledek primárního onemocnění ledvin až zániku jejich funkce.
Stupeň ani spektrum metabolických změn nejsou paralelní k tíži postižení ledvin. Ztráta až 50% funkčního renálního parenchymu ledvin ( viz dále) zůstává prakticky nejen klinicky asymptomatická, ale i bez retence katabolitů a bez jiných metabolických změn.
Jestliže se objeví první odchylky ( zvýšení sérové koncentrace urey, kreatininu a dalších katabolitů, ale i snížená koncentrace látek produkovaných v ledvinách – kalcitriol, erytropoetin ) s laboratorními i funkčními důsledky,tak se druhotně zesilují některé transportní renální procesy (eliminace kreatininu se děje nejen glomerulární filtrací, ale ve zvýšené míře i tubulární sekrecí; retence fosfátů je kompenzována zvýšenou fosfaturií podmíněnou zvýšenou aktivitou příštítných tělísek.
Pokud je tedy zachován určitý funkční renální parenchym, mohou být eliminační nároky organismu udrženy i jinak- třeba akcentací určitých regulačních smyček.
Při poklesu funkce ledvin jsou aktivovány a modifikovány mnohé regulační smyčky, které zprvu mohou být považovány za kompenzační, později jsou však maladaptivní nebo i nefunkční. Rozhoduje o tom intenzita faktorů které ovlivňují progresi změn, která vede k rozvoji chronického selhání ledvin. Výsledný obraz poruchy metabolismu při terminálním selhání ledvin je pak kombinací nejen zcela chybějících renálních funkcí, ale i důsledkem poměrně dlouho probíhajících aktivovaných regulačních dějů v předchozím období.
Ve stadiu Stadiu renálního poškození (impairment) (tj.tehdy, jestliže zbývá asi 50% funkčních nefronů) : Glomerulární filtrace je zvýšená, diuréza bývá paradoxně taktéž zvýšená. Je to tím,že průtok zbylými nefrony se zdvojnásobil a zpětná resorpce vody v tubulech není dostatečná. Pacienti si často stěžují na nykturii. Homeostáza zatím není narušena, ale ledviny nejsou schopny koncentrovat moč.
Ve stadiu Chronické renální insuficience, (CHRI ) je středně závažné snížení GF (GF zůstává vyšší než 20 -25% normální hodnoty): dochází k výrazným změnám ve složení ECT a také ke změnám v metabolicko – endokrinní funkci ledvin. Změny jsou vystupňovány při zátěži organismu ( trauma,, operace, infekce,zvýšený přívod bílkovin, tekutin, elektrolytů apod).
Ve stadiu Chronického selhávání ledvin, ( CHSL) (GF je nižší než 20% normálních hodnot):Funkce ledvin je snížena tak,že ledviny nejsou schopny udržet normální složení vnitřního prostředí ani za bazálních podmínek, speciálních dietních a medikamentózních opatřeních a vyrovnané metabolické situace organismu.
Kromě snížení GF u obou stavů (CHRI a CHSL) sledujeme a hodnotíme funkci ledvin vyšetřením koncentrační schopnosti ledvin a clearancové hodnoty určitých látek ( kreatinin, cystatin C, inulin, plazmatickou ureu, také stav poškození tubulů stanovením beta 2- mikroglobulinu v krvi a moči, stanovením aktivity N-acetyl-beta-D glukoasaminidázy (NAG), vyšetření substancí, které ukazují na syndromy renální tubulární acidózy ( sekrece H+, K+ apod).
Uremický syndrom je soubor klinických příznaků, které mohou,ale nemusejí provázet CHSL ( nauzea, zvracení, krvavé průjmy, polyneuropatie, perikarditida, bronchopneumonie, poruchy vědomí apod.). Za jejich jedinou a hlavní příčinu není však dnes považována jen zvýšená hladina urey v plazmě. V souvislosti s uremickým syndromem a selháváním ledvin se věnuje stále větší pozornost také tzv. „uremickým toxinům“.
Příčiny chronického selhávání ledvin
v našich podmínkách jsou nejčastěji tyto:
- Diabetická nefropatie
- Systémová arteriální hypertenze
- ischemie ledvin
- primární a sekundární glomerulopathie
- chronické tubulointersticiální nefritidy
- polycystická choroba ledvin
- myelomová nefritida
- hereditární nefritidy
- vaskulární nefroskleróza
- ostatní nefropatie
Faktory progrese vedoucí ke chronické renální insuficienci
a) Zánik nefronů podmíněný snížením počtu nefronů základním patologickým procesem
b) Zánik nefronů podmíněný arteriální hypertenzí
Tyto změny jsou v počátku pozitivní a umožňují zvýšení výkonu zbytkových nefronů pomocí těchto hlavních mechanismů:
- Převažuje dilatace aferentní arterioly s intraglomerulární hypertenzí
- Zvyšuje se průtok plazmy jednotlivými nefrony
- Zvyšuje se glomerulární filtrace v jednotlivém nefronu
- Glomerulo-tubulární adaptace bránící zvýšeným ztrátám solutů a vody při zvýšené filtraci v nefronu
- Je zvýšená produkce kyselin ( zvýšena Na-H směna, zvýšená produkce NH4, snížená reabsorpce PO4 (PTH)
- Je zvýšena frakční exkrece PO4, kalia,-zvýšení Na-K-ATPázy, zvýšení frakční exkrece Na a H2O.
Rychlost zániku fungujících reziduálních nefronů je významně závislá na základním patologickém procesu postihujícím ledviny. Jakmile však dojde k zániku jistého kritického množství nefronů, více než 75% (hodnota sérového kreatininu přesáhne asi 200 umol/l) , ve zbylých reziduálních nefronech pak probíhají další funkční změny již samy o sobě a nezávisle na základním onemocnění a vedou k postupnému zániku zbylých nefronů !
Vzniklé funkční změny umožňují po určitou dobu maximální výkon reziduálních nefronů, avšak současně vedou postupně ke vzniku glomerulární hypertenze a hyperfiltrace k aktivaci glomerulárního mesangia , skleróze a k zániku glomerulů. Jakmile tedy dojde, ke kritickému omezení počtu fungujících nefronů postupuje další zánik nefronů autonomně uvedeným mechanismem. Zbytkové glomeruly hypertrofují ( aktivace růstových faktorů – PDGF,IL-1, AG II,TGFB,TNF).
Tubulární buňky reziduálních nefronů jsou vystaveny větší metabolické zátěži. Zvýšená zátěž zbytkových nefronů postupně vede ke zmnožení mesangiální matrix, rozvoji intesticiální fibrózy ( ET-1) a výsledkem je nakonec další redukce počtu fungujících nefronů v důsledku glomerulární sklerózy.
Adaptační změny reziduálních nefronů umožňují zachování vnitřního prostředí i při značném snížení GF, přesto však je pokles GF určitým ukazatelem jejich počtu .
Dochází také ke změnám intenzity tubulárních transportních procesů, které umožňují zejména udržení vyrovnaného sodíkového,draslíkového a vodního metabolismu. Tyto změny spočívají ve snížení tubulární resorpce, zvýšení tubulární sekrece řady látek (frakční exkrece, FE).
c) Zevní faktory, které v šírším rozsahu mají vztah k progresi chronické renální insuficience jsou:
- Neovlivnitelné: typ nefropatie, věk, pohlaví, rasa
- Ovlivnitelné : proteinurie, arteriální hypertenze, glykémie, hyperlipidémie, obezita,hyperurikémie,hyperparathyreoidismus, kouření.
Klinicky se za jeden z nejvýznamnějších faktorů progrese CHRI považuje přítomnost systémové hypertenze a proteinurie. Nepříznivě se projevuje hyperparathyreoidismus a t. zv. „uremické toxiny“ .
Proto je i možné,že nemocní s poklesem GF až na 10% mohou být při určitých dietních opatřeních i ve vyrovnaném metabolismu.
Díky vzestupu FE může být zachována homeostáza až do stadií velmi nízkých hodnot GF. Existují však určité maximální hodnoty FE, např. FE Na+ 25-30%, FE K+ 150-100% , FE H2O 30-35% atd.
Adaptace tubulárních funkcí však také záleží na velikosti příjmu sledované látky, popřípadě na jejím extrarenálním vylučování.
Reziduální diuréza nemocných s CHRI má většinou normální objem, ale v důsledku porušené koncentrační schopnosti ledvin se může vyskytnout polyurie, zejména u nefropatií s výrazným postižením tubulárních funkcí (např. TIN). V těchto případech mají nemocní i polydipsii a jsou náchylní k dehydrataci. Natriurie může být vysoká, ale obvykle se se trvale pohybuje kolem 60-70 umol/l (polyurická izostenurie). Náhlé omezení příjmu NaCl v potravě může být pro tyto nemocné nebezpečné.
Pro posouzení bilance natria je nutné stanovit odpady Na močí za 24 hodin.
Na druhé straně oligoanurie bývá přítomna v konečných stadiích CHSL, především u nemocných v PDL.
Metabolické důsledky chronické renální insuficience
Metabolická aktivita ledvin je velmi intenzivní ( což dokumentuje skutečnost, že mají vysokou spotřebu kyslíku na jeden gram tkáně. Tím je zajištěna jak jejich exkreční funkce, tak i řada dalších funkcí metabolických a regulačních.
Při renálním selhání dochází k retenci katabolitů, vodní a elektrolytové nerovnováze, metabolické acidóze a deficitu látek produkovaných v ledvinách. Vzniká tedy komplexní metabolická porucha, jejímž klinickým korelátem je uremický syndrom. Uremická toxicita je tedy multifokální etiologie.
Patogenetické mechanismy lze rozdělit do 3 skupin:
- Akumulace látek
- Deficit látek
- Poruchy regulací
Poruchy metabolismu bílkovin a aminokyselin
Ledviny se podílejí na metabolismu bílkovin a aminokyselin na několika úrovních: eliminace bílkovin a peptidů , syntéza aminokyselin , amoniogeneze. Porušení jejich funkce je tedy logicky provázenou poruchou metabolismu proteinů, který zahrnuje:
- Nižší přívod bílkovin potravou,
- snížení tvorby bílkovin ve svalech ( nedostatek aminokyselin),
- lepší využití aminokyselin ( zvýšená aktivita proteosyntetických enzymů v játrech a snížená aktivita enzymů ureového cyklu )
- vysoká reutilizace dusíku močoviny (30 – 40%)
- zvýšené vylučování močoviny extrarenálními cestami (stolicí, kůží)
- snížení extracelulárních i celkových zásob albuminu
- změny intracelulárních hladin aminokyselin ve tkáních i v plazmě
- při snížené exkreční činnosti ledvin stoupají hladiny některých menších bílkovinných molekul:alfa, beta –mikroglobulinu, lysozymů, alfa-1 glykoproteinu a fibrin-degradačních produktů.
- Mění se poměr esenciálních AMK (EAK) a neesenciálních (NEAK) tak, že (EAK se snižují, NEAK stoupají)
- Typický je nález snížené hladiny rozvětvených esenciálních AMK (leucin, izoleucin, valin).
Porucha metabolismu sacharidů
- Zvýšení glykémie na lačno (30% nemocných)
- Porucha glukózové tolerance při GTT ( glukózovém tolerančním testu) je u 60% nemocných, typ křivky má předdiabetický charakter.
- Je zvýšena hladina inzulinu v důsledku periferní tkáňové rezistence (postreceptorový defekt), ledviny nekatabolizují inzulin
- Sekrece inzulinu je navíc stimulována zvýšenou sérovou koncentrací kalia ( inzulin zvyšuje vstup kalia do buněk)
- Je blokáda glykolýzy a inhibice utilizace glukózy
PTH – participuje na poruše metabolismu glukózy přes ionty Ca2+. Inhibuje i produkci inzulinu v beta- buňkách Langerhanzových ostrůvků pankreatu ,což vyvolá porušenou odpověď organismu na zátěž glukózou. Při snížení PTH se zlepší utilizace glukózy.
V pokročilých stadiích CHRI se snižuje také aktivita enzymů střevní stěny což znamená porušení resorpce sacharidů.
Porucha metabolismu sacharidů má těsný vztah k metabolismu lipidů. Hyperglykemie samotná může vést k produkci abnormálních cirkulujících proteinů jako je glykovaný Hb a může se přímo podílet na abnormalitách ve struktuře bílkovin bazální membrány kapilár ve svalech a ledvinách. Hyperinzulinémie zvyšuje syntézu triacylglycerolů v játrech a inzulin je jedním z hlavních regulátorů lipoproteinové lipázy, snižování odbourávání TTC vede k jejich vzestupu v plazmě, zvyšují se i VLDL.
Porucha metabolismu lipidů
- Hyperlipoproteinemie se vyskytuje při poklesu GF pod 1ml /s
- (až u 70% nemocných)
- Patogeneza této sekundární hyperlipoproteinemie je komplexní povahy (porušené odbourávání, zvýšená tvorba)
- Hodnoty celkového cholesterolu jsou většinou v normě, nebo jsou lehce zvýšeny
- Hodnoty VLDL a LDL jsou zvýšené, hodnoty HDL sníženy
- Hodnoty celkového triacylglycerolu jsou zvýšeny,
- Hodnoty celkového apo-A a celkového apo-C jsou sníženy.
- Celkový apo-B a celkový apo –E jsou zvýšeny. Apoproteinům (bílkovinné části lipoproteinů je v poslední době věnována zvýšená pozornost, ovlivňují vazbu a vychytávání lipoproteinů na buněčné receptory.
- Nejasná je zatím role karnitinu, homocysteinu a leptinu u nemocných s CHSL. Chybí přesné údaje i pokud se to týká dialyzačního programu.
Porucha acidobazické rovnováhy
Porucha acidobazické rovnováhy je u onemocnění ledvin častá a projevuje se buď ve formě metabolické acidózy nebo alkalózy:
Metabolická acidóza nastává v důsledku postupného poklesu GF se současně se rozvíjející tubulární dysfunkcí. Komplexním výsledkem je:
- Retence fosfátů s sulfátů
- Poruchy syntézy amoniaku v tubulárních buňkách
- Kompenzační mechanismy (sekrece H+ v reziduálních nefronech a zvýšení nabídky fosfátů do tubulárních lumen) obvykle postačují k udržení acidobazické rovnováhy do poklesu GF na 0,24 – 0,33ml/sec
- Pak dojde i ke snížení resorpce bikarbonátů
- Metabolická acidóza (BE větší než 5mmol/ l) zvyšuje intenzitu katabolických procesů a urychluje rozvoj renální osteopatie.
- Při CHSL klesá pH pod 7,4, bikarbonáty pod 22 mmol/l, je zvýšený anion gap.
Metabolická alkalóza CHSL nastává při zvracení, zvýšeném příjmu alkálií nebo antacid, při velkých transfuzích, hypochloremii, hypokalemii.
Příčinou mohou být i terapie diuretiky, Bartterův syndrom, Liddleův syndrom, zvýšená stimulace distálního úseku nefronu aldosteronem, z endokrinních příčin při Cushingově syndromu,a adrenogenitálním syndromu. Hodnoty pH krve stoupají nad 7,4,bikarbonáty nad 26 mmol/l, kompenzace vede ke zvýšení CO2.
Poruchy vodního a elektrolytového metabolismu
Ledviny se za fyziologických poměrů dokáží vyrovnat velmi účinně s měnícím se metabolismen minerálů a vody. S postupným úbytkem ledvinných funkcí však tato schopnost klesá.
Sodík při ledvinné nedostatečnosti
Omezení této schopnosti se však neprojevuje v metabolismu sodíku vždy stejným způsobem. V zájmu udržení rovnováhy ve vnitřním prostředí dochází u nemocných k adaptačním změnám v ledvinových kanálcích, které mohou vést ke zvýšeným ztrátám sodíku do moči.. Před přísným omezením příjmu kuchyňské soli je nutno vždy vyšetřit ztráty sodíku do moči /24hod.
Stejně tak i při nadměrném příjmu soli může dojít ke vzniku otoků. Renální otoky mohou vzniknout i z jiných příčin (snížená hladina krevních bílkovin, městnavá srdeční slabost, onemocnění jater, místní cévní příčiny apod.), příjem soli a tedy obsah sodíku v organismu vždy hraje důležitou roli.
Velmi citlivým a jednoduchým ukazatelem je sledování tělesné hmotnosti. Její přírůstek mluví pro retenci a tedy pro nadbytečný přívod sodíku dietou. Rychlá ztráta hmotnosti může být příznakem sodíkové deplece a nutnost zvýšení jeho přívodu.
U chronického selhání ledvin může být hyponatremie i hypernatremie.
Obvyklý denní příjem sodíku je kolem 3,5g, neboli 5- 12,5 g NaCl (130-210 mmol/l).Jestliže z diety vyloučíme solené pokrmy a masové výrobky a při vaření nepřidáme sůl,klesá obsah v dietě na 2,7g Na, neboli 5-7,5g NaCl (80-115mmol). Jsou –li přítomny závažné otoky a obtížně korigovatelná hypertenze snižujeme dále přívod kuchyňské soli při sledování odpadu sodíku do moči a tělesné hmotnosti, postupně až na 2,5- 4,5g. Takovéto snížení není možné u nemocných u kterých nemá příjem soli klesnout pod 4-5g/den.
Příznakem deplece natria jsou často hypotenze, zvracení a křeče. Naopak retence sodíku vede často k otokům a zvýšení krevního tlaku.
Všechna tato opatření úzce souvisejí s příjmem tekutin. Doporučený příjem má být v rovnováze s objemem vyloučené moči a pohybuje se zhruba v rozmezí 1,5-2,5 l. V pokročilých stadiích ledvinného selhání, kdy musí být nemocní léčeni dialýzou prudce klesá vyloučené množství moči a nemocní zadržují tekutiny. Teprve za této situace omezujeme příjem tekutin na 600-1000 ml/den.
Draslík při ledvinné nedostatečnosti
Sledování hladiny draslíku má význam u onemocnění ledvin, jsou možné výkyvy oběma směry, tedy hyperkalemie, ale i hypokalémie.
Při velkém objemu moči u nemocných s porušenou koncentrační schopností se v moči ztrácí i velké množství kalia, a může se rozvinout hypokalémie. Ještě výraznější změny mohou nastat při současném zvracení a průjmech ( ztráty kalia střevem) . Zvýšené ztráty kalia podporují zvýšené ztráty cukru v moči u nevyrovnané cukrovky, či nadměrné podávání léků na odvodňování. Případný draslíkový deficit hradíme buď dietou s vyšším obsahem kalia v potravinách ( meruňky, fíky, hrozny, sušené švestky aj.), nebo KCl ( to se užívá při současné alkalóze vnitřního prostřed), také K-citrát,K-karbonát). Klinicky se příznak nedostatku kalia projevuje svalovou slabostí, poruchami trávení, meteorismem, zácpou a poruchami střevní pasáže.
V terminálních stadiích CHSL spojených s nedostatečným vylučováním draslíku je nemocný ohrožen rozvojem hyperkalémie (při hodnotě plazmatického kalia více jak 6 mmol/l je vždy velmi nebezpečný stav – hrozí zástava srdce).( Normální hladina kalia v plazmě je kolem 4,5 mmol/l). Jsou typické změny na EKG : zvýšení vlny T, oploštění P, prolongace PR intervalu a QRS komplexu,arytmie, poruchy srdeční frekvence. Nečastěji jsou spojené s nadměrným příjmem kalia při snížené schopnosti ledvin kalium vylučovat. Nebezpečné je i předávkování léky obsahující draselné soli, ale také neúměrné podávání léků na odvodňování zadržujících draslík. Výjimečně je nutno omezovat příjem kalia u nemocných, kteří močí více než 1l/den. Obvykle stačí běžný příjem kalia v potravě v rozmezí 1,2-3g (30-80 mmol/l). Při současném poklesu renálních funkcí omezujeme příjem kalia v dietě na 40-50 mmol/den.
Retence katabolitů
Retinované katabolity se se artificiálně dělí podle relativní molekulové hmotnosti na malé, střední a vysokomolekulární látky.
Malé molekuly jsou dobře odstranitelné dialýzou, a patří mezi ně močovina,kreatinin (tedy dva základní biochemické parametry sledované při selhání funkce ledvin),které jsou relativně málo toxické, dále kyselina močová a homocystein, jejichž zvýšené hladiny jsou dávány do souvislosti s rozvojem arteriosklerózy. Střední molekuly přecházejí přes dialyzační membránu mnohem obtížněji a jedná se o různé peptidy, hormony a jiné organické sloučeniny. Nejzávažnější je retence vysokomolekulárních látek, které především přes“low-flux“ membrány neprocházejí vůbec. Nejdůležitějším představitelem je b-2 mikroglobulin, jehož retence vede ke vzniku dialyzační amyloidózy.
Poruchy kalciumfosfátového metabolismu
Jde nejen o změny hladin fosfátů a vápníku, ale i parathormonu a vitaminu D. Změny kalciofosfátového metabolismu, endokrinní změny a především heterogenní změny kostní morfologie jsou souhrnně označovány jako součást systémového metabolického onemocnění nazývaného „ minerálová a kostní porucha při chronickém onemocnění ledvin“ neboli CKD- MBD ( Chronic kidney diseases – Mineral and Bone disorder), která zahrnuje:
- Abnormality v metabolismu kalcia, fosforu, parathormonu ( PTH) a vitaminu D
- Abnormality v kostním obratu, mineralizaci, objemu, růstu a pevnosti kostí
- Vznik extraoseálních kalcifikací ( vaskulární kalcifikace, kalcifikace měkkých tkání)
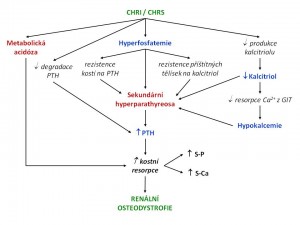
Vznik a vliv hyperfosfatemie při CHRI
Při chronické renální insuficienci klesá s množstvím funkční renální rezervy i glomerulární filtrace (GF)a tím i filtrace fosfátů. Při zachovalé úrovni tubulární reabsorpce by fosfatemie stoupala, ale snížení filtrace je dlouho kompenzováno snížením tubulární resorpce fosforu pod vlivem zvýšené hladiny parathormonu (PTH). Vzrůstá tedy frakční exkrece fosforu FEpi nad 20% a jeho sérová hladina se nemění. Ta se zvyšuje nad fyziologickou úroveň většinou až při snížení GF pod 20% fyziologické hodnoty. FEPi může dosáhnout téměř 100%.Podle původní teorie nadbytek fosfátů posune rovnováhu reakce Ca2+ + HPO42- ↔ CaHPO4 směrem doprava.V důsledku toho klesne hladina kalcia , což stimuluje sekreci PTH ,ten uvolňuje kalcium z kostí a zvyšuje frakční exkreci fosfátů, ustanoví se nový steady state a normalizuje se hladina obou iontů. Při progresivním poklesu ledvinné funkce se se takto vyvíjí těžká hyperparathyreóza (sekundární).
Hyperfosfatemie má také vliv na snižení tvorby kalcitriolu prostřednictvím snížené aktivity 1-alfa- hydroxylázy. Tak dojde k další podpoře rozvoje hyperparathyreózy jednak z důvodu snížené koncentrace kalcia při poklesu jeho resorpce v gastrointestinálním traktu, jednak z důvodu snížení (-) inhibičního efektu kalcitriolu na sekreci PTH, která se uskutečňuje prostřednictvím receptorů pro vitamin D. Tato hypokalcemie je pak silným stimulem pro zvýšení sekrece PTH a dokonce i pro proliferaci příštítných tělísek. PTH naproti tomu syntézu kalcitriolu zvyšuje.
Poruchy metabolismu kalcitriolu při CHRI
Kalcitriol normálně tlumí funkci příštítných tělísek ; hyperfosfatemie tomuto působení zabraňuje, což opět vede k hyperparathyreóze. Hyperfosfatemie dále snižuje účinnost působení PTH na kosti (tzv. rezistence skeletu vůči PTH) a pravděpodobně i přímo podporuje činnost i proliferaci příštitných tělísek. Omezení příjmu fosfátů v dietě zlepšuje stav nemocných.
Již při snížení GF pod 1ml/s klesá aktivita 1-alfa- hydroxylázy. Parathormon tento enzym stimuluje a tak hladina kalcitriolu klesá teprve později. Inhibiční vliv na tento enzym má také hyperfosfatémie.
Nedostatek kalcitriolu tedy přispívá ke zhoršování hyperparathyreózy několika mechanismy: zvýšením transkripce genu pro PTH, snížením počtu svých receptorů, existencí uremických toxinů.Nedostatek kalcitriolu také nepřímo zvyšuje sekreci PTH přes hypokalcemii- jednak cestou snížení resorpce kalcia v GI traktu a jednak rezistencí skeletu k hyperkalcemizujícímu účinku PTH.
Poruchy funkce příštítných tělísek při CHRI
I mírná retence fosfátů vede ke zvýšené produkci parathormonu což záleží na zvýšené tvorbě a stabilitě PTH-mRNA (regulace na transkripční i posttranskripční úrovni). Později dochází i k proliferaci buněk příštitných tělísek, která přes stadium hyperplazie může vést až ke klonální expanzi, vzniku nodulární hyperplazie, a tedy k tvorbě adenomu. Tento proces ovlivňuje hyperfosfatemie a hypokalcemie. Noduly jsou typické výrazným snížením počtu receptorů pro vitamin D a pro kalcium a tím i autonomní sekrecí PTH bez ohledu na na kalcemii a hladinu kalcitriolu. Právě těžká hyperparathyreóza daná výskytem těchto nodulů uvolňuje nadměrně kalcium ze skeletu a je tak – vedle léčby kalciovými vazači fosfátů či kalcitriolem a adynamické kostní nemoci – příčinou hyperkalcemie u některých pacientů se selháním ledvin.
V příštitných tělíscích dochází pravděpodobně též ke zvýšení set- pointu, což znamená, že ke stejné supresi sekrece PTH je tedy nutná vyšší kalcémie. Tvorba parathormonu je navíc stimulovaná acidózou. Podávání kalcitriolu může rozvoji sekundární hyperparathyreózy zabránit.
Adaptivní a maladaptivní stránka hyperparathyreózy
Při různém mechanismu vzniku je zvýšená sekrece PTH zpočátku adaptivní a pro organismus přínosná, neboť normalizuje hladiny fosfátů i kalcia. Protože však tato normalizace není úplná, dochází k poklesu tvorby kalcitriolu, a tak k podpoře sekrece PTH. S postupným snižováním GF je sklon k retenci fosfátů stále větší, což podněcuje další zvýšení sekrece PTH. Při snížení GF pod 0,4 – 0, 5 ml/s už ani maximální zvýšení frakční exkrece fosfátů nestačí pro udržení normofosfatémie. V této chvíli už PTH nezvýší další vylučování fosfátů, ale naopak uvolňuje fosfor z kostí, což bez omezení příjmu fosfátů v dietě nutně vyústí v těžkou hyperfosfatémii. Takto začíná circulus viciosus, protože hyperfosfatémie dále stimuluje sekreci PTH. V této chvíli se hyperparathyreoidismus stává maladaptivní, neboť zhoršuje biochemické poruchy a vede k extraoseálním kalcifikacím a poškození kostí.
Změny kalciofosfátového metabolismu při CHRI zasahují nejenom do endokrinní regulace ledvin, ale vedou k poškození řady orgánových systémů.
Heterogenní změny kostní morfologie doprovázející chronické selhání ledvinných funkcí jsou souhrnně označovány jako renální kostní choroba, či renální osteodystrofie a pro pacienta představují zvýšené riziko fraktur, vznik kostních bolestí a v dětství poruchy růstu. V současné době je na renální kostní nemoc pohlíženo jako na součást systémového metabolického onemocnění nazývaného „minerálová a kostní porucha při chronickém onemocnění ledvin .
Renální osteopatie, CKD-MBD – Chronic kidney diseases-Mineral and bone disorder
Klíčovou roli v rozvoji a progresi renální kostní choroby hraje sekundární hyperparathyreóza.
Protrahované hypokalcemie, hyperfosfatemie a deficit kalcitriolu vedou přes snížení aktivace CaSR (calcium senzing receptor a VDR ( jaderný receptor pro vitamin D) v příštítných tělíscích ke zvýšené produkci parathormonu (PTH).
PTH přes zvýšení fosfaturie, stimulaci produkce alfa- hydroxylázy ( enzym konvertující kalcidiol na kalcitriol) a zvýšením kostního obratu ( uvolnění kalcia a fosforu ze skeletu) pomáhá udržet sérové hladiny kalcia a fosforu.
Dlouhodobá hypostimulace CaSR a VDR vede ke klonální proliferaci buněk příštítných tělísek a vzniku nodulární hyperplazie s rizikem vývoje adenomu při monoklonální expanzi ( terciární hyperparathyreóza) a excesivní produkci PTH.
V této fázi je již sekrece parathormonu díky snížené expresi CaSR a VDR do značné míry autonomní a obtížně farmakologicky ovlivnitelná a je nutno přistoupit k paratyreoidektomii.
Velmi nízká hodnota PTH je také nepříznivá. Pro zajištění normálního kostního obratu u dialyzovaných nemocných je kvůli rezistenci skeletu na PTH (důsledek hyperfosfatemie, metabolické acidózy, uremických toxinů) zapotřebí cca 2 -9 násobně vyšší hladina PTH. Suprese produkce PTH buď nadměrnou farmakoterapií nebo v důsledku paratyreoidektomie může vést ke vzniku adynamické kostní choroby při které je nízký kostní obrat a kost je místy zcela acelulární („mrtvá kost„). Takto poškozený skelet je vysoce fragilní. Nízkoobratová osteodystrofie je spojena s hyperkalcemií hyperfosfatemií a zvýšenou tvorbou vaskulárních kalcifikací.
Protrahované působení metabolické acidózy na skelet jako nárazníkový systém je také nepříznivé.
Výsledkem je úbytek kostního minerálu cestou disoluce a uvolňování iontů kalcia a fosforu ze struktury hydroxyapatitu a uhličitanu vápenatého, tak i stimulováním osteoklastů. Naopak, činnost osteoblastů je tlumena. Acidóza a PTH mají při demineralizaci skeletu synergický účinek. Za CHRI může být acidózou navíc potlačena ještě více aktivita 1- alfa- hydroxylázy buď přímým vlivem, nebo zvýšením frakce ionizovaného kalcia.
Souhrn patofyziologických faktorů CKD-MBD
1. Snížené vylučování fosforu ledvinami v důsledku poklesu GF, výsledkem je hyperfosfatémie, která
- Inhibuje 1 alfa- hydroxylázu a snižuje tvorbu kalcitriolu
- Má přímý stimulační vliv na buňky příštítných tělísek
- Blokuje inhibiční vliv kalcitriolu na buňky příštítných tělísek
FGF -23 ( fibroblast growth factor-23) je nová molekula, která se účastní komplexní minerálové poruchy u CHSL a je zodpovědná za důsledky hyperfosfatémie:
- Je tvořen kostními buňkami při vzestupu fosfatémie
- Zvyšuje vylučování fosforu ledvinami a snižuje syntézu kalcitriolu
- Je zodpovědný za snížení kalcitriolu při poklesu funkce ledvin
- U HD dialyzovaných pacientů jsou koncentrace FGF–23 velmi vysoké
- FGF–23 může být významným vyvolavatelem sekundární hyperparathyreózy.
2. Snížená hydroxylace 25-hydroxydiolu kalcitriolu v buňkách proximálního tubulu ledvin vede k nedostatku kalcitriolu, důsledky tohoto nedostatku jsou:
- Nedostatečné vstřebávání kalcia ze zažívacího traktu vede k hypokalcémii, která nepřímo zvyšuje sekreci PTH
- Na receptory pro kalcitonin (VDR) v příštítných tělíscích se váže méně kalcitriolu, což vede k oslabení inhibice transkripce genu pro PTH a k přímému zvýšení sekrece PTH.
- Koncentrace ionizovaného kalcia v séru potřebná k potlačení sekrece PTH o 50 % (tzv. „set point“) je posunuta do vyšších hodnot.
3. CHSL navozuje rezistenci skeletu na působení PTH. Proto jsou koncentrace PTH v séru vyšší než u zdravé populace ( norma u zdravých je je 65 pg/ ml), u nemocných v PDL jsou považovány za „normální“ hodnoty až do 200 pg/ml. U nemocných s pokročilými formami sekundární hyperparathyreózy se snižuje počet VDR v buňkách příštítných tělísek. Kalcitriol proto není schopen suprimovat tvorbu PTH a léčba aktivními formami vitamínu D vede k hyperfosfatémii, hyperkalcémii a ke vzniku extraoseálních kalcifikací. Předpokladem úspěšné terapie aktivními metabolity vitaminu D je úprava hyperfosfatémie a normalizace kalcémie. Dlouhodobá stimulace příštítných tělísek vede k jejich nodulární hyperplazii.
Současný přehled základních forem renální osteopatie
- Fibrózní osteodystrofie
- Osteomalacie ( deficit kalcitriolu)
- Mírná forma renální osteodystrofie
- Smíšená forma (kombinace fibrózní osteodystrofie a osteomalacie, až 8o% dialyzovaných pacientů)
- Adynamická forma kostní nemoci (postihuje starší nemocné, diabetiky,PD,nemocné po paratyreoidektomii, nebo je důsledkem iatrogenně navozené hypoparathyreózy, může být také způsobena předávkováním vazačů obsahujících kalcin, předávkováním D a vysokým obsahem kalcia v dialyzátu.
Přesný typ renální kostní choroby lze spolehlivě stanovit pouze biopsií.
Klinické projevy MBD-CKD :
- Nejdříve asymptomatické
- Bolesti kostí, spontánní fraktury, pruritus, svalová slabost (stehenní svaly), zhoršení pohyblivosti
- Extraoseální kalcifikace – ve stěnách cév, periartikulárně, v kůži, podkoží, spojivky, rohovka, (sy červených očí), viscerální kalcifikace (chlopně, plíce, atd.), chondrokalcinóza.
Hliníková osteopatie: je druh vitamin D-rezistentní osteomalacie renální osteopatie, který se vyvíjí na podkladě nízkého kostního obratu a je charakterizován nadbytkem nemineralizovaného osteomu. Příčinou akumulace hliníku v kostech a v dalších tkáních (např. plicích, mozku, játrech) je zásadní omezení hlavní cesty jeho vylučování – renální exkrece. Existují také rizika jeho neadekvátního příjmu i zvýšené střevní resorpce.
Nahromaděný hliník způsobuje:
- Poruchu mineralizace osteomu na povrchu kostních trámců
- Vznik depozit hliníku v cytoplasmě makrofágů nejasného významu
- Předpokládá se přímé působení iontů hliníku na sekreci PTH
- Hliník také poškozuje metabolismus železa – vytěsňuje železo na transferinu.
Vznik extraoseálních kalcifikací (vaskulární kalcifikace, kalcifikace měkkých tkání )
Významné snížení renálních funkcí při CKD 3-5 vede k neschopnosti ledvin vyloučit adekvátní množství fosfátů do moči, poruše konverze vitaminu 25 (OH) D (kalcidiol) na účinnou formu 1,25(OH)2D3 ( kalcitriol) v ledvinách a tím snížení intestinální absorpce kalcia. Kombinace hypokalcemie, hyperfosfatemie a deficitu vitaminu D nastartuje kaskádu změn v tvorbě řady regulačních hormonů ( parathormon, fibroblast growth factor -23, růstový hormon). Tyto mechanismy jsou do určité míry adaptivní a pomáhají znovu nastolit porušenou rovnováhu, není-li však včas zahájena adekvátní terapie, dochází k poškození nejen skeletu, ale i cév a měkkých tkání.
Vaskulární kalcifikace jako nejzávažnější komplikace CKD –MBD nejsou pouze pasivním ukládáním kalcium fosfátu do stěny cév, ale aktivním dějem při kterém se uplatňuje řada endokrinních látek produkovaných osteoklasty a osteoblasty ( osteopontin, osteoprotegerin ( OPG), systém ligand aktivátoru receptoru NF k-B ( RANK). Většina systémových i lokálních inhibitorů kalcifikací ( fetuin – A , osteoprotegerin, pyrofosfáty) dosahuje v přítomnosti urémie nižších sérových koncentrací proti zdravé populaci.
Dalším z důsledků hyperfosfatemie je stimulace tvorby látky ze skupiny fosfatoninů, nazývané fibroblast growth factor – (FGF – 23), která je produkována osteoklasty, zvyšuje fosfaturii, potlačuje tvorbu alfa- hydroxylázy v ledvinách a vede tak k prohloubení deficitu kalcitriolu s negativním dopadem na progresi sekundární hyperparathyreózy.
Fetuin A
- Je negativní protein akutní fáze
- Je syntezován v játrech
- Je systémový inhibitor tvorby patologických mimokostních kalcifikací
- Nízká koncentrace fetuinu A u CHSL jsou spojeny se zánětem a malnutricí
- Nízké koncentrace fetuinu A u HD pacientů signifikantně zvyšuje kardiovaskulární mortalitu
Metabolismus stopových prvků a vitaminů při CHRI
CHSL je často spojena s poruchou metabolismu stopových prvků, zejména zinku, mědi,selenu, chrómu. Dříve byla známa intoxikace hliníkem,který byl používán jako vazač fosfátů ve střevě.
Ledvinná onemocnění, především pak renální insuficience jsou spojeny také se změnami v metabolismu některých vitaminů. Může se jednat jak o hypovitaminózy, tak o hypervitaminózy relativní nebo absolutní.
Na snížení hladin vitaminů se podílejí:
- snížený příjem vitaminů v potravě při nechutenství, zvracení, poruchách resorpce či nevhodném typu diety vzhledem k renálnímu postižení
- ztráty vitaminů do dialyzačního roztoku
- ztráty vazebných bílkovin, např. při nefrotickém syndromu
- interference s některými léky při absorpci a metabolismu vitaminů
Na zvýšení hladiny vitaminů se podílejí:
- poruchy metabolické degradace vitaminů v ledvinách
- patologické zvýšení hladiny vazebných proteinů
- léková interference při metabolické degradaci
V souvislosti se selháváním ledvin je nejvíce známo o vitaminu D (viz dříve) a pak o vitaminu A (ledviny hrají klíčovou roli v metabolismu retinolů (jeho hladina při renální insuficienci stoupá) a to jak při jeho katabolismu RPB (retinol vázající protein), jaterního uvolňování retinolu a syntézy kyseliny retinové,vitamin E je známý svým antioxidačním účinkem . Při chronickém selhání ledvin se zpravidla snižuje hladina vitaminu C, je nutno jej dodávat.
O dalších speciálních projevech nedostatku nebo přebytku ostatních vitaminů při selhávání ledvin,( kromě důsledků poruchy jejich specifického místa v metabolismu všech tkání) není více známo.
Vztah systémové hypertenze a postižení ledvin
Vztah mezi krevním tlakem a ledvinami je vzájemný: ledviny se uplatňují v patogenezi esenciální hypertenze, naopak hypertenze je velmi častým důsledkem vrozených či získaných onemocnění ledvin.
Arteriální hypertenze bez rozdílu etiologie může vést k následnému poškození ledvin rozvojem nefroangiosklerózy nebo aterosklerózy arteriálních tepen. Hypertenze je také důležitým faktorem renálního rizika- urychluje progresi chronických onemocnění ledvin (CHRI).
Takže z tohoto vztahu vyplývá také to, že ledviny ve vztahu k hypertenzi mohou vystupovat někdy v roli viníka, někdy zase oběti. Navíc hypertenze provázející CHRI zvyšuje míru kardiovaskulárního (KV) rizika.
Onemocnění ledvin jsou spolu s primárním aldosteronismem nejčastějšími příčinami sekundární hypertenze. Prevalence renální hypertenze je 5-6% . Častěji jde o prvotní postižení tkáně ledvin – renální parenchymatózní hypertenzi – než o postižení tepenného řečiště ledvin – renovaskulární hypertenzi.
Výskyt renální parenchymatózní hypertenze
Hypertenze provází akutní i chronická, vrozená nebo získaná, oboustranná i jednostranná onemocnění ledvin.. Její přítomnost a tíže závisí na věku nemocných, tělesné hmotnosti, typu a trvání ledvinného onemocnění a závažnosti poruchy renální funkce podle stadií I -V poslední klasifikace chronických postižení ledvin. Při oboustranném postižení ledvin se hypertenze nejčastěji nachází u primárních a sekundárních glomerulárních onemocnění, z neglomerulárních je nejvíce zastoupená u autozomálně dominantního polycystického onemocnění ledvin. Hypertenze se také vyskytuje u řady vrozených a získaných, zánětlivých či nádorových jednostranných onemocnění ledvin.
Renoparenchymatózní hypertenze se podílí na 60-80 sekundárních hypertenzí u dětí a dospívajících: je na prvním místě výskytu u dětí od narození do 10 let věku, od 11 do 18 roků již převažuje esenciální hypertenze a renální příčiny jsou na druhém místě.
Hypertenze je přítomná přibližně u 80-86% dospělých pacientů s CHRI.
U onemocnění ledvin bez závažnější prevalence hypertenze dosahuje 60%. Je přítomná u 80-90% pacientů konzervativně léčených pro chronické selhání ledvin, u 50-85% léčených hemodialýzou, u 30% léčených peritoneální dialýzou a u 60-80% příjemnců transplantované ledviny.
Patogeneze renální parenchymatózní hypertenze
U jednotlivých ledvinných onemocnění jsou mechanismy zodpovědné za vznik a udržování hypertenze rozdílné. U oboustranných postižení ledvin se uplatňuje zadržování sodíku a vody s následným nárůstem plazmatického objemu a srdečního výdeje. Současně nebo následně se na udržování hypertenze podílí nerovnováha v působení vazoaktivních působků- na jedné straně aktivace/ nedostatečná suprese vazokonstrikčních systémů (renin-angiotenzin-aldosteron, sympatiku-katecholaminy, AT-II, ADH,endotelin, tromboxan) a na straně druhé snížená tvorba látek s vazodilatačním účinkem (NO, prostaglandiny), bradykinin, adenosin,natriuretické peptidy). Zvýšená hladina cirkulujícího ouabainu podobného faktoru ( inhibitor Na+, K+- ATPázy) může zvětšením koncentrace intracelulární koncentrace sodíku a vápníku ovlivnit funkci svalových buněk cévní stěny a přispět ke zvýšení periferní cévní rezistence.
U jednostranných renálních onemocnění má důležitou roli aktivace renin-angiotenzinového systému.Nejčastěji k ní dochází z důvodů ischémie- jizvení u zánětlivých chorob, z objemově i lokálně rostoucích procesů – nádory, solitární cysty) nebo dilatace pánvičky u hydronefrózy.
Jednoznačné odlišení volumové hypertenze od reninové je obtížné, ve většině případů se oba mechanismy protínají. S poklesem filtrační funkce ledvin a rozvojem renální insuficience či selhání ledvin podíl retence sodíku a vody na udržování hypertenze stoupá.
Častá sekundární hyperparathyreóza provázená vzestupem intracelulární koncentrace vápníku se spolupodílí na zvýšení periferní cévní rezistence. K hypertenzi ( zhoršení její kontroly) přispívá léčba renální anémie lidským rekombinačním erytropoetinem. Při systolické hypertenzi se uplatňují kalcifikace, snížená elasticita velkých tepen a také často přítomná hyperkinetická cirkulace při anémii a arteriovenózní anastomóze pro cévní přístup při hemodialýze.
Příčiny renální parenchymatózní hypertenze
Akutní renální onemocnění. Akutní postinfekční glomerulonefritidy – přechodná hypertenze se vyskytuje až u 80% pacientů. Ke zvýšení krevního tlaku dochází zvětšením objemu extracelulární tekutiny při retenci sodíku a vody. Současně je přítomná suprese systému renin-angiotenzin a zvýšená plazmatická koncentrace axiálního natriuretického faktoru. Krevní tlak se zvyšuje v návaznosti na přítomnost otoků a pokles diurézy. Většinou nejde o závažnou hypertenzi. Akutní obstrukce močových cest – hypertenzi může vyvolat obstrukce jak močovodu, tak i močové trubice. Uplatňuje se aktivace systému renin – angiotenzin. Hypertenze je mírného stupně a upravuje se po obnovení průchodnosti močových cest. Léčba nefrolitiázy litotrypsí – po extrakorporální litotrypsi dochází ke zvýšení krevního tlaku, které může až u 30% léčených přetrvávat až několik měsíců. Hypertenze je způsobena reninovým mechanismem při mikrotraumatizaci tepenného systému ledviny. Akutní selhání ledvin – až 40% nemocných s akutním oligoanurickým selháním ledvin má hypertenzi. U tří čtvrtin jde o důsledek onemocnění ledvinných cév a glomerulů a jen v 15% je důsledkem tubulointersticiálního postižení. Možné jsou i iatrogenní příčiny – léčba inhibitory ACE u osob s oboustrannou stenózou ledvinné tepny či okluze renálních tepen cholesterolovou embolizací po intervenčních radiologických nebo chirurgických výkonech.
Chronická onemocnění ledvin. Glomerulonefritidy. Hypertenze provází primárně i sekundárně vzniklá onemocnění glomerulů v rozmezí od 20 – 90%, tíže odpovídá biopsii. Vyskytuje se až u 50% dospělých jedinců s celosvětově nejčastější primární glomerulonefritidou – IgA nefropatií (Bergerovou chorobou) a u 70 – 80% nemocných s membranoproliferativní glomerulonefritidou nebo fokální a segmentální glomerulosklerózou. Mezi sekundárními glomerulopatiemi je nejčastější diabetická glomeruloskleróza, kde je hypertenze přítomná již ve stadiu mikroalbuminurie a její výskyt dále stoupá s rozvojem manifestní proteinurie k 80% u diabetiků 2. typu. U hemolyticko-uremického syndromu, renálních vaskulitid a u renální sklerodermie je hypertenze provázena aktivací systému renin-angiotenzin. U lupusové nefritidy s fokálními a difúzními proliferativními změnami jde o volumový typ hypertenze. Chronické tubulointersticiální nefritidy (TIN) – v časném stadiu je hypertenze méně častá (cca 30%), protože porucha koncentrační schopnosti, typická pro postižení dřeně ledvin, vede ke zvýšeným ztrátám sodíku močí a omezuje nárůst plazmatického natria. Výskyt hypertenze stoupá s dalším vývojem nemoci a současným poklesem filtrační funkce ledvin. Autosomálně dominantní polycystické onemocnění ledvin – zvýšení krevního tlaku bývá nejčasnějším projevem onemocnění, projevuje se ještě dříve než nastanou změny ve filtrační schopnosti ledvin a v době ledvinné nedostatečnosti se hypertenze projeví ve l00% případů onemocnění. Hypertenze se nejčastěji vyskytuje u jednostranného zmenšení ledviny na podkladě chronické pyelonefritidy a refluxové nefropatie. Může také provázet hydronefrózu, úraz ledviny, radiační nefritidu, tuberkulózní postižení nebo velkou solitární renální cystu. Ve 100% bývá přítomná u vzácného tumoru z juxtaglomerulárních buněk – hemangiopericytomu (reninomu, u 50% dětí postižených neuroblastomem (Wilmsův tumor) a u části pacientů trpících karcinomem ledviny.
Vztahy jater a ledvin při renálních, hepatálních a hepatorenálních chorobách
Ledviny a játra jsou metabolicky nejaktivnější solidní orgány. Hrají významnou roli v intermediárním metabolismu, udržování vodní a minerálové homeostázy, produkují pro organismus řadu nepostradatelných látek. Jsou hlavním místem detoxikace a eliminace látek organismu cizích a exkrece odpadních produktů. Citlivě reagují na změny v ostatních systémech a vzájemně se ovlivňují.
Onemocnění ledvin a jater lze rozdělit do tří základních skupin:
- Onemocnění postihující současně játra a ledviny
- Postižení ledvin při selhání jater
- Postižení jater při selhání ledvin
Ad 1) Onemocnění postihující současně játra i ledviny
a) Významná je polycystóza jater a ledvin. Postižení ledvin je závažnější a je třetí nejčastější příčinou selhání ledvin. Cysty v játrech jsou většinou bez příznaků, tlak na okolí vytvářejí jen velké cysty a pak se projeví jako obstrukční ileus, nebo portální hypertenze, ascites. Obávanou komplikací je infekce cyst.
b) Wilsonova choroba. Není častá, ale je pozdě diagnostikovatelná (hepatolentikulární degenerace). Podstatou je geneticky podmíněná porucha vylučování mědi do žluči, což vede k akumulaci mědi v játrech, mozku a dalších tkáních včetně ledvin.
Nejčastěji se projevuje neurologickými poruchami (třes, porucha řeči, hyperkinézy, porucha hybnosti, vegetativní příznaky – slinění, pocení, akrocyanóza, Kayser-Fleischerův prstenec, nízká hladina ceruloplazminu.
U dětí je častější jaterní forma Wilsonovy choroby, která probíhá pod akutním obrazem akutní hepatitidy často s fulminantním průběhem.
c) Dalším vrozeným onemocněním s postižením jater a ledvin je cystická fibróza: je abnormální obsah sodíku, chloridů, vápníku v tělesných sekretech – což vede ke změně viskozity hlenu. Klinicky je poškození exokrinních žláz zejména v dýchacích cestách a GIT.
d) Deficit alfa-1-antitrypsinu: jde o vrozené snížení alfa-1–antitrypsinu v plazmě. Při tomto deficitu dominuje emfyzém plic a postižení jater (hepatitis, cirhóza, glomerulonefritida).
d) Další vrozené metabolické choroby–tyrozinemie 1. typu, cystinóza, glykogenózy, galaktosemie, vrozená intolerance fruktózy, dalších AMK, lipoproteinů apod., jsou většinou vzácná onemocnění, projevují se v dětském věku.
e) Infekce: současné onemocnění jater a ledvin vyvolávají leptospirózy (žňová – blaťácká horečka, Weilova choroba), játra i ledviny jsou často postiženy u infekční mononukleózy, infekce HIV, legionelová infekce, malárie, schistosomóza, dále hepatitidy. Postižení ledvin při infekcích není vyvoláno přímo infekčním agens, hlavní roli hraje imunitní odpověď.
e) Otravy houbami (muchomůrka zelená,) léky – paracetamol a další – např. tetrachlormetan, toluen, trichloretylen.
f) Postižení jater a ledvin v těhotenství: idiopatická akutní steatóza, preeklampsie, eklampsie, hemolyticko-uremický syndrom po porodu.
g) Postižení jater a ledvin je také součástí smíšené esenciální kryoglobulinémie, Sjögrenova sy, sarkoidózy, amyloidózy.
h) Postižení jater a ledvin u oběhového selhání: stavy s hypoxémií – ledviny jsou na hypoxii citlivější než játra – v ledvinách může rychle vzniknout i tubulární nekróza, hypoxie v játrech k nekróze nevede.
Těžké poruchy ledvin a jater nastávají v rámci syndromu MODS a MOF u kriticky nemocných (polytraumata, popáleniny, sepse, těžké operace).
Ad 2: Postižení ledvin při selhání jater
Postižení ledvin je často prokazovanou komplikací při jaterní cirhóze: retence sodíku – ascites. Převažujícím mechanismem retence je zvýšená tubulární reabsorpce sodíku – důsledkem je snížené vylučování vody.
Jaterní encefalopatie bývá často spojena s diluční hyponatrémií a hypoosmolaritou séra. Při současném zvýšení sérových koncentrací kreatininu a močoviny jde o funkční selhání ledvin,jehož extrémní formou je hepatorenální syndrom.
U jaterních chorob mohou být postiženy ledviny při léčení cirhotiků s ascitem diuretiky, akutní tubulární nekróza vzniká také při obstrukčním ikteru, renální tubulární acidóze.
Hepatorenální syndrom
Je život ohrožující stav, který je spojen se selháním ledvin u pacientů s poškozením jaterní tkáně. Samotné ledviny jsou původně zdravé. Existují 2 typy hepatorenálního syndromu.
- typ – u pacientů dochází ke zhoršování renálních parametrů s rychlým vzestupem kreatininu nad 220 μmol/litr. Má špatnou prognózu.
- typ – u pacientů došlo ke zhoršení renálních funkcí, ale stav dále neprogreduje do akutního selhání. Na principu selhání se podílejí zejména regulační humorální působky uvolňované při selhávání jaterní tkáně. Dochází k překrvení splanchniku a centrální arteriální hypovolemii, což je následováno aktivací systému renin-angiotenzin-aldosteron (RAAS) a adrenergního systému. To vede k vazokonstrikci ledvinových arteriol. Postupně nastane nepoměr tvorby vazokonstrikčních a vazodilatačních působků v ledvinové tkáni a výsledkem je zhoršení prokrvení ledvinných tkání a jejich selhávání.
Projevy: dochází k nárůstu parametrů poškození jater, vzrůstá hladina dusíkatých zplodin, což vede ke zhoršení projevů odpovídajících příznaků jaterní encefalopatie. Organismus retinuje sodík, obvykle je ascites. Únava, letargie, koma, smrt.
Ad 3) Postižení jater při chorobách ledvin
Postižení jater při primárním renálním onemocnění je u polékového poškození jater a vzácnější nefrogenní syndrom z jaterní dysfunkce popsaný u pacientů s tumorem ledviny.
Kardiovaskulární postižení při CHRI
Kardiovaskulární komplikace se podílejí na více než 50% úmrtí u nemocných s CHRI. Problém se zvýrazňuje při rozvoji a délce renální insuficience, dialyzačním léčení a následné transplantaci.
Koronární skleróza je u 1/3 nemocných v dialyzačním programu, na IM umírá 10% nemocných. Vysoký je i výskyt kardiovaskulárních komplikací po transplantaci ( 25% úmrtí s ledvinným štěpem).
Významný je i výskyt hypertrofické a dilatační kardiomyopatie. Uplatňují se zde jak hemodynamické tak metabolicko –uremické faktory:
Hemodynamické faktory: hypertenze,retence tekutin, renální anemie a-v píštěle, získané srdeční chlopenní vady.
Metabolicko-uremické faktory (nehemodynamické): ischemická choroba srdeční, diabetická kardiomyopatie, zvýšený přísun železa, dysfunkce sympatického vegetativního systému, hypokalcemie, myokardiální kalcifikace, zvýšená hladina PTH, metabolická acidóza, zvýšený přísun hliníku, beta 2 mikroglobulinová depozita, deficience thiaminu, deficience karnitinu.
Hypertrofie levé komory a její porušená funkce
Hypertrofická kardiomyopatie je nejčastější srdeční poruchou u nemocných se selháním funkce ledvin s prevalencí 30-80%.
Dilatace levé komory je často spojena s hyperhydrarací, hemodynamicky významnou a-v píštělí a anémií.
Rizikovým faktorem pro rozvoj hypertrofie levé komory u CHRI je hypertenze. Je ale také vztah mezi tíží renální anémie a hypertrofií levé komory nezávisle na krevním tlaku.
Chronická hyperhydratace zvyšuje plnicí tlaky a žilní návrat a tak výrazně ovlivňuje dilataci srdeční. K hypertrofii a dilataci může vést i a-v píštěl vysokým průtokem.
Arterioskleróza a ischemická choroba srdeční: nemocní s CHRI jsou náchylní k arterioskleróze, neboť i výskyt rizikových faktorů je u nich vysoký: arteriální hypertenze, hyperlipoproteinémie, diabetes mellitus, porucha glycidové tolerance, hyperurikemie a stres.
Perikarditida: dialýza zlepšila prognózu nemocných s perikarditidou, často se sdružuje s vysokými hladinami kyseliny močové.
Gastroenterologické potíže při chronickém onemocnění ledvin
Ty mohou být způsobeny:
- Jiným základním onemocněním, které vedlo k postižení ledvin (gastroparéza při diabetes mellitus, cysty v játrech či pankreatu při polycystické chorobě)
- Iatrogenním postižením medikamentózní terapií – kolitida po antibioticích, vředové slizniční léze při léčbě kortikoidy
- Nejčastější je gastrointestinální postižení tam, kde je ledvinné onemocnění per se.
Gastroenterologické komplikace u nemocných s chronickou renální insuficiencí se vyskytují často a jsou spojeny s vysokou morbiditou a mortalitou ( v období před dialýzou byly GIT komplikace asi u 50 % všech nemocných s CHRI, anorexie, průjmy, uremický foetor, slizniční ulcerace a krvácení do GIT dominovaly v terminální fázi CHRI.).
Podle jednotlivých úseků gastrointestinálního traktu lze dominantní nálezy rozdělit na:
Postižení žaludku a duodena při CHRI
Jsou z těch, které jsou odlišné v období před existencí dialýzy a nyní, kdy dialýza se terapeuticky uplatňuje. Nejdůležitější morfologické změny: gastritida, duodenitida, peptické léze, při hyperparatyreóze jsou heterotopické kalcifikace v žaludeční sliznci. Dále jsou poruchy motility: zpomalení vyprazdňování žaludku (i u nediabetiků), oslabení kontrakcí, nebo špatná koordinace kontrakcí antra a duodena. Patogenetické příčiny: poruchy elektrolytů, změny hladin GI hormonů, dysfunkce autonomního nervstva. Žaludeční sekrece: hypacidita (příčinou je uremická gastritida? Nebo zvýšení obsahu amoniaku ?). Peptické léze gastroduodenální nejsou častější než u ostatní populace, avšak větší riziko krvácení. Krvácení do horních partií GIT je nejzávažnější komplikace při CHRI, příčinou jsou peptické léze, gastritida duodenitida.
Postižení tenkého střeva při CHRI
Tenké střevo: edém stěny, dilatace střevních kliček, lokalizovaná či difúzní infiltrace stěny , zkrácení střevních klků. Důsledkem jsou tyto funkční změny: Porušená resorpce tuků. Snížená aktivní resorpce vápníku v duodenu (deficit vit D). Snížený příjem proteinů, pokles aktivity střevních disacharáz a dipeptidáz (není přímá návaznost na uremický syndrom). Snížení primárních žlučových kyselin – průjmy. Změna bakteriální flóry. Malabsorpční syndrom (steatorea, průjmy, objemné stolice).
Postižení tlusté střevo při CHRI
Vředové léze a pseudomembranózní kolitidy (působení urémie per se). Zvýšená sekrece kalia ( při snížení sekrece kalia ledvinami). Divertikulóza tračníku – až zánět. Ulcerace solitární i mnohočetné, angiodysplázie až spontánní perforace (fekalomy, bezoáry). Ischémie kolon – časté těžké hypotenze. Zvýšený výskyt střevních lymfomů. Krvácení je komplikací všech uvedených lézí
Pankretatické a biliární kompplikace při CHRI
Riziko akutní pankreatitidy je u CHRI několikanásobně vyšší než v ostatní populaci, mortalita je vysoká.
Diagnóza pankreatitidy je obtížná, protože u CHRI jsou zvýšené hladiny sérových amyláz běžné, jako důsledek snížené renální clearance enzymu.
Souvislost selhání ledvin s cholelithiázou není přesně známá.
Poškození nervového systému při CHRI
Souvisí s retencí a porušenou metabolickou degradací řady katabolitů při CHRI. Významnou roli má i PTH..
Poškození mozku má funkční charakter – je reverzibilní. Je uremická encefalopatie, pseudoneurasthenický syndrom, různý stupeň poruchy vědomí. Mohou však být i generalizované křeče, nebo fokální epileptický záchvat. Jsou časté cerebrovaskulární komplikace.
Poškození periferních nervů: jsou strukturální změny – tzv. uremická polyneuropatie – velmi pomalu se upravuje. U nemocných s pozdním začátkem dialýzy může vzniknout až syndrom periferní obrny v oblasti motorické, senzitivní i senzorické. Parestézie končetin, křeče, syndrom neklidných nohou.
Poruchy hormonálních funkcí při CHRI
Endokrinní funkce u nemocných v CHRI mohou být porušeny v důsledku nedostatečné koncentrace cirkulujících hormonů, nebo v důsledku poruchy účinku hormonů na cílovou tkáň. Ledviny jsou místem katabolismu řady polypeptidických hormonů, které se při CHRI kumulují.
Patofyziologické mechanismy hormonálních poruch při CHRI:
- Zvýšená hladina hormonů či hormonálních fragmentů. Porušená degradace hormonů může být renální ( inzulin, proinzulin, glukagon, PTH , kalcitonin) a extrarenální ( inzulin, PTH). Zvýšená sekrece: jako odpověď na homeostatický signál (LH, PTH) nebo odpověď bez zjevné homeostatické signalizace (PRL)
- Snížená hladina hormonů (erytropoetin, 1,25(OH)2-D3) nebo redukovaná produkce extrarenálních hormonů (testosteron, estradiol).
- Poruchy účinku hormonů: Může být porušena aktivace prohormonů (IGFI,T3/T4), mohou se vyskytovat izoformy hormonů s nízkou biologickou aktivitou (LH), může být porušena vazba hormonů a vazebných proteinů v plazmě (somatomediny), může také jít o porušenou tkáňovou citlivost a to jak na receptorové, tak i na postreceptorové úrovni může dojít na ke snížení hustoty receptorů, změně inhibitorů receptorů.
Endokrinní žlázy, které jsou nejvíce postiženy jsou:
Štítná žláza: (zvýšení plazmatického jodu – nevylučuje se, snižuje se celkový T4 a T3 – jejich hladina závisí také na na metabolicko-nutričním stavu, množství globulinů a albuminů. TSH je normální.
Růstový hormon: STH je zvýšen, koreluje se zvýšenou hladinou kreatininu, stimuluje somatomediny (inzulin-like růstový faktor IGF I a II).
Pohlavní hormony: Abnormality ve funkci gonád se vyvíjejí časně v průběhu CHRI a prohlubují se s její progresí. Je asi defekt na úrovni hypotalamu i na cílových gonádách. Testosteron klesá, zvyšuje se FSH, LH a prolaktin. Porucha potence , fertility a sexuálních funkcí.
Endogenní opioidy: Slouží také jako neurotransmitery v CNS a regulují sekreci klíčových hormonů: gonadotropinů, prolaktinu, inzulinu, glukagonu a TSH. Beta-endorfin bývá v CHRI zvýšený (současně je hyperglukagonemie, glukózová intolerance, sekundární hyperparathyreóza). Ovlivňuje TK i průtok krve – vliv na GF.
GIT hormony: Řada GIT hormonů (gastrin, cholecystokinin, pepsinogen, amylázy apod.) jsou u nemocných s CHRI zvýšeny (snížená degradace, zvýšená produkce). Ve vztahu k orgánovým komplikacím a změnám metabolismu při chronických nefropatiích je stále pečlivěji sledovaná (i ve vztahu k dialyzačním metodám)
Uremické toxiny a retinované molekuly
Klasifikaci přibližně 90 rozpoznaných organických molekul, které se při selhání ledvin retinují a mohou mít toxické a klinické důsledky navrhla pracovní skupina EUTOX. Z 90 organických molekul má 68 sice malou molekulovou hmotnost (do 500 daltonů), avšak jen část je dialyzabilní (ostatní jsou vázané na bílkoviny tj. vzhledem k velikosti proteinů na které jsou navázány nemohou přejít přes polopropustnou dialyzační membránu. Dvanáct největších sloučenin má molekulovou hmotnost vyšší než 12 tisíc daltonů (vysokomolekulární toxiny např. leptin), ostatní jsou střední molekuly. Dvacet látek má koncentraci při selhání ledvin oproti fyziologické koncentraci až 15 a vícenásobně zvýšenou např. indoxylsulfát (88x vyšší).
EUTOX klasifikace uremických toxinů a retinovaných molekul
Klasifikace rozlišuje 2 termíny: uremické toxiny a retinované molekuly. Uremické toxiny jsou jen ty, u kterých byla demonstrována přímá toxicita. I když pro řadu látek není zatím prokázána přímo nějaká konkrétní biologická toxicita, je nutné připustit, že právě komplex takto retinovaných molekul či toxinů je ve svém celku zodpovědný za často obecně označovanou „uremickou toxicitu“ a že tzv. retinované molekuly nemůžeme považovat za bezpečné.
Malé molekuly: asymetrický dimetylarginin, kreatin, kreatinin, dimetylglycin, guanidin, kyselina guanidinojantarová, hypoxantin, malonaldehyd, oxalát, močovina, kyselina močová, xantin aj.
Látky se známou nebo předpokládanou vazbou na bílkoviny: Glyoxal, kyselina hippurová, homocystein, indoxylsulfát, leptin, p-kresol, putrescin, protein vážící retinol.
Středně velké či velké molekuly: Adrenomedulin, beta2-mikroglobulin, beta-endorfin, komplementový faktor D, cystatin C, DIP (protein inhibující degranulaci neutrofilů), kyselina hyaluronová, neuropeptid Y aj.
Nespecifická uremická toxicita se dává do souvislosti např. s anorexií, s polyneuropatií, s imunodeficitem, s celkovým neprospíváním („wasting syndrom“).
K látkám s nejvyšším rozdílem fyziologické a patologické koncentrace patří např. kyselina guanidinojantarová, beta2-mikroglobulin, interleukin (zánětlivý cytosin či pentosidin (spadající do třídy AGE molekul).
Vybrané retinované molekuly či uremické toxiny
Beta2–mikroglobulin: 11 000 daltonů, je filtrován glomerulem, katabolizován buňkami proximálního tubulu, při CHRI se zvyšuje 10x. Zodpovědný za dialyzační amyloidózu – zejména jeho modifikovaná forma. Zdokonalení dialýzy snížilo toto riziko, dnes slouží jako marker uremické toxicity.
Leptin: hormon 16 000 daltonů, produkován v adipocytech, u CHRI je zvýšený poměr leptin/tělesný tuk, je zvýšení i v plazmě. Souvisí asi s anorexií (reguluje pocit sytosti, snižuje příjem potravy, spolu s grelinem se podílí na regulaci chuti. Ovlivňuje energetický výdej, imunitní a endokrinní funkce.
Indol a indoxylsulfát: Vzniká v trávicím ústrojí (metabolit tryptofanu) činností střevních baktérií, v játrech se mění na indoxylsulfát. Selhání ledvin vede ke změně střevní mikroflóry,tudíž produkce obou látek se zvyšuje. Indoxysulfát je látka přímo toxická již ve stadiu iniciálních chronických nefropatií (podněcuje renální fibrotizaci, která je zodpovědná za renální progresi nefropatií). Indoxylsulfát je nefrotoxický ( akcelerace glomerulární sklerózy).
Guanidiny: Skupina nízkomolekulárních látek (kreatinin, metylguanidin, guanidin a kyselina guanidinojantarová). Koncentrace těchto látek se při CHRI několikanásobně zvyšuje. U některých není přímá významná toxicita (kreatinin), naopak nově se ukazuje, že ADMA (asymetrický dimetylarginin může významně poškozovat endotel a přispívat k hypertenzi pacientů se selháním ledvin.
Produkty pokročilé glykace: AGEs (advanced glycation end products) heterogenní skupina látek. Produkty pokročilé glykace (AGE látky) jsou považované za významné uremické toxiny s prokázanými negativními biologickými a klinickými důsledky (vyskytují se i fyziologicky), ale při CHRI je několikanásobný nárůst a to u nediabetiků i diabetiků se selháváním ledvin. U diabetiků bez selhání ledvin tento nárůst není. Tvorba AGE: Schiffova reakce – Amadori produkt – AGE. AGE mimo jiné modifikují strukturu buněčných a tkáňových proteinů, což vede k jejich ke změně jejich biologické funkce. Další řada biologických reakcí AGE je spuštěna vazbou na na receptory RAGE – ty dále stimulují transkripci některých genů pro cytosiny – výsledkem je akumulovaná zánětlivá odpověď. Vysoké koncentrace AGE při selhání ledvin jsou podmíněny nejen jejich zvýšenou tvorbou. Ale i sníženou eliminací a též zvýšeným vznikem v důsledku jejich oxidativního a karbonylového stresu.
Klinické důsledky metabolických změn při CHRI
U pokročilé CHRI: je zejména změna složení tělesných oddílů a retence patologických substancí. Poškození může být asymptomatické, výrazně klinicky vyjádřené (kardiovaskulární komplikace, postižení skeletu, malnutrice).
Akumulace látek, AGE, poškození genomu může postupovat sice bez příznaků, ale skrytě progresivně. Zevní faktory (léky) mohou přispět k manifestaci metabolických změn, zejména těch, které se vylučují ledvinami (upravit dávky, třeba ATB, ale i inzulin aj.), některé léky jsou kontraindikovány nebo nejsou účinné (thiazid. diuretika), u každého léku pečlivě sledovat pacienta.
Pro správné léčení je nutno počítat s tím, že při postižení ledvin může být změněn nejen renální, ale i hepatální metabolismus a eliminace léků. Uremické toxiny (i ty ještě neidentifikované) působí pravděpodobně ve svém komplexu a kromě procesů redukce, acetylace, hydrolýzy mění i koncentraci a také spektrum složení látek určité skupiny ( (komplex dyslipidémie).
Mění se také spektrum AMK: Snížení poměru esenciálních/neesenciálních AMK a změna zastoupení rozvětvených AMK, detailní patogeneza odchylek metabolismu lipidů je zatím nejasná.
Výživa a její problematika při CHRI
Paradoxem nutrice při poruchách metabolismu u nefropatií je to, že když chceme, aby pacient nutričně prospíval, musíme počítat s tím, že s přijatou nutričně kvalitní potravou zvýší svou produkci katabolitů včetně močoviny, kreatininu, ale i jiných významně toxičtějších látek (fosfor, AGE aj.). Dáme přednost kvalitní výživě, malnutrice je prokazatelně negativním prognostickým faktorem.
Významnější než prostá je u CHRI malnutrice spojená se zánětem (MIA syndrom) a k rozvoji obou přispívá anorexie (častá) – jejímž patogenetickým faktorem jsou také „ uremické toxiny“- zatím ne všechny přesně identifikované (asi střední molekuly, zánět, změněné spektrum AMK, změny hormonální (grelin a leptin) a změny neuropeptidů.
Metabolické změny při selhání ledvin mají především vliv: na cévní stěnu – změna funkční i morfologická (ve smyslu aterosklerózy a arteriosklerózy). Funkčně je céva méně pružná, více tuhá, jejímž důsledkem je zvýšení výkonu srdce.
Metabolické změny, které na tomto procesu mají účast jsou: porucha kalciofosfátové homeostázy, nefyziologická aktivace RAS, dysfunkce endotelu, výrazně zvýšený oxidativní stres, formace AGE, chronická hyperglykémie a hyperinzulinémie u diabetiků, porucha metabolismu lipidů a nespecifické „uremické toxiny“ nebo vlastní postižení ledvin samo o sobě.
Jestliže nastanou změny cév, tak znamenají negativní kardiovaskulární prognózu a nejvíce se na nich podílí konstelace čtyř významnějších a přítomných faktorů – zánět, dyslipidémie, hyperhomocysteinémie a oxidativní stres.
Dyslipidémie: Je zvýšena koncentrace TTC v plazmě, také je vzestup VLDL a IDL, dále pokles HDLcholesterolu, zvýšení lipoproteinu Lp(a).
Zánět: Při selhání ledvin jsou velmi vysoké hodnoty mnoha prozánětlivých cytokinů a mediátorů (interleukin IL-, TNF-alfa, INF-gama aj.) spolu s aktivací komplementu i buněčné imunity. U pacienti je zvýšený CRP.
Spojitost zánět-malnutrice-ateroskleróza byla označena jako MIA syndrom. Pacienti s MIA-syndromem mají horší prognózu, i když musíme počítat i s přítomností zevních příčin (bakteriální, okultní aj. infekce), metabolická příčina je podstatnou součástí MIA syndromu a to právě vlivem zánětlivé odpovědi.
Hyperhomocysteinémie: Až 90% pacientů s CHRI má mírnou až střední hyperhomocysteinémii, která je paralelní k postupnému snižování funkce ledvin. Pravděpodobnou příčinou není porucha eliminace ledvinami, ale asi porucha extrarenálního mechanismu jeho metabolismu.
Oxidativní stres: Je definován nerovnováhou mezi tvorbou reaktivních kyslíkových radikálů (ROS) a antioxidativními mechanismy. CHRI vychyluje tuto rovnováhu – značný podíl má právě „uremické prostředí“, přispívá i peroxidace lipidů.
Dialyzační proces je provázen oxidativním stresem, vyvolavatelem oxidačního stresu je intravenózní aplikace železa.
K výše uvedeným okruhům pro kardiovaskulární postižení patří i mimo jiné i porucha fosfokalciového metabolismu se zvýšenou koncentrací fosforu, PTH a s deficitem cirkulačních inhibitorů kalcifikací – např. snížené hodnoty fetuinu A.
Rozsah metabolických změn a možností poruch činnosti ledvin a znalosti poruch metabolismu při nich nelze oddělit.
Metabolické poruchy a mimotělní eliminační metody
Dialýza – eliminace retinovaných katabolitů v mimotělním okruhu je velmi účinná metoda léčby dnes. Avšak pro posouzení stavu pacientů léčených některou z dialyzačních metod je nutno znát i úskalí těchto metod:
Dialýza je parciální: neeliminuje celé spektrum retinovaných molekul, při hemodialýze je důležitý i časový pohled – metoda je intermitentní – jen několik hodin týdnu probíhá eliminace, v mezidobí pokračuje akumulace. Dialýza sama o sobě má určité metabolické důsledky – ty spočívají nejen ve ztrátě určitých látek do dialyzátu (např. AMK), ale i v indukci svalové a celotělové proteolýzy, oxidace lipidů, AMK apod., aktivace komplementu, indukci opakované zánětlivé odpovědi.
I když se vlastnosti dialyzační membrány stále zlepšují a mají kapacitu odstraňování stále širšího spektra toxinů a retinovaných látek („High- flux“ membrány), stále platí, že ochrana funkce ledvin je základním cílem nefrologie právě pro metabolické důsledky porušení jejich funkce.
Použitá literatura a literatura k dalšímu studiu
TEPLAN, V. Chronické selhání ledvin. In: Teplan (Ed.), Nefrologie, Praha, Triton 2001. P. 271
Rychlík, Chronické selhání ledvin, Postragraduální medicína 9/2003.
Dusilová, Sulková: Renální osteopatie, 1. Vydání Maxdorf 2007.