autor: MUDr. Ondřej Veselý
pracoviště: Dětské oddělení a Dětská endokrinologická ambulance Svitavské nemocnice a. s., Ústav patologické fyziologie LF UP Olomouc
Anamnéza
Osmiletá dívka s cukrovkou 1. typu, kterou má od dvou let věku. Léčená kombinací dlouhodobě účinného analoga inzulinu glarginu (Lantus) podávaného 1xdenně večer s bolusy rychlého humánního inzulinu 3x denně (Actrapid) před snídaní, obědem a večeří. Denní přísun sacharidů má rozvržen následovně: 2,5-1-2,5-1,5-2-0,5 výměnných jednotek (1 VJ je rovna 12g sacharidům), tedy celkem 120 g cukrů na den.
1.den nemoci měla 1x teplotní špičku 39,3 stC, jinak subfebrilní, začala pokašlávat, večer 4x zvracela, večerní glykemii měla 11,3 mmol/l, rodiči snížena večerní dávka rychlého inzulinu na 40 % obvyklé dávky, protože nesnědla první ani druhou večeři, dlouhodobý analog inzulinu podán v plné dávce. V noci nezvracela, ale 2. den nemoci po 5.hodině ranní znovu začala opakovaně zvracet, zvracela co 1/4 hodiny, glykemie ráno 17,1 mmol/l, dostala čtvrtinu obvyklé ranní dávky rychlého inzulinu, protože nesnídala a rodiče měli strach, že by mohlo dojít k rozvoji hypoglykemie, dceru naložili do auta a přivezli ji do nemocnice. Průjem neměla, močila naposledy ráno před odjezdem do nemocnice, před nemocí vážila 24 – 25 kg.
Somatický nález při přijetí, ráno 8:30 h
Přinesená v náruči, při vědomí, ale ospalá, GCS 14b, stěžuje si na žízeň a bolesti v epigastriu, meningeální příznaky negativní, kapilární návrat lehce prodloužen (na 3 vteřiny), kruhy kolem očí a snížený tonus očních bulbů, „špičatý“ nos, oschlý a bíle povleklý jazyk, hrdlo prosáklé s hypertrofickými tonzilami bez zarudnutí, bez čepů či povlaků, krční uzliny 1-1,5cm podél kyvačů, dýchání prohloubené a zrychlené (Kussmaulovské), akce srdeční pravidelná, ozvy ohraničené, břicho: pod niveau, prohmatné, citlivé ve středním a levém epigastriu, TK 105/65 mmHg a 100 pulzů/min, hmotnost 22kg, glykemie 19,9 mmol/l, glukosa a ketolátky v moči +++. Hmotnost 22 kg.
Pracovní diagnosa
Diabetická ketoacidóza se středně těžkou dehydratací při respiračním infektu
Patofyziologický komentář I
Takřka učebnicový příklad rozvoje diabetické ketoacidózy (DKA). Dívka má DM 1. typu vzniklý na podkladě autoimunní destrukce beta buněk pankreatu vedoucí k absolutnímu deficitu inzulinu. Rozvíjející se respirační infekt s teplotou představuje situaci se zvýšením metabolických požadavků organismu. Dítě má menší chuť do jídla, ale protože nemá ani obvyklou denní pohybovou aktivitu a zůstává ležet doma tak glykemie stoupá. Ovšem buňkám se nedostává potřebného energetického substrátu, situace se zhoršuje večer a vrcholí 2. den ráno opakovaným zvracením, není schopná přijmou žádné cukry a rodiče proto ze strachu z hypoglykemie snižují dávku inzulinu. Dobrými úmysly je dlážděna cesta do pekel, v tomto případě směrem k DKA, protože nedostatek energie ve formě sacharidů a deficit inzulinu vedou k přechodu metabolismu na lipolýzu a produkci ketolátek, které představují náhradní zdroj energie. Současně dochází mechanismem osmotické diurézy ke ztrátám tekutin a rozvoji hyperosmolární dehydratace, která může nabýt hrozivých rozměrů a může vyústit až v hypovolemický šok. Toto je akcentováno zejména u dětí, protože mají snížený absolutní celkový objem tělesných tekutin a proto i „pár“ zvracení stačí k rozvratu vnitřního prostředí i bez přítomnosti diabetu, dále mají děti relativně menší poměr velikosti ICT ku ECT a tím i sníženou schopnost ICT „pufrovat“ po osmotickém gradientu objemový deficit v EC prostoru. Otázkou je zda večerní zvracení byl už symptomem rozvíjející se acidózy (u ranního zvracení o tom není pochyb) nebo (pravděpodobněji) šlo o zvracení, které často provází infekty dýchacích cest u dětí, protože tyto se neumí vzhledem k věku patřičně vysmrkat, vykašlat a vyplyvnout nahromaděné sekrety a ty se pak stávají zdrojem dráždění vedoucího ke zvracení. Chybí nám údaj o přítomnosti ketolátek v moči, rodina již po prvním zvracení měla kromě glykemie zhodnotit i ketonurii pomocí testačních proužků, rovněž je třeba vždy stanovit přítomnost ketonů při glykemii nad 15 mmol/l a především mezi základní pravidla, jimiž jsou edukováni všichni diabetici patří i následující zásada: Diabetik, který zvrací, podruhé patří do nemocnice.
Iniciální infuzní terapie a první laboratorní nálezy
Okamžitě po přijetí zajištěna periferní žíla a zahájena parenterální rehydratace plným Hartmannovým roztokem. Objem a rychlost infuze volena z kalkulace bazálních potřeb tekutin plus uhrazení poloviny z vypočteného deficitu tekutin během prvních 12 hodin léčby. Deficit odhadnut na 8 – 10 % tělesné hmotnosti na základě rozdílu hmotnosti před nemocí a při přijetí.
Současně odebrány základní biochemické odběry plus Astrup, jejichž výsledky přichází během první hodiny po přijetí (v závorkách uvedeny normy):
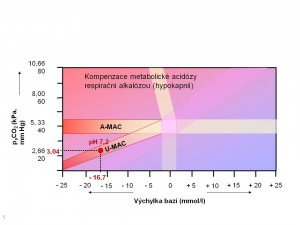
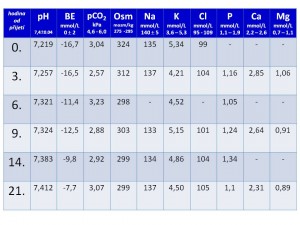
Astrup: pH 7,219 (n 7,4 ± 0,04), paCO2 3,04 kPa (n 4,6 – 6,0), aHCO3 9,3 mmol/l, BE – 16,7 mmol/l
Biochemie: Urea 10,4 mmol/l (n 1,7 – 6,7), Kreatinin 54 umol/l (n 27 – 88), Kys.močová 610,2 umol/l (n 180 – 360), ALT 0,37 ukat/l (n do 0,7), AST 0,66 ukat/l (n do 0,8), AMS 0,37 ukat/l (n 0,2 – 1,5), CRP 31,1 mg/l (n do 5), Na 135 mmol/l (n 135 – 145), K 5,34 mmol/l (n 3,6 – 5,4), Cl 99 mmol/l (n 95 – 109), P-osm 324 mmol/kg (n 275 – 295).
Krevní obraz: leu 14,2 ery 5,32 Hb 144 HK 0,43 MCV 81,2 MCH 27,1 Trb 334
diferenciál: neu 84 % ly 11 % mo 5 % eo 0 % ba 0 %.
Patofyziologický komentář II
Vyšetření potvrzuje diagnózu diabetické ketoacidózy, jedná se o metabolickou acidózu ze zvýšené endogenní produkce ketokyselin. Přítomnost hypokapnie a Kussmaulovského dýchání svědčí pro rozvinutou kompenzační odpověď dýchacího systému v podobě respirační alkalózy, po dosazení hodnot do acidobazického kříže (viz obrázek) vidíme, že se jedná už o ustálenou metabolickou acidózu s maximálním rozvojem kompenzační hyperventilace, která ale nestačí k úplné kompenzaci tj. návratu pH k normě. Z výsledků biochemických je na první pohled zřejmý výrazně hyperosmolární charakter dehydratace (vysoká P-osm, vysoká urea, vysoká kyselina močová) při dobré funkci ledvin (kreatinin v normě). Pokud by byl kreatinin vyšší pak by to mohlo svědčit pro počínající prerenální insuficienci ledvin z hypoperfuze. Dále jsou přítomny nepřímé známky vystupňovaného katabolismu (vysoká kys. močová). Vyšší CRP odpovídá lehčímu respiračnímu infektu . Velmi zrádné jsou výsledky mineralogramu Na, K, Cl, protože „papírově“ jsou hladiny minerálů v normě. Ve skutečnosti je ale diabetická ketoacidóza provázena deplecí všech minerálů především následkem osmotické diurézy. Případná hyponatremie pak má ještě složku distribuční, kdy vlivem hyperosmolarity v extracelulárním prostoru, dochází k přestupu vody z buněk a tím poklesu koncentrace natria v plazmě. Na depleci draslíku se kromě osmotické diurézy podílí katabolismus spojený s degradací makroergních fosfátů, tedy nedifuzibilních aniontů, které zadržují draslík v buňkách a představují tak elektrickou protiváhu k chemickému gradientu draslíku. Ztráty draslíku močí jsou vystupňovány sekundárním hyperaldosteronismem, jehož příčinou je pokles efektivního cirkulujícího objemu s aktivací systému renin-angiotenzin II , to vše je pak umně maskováno za nevinně se tvářící normo či dokonce hyperkalemií podporovanou výstupem draslíku z buněk vlivem acidózy. K výpočtu deficitu draslíku ve vztahu k pH a kalemii lze použít různé nomogramy či složité rovnice nicméně základní odhad můžeme provést srovnáním pH a aktuální kalemie podle vztahu, že změna pH o 0,1 vede ke změně kalemie o 0,6 mmol/l. V našem případě by tedy při pH pacientky 7,2 měla být kalemie 4,5 + 2 x 0,6 = 5,7 mmol/l, ale je 5,34 mmol/l, což hodnoceno izolovaně je při horní hranici normy, ale ve skutečnosti svědčí pro deficit draslíku. Celotělový nedostatek lze pak orientačně odhadnout podle vztahu: změna kalemie o 1 mmol/l znamená změnu celotělových zásob draslíku o 10 %, přičemž fyziologicky je stav zásob 50 mmol K+/kg hmotnosti. V našem případě tedy dle výše uvedených orientačních formulek můžeme deficit odhadnout takto: při pH 7,2 je kalemie 5,34 mmol/l, ale měla by být 5,7 mmol/l, rozdíl 0,36 mmol/l tedy odpovídá deficitu kalia 3 – 4 %, což představuje deficit 1,5 – 2,0 mmol K+/kg hmotnosti, pokud k tomu připočteme bazální potřeby dítěte na dodávku draslíku ve výši 2-3 mmol K+/kg/den, pak bude nutno v infuzích zajistit celkovou dodávku draslíku ve výši asi 4 – 5 mmol K+/kg/den, tedy 4 až 5 x 25 = 100 – 125 mmol K+/den, tzn. každou hodinu musí z infuzí vykapat 4 – 5 mmol K+.
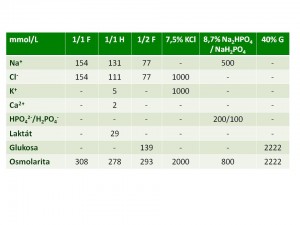
Proč nebyl pacientce podán ihned inzulin? Protože rehydratace cestou infuzí má v léčbě DKA přednost před léčbou inzulinem, zejména tehdy, jsou-li známky počínajícího šoku, pak musí být objemová resuscitace velmi razantní. Zajištění dostatečné perfúze orgánů je nezbytným předpokladem účinnosti následné inzulinové léčby. Iniciálně volíme plné roztoky krystaloidů jako je fyziologický roztok (1/1F) nebo v tomto případě roztok Hartmannův (1/1H), který kromě iontů Na+ a Cl- obsahuje i menší množství K+, Ca2+ s laktátem a jehož mírnou výhodou oproti fyziologickému roztoku je menší koncentrační zátěž sodíku a zejména chloridů, přítomnost draselných iontů a bonus v podobě laktátu, který má po své metabolizaci mírně alkalizující účinky (viz tabulka srovnání složení roztoků). Celková potřeba tekutin se počítá z bazálních potřeb, uhrazení deficitu tekutin a průběžného hrazení případných dalších ztrát (zvracení, horečka). Uhrazení celkové ztráty tekutin se rozpočítává nikoliv na 24h, ale na 48h s tím, že polovina má být uhrazena v prvních 12 hodinách a druhá polovina v dalších 36 hodinách.
V krevním obraze patrná leukocytosa s neutrofilií by mohla vést k podezření na bakteriální infekci, ale v tomto případě se jedná o stresovou neutrofilii při zvracení a hladovění, CRP není vysoké a v klinickém obraze bylo jen známek lehčího respiračního infektu.
Stav a léčba mezi 1. a 3. hodinou po přijetí
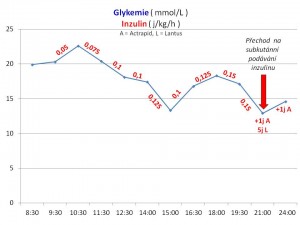
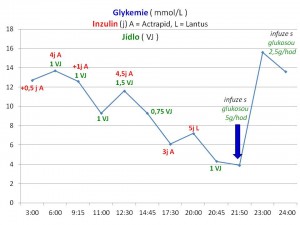
Pacientka je pod intenzivním dohledem, je jí monitorován krevní tlak (TK), srdeční pulz (P), dechová frekvence (D), stav vědomí, glykemie po jedné hodině, mineralogram a Astrup po 3h, bilance příjmu a výdeje tekutin. Po obdržení výše uvedených výsledků a s hodinovým odstupem od zahájení infuze provedena kontrola glykemie, která byla 20,3 mmol/l. Po jejím stanovení zahájena léčba inzulinem v podobě kontinuální infuze rychlého humánního inzulinu naředěného do 1/1F, podávaného k zajištění přesnosti přes lineární dávkovač a současně do infuze krystaloidu přidána glukosa. Dávka inzulinu se pak měnila podle dalších glykemií dělaných v hodinových intervalech (viz graf glykemie v prvních 24 hodinách).
Patofyziologický komentář III
Iniciální bolus samotných krystaloidů obvykle vede prostým „naředěním“ k poklesu glykemie, který může být značný a proto se na rozdíl od dospělého věku se zahájením inzulinové terapie vyčkává obvykle 1 – 2h jako prevence hrozby rozvoje edému mozku z rychlého poklesu osmolarity a hypokalemie s rizikem rozvoje srdečních arytmií a svalové paralýzy. Hypokalemie vzniká přesunem draslíku provázejícího glukosu do buněk účinkem inzulinu. Ze stejných důvodů se upustilo od podávání bolusů inzulinu. Inzulin je aplikován ve formě i.v. infuze, iniciální dávka inzulinu závisí na tíži acidózy a na věku (mladší děti jsou více inzulinsenzitivní), průměrná dávka je 0,05 – 0,15 j/kg/hod. Pokračovací rychlost infuze s inzulinem se pak „titruje“ podle poklesu glykemie tak, aby rychlost poklesu glykemie nepřesáhla 5 mmol/l/hodinu a současně nesmí dávka inzulinu klesnout pod 0,05j/kg/hod, protože by to vedlo k „restartu“ ketogeneze.
Proč pacientka dostává glukosa, když má hyperglykemii? Hyperglykemie je jen symptomem DKA, pravda po překročení renálního prahu, vede k glykosurii a osmotické diuréza, ale podstatou problémů pacienta v DKA je nedostatek glukosy v buňkách, který při absolutním deficitu inzulinu vede k excesivní aktivaci lipolýzy a ketogeneze. Glykemie 20-30 i více mmol/l sice vypadá hrozivě, ale ze samotného poklesu glykemie mnoho gramů glukosy pro buňky nebude, důkazem budiž následující propočet: objem extracelulárního prostoru je asi 20 % tělesné hmotnosti, což u pacientky vážící 25kg činí 5 litrů. Pokud by vlivem inzulinové léčby klesla koncentrace glukosy v ECT z 25 mmol/l na 5 mmol/l znamenalo by to, že do buněk vstoupilo 5 x 20 = 100 mmol glukosy a to při relativní molekulové hmotnosti glukosy 180 g/mol znamená, že do buněk vstoupilo pouhých 18g tedy 1,5 výměnné jednotky. Obvyklý denní příjem sacharidů u této dívky je ovšem 120g, tzn. že vlastní snížení glykemie by pokrylo jen 15 % její denní potřeby přísunu cukrů. Samotný pokles glykemie nestačí k pokrytí denních energetických požadavků organismu na množství sacharidů a proto je potřeba dodávky glukosy v infuzích, jinak nedojde ke „zlomení“ DKA. Glukosa se tedy přidává ke krystaloidům a to nejpozději při poklesu glykemie na hodnoty mezi 15 – 20 mmol/l.
Kontrolní odběry po 3 hodinách léčby (1. den poledne, 12:00h)
Astrup: pH 7,257 paCO2 2,57 kPa, aHCO3- 8,6 mmol/l, BE -16,5 mmol/l
Biochemie plazmy: Na 137 mmol/l, K 4,21 mmol/l, Cl 104 mmol/l, Ca 2,85 mmol/l (n 2,2-2,6), P 1,16 mmol/l (n 1,1-1,9), Mg 1,06 (n 0,7 – 1,07), P-osm 312 mmol/kg.
Stav a léčba mezi 3. až 6. hodinou po přijetí
Tekutiny popíjí, chuť do jídla nemá, nezvrací, pospává, bez teploty, hyperventiluje, dechová frekvence okolo 25-30/min, TK 115-120/70-75 mmHg, pulzy 110-120/min. Pokračováno v infuzní terapii, jako nosný roztok zvolen poloviční roztok fyziologický (1/2 F), který obsahuje v poměru 1:1 roztok fyziologický a roztok 5 % glukosy, do tohoto nosného roztoku přidány roztoky 7,5 % KCl, 8,7 % NaH2PO4/Na2HPO4 a 40 % glukosa. Dodávka inzulinu postupně navýšena až na dávku 0,1 j/kg/h s pozvolným poklesem glykemie (viz graf).
Patofyziologický komentář IV
Vyšetření na Astrupa ukazuje, že prohlubování base excessu se zastavilo, pH mírně zlepšeno. Proč pacientka nedostala bikarbonáty? Bikarbonáty jsou v léčbě metabolické acidózy indikovány jen tam, kde dochází k jejich ztrátám z organismu či za některých specifických situací (otrava salicyláty, protrahované resuscitace, CHRS) mezi které ovšem diabetická ketoacidóza nepatří. Při DKA je příčinou zvýšená endogenní produkce a hromadění ketokyselin (acetoacetát, beta-hydroxy-butyrát, tedy Ket- + H+). Léčba DKA inzulinem a glukosou je v tomto ohledu kauzální a zcela dostačující ke zvládnutí acidózy, protože nabídneme glukosu jako energetický substrát, inzulin zajistí její přesun do nitra buněk, dojde k zástavě lipolýzy, ketogeneze a k metabolizaci nashromážděných ketolátek za spotřeby H+ iontů (protonkonzumpční reakce), tím se „uvolní“ bikarbonáty, které museli pufrovat H+ ionty z ketolátek (tzv. potencionální hydrogenuhličitany) a dojde k „samovolnému“ vyřešení acidózy s postupnou normalizací BE, pH a vyhasnutím respirační kompenzace. Naopak podáním bikarbonátů si zaděláváme na problémy, protože
- (a) může dojít k přestřelení do alkalózy s hypokalcemií a křečemi a to i při podání části z vypočteného množství chybějících bikarbonátů, protože i po korekci bude respirační systém ještě 12 – 24 h pokračovat v hyperventilaci,
- (b) paradoxně se zhorší intracelulární acidosa difuzí CO2, vzniklého reakcí mezi H+ a HCO3-, do buněk,
- (c) vzniklý CO2 rovněž zvyšuje nároky na ventilační úsilí,
- (d) posun disociační křivky Hb doleva znamená zhoršené uvolňování kyslíku z hemoglobinu ve tkáních,
- (e) urychlený vstup kalia do buněk hrozí smrtící hypokalemií,
- (f) prodlužuje se období ketogeneze v játrech a zhoršené utilizace ketolátek v periferii,
- (g) zhoršuje se účinnost katecholaminů,
- (h) 8,4 % a 4,2 % roztoky NaHCO3 představují značnou osmotickou zátěž.
Řadou studií nebyl prokázán žádný pozitivní vliv korekce DKA pomocí bikarbonátů, extracelulární pH není přesným obrazem intracelulárního pH, viabilita buněk zůstává zachována i při nízkém pH. Podávání bikarbonátů v léčbě diabetické ketoacidózy je tedy nejen neopodstatněné, ale přináší řadu potencionálních rizik a nebezpečných komplikací!
Proč je do nosného roztoku přidáváno kalium a glukosa jsme si vysvětlili výše, ale proč tam patří i fosfáty? Fosfáty představují druhý iont po draslíku, který je třeba v léčbě DKA bedlivě hlídat. DKA je provázena deplecí fosfátů, geneze je obdobná jako u draslíku, především se uplatňuje katabolismus spojený s degradaci makroergních/organických fosfátů v buňce a osmotická diuréza. Po zahájení léčby inzulinem pak fosfáty vstupují společně s glukosou a kaliem do buněk a jsou nezbytné pro restituci organických fosfátů a tvorbu ATP. Těžká hypofosfatemie snižuje transportní kapacitu erytrocytů pro kyslík a uvolňování O2 z hemoglobinu (pokles hladiny 2,3-DPG v erytrocytech) a ohrožuje energetický metabolismus všech buněk (snížená hladina ATP), což se projeví zejména na funkci nervového systému (slabost, malátnost, nechutenství, zmatenost, křeče, koma), myokardu (arytmie-bradykardie, bloky, srdeční selhání), respirační svalech (s rizikem rozvoje hypoventilace, hyperkapnie a respirační acidózy), kosterních svalů (svalová ochablost, paralýza, rhabdomyolýza). Potřeba fosfátů se pohybuje okolo 0,5 – 1 mmol/kg/den. K úhradě deficitu fosfátů jsou k dispozici roztoky: KH2PO4, který má tu výhodu, že současně dodáváme i kalium (celkový deficit kalia pak hradíme v poměru 1-2:1 roztoky 7,5 % KCl a K2HPO4) a je-li na daném pracovišti dostupný je vhodnější než 8,7 % NaH2PO4/Na2HPO4.
Ač byl dodržen bezpečnostní limit pro rychlost snižování glykemie (max. 5 mmol/l/hodinu) došlo k poklesu osmolarity o 12 mmol/l za 3h, což je příliš rychlé, bezpečná rychlost snižování plazmatické osmolarity je 2 mmol/l/hodinu (naopak jako rizikový pro rozvoj edému mozku je brán pokles rychlejší než 3 mmol/l/hodinu). Záměrně proto mezi 3. – 6.hodinou léčby byla použita hyperosmolární infuze (1/2F 450ml + 30ml 40 %Glu + 15ml 7,5 % KCl + 10ml 8,7 % NaH2PO4 má celkovou osmolaritu 467 mmol/l).
Kontrolní odběry po 6 hodinách léčby (1. den odpoledne, 15:00 h)
Astrup: pH 7,321 paCO2 3,23 kPa, aHCO3- 12,5 mmol/l, BE -11,4 mmol/l
Biochemie plazmy: K 4,52 mmol/l, P 1,05 mmol/l (n 1,1 – 1,9), P-osm 298 mmol/kg.
Celková bilance tekutin po 6h léčby plus 500ml (příjem infuze+minerálka 1350ml, diuréza 850 ml)
Patofyziologický komentář V
Vidíme, že stav ABR se zlepšuje a to i bez bikarbonátů. Hladina kalia se drží, fosfáty i přes dodávku klesly a bude potřeba zvýšit rychlost jejich podávání.
Nepříjemným překvapením je další pokles osmolarity i přes podání výše uvedeného hyperosmolárního roztoku, jak to? Zde udělal sloužící lékař a autor tohoto textu v jedné osobě chybu. Celková osmolarita roztoku sice byla vysoká, ale tuto hyperosmolaritu ze 2/3 zajišťoval obsah glukosy. Glukosa v přítomnosti inzulinu ovšem přestává byt efektivním solutem, protože vstupuje do buněk. Druhým důvodem byl poměrně rychlý perorální příjem izotonické minerálky. Rychlý pokles osmolarity v extracelulárním prostoru ohrožuje pacienta vznikem edému mozku, protože intracelulární osmolarita mozkových buněk je vyšší a dochází k přestupu vody po osmotickém gradientu. Edém mozku představuje nejzávažnější komplikaci a nejčastější příčinu smrti pacientů v DKA (1 – 2 % pacientů s DKA). Vznik edému nesouvisí jen s infuzní terapií a rychlým poklese osmolarity. Vyskytuje se i u pacientů u kterých se osmolaritu daří snižovat předpisovým způsobem. Ohroženy jsou zejména malé děti a pacienti s protrahovanou hypokapnií. Vysvětlení může být následující: hypokapnie vede fyziologicky k vazokonstrikci, ale při jejím delším trvání dojde vlivem jiných lokálních faktorů (acidosa?) k násilné vazodilataci mozkových cév, zvýšení průtoku krve mozkem a růstu nitrolebního tlaku a vazogennímu (zvýšený hydrostatický tlak v mozkových kapilárách) otoku mozku, který se kombinuje s otokem buněčným (výměna H+ za Na+ s nímž ale do mozkových buněk přichází i voda).
Stav a léčba mezi 6. až 9. hodinou po přijetí
Okamžitě po zjištění poklesu osmolarity byla zastavena infuze 1/2F. V nové infuzi jako nosný roztok zvolen 1/1F, do něho dány iontové koncentráty 7,5 % KCl, 8,7 % NaH2PO4/Na2HPO4 a 40 % glukosa, efektivní osmolarita nové infuze (po odečtení glukosy) činila 386 mmol/l/h, tedy hyperosmolární, dále zpomalena rychlost infuzí a lehce snížena rychlost podávání inzulinu tak aby došlo k mírnému nárůstu glykemie (viz graf). Bedlivě monitorován klinický stav pacientky zejména po stránce neurologické a oběhové (nitrolební hypertenze jen provázena vzestupem krevního tlaku a bradykardií). Během odpoledne se objevilo pobolívání hlavy a mrzutost dítěte, nezvracela, vědomí bez alterace, GCS 15b, meningeální příznaky negativní, pulzy 110-130/min, TK 120-125/60-70, bolesti ustaly asi po hodině, k večeru už i zlepšení nálady a snědla trochu jídla.
Kontrolní odběry po 9 hodinách léčby (1. den, večer 18:00 h)
Astrup: pH 7,324 paCO2 2,88 kPa, aHCO3- 11,2 mmol/l ,BE -12,5 mmol/l
Biochemie plazmy: Na 133 mmol/l, K 5,15 mmol/l, Cl 101 mmol/l, Ca 2,64mmol/l (n 2,2-2,6), P 1,24 mmol/l (n 1,1-1,9), Mg 0,91 (n 0,7 – 1,07), P-osm 303 mmol/kg.
Patofyziologický komentář V
Pokles osmolarity se podařilo výše uvedenými opatřeními zvládnout. Celkový pokles osmolarity po 9 hodinách léčby činil 21 mmol/l, tedy přijatelných 2,33 mmol/l/hodinu. Pokud by došlo ke zhoršování neurologického stavu byli jsme připraveni podávat manitol a učinit případná další opatření.
Nálezy v ABR a mineralogramu jsou uspokojivé. Mírné snížení natremie není třeba zvláště řešit, dodávka Na+ je v rámci doposud použitých nosných roztoků (1/1H, ½ F , 1/1F) dostatečná k vyřešení deplece sodíku v organismu daného osmotickou diurézou, rychlost dodávky draslík a fosfátů na základě výsledků upravena v další infuzi, magnesium suplementováno perorálně. Nelze přidat infuzní roztoky magnesia (10 % MgSO4) do infuze obsahujícího fosfáty, došlo by k precipitaci!
Stav a léčba mezi 9. až 14. hodinou po přijetí
Celkový stav je dobrý, dívka je oběhově stabilní, subjektivně bez větších potíží, hlava ji nebolí, trápí ji pouze časté odběry kapilární krve na glykemii a dráždivý kašel. Nezvrací, kromě tekutin snědla část 1. a 2. večeře. Od večera (po 12. h od přijetí) přecházíme na subkutánní podávání bolusů inzulinu s obvyklou večerní dávkou dlouhodobě působícího analoga inzulinu. Bilance tekutin mezi 6. a 12. hodinou léčby činila +280 ml (příjem 740ml, výdej 460 ml).
Kontrolní odběry po 14 hodinách léčby (1. den noc, 23:00 h)
Astrup: pH 7,383, paCO2 2,92 kPa, aHCO3- 13,0 mmol/l, BE -9,8 mmol/l
Biochemie plazmy: Na 134 mmol/l, K 4,86 mmol/l, Cl 104 mmol/l, P 1,34 mmol/l (n 1,1-1,9), P-osm 299 mmol/kg.
Stav a léčba mezi 14. až 21. hodinou po přijetí
Po podání antitusik dítě usíná. Prodlužujeme intervaly kontroly glykemií, dle jejich výše připichujeme rychlého inzulinu, kape pomalá infuze 1/1F s koncentráty kalia, fosfátů a glukosy, zklidňuje se dýchání (dechová frekvence 20/min). bilance tekutin za noc +500ml (příjem 840 ml, výdej 340ml)
Ráno po probuzení čilá, při snídani ji vypadl zub, jazyk vlhký, dýchání sklípkové, bez vedlejších dechových fenoménů, bez teploty, břicho klidné.
Kontrolní odběry po 21 hodinách léčby (2. den ráno, 6:00 h)
Astrup: pH 7,412, paCO2 3,07 kPa, aHCO3- 14,6 mmol/l, BE -7,7 mmol/l
Biochemie plazmy: Na 137 mmol/l, K 4,5 mmol/l, Cl 105 mmol/l, Ca 2,31 mmol/l, P 1,1 mmol/l , Mg 0,89 mmol/l, P-osm 299 mmol/kg.
Patofyziologický komentář VI
Jakmile dítě nezvrací, je schopno přijímat p. o., v moči nemá více ketolátek jak na jeden + testovacího proužku a acidosa je úplně kompenzována je možno přejít na subkutánní inzulin. Příjem sacharidů p. o. také snižuje potřebu dodávky glukosy v infuzích.
Vyšetření Astrupa navíc pěkně demonstruje přetrvávající respirační kompenzaci acidosy hyperventilací. Pokud bychom podávali během léčby bikarbonáty, mohlo dojít 2. den k přestřelení do alkalosy se všemi riziky z toho plynoucími.
Další průběh hospitalizace
2. den byla dívenka subfebrilní, dráždivě frekvenčně pokašlávala, tekutiny i menší množství suché stravy přijímala perorálně, hydratace dobrá, sliznice vlhké, bilance tekutin 1500ml příjem 1100ml výdej, na noc pro menší příjem sacharidů v průběhu dne s večerní hypoglykemií ještě infuze iontů s glukosou, inzulin podáván celý den subkutánně, suplementace kalia a magnesia v tabletách, glykemie viz graf.
3. den měla 1x horečku 38,5stC, klinický obraz rhinosinusitidy, CRP nízké, léčba symptomatická lokální (nosní kapky, animizace, inhalace), bez antibiotik, RTG PND bez hladinek
4. – 5. den bez teploty, rýma mírnější, kašel nadále dráždivý, pila a jedla dostatečně, glykemie zlepšeny, 5. den propuštěna do domácí péče.
Kontrolní odběry po 2 dnech od přijetí
Biochemie plazmy: Na 134 mmol/l, K 4,69 mmol/l, Cl 100 mmol/l, P 0,92 mmol/l (n 1,1 – 1,9), Mg 0,88 mmol/l(n 0,7 – 1,1), P-osm 292 mmol/kg, CRP 8,6 mg/l. Astrup nedělán.
Závěrečný komentář
Diabetická ketoacidosa představuje závažnou akutní komplikaci cukrovky. Její příčinou je absolutní nedostatek inzulinu, který vede k odbrždění lipolýzy a ketogeneze a proto se vyskytuje častěji v souvislosti s DM 1. typu. Může být prvním projevem cukrovky (1/4 – 1/3 nových DM 1. typu) nebo vzniká dekompenzací diabetika za akutní stresové situace s vyššími metabolickými požadavky (infekce, operace, úraz atp.), sníženým příjmem sacharidů (zvracení, průjem, hladovění) často v kombinaci nedostatečnou inzulinovou léčbou (relativní při zvýšené hladině kontraregulačních hormonů jako jsou katecholaminy a glukokortikoidy v rámci stresu nebo absolutní při chybně nižší podané dávce inzulinu). Diagnostickými kriterii DKA jsou: hyperglykemie (nad 11 mmol/l), metabolická acidosa (pH pod 7,3, HCO3- pod 15 mmol/l) a průkaz ketonemie/ketonurie. Diabetická ketoacidóza ohrožuje primárně život pacienta hypovolemickým šokem, acidotickým komatem, otokem mozku. Prvním krokem v léčbě DKA je stabilizace oběhu, případně odvrácení hrozícího či rozvíjejícího se šokového stavu. K tomu využíváme infuzí plných roztoků krystaloidů a tato léčba má přednost před léčbou inzulinem. Kauzální terapií DKA je dodávka inzulinu a glukosy jedině tak může dojít k vyřešení metabolické acidosy. Samotné podávání inzulinu nestačí, množství glukosy v plazmě resp. v ECT je i přes hyperglykemii nedostatečné k uspokojení metabolických požadavků tkání na dodávku glukosy jakožto rychlého zdroje energie. Symptomatické podání bikarbonátu ke korekci acidózy je kontraproduktivní a zatížené řadou rizik. Acidosa není příčina, ale pouze příznakem DKA. Diabetická ketoacidosa je vždy spojena s deplecí minerálů a to i přes zdánlivě normální hladiny iontů v plazmě. V souvislosti s léčbou DKA inzulinem, se pak život ohrožujícím způsobem může demaskovat deficit draslíku a fosfátů. Pokud pacient močí a nemá na EKG známky hyperkalemie, možno dodávat draslík do infuzí od začátku léčby a nejpozději v okamžik zahájení terapie inzulinem. Rovněž je nutné nezapomenout na dodávku fosfátů. Léčba DKA skrývá i další nástrahy, které mohou vést ke smrti pacienta. I přes zajištění adekvátní terapie umírá 1 – 2 % pacientů s DKA, nejčastější (4/5 úmrtí) příčinou smrti diabetika v DKA je edém mozku. Základním preventivním opatřením proti rozvoji edému mozku při DKA je postupné snižování glykemie (do 5 mmol/l/hodinu) a osmolarity plazmy (do 2 mmol/l/hodinu). Někdy se ale edém mozku rozvíjí i přes nejlepší péči, rizikové jsou zejména malé děti pod 5 let a pacienti s protrahovanou hypokapnií, mechanismus vzniku tohoto edému pravděpodobně souvisí se selháním autoregulace mozkové cirkulace s následným nárůstem nitrolebního tlaku. K dalším komplikacím DKA a léčby DKA patří hypokalemie, hypoglykemie, zvrat do alkalózy, akutní renální selhání, DIC, trombembolie a jiné.