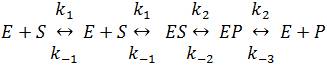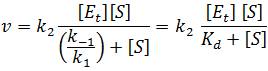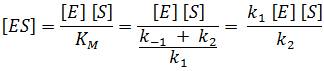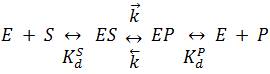Úvod
Experimentálně zjištěná závislost rychlosti v na koncentraci substrátu [S] obecné reakce katalyzované enzymem E podle následující rovnice (i) (Haldanův model)
velmi často vyhovuje následujícímu vztahu (ii)
kde [S] je koncentrace substrátu S, [Et] je celková koncentrace enzymu E, Vmax = kkat . [Et] je maximální rychlost reakce, kkat je rychlostní konstanta a KM je Michaelisova konstanta. Komplexy ES a EP spolu s náležitými kinetickými konstantami modelu (i) v tomto případě považujeme za totožné. Závorky [ ] v textu a v rovnicích vždy označují látkovou koncentraci (mol . l-1).
Mechanismus Michaelise-Mentenové
Jestliže je v modelu (i) ES ≡ EP, tj. meziprodukt EP se netvoří, ES se přímo rozpadá na E + P, k-2 ≡ k-3 zanedbáváme (reakci rozpadu ES považujeme za nevratnou; a k2 ≡ k3 ≪ k-1, je [ES] v rovnováze s [E] a [S] a k2 určuje nejpomalejší stupeň v přímé reakci. Jde o mechanismus, který rozebrali L. Michaelis a M. L. Mentenová (1913).
Pro tuto reakci je
v = k2 [ES] (rovnice iii).
Protože koncentrace volného enzymu [E] je
[E] = [Et] – [ES] (rovnice iv)
a podle následující rovnice (v) je
(kde Kd je disociační konstanta komplexu ES), platí pro ustálenou počáteční rychlost reakce
Srovnání této rovnice s rovnicí (ii) ukazuje, že:
- Konstanta kkat = k2, tj. kkat je v tomto modelu rovno rychlostní konstantě 1. řádu charakterizující chemickou přeměnu komplexu ES po jeho vytvoření v prvním („fyzikálním“) stupni reakce;
- Konstanta KM = k-1 /k1 = Kd, tj. KM je v tomto modelu rovna skutečné rovnovážné disociační konstantě komplexu ES, a charakterizuje tak (podle (v)) pevnost vazby substrátu na enzym.
Mechanismus Briggse-Haldanea
Při ES ≡ EP, k-2 ≡ k-3 opět zanedbáváme, ale k2 ≡ k3 ≅ k-1, jde o mechanismus, jehož rozbor podali G. E. Briggs a J. B. S. Haldane (1925). Opět platí (iii) a (iv), ale neplatí (v) – koncentrace [ES] nyní nebude rovnovážná. Koncentraci [ES] zde můžeme vypočítat z předpokladu stacionárnosti – jestliže je rychlost v po ustaveni stacionárního stavu stálá, je [ES] zřejmě také stálá.
Proto
a po výpočtu [ES] odtud a dosazení do (iii) je
Je patrné, že pro mechanismus Briggse-Haldanea zůstává kkat = k2 stejně, jako tomu bylo pro mechanismus Michaelise-Mentenové, ale KM = (k-1/k1) + (k2/k1) > Kd, tj. KM je nyní větší než skutečná rovnovážná disociační konstanta Kd komplexu ES; KM je nyní nepravou, zdánlivou disociační konstantou komplexu ES. Při k2 ≅ k-1 je KM ≅ 2Kd, a stacionární [ES] je tedy relativně menší než rovnovážná [ES]. Při k2 ≪ k-1 přechází zdánlivá KM ve skutečnou rovnovážnou Kd (viz mechanismus Michaelise-Mentenové). Naopak při k2 ≫ k-1 je KM ∼ k2/k1, tj. KM ∼ kkat/k1 (viz níže mechanismus van Slyka a Cullena).
Mechanismus van Slyka a Cullena
Mechanismus, který je v jistém smyslu opakem mechanismu Michaelise-Mentenové a druhým krajním případem mechanismu Briggse-Haldanea, rozebrali D. D. van Slyke a G. E. Cullen (1914). Mechanismus předpokládá k2 ≫ k-1, a dovoluje tak zanedbat k-1. V modelu (i) opět zůstává k2 ≡ k3, ES ≡ EP a k-2 ≡ k-3 zanedbáváme. Nahradíme-li nyní podle (v) a (vi) konstantu Kd jako míru afinity E k S konstantou KM, platí
Podle (iii) potom je
v = k1 [E] [S] (rovnice vii)
Obdobnou rovnici získáme, jestliže v rovnici (ii) budeme uvažovat o velmi nízké koncentraci substrátu S - totiž že [S] ≪ KM. Podle (iv) pak zároveň platí [Et] ∼ [E], a tedy následující rovnice (viii):
Konstanta k1 rovnice (vii) je konstantou prvního (fyzikálního) stupně reakce (i). Je konstantou 2. řádu. Neoznačujeme ji kkat, protože kkat rezervujeme pro reakce 1. řádu a vztahujeme ji k chemickým přeměnám v komplexu ES.
Ze srovnání rovnic (vii) a (viii) vyplývá, že veličina kkat/KM odpovídá k1. Výraz kkat/KM lze interpretovat jako zdánlivou konstantu rychlosti 2. řádu charakterizující rychlost tvorby komplexu ES.
Pokud jde o interpretaci KM, ze (vii) a (viii) je zřejmé, že KM ∼ kkat/k1.
Kompletní Haldaneův model
Jestliže konečně bereme v úvahu, že ES ≢ EP a počítáme se všemi konstantami modelu (i), potom, za předpokladu stacionárnosti, máme:
Odtud můžeme vypočítat /ES/ a /EP/:
Rychlost reakce je rovna rozdílu přímé a zpětné rychlosti některého stupně, např.
v = k2[ES] – k-2[EP]
V mezním případě, kdy [P] = 0, je
Odtud máme důležitou rovnici (ix)
a neméně důležitou rovnici (x)
Veličiny ←kkat a KMP pro reakci v obráceném směru by se vypočítaly obdobně.
Smysl konstanty kkat
Z rovnice (ix) vyplývá, že v podrobnějších modelech lépe odpovídajících skutečnosti, jako je např. Haldaneův model, je konstanta kkat kombinací různých rychlostních konstant 1. řádu a nemůže být přiřazena jednomu konkrétnímu stupni. Vyjma mezních případů, kdy může dosáhnout hodnoty některé ze skutečných konstant 1. řádu přímé reakce, je kkat zdánlivou konstantou a je vždy menši než kterákoliv z konstant 1. řádu přímé reakoe. Představuje tedy dolní hranici rychlostních konstant chemických přeměn komplexu ES.
V literatuře je kkat známa také pod označením „čislo přeměny“ anebo jako molekulová aktivita enzymu (tj. katalytická aktivita násobená počtem činných aktivnich míst na molekule enzymu).
Horní hranicí rychlostních konstant chemických mono- (neboli vnitřně-)molekulových přeměn je frekvence molekulových vibrací, tj. 1012-1013 s-1.
Je-li nejpomalejšim stupněm n reakce rozpad komplexu EP, pak je kkat rovna ryohlostní konstantě kn tohoto stupně – v přikladu (i) by to mohla být konstanta k3.
Smysl konstanty KM
Z výrazu (x) vyplývá, že rovněž KMS (a popř. KMP) je kombinací různých konstant a nemůže být přiřazena určitému stupni. Může být větěí i menší než Kd anebo, v mezním případě, rovna Kd.
Jak ukazuje následující rovnice (xi), konstanta KMS je mírou celkového množství enzymu, které je v té či oné formě vázáno se substrátem:
(Ʃ[ES] je součet všech forem enzymu vázaných se substrátem při jeho přeměnách v produkt). KMS je zdánlivou disociační konstantou komplexu ES.
Skutečná, pravá „KMS je mezní hodnotou
kde Ʃ[E] je součet všech enzymových forem přítomných při [S] = 0 a Ʃ[ES] představuje součet všech enzymových forem vázanýoh se S, když [S] = ∾.
Poměr kkat/KM
Podíl obou zdánlivýoh konstant kkat/KM, le rovněž považovat za zdánlivou konstantu. Tento výraz představuje dolní hranici možné hodnoty rychlostní konstanty 2. řádu k1, která určuje rychlost tvorby komplexu ES.
Jestliže je, v mezním případě, rychlost enzymové reakce limitována rychlostí tvorby komplexu ES (tj. všechny konstanty přímé reakce, vyjma k1, jsou mnohem větší než k-1), je podle (vii) a (viii) podíl kkat/KM skutečnou mikroskopickou konstantou totožnou s k1.
Horní hranicí hodnot konstanty kkat/KM = k1 je hodnota difúzní konstanty kD v daném prostředí.
Zdánlivá ryohlostní konstanta 2. řádu kkat/KM uvádí podle (vii) a (viii) do vztahu rychlost reakce s koncentrací volného enzymu. Ze vztahu
[E] = [Et] – Ʃ[ES] (rovnice xii)
a vztahu (xi) vyplývá rovnice (xiii):
Při [S] ≪ KM je [E] ∼ [Et] a při [S] ≅ KM je [E] ≅ 1/2[Et]. Až při [S] ≫ KM (tj. nasycení enzymu) bude [E] ∼ 0 a rychlost reakce bude podle vztahu (ii) úměrná kkat, a ne kkat/KM.
Vztah mezi zdánlivými kinetickými konstantami a rovnovážnou konstantou reakce
V rovnováze je celková ryohlost reakce (i) rovna 0, a proto při nízkých [S] a [P] podle (viii) platí
Odtud vyplývá následující, tzv. Haldaneův vztah (xiv), podle kterého je
Výraz na pravé straně rovnice (xiv) je roven rovnovážné konstantě reakce, Krovn. Haldaneův vztah je důležitý tím, že vyjadřuje rovnovážnou konstantu Krovn katalyzované reakce pomocí kkat (popř. Vmax) a KM. Ukazuje, že Krovn není pouhou kombinací konstant kkat přímého a zpětného směru, ani není jednoduchou kombinací KMS a KMP.
Jestliže je KMS ∼ KMP, bude platit Krovn ∼ kkat→/←kkat. Jestliže se však KMS a KMP budou od sebe navzájem výrazně lišit, pak také kkat→ a ←kkat budou odlišné od hodnot vypočtených s použitím rovnovážné konstanty a pro vysvětlení tohoto rozdílu se musí vzít v úvahu hodnoty KMS a KMP, tedy vazba substrátu, popř. produktu, na enzym. V mezním případě, kdy
se vysvětlení přímo opírá o hodnoty Kd komplexů ES a EP.
Příklad. Podle své konstanty Krovn je např. syntéza S-adenosylmethioninu téměř reverzibilní, a proto by kkat→ přímého směru reakce by měla být rovna ←kkat zpětné reakce. Pokud je ale katalyzována S-adenosyltransferázou, probíhá tato reakoe v přímém směru téměř 5.105 krát rychleji než ve zpětném směru. KMP je tedy téměř 5.105 krát menší než KMS.
Reakce katalyzovaná S-adenosyltransferázou tak je příkladem katalýzy tzv. „jednosměrným“ enzymem. Obdobné příklady lze nalézt v reakcích katalyzovaných transportními a svalovými ATPázami aj. Jsou dokladem, že vazebná energie ligandů (S a P) může být použita jednou pro vazebné účely (v uvedeném příkladu – v činnosti S-adenosyltransferázy – pro vazbu produktu P), a jindy pro snížení aktivační energie a urychleni reakce (v uvedeném přikladu jde o urychlení reakce v přímém směru).
Kompetice většího počtu substrátů o aktivní místo
Rovnice (xiv) popisuje zvláštní případ obecnější situace, kdy o aktivní místo enzymu soutěží více substrátů. Máme-li zjistit poměr rychlostí, v jakém budou enzymem zpracovávány dva nebo více substrátů, lze podle (viii) použít
a
Poměr rychlostí potom vyjadřuje následující rovnice (xv):
Vyplývá z ní, že o přednostním zpracováni substrátu enzymem rozhoduje podíl kkat/KM, a ne pouze podíl hodnot KM nebo Vmax. Znovu se potvrzuje, že specifičnost katalyzátoru zahrnuje jak vazebnou, tak i rychlostní komponentu katalýzy.
Reakce limitované difúzí
Konstanta k1 vystupující v rovnici (vii) je složenou konstantou, která zahrnuje konstanty všech jednotlivých stupňů celého procesu vazby S na E a vytvoření ES. Zpravidla jde o vícestupňový proces. Hodnota konstanty kkat/KM je potom limitována hodnotou rychlostní konstanty nejpomalejšího stupně vazby (např. nutností desolvataoe, konformační změny a pod.) a nemůže ji překročit.
Pro teoretický rozbor lze vazebný děj považovat za jednostupňový a soustředit se pouze na omezující vliv difúze na rychlost enzymové reakce. Níže se tedy přepokládá, že všechny ostatní stupně vazby jsou mnohem rychlejší než difúze.
Z přístupu rozpracovaného M. Smoluchowským (1917) vyplývá, že konstanta difúze kD, s níž jedna (sférická) částice difunduje ke druhé a setkává se s ní, je rovna
kde ζ je viskozita prostředí. Při rovnosti poloměrů obou částio ra = rb vychází hodnota kD ve vodě při 25 °C asi 7.109 mol-1.l.s-1.
Odtud lze dovodit, že maximální hodnota kD, určující frekvenci setkání S s E, je o 1 – 4 řády menší, než je teoretická horní hranice pro konstanty kkat chemických přeměn komplexu ES. Proto počet srážek může být limitujícím faktorem rychlosti chemických (katalyzovaných) reakcí. V takových případech se hovoří o reakcích limitovaných difúzí.
Chemické stupně přeměny substrátu v produkt mohou probíhat rychleji než difúze. Děje se tak zpravidla tehdy, když jsou katalyzovány vysoce vyvinutými enzymy.
Je-li typickou hranicí k1 ∼ kD asi 109 mol-1.l.s-1, pak pro vysoce vyvinuté enzymy by podle (vii) a (viii) měla veličina KM = kkat/k1 dosahovat hodnoty kolem 10-9 kkat. Jestliže [S] ≪ KM, pak podle (viii) je
v = 109 . [E] . [S] ≅ 109 [Et] . [S] (rovnice xvi)
Uvedený výraz představuje difúzní limit maximální rychlosti tvorby produktu pro případy, že jediným faktorem, který určuje další rychlost reakce, je katalytická schopnost enzymu.
„Evolučně dokonalý“ enzym
Z rovnioe (viii) je patrné, že při konstantní koncentraci substrátu může dojít ke zvýšení rychlosti následujícími cestami:
- Zvýšením [Et]. Při zachováni všech ostatních parametrů se následně zvyšuje hodnota volného [E] (v souladu s (xii)). Možnost, že by za fyziologických podmínek mohla [Et] překročit číselnou hodnotu KM substrátu, však není příliš pravděpodobná. Zvyšování [Et] („extenzívní cesta“) ani není žádoucí, protože klade nároky na proteosyntetioký aparát a na energetické zabezpečení jeho činnosti.
- Při stálé hodnotě [Et] lze hodnotu [E] zvýšit zvětšením KM. Potom se [E] zvyšuje v souladu se vztahem (xiii).
- Vzrůst KM však má za následek pokles hodnoty podílu kkat/KM, a tedy snížení rychlosti v. Je proto žádoucí, aby zvýšení KM bylo zároveň provázeno současným zvýšením kkat - jinými slov aby část vazebné energie, ušetřená zvětšením KM, byla využita ke snížení aktivační energie chemické přeměny.
V případě, že KM ≈ (k-1 + kkat)/k1, může KM vzrůst diky zvětšení pouze k-1 beze změny kkat. Potom hodnota kkat/KM skutečně poklesne.
Jindy však, což je žádaný případ, může KM vzrůst diky zvětšení k-1 i kkat. Jestliže přitom roste kkat rychleji než k-1, spěje systém k dosažení mechanismu van Slyka a Cullena.
K podobnému závěru vede rozbor podrobnějších modelů (např. (i) a vztahů (ix) a (x)) – jestliže KM roste díky zvětšení rychlostních konstant uni-molekulárních stupňů především přímého směru reakce, roste kkat/KM i při zvětšováni KM.
Zvětšení kkat pak dovoluje udržet Vmax i při poklesu [Et] („intenzívní cesta„).
Princip maximalizace KM při zachování kkat/KM
Enzymy se skutečně vyvíjejí k vyšším KM při zachování kkat/KM. Hovoří se o principu maximalizaoe KM při zachování kkat/KM. Tento princip protiřečí rozšířenému mylnému dojmu, že čím „lepší“ je enzym, tím pevněji váže substrát. Je však v souladu s poznáním úlohy vnitřní vazebné energie v enzymové katalýze.
Za „evolučně dokonalý“ se považuje enzym, který má KMS ≫ [S] a (kkat/KM) ∼ k1 ≅ 108-109 mol-1 . l . s-1 ≈ kD. Jak ukazuje rovnice xvi, zpracování substrátu takovým enzymem probíhá rychlostí difúze.
Hodnoty KM, a kkat/KM nemohou růst nad všechny meze. Přesnější analýzy posunují hodnoty KM do okolí KM ∼ [S], k2 do oblasti k2 ∼ k-1 a hodnoty kkat/KM k maximu asi pouze 10-1 k1 anebo níže.
Kritéria bývají odvozována z předpokladu, že enzym má zajistit co největší reakční tok. Tento předpoklad není univerzální. Nezahrnuje např. enzymy, které zajišťují plynulý tok produktů i přes to, že hladiny jejich substrátů výrazně kolísají (např. proteolytické trávicí enzymy), anebo enzymy, které mají v metabolickýoh cestách regulační úlohu. Kromě toho se „katalytioká dokonalost“ izolovaného enzymu nemusí shodovat s dokonalostí enzymových komplexů, které jsou činné in vivo. Enzymy se vyvíjejí v rámci složitějších biokatalytických systémů a ani dosažení maximálnich hodnot kritéria kkat/KM při vysokých KM nevyčerpává veškeré možnosti jejich evoluce.
Hodnota kkat/KM termodynamicky nevýhodné reakce nemůže, jak vyplývá ze vztahu (xiv), dosáhnout katalytického limitu – hodnota kkat/KM zpětné reakce by pak přesáhla difúzní limit.
Kinetický potenciál
Poměr kkat/KM se někdy také označuje jako katalytický potenciál anebo jako katalytický výkon, katalytická aktivita.
Pro výstižnější hodnocení skutečné katalytické schopnosti in situ se nahrazuje poměrem Vmax/KM (kinetický potenciál neboli kinetický výkon, kinetická aktivita). I tento poměr je zdánlivou konstantou 1. řádu. Ze vztahů (ii) a (iii) vyplývá, že je roven rychlosti přeměny jednotkové koncentrace substrátu v podmínkách, kdy [S] je faktorem limitujícím rychlost.
Teoretickou horní hranicí hodnot Vmax/KM je (analogicky ke kritériu kkat/KM) hodnota
Vmax/KM = k1[Et]
při k1 = kD.
Zpracoval: Jaroslav Veselý, Ústav patologické fyziologie LF UP v Olomouci a Katedry fyziologie a patofyziologie LF OU v Ostravě.