CHRONICKÁ OBSTRUKČNÍ ONEMOCNĚNÍ PLIC
Chronická obstrukční onemocnění plic jsou charakterizována chronicky zvýšeným odporem a ztíženým prouděním vzduchu v dýchacích cestách.
Tuto podmínku splňují:
- Chronická obstrukční plicní nemoc (CHOPN)
- Chronická bronchitida
- Emfyzém
- Astma bronchiale
- Bronchiektázie
- Cystická fibróza
V následujícím textu se budeme věnovat hlavně detailnímu rozboru chronické obstrukční plicní nemoci a astma bronchiale. Věnujte prosím pozornost také následujícím materiálům:
Téma: Funkční anatomie a fyziologie respiračního systému.
Záznam přednášky: Transport kyslíku krví.
Záznam přednášky: Úvod do patofyziologie dýchacího systému.
Záznam přednášky: Klasifikace plicních onemocnění, význam spirometrie (v této přednášce jsou také blíže popsána vyšetření znázorněná na obr. 1 a 2).
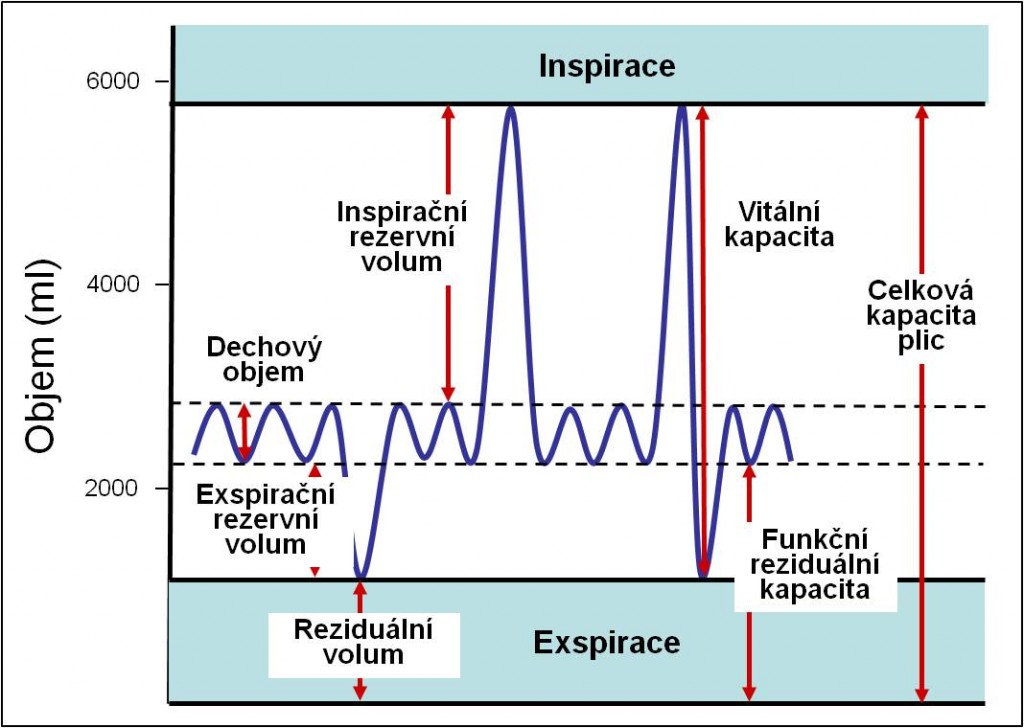
Obr. 1 Spirometrické objemy a kapacity. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.)
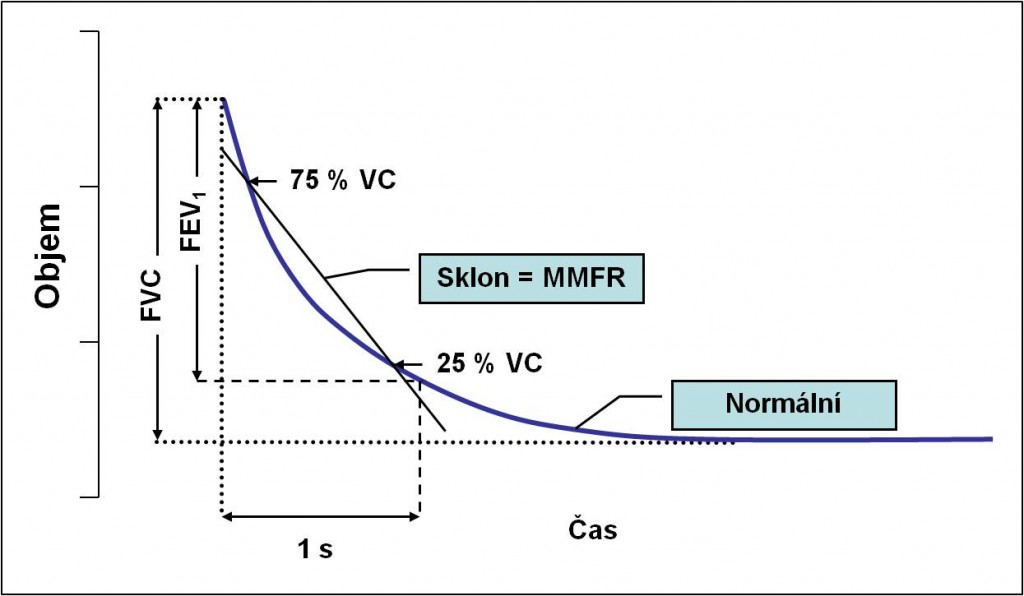
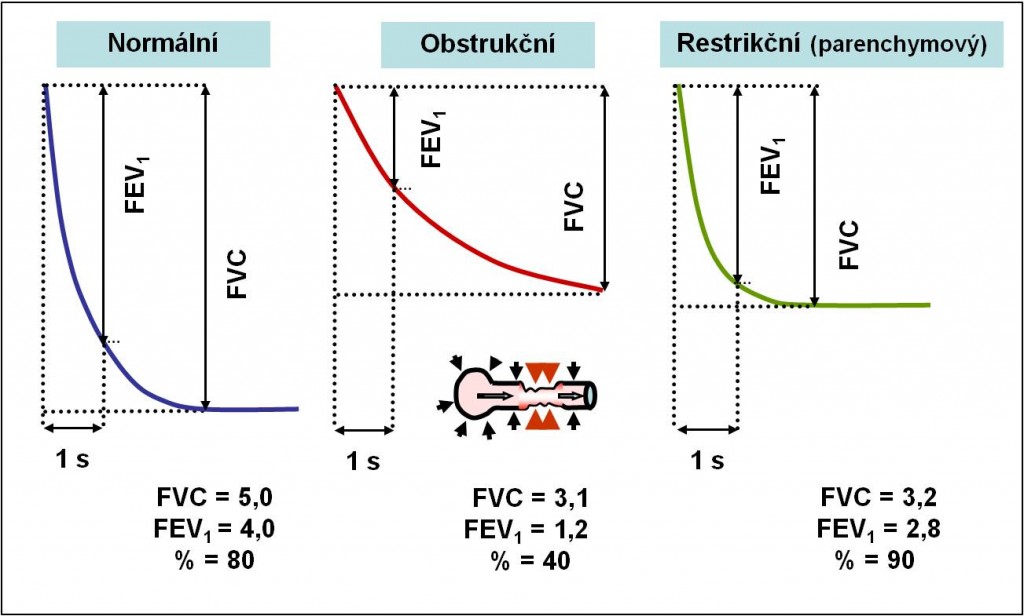
Obr. 2. Měření FVC, FEV1 a FEF25-75%. FVC = vitální kapacita při usilovném výdechu; FEV1 = objem usilovného výdechu za 1 s; FEF25-75% = objem usilovného výdechu mezi 25 % a 75 % FVC; MMFR = střední maximální výdechový proud. (Podle RA Hope et al.: Oxford Handbook of Clinical Medicine, 3rd Ed. Oxford , New York.1994.)
Chronická obstrukční plicní nemoc (CHOPN)
Chronickou obstrukční plicní nemoc charakterizuje obstrukce dýchacích cest, která není plně reverzibilní. Obstrukce má progredující charakter. Nemoc se projevuje ztíženým výdechem a poklesem výdechové rychlosti. Přestože je CHOPN primárním onemocněním plic, může mít často systémové následky. Složkami CHOPN jsou chronická bronchitida a emfyzém.
Epidemiologie CHOPN
Chronickou obstrukční plicní nemocí v současnosti trpí na celém světě přibližně 600 milionů obyvatel (ve srovnání s astmatem je to dvojnásobný počet pacientů). Mezi neinfekčními nemocemi světa se řadí CHOPN na druhé místo. Prevalence výskytu zatím není stálá, ale pořád stoupá. Příčinou vzestupu této nemoci je rozhodně nárůst kouření tabáku, a to nejenom u mužské populace, ale rapidní vzestup zaznamenáváme právě u ženské populace, hlavně u mladých dívek a žen. V České republice se prevalence CHOPN pohybuje kolem 8 % všech obyvatel, což je asi 800 tisíc pacientů.
Mortalita se u nás pohybuje kolem 3 tisíce pacientů za rok. Incidence CHOPN závisí také na vyhledávání rizikových osob, což jsou kuřáci, kteří kouří aspoň 20 cigaret za den po dobu 20 let. Aktivní dispenzarizace by měla platit už pro pacienty s chronickou bronchitidou, vzhledem k tomu, že touto nemocí trpí více než 50 procent všech kuřáků. Nejnovější studie ukazují, že plně rozvinutá CHOPN vzniká u osob s chronickou bronchitidou až ve 49 procentech. Nejúčinnější prevencí je nezačít kouřit!
S přibývajícím věkem pacienta stoupá i prevalence CHOPN. Odráží se to jak na morbiditě, tak na mortalitě těchto lidí. I když v současnosti pozorujeme u ženské populace vzestup CHOPN, pořád je výskyt této choroby u mužů častější. Ke vzniku CHOPN vyvolané kouřením jsou náchylnější ženy než muži, vzhledem ke své menší postavě a k většímu sklonu k bronchiální hyperreaktivitě. Svoji roli sehrává i podceňování diagnózy CHOPN.
Rizikové a vyvolávající faktory CHOPN
Faktory hostitele:
- genetické vlivy
- bronchiální hyperreaktivita
- růst plic (průběh gravidity, porodní hmotnost, životospráva matky během těhotenství, respirační infekce v časném dětství…)
Faktory prostředí:
- tabákový kouř (aktivní i pasivní). Tabák je jediný legální produkt na trhu, který člověka poškozuje a následně zabíjí v doporučených dávkách.
- profesní nákazy (prachy, chemikálie)
- znečištění ovzduší
- znečištění domovního ovzduší
- infekce
- strava
- sociálně ekonomické postavení
Faktory vyvolávající exacerbaci:
- bakteriální respirační infekce
- virové respirační infekce
- znečištění ovzduší
- přerušení terapie
- chladné počasí
Etiopatogeneze CHOPN
Hlavní složkou patogeneze a patofyziologie je chronický zánět s oxidačním stresem a nerovnováha mezi proteázovým a antiproteázovým systémem. Patofyziologické změny, které se v průběhu CHOPN vyvíjejí, se nedotýkají jenom průdušek, ale i plicního parenchymu. CHOPN jako primární onemocnění plic má i svoji systémovou komponentu, která se může projevit např. dystrofií kosterního svalstva a poruchou výživy organismu. Hlavním patofyziologickým faktorem je obstrukce dýchacích cest a hyperinflace plic. Trvalá progrese CHOPN vede až ke vzniku respirační insuficience.
Za nejvýznamnější patogenetický mechanismus se považuje zánět, který neustále akceleruje a progreduje. Pokud se CHOPN pozdě diagnostikuje (což je velmi časté), přítomný zánět je tak rozvinutý, že ani eliminace expozice nedokáže zánětlivou složkou úplně odstranit. Dochází k remodelačnímu procesu hlavně na periferii plic, kde se postupně destruuje parenchym – vzniká emfyzém a dochází k fibróze periferních dýchacích cest – vznik chronické obstrukční bronchiolitidy. Současně jsou postiženy i plicní cévy.
Základní buněčné typy
Chronického zánětu při CHOPN se účastní řada buněk:
- neutrofily – nachází se jak ve sputu, tak v tekutině získané bronchoalveolární laváží. Neutrofily produkují neutrofilní elastázu, kathepsin, metalproteinázu, aj. Elastáza a katepsin se podílejí na destrukci plicního parenchymu.
- makrofágy – jejich zvýšený počet se vyskytuje už u mladých kuřáků. Nachází se ve sputu, v tekutině z bronchoalveolární laváží, v subepiteliální vrstvě bronchů i ve stěně alveolů. Makrofágy po aktivaci produkují TNFα (hlavní cytokin zánětu u CHOPN) a leukotrien B4. Uvolněný TNFα vede k zvýšené produkci IL-8 a přísunu neutrofilů do místa zánětu.
- eozinofily – jsou přítomné ve sputu, ale nejsou degranulované (ve srovnání s astmatem)
- dendritické buňky – antigen prezentující buňky
- žírné buňky – buňky časné alergické reakce, ale i chronického zánětu
- fibroblasty – jejich aktivace probíhá uvolňováním mediátorů z ostatních buněk, podílí se na perzistenci zánětu
- T-lymfocyty – nejdůležitějším podtypem T-lymfocytů, který se účastní zánětlivé odpovědi u CHOPN, jsou Th2 lymfocyty (CD8+). Dochází k značnému nepoměru mezi CD8+ a CD4+ lymfocyty ve prospěch CD8+ lymfocytů
- B-lymfocyty – jako buňky paměťové, představují dlouhodobou zánětlivou odpověď (společně s T-lymfocyty, na rozdíl od neutrofilů, makrofágů či eozinofilů)
Hlavní zánětlivé mediátory
- leukotrien B4 (LTB4) – produkován makrofágy. Je považovaný za chemoatraktant pro neutrofily
- interleukin 8 (IL-8) – produkován makrofágy i neutrofily se stejnými účinky jako LTB4
- tumor nekrotizující faktor (TNFα) – po jeho vyplavení se aktivuje prozánětlivý transkripční faktor, který následně vede k zvýšené produkci IL-8
Reaktivní formy kyslíku a dusíku
Volné radikály a oxidanty, které vznikají při inhalaci tabákového kouře, vedou k rozvoji zánětu v dýchacích cestách. Kromě toho poškozují buněčné membrány, narušují fyziologický průběh biochemických reakcí a vedou též k nerovnováze mezi proteázovým a antiproteázovým systémem. Oxidační stres můžeme hodnotit za pomoci zvýšené hladiny oxidu dusnatého a peroxidu vodíku, který má i bronchokonstrikční účinek. Neenzymatickou peroxidací membránových lipidů účinkem oxidačního stresu vznikají isoprostany, které vedou k bronchokonstrikci a zvýšené sekreci hlenu. Touto peroxidací vznikají i látky, které vedou k dysfunkci kosterní svaloviny.
Poškození mukociliárního aparátu
Při působení dráždivých látek (tabákový kouř, znečištěné ovzduší…), dochází v dýchacích cestách k poškození řasinek cylindrického epitelu, na kterém se postupně vyvíjí dlaždicová metaplazie, což vede k mukociliární dysfunkci. Další změnou, která se odehrává, je hypertrofie mukózních žlázek se zmnožením pohárkových buněk, čímž se zvyšuje produkce hlenu a kvůli mukociliární dysfunkci je zhoršený posun hlenu orálním směrem. Stáza a nadprodukce hlenu nevede jenom k obstrukčním poruchám v plicích, ale zároveň dává predispozici k bakteriální kolonizaci sliznic s dalšími klinickými následky.
Dysbalance mezi proteázovým a antiproteázovým systémem
U CHOPN dochází k převaze proteázového systému nad antiproteázovým systémem. Za fyziologických okolností jsou protézy inhibovány α1-antitrypsinem, α1-antichymotrypsinem aj. (vrozený deficit α1-antitrypsinu způsobuje vznik emfyzému). Na nerovnováze obou komponent se podílí také oxidační stres (viz výše). Neutrofilní elastázy pokud nejsou inhibovány vedou k masivní degradaci elastinu a zvyšují sekreci hlenu.
Brochiální hyperreaktivita
Bronchiální hyperreaktivita (BH) je charakterizována jako zvýšená bronchokonstrikční odpověď na podněty endogenního nebo exogenního původu. BH je určitá predispozice nebo sklon k bronchokonstrikci, není to bronchokonstrikce sama. I když BH má genetický základ, klíčovým faktorem k jejímu vzniku je zánět. Ke stanovení nadměrné reaktivity průdušek se využívají bronchokonstrikční provokační testy s hodnocením plicních funkcí před a po inhalaci určitých nespecifických nebo specifických látek, které přímo stimulují hladké svaly (histamin, acetylcholin, metacholin, látky z profesního prostředí). Lze také využít i nepřímé stimuly, kterými mohou být hyper nebo hypotonické roztoky. Další možností jsou zátěžové testy v podobě volného běhu nebo bicyklové ergometrie. V hodnocení bronchokonstrikčního testu se nejvíc využívá hodnota FEV1. Za pozitivní reakci považujeme pokles FEV1 o 20 % ve srovnání s hodnotou před provedením testu.
Obstrukční projevy v dýchacích cestách
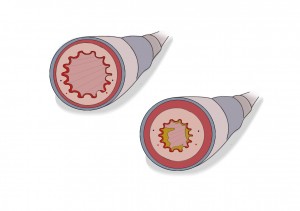
Ireverzibilní obstrukce bronchů (obr. 3) je důležitým patofyziologickým znakem CHOPN. Obstrukce souvisí se zánětlivou remodelací periferních průdušek (průměr menší než 2 mm). U zdravých lidí se na celkové rezistenci dýchacích cest periferní průdušky podílejí jen malou měrou. U pacientů s CHOPN však rezistence v periferních dýchacích cestách hraje významnou roli. Celkově se na obstrukci u CHOPN podílejí: zánětlivé až fibrotické procesy s edémem a hypersekrecí sliznice, zúžení bronchů s tkáňovou přestavbou, alveolo-kapilární destrukce (emfyzém) spojena s plicní hypertenzí. Akutní zánět a konstrikce hladké svaloviny bronchů jsou děje reverzibilní. Jako ireverzibilní stavy hodnotíme fibrózu se zúžením bronchů a destrukci parenchymu plic. Snižování elastické podpory periferních dýchacích cest při exspiriu vede k předčasnému uzavírání bronchiolů, které má za následek zvyšování objemu plic na konci výdechu. Tento stav se označuje jako plicní hyperinflace. Hrudník se nachází v inspiračním postavení a každým dalším nádechem se zvyšuje reziduální objem plic.
Příznaky CHOPN
Klinické projevy u CHOPN jsou stejné jako u chronické bronchitidy: kašel s vykašláváním sputa aspoň po tři měsíce v jednom roce a minimálně ve dvou po sobě následujících letech. Ke kašli se přidává dušnost při námaze, která je důsledkem obstrukce bronchů a zvýšeného reziduálního objemu plic. Obě tyto příčiny můžeme objektivizovat za pomocí spirometrického vyšetření. Obstrukce bronchů se subjektivně projevuje dušností. Objektivně můžeme slyšet na plicích fenomény jako pískoty a vrzoty. Hyperinflace je důsledkem obstrukce dýchacích cest (air trapping - výdechový kolaps některých bronchů a zvyšování reziduálního objemu) a posunu dýchání do oblasti vyšších plicních objemů – jde o adaptivní mechanismus umožňující redukci obstrukce dýchacích cest zvýšením obvodového tahu (obr. 4 - 6). Hyperinflace nejvíce koreluje s projevy dušnosti. Kašel vzniká iritací senzorických nervů v dýchacích cestách, mediátory zánětu a zvýšenou produkcí sputa.
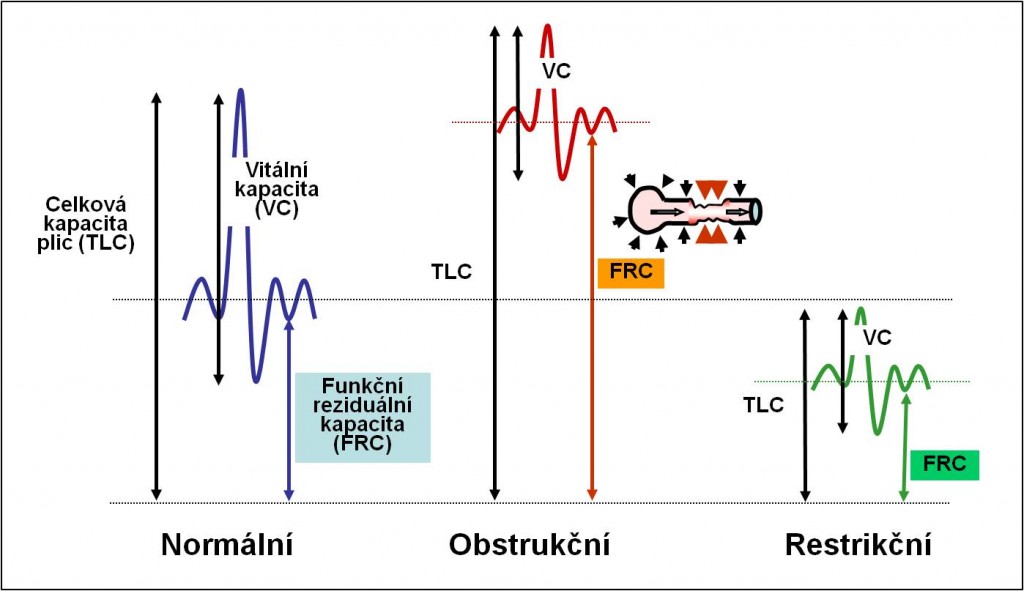
Obr. 4. Spirometrické nálezy u obstrukčních a restrikčních poruch. (Podle RA Hope et al.: Oxford Handbook of Clinical Medicine, 3rd Ed. Oxford , New York.1994.)
Obr. 5. Příklady spirogramů obstrukčních a restrikčních poruch. (Podle RA Hope et al.: Oxford Handbook of Clinical Medicine, 3rd Ed. Oxford , New York.1994.)
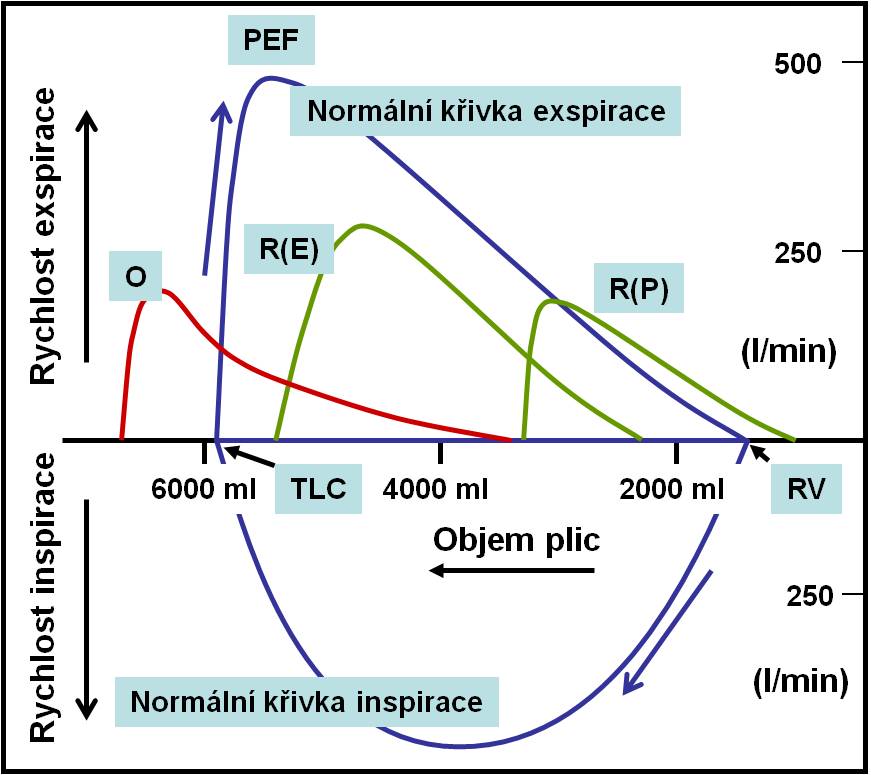
Obr. 6. Křivky proud-volum hlavních respiračních poruch. O – obstrukční; R(E) – restrikční extraparenchymová; R(P) – restrikční intraparenchymová; TLC – celková kapacita plic; RV – reziduální volum; PEF – vrcholová výdechová rychlost. Volum plic se podle konvence zvětšuje směrem doleva! (Podle Harrison´s Principles of Internal Medicine, 15th Ed. McGraw-Hill, New York, 2001.
Rozvoj plicní hypertenze vede časem ke vzniku cor pulmonale (CP) – postižení pravé komory na základě postižení plic. Rozlišujeme akutní a chronické cor pulmonale (CP). Akutní CP je dilatace pravé komory při akutní plicní hypertenzi – příkladem je plicní embolie. Chronické CP je hypertrofie pravé komory, která je způsobená plicní hypertenzí při plicních onemocněních – při CHOPN, plicní fibróze apod. (Hypertrofie pravé komory na podkladě jiné příčiny než je plicní onemocnění – např. při levostrannén srdečním selhávání, není cor pulmonale!) K tomu, že se u CHOPN vyvine hypoxemická prekapilární plicní hypertenze přispívají faktory, mezi něž patří destrukce kapilár při emfyzému, vazokonstrikce, remodelace plicních artérií. Pokud se vyvine pravostranné srdeční selhání, projevuje se žilní stázou a trombózami, které ohrožují pacienta embolizací do plic a tím dále zhoršují plicní cirkulaci.
Příčinou respiračního selhání u CHOPN jsou:
- Emfyzém – redukce plicního parenchymu – kritické snížení funkčních rezerv plic při případné infekci.
- Ztížené dýchání proti odporu na vyšších plicních objemech → zvyšování dechové práce.
- Dýchací svaly pracují mimo optimální délkové poměry (inspirační postavení hrudníku) → rychlejší únava svalů → respirační selhání.
Pokud exacerbace projevů není těžkého stupně, bývá přítomna mírná hypoxemie a hypokapnie (kompenzační mechanismus hypoxemie, někdy i bez hypoxemie). Objevení se hyperkapnie signalizuje únavu dýchacích svalů a inhibuje dýchací centrum. Tento stav se označuje jako CO2 narkóza. Prohlubování těchto dějů může vést ke vzniku respirační acidózy.
CHRONICKÁ BRONCHITIDA
Definice chronické bronchitidy je založena na symptomech, ne na morfologickém podkladě. U pacienta musí být přítomný produktivní kašel nejméně tři měsíce v jednom roce a minimálně ve dvou po sobě následujících letech. U této nemoci můžeme definovat ještě několik stavů:
- jednoduchá chronická bronchitida – kašel s expektorací, dýchací cesty bez známek obstrukce
- chronická astmatická bronchitida – hyperreaktivita dýchacích cest, intermitentní záchvaty astmy
- chronická obstrukční bronchitida – spirometrický nález obstrukce dýchacích cest
Etiopatogeneze chronické bronchitidy
Faktory, které vyvolávají chronickou bronchitidu, mohou být různé. Jejich společnou vlastností ale je dráždění dýchacích cest s následným rozvojem zánětlivé reakce. Nejčastějším faktorem vedoucím ke vzniku zánětu je na prvním místě kouření. V menší míře se uplatňují složky životního prostředí, bakteriální nebo virové infekce.
Účinek cigaretového kouře:
- obsah iritačních látek, které působí na dýchací cesty
- inhibice ciliárního transportu hlenu a zvýšená produkce hlenu přes receptory EGF
- chemické kancerogeny
- porucha transportu kyslíku hemoglobinem
Hypersekrece hlenu je spojena s hypertrofii hlenových žláz v podslizničním prostoru trachey a bronchů. Ve sliznici bronchiolů se zvyšuje i počet hlenotvorných buněk. U bronchiolů < 2 mm vede zvýšená produkce hlenu k obstrukci dýchacích cest.
Za chronický zánět jsou zodpovědné neutrofily, makrofágy, T buňky (CD8+). Nejsou přítomné eozinofily. Ty se vyskytují jenom u astmatické bronchitidy. Následkem zánětu vzniká edém a ztluštění sliznice dýchacích cest. Dochází k nadměrné sekreci hlenu. Může docházet k fibróze bronchiolů a k hyperplazii hladké svaloviny. Všechny tyto změny vedou k obstrukci dýchacích cest. Chronická bronchitida může časem vést ke vzniku CHOPN (viz výše).
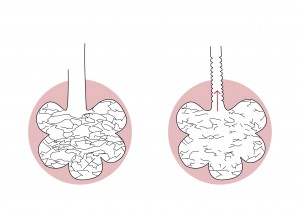
EMFYZÉM
Emfyzém je stav, u kterého vzniká nahromadění vzduchu v tkáních. Emfyzém plicní neboli rozedma plic (obr. 7) se definuje jako trvale zvětšené a dilatované dýchací cesty distálně od terminálních bronchiolů spojené s destrukcí a ztrátou alveolárních sept. Na rozdíl od chronické bronchitidy je to definice založena na morfologickém podkladě a nepostihuje struktury nad terminálními bronchioly. Obě tyto nemoci mohou být současně přítomny například u kuřáků nebo se emfyzém vyskytuje izolovaně u pacientů s vrozeným deficitem α1-antitrypsinu.
V průběhu postupných ztrát sept dochází i k zánikům úponů, které udržují otevřené drobné poddajné distální bronchioly. To má za následek kolaps dýchacích cest hlavně při výdechu, s následným hromaděním vzduchu za překážkou. Tato porucha se klinicky projeví jako výdechová dušnost. U nemocných můžeme pozorovat aktivní výdech (sešpulené rty).
Klinickým projevem plicního emfyzému je kašel a námahová dušnost. Při fyzikálním nálezu můžeme pozorovat soudkovitý tvar hrudníku a vyklenutí podklíčkové a nadklíčkové jamky. Na hrudi je přítomný hypersonormní poklep. Na RTG snímku je vidět projasnění plicních polí.
Pacienty s plicním emfyzémem můžeme rozdělit do dvou klinických kategorií.
- V první kategorii – emfyzematická forma – se nachází většinou asteničtí pacienti se soudkovitým hrudníkem. Pacienti jsou sice dušní, ale není přítomná cyanóza. Tento typ pacientů se označuje jako růžový typ – „pink puffers“.
- Druhá kategorie - bronchiální forma - je typická pro obézní pacienty s protruzí bulbů, s cyanózou a známkami dekompenzovaného cor pulmonale. Jedná se o tzv. modrý typ pacientů – „blue bloaters“.
Typy emfyzémů podle patologicko-anatomických změn:
- centrolobulární emfyzém – postižený převážně začátek acinu s respiračním bornchiolem. Výskyt u kuřáků.
- panacinární emfyzém – difuzní postižení alveolů. Výskyt při defektu α1-antitrypsinu.
- distální emfyzém – postižení konečných částí acinů pod viscerální pleurou. Riziko vzniku pneumotoraxu (např. při kašli).
Porucha plicních funkcí při emfyzému není spojena jenom s poruchou difuze (destrukce alveolů → redukce plochy), ale i s poruchou perfuze (se zánikem sept zanikají i kapiláry). Zánik cév společně se spazmem cév v důsledku hypoxie vede u pacientů s emfyzémem k rozvoji prekapilární plicní hypertenze, ze které se vyvíjí pravostranná hypertrofie srdce až pravostranné selhání. Asi 10 % – 15 % pacientů s CHOPN tak umírá na selhání pravého srdce.
Kromě plicního emfyzému rozlišujeme ještě podkožní a mediastinální emfyzém. Podkožní emfyzém bývá přítomný např. u pneumotoraxu nebo zlomených žeber. Při fyzikálním nálezu u pacienta cítíme pod prsty praskání, které vzniká na podkladě pohybu vzduchu v intersticiu. Současně s tímto typem emfyzému se vyskytuje často i mediastinální emfyzém. Auskultačně ho můžeme diagnostikovat nad mediastinem jako třecí šelest, který je synchronní se srdeční činností.
ASTMA BRONCHIALE
Astma bronchiale (AB) je chronické zánětlivé onemocnění dýchacích cest. Chronický zánět je spojen s bronchiální hyperreaktivitou, která vede k epizodické záchvatovité obstrukci s dušností, tíží na hrudi a kašlem. Tato obstrukce je často reverzibilní buď spontánně, nebo vlivem terapie.
Epidemiologie bronchiálního astmatu
V současnosti je na světe asi 300 milionů astmatiků. Celková prevalence astmatu v ČR je kolem 8 %, u dětí dokonce 12 – 15 %. Incidence astmatu pořád stoupá, a to zejména u dětí. Byla zjištěna koincidence astmatu s alergickou rýmou. 80% astmatiků trpí alergickou rýmou. Astma těžkého stupně se vyskytuje u 5% všech astmatiků. Mortalita je především spojena s nedostatečnou nebo chybějící dlouhodobou protizánětlivou léčbou.
Rizikové a vyvolávající faktory astma bronchiale
Faktory hostitele:
- genetická predispozice
- atopie – skoro 50% astmatiků má atopickou anamnézu
- hyperreaktivita dýchacích cest
- rasa a etnický původ
- pohlaví
- perinatální faktory – nízká porodní hmotnost, kuřáctví matky
Faktory prostředí:
- alergeny vnějšího prostředí – pyly
- znečištění vnějšího ovzduší – průmyslový smog
- alergeny obytných budov – domácí prach (roztoči, domácí zvířata…)
- profesní ovzduší
- kouření
- infekce dýchacích cest
- potraviny
Faktory vyvolávající exacerbaci:
- alergeny
- respirační infekce
- hypoventilace
- počasí a vzdušné polutanty – teplotní inverze, oxid siričitý
- potraviny
Etiopatogeneze AB
Na etiopatogenezi astmatu se kromě dědičných faktorů podílejí imunologické mechanismy, autonomní nervový systém, inhibice cyklooxygenázy-1 nesteroidními antiflogistiky a jiné faktory, u kterých není jasné, jak vyvolávají bronchokonstrikci (námaha, stres, chladný vzduch…)
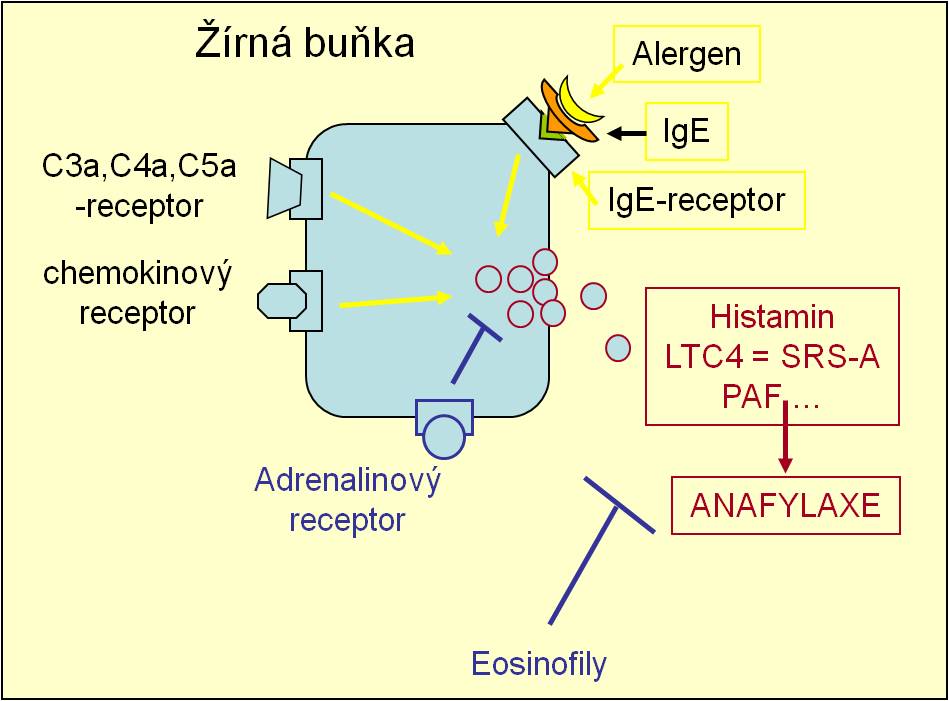
Genetická predispozice k alergické reakci na běžné podněty zprostředkované IgE se nazývá atopie (obr. 8). Pojmem alergie označujeme fenotypický projev atopie. Opakovaný kontakt organismu s alergenem navozující proces senzibilizace a v konečném důsledku i aktivace specifické imunologické reakce, je základní podmínkou vzniku alergického onemocnění. Imunologické reakce se projeví nejvíce v oční spojivce, ve sliznici dýchacích cest, v kůži a v sliznici střev. Život ohrožující alergická reakce – anafylaktický šok vzniká, pokud pronikne alergen přímo do krve pacienta.
Obr. 8. IgE a žírné buňky v bronchiální reakci při astmatu.
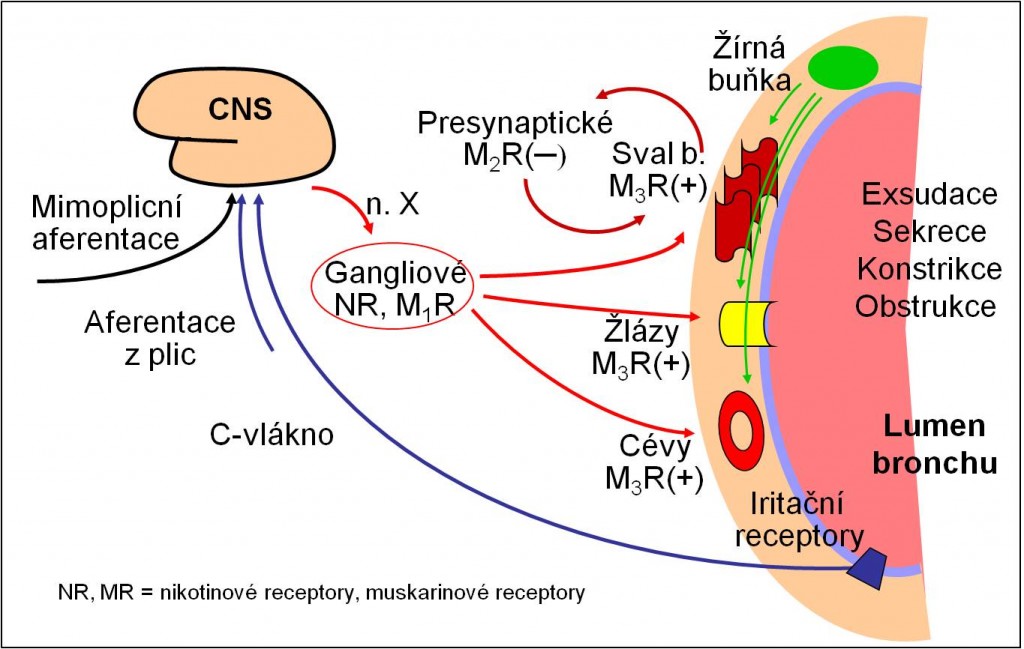
Z autonomního nervového systému se uplatňuje převaha parasympatiku a uvolňování neuropeptidů ze zakončení senzorických nervů (obr. 9). Tyto působky vedou k vazodilataci, k zvýšené permeabilitě cévní stény, bronchokonstrikci a zvyšování sekrece hlenu.
Obr. 9. Neimunologická (cholinergní) bronchiální obstrukce.
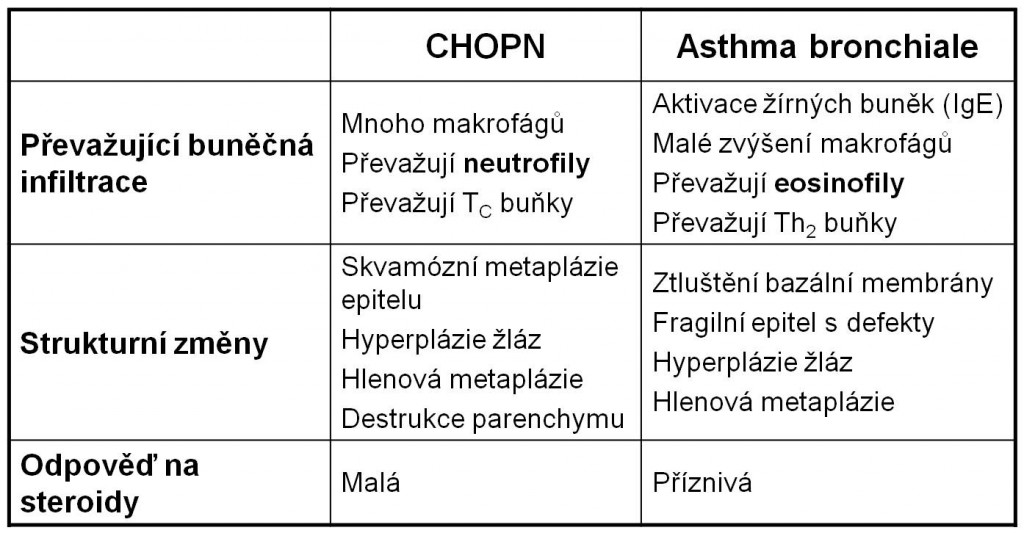
Mezi hlavní buněčné typy, které se podílejí na zánětu, řadíme (tabulka 1):
- eozinofily – klíčové buňky pozdní fáze alergické reakce a jsou odpovědné za vznik alergického zánětu. Uvolňují mediátory, které poškozují epitel bronchů, vedou ke kontrakci hladkých svalů, zvyšují bronchiální hyperreaktivitu. Mediátory jsou uskladňované v eozinofilních granulích. Eozinofily možno najít ve sputu, v biopsiích, v bronchoalveolární laváži a v periferní krvi.
- žírné buňky – účastní se časné fáze alergické reakce i anafylaxe. Na svém povrchu mají kromě jiných receptorů, receptory pro IgE, adrenalin, chemokiny, komplement atd. Na vysokoafinitní receptor pro IgE se váže IgE stimulovaný alergenem, čímž dochází k degranulaci žírných buněk a uvolnění mediátorů, jako jsou histamin, leukotrieny, prostaglandiny aj., které vyvolávají bronchospasmus.
- antigen prezentující buňky – dendritické buňky (exprimují na svém povrchu HLA II.třídy)
- neutrofily – vyskytují se hlavné u pacientů s chronickým těžkým astmatem a v průběhu exacerbací. Produkují matrixové metaloproteinázy, které se účastní remodelace průdušek.
- U astmatu hrají klíčovou roli eozinofily (viz výše). V poslední době se zavedla nová nozologická jednotka non-eozinofilní astma, kde klíčovou roli sehrávají právě neutrofily. Tento typ astmatu se vyskytuje především u astmatiků kuřáků.
- makrofágy – se podílejí na přestavbě dýchacích cest, degradují makromolekuly extracelulární matrix
- bazofily – produkují prozánětlivé mediátory po vazbě a následném přemostění molekul IgE na jejich povrchu, cytokiny, přispívají i k pozdní alergické reakci
- T lymfocyty – u astmatu převažuje podtyp Th2. Má to zásadní význam pro rozvoj alergického zánětu. Tento podtyp lymfocytů produkuje cytokiny IL-4, které stimulují produkci protilátek u B lymfocytů. Produkcí jiných cytokinů dále ovlivňují funkci bazofilů, eozinofilů atd.
- epitelové buňky – za pomoci NO-syntázy produkují oxid dusnatý, který vede k vazodilataci a zvýšené sekreci hlenu. Také tvoří prozánětlivé cytokiny aj.
Tabulka 1. Zánět průdušek u CHOPN a asthma bronchiale.
Bronchiální hyperreaktivita
Bronchiální hyperreaktivitu (BH) můžeme chápat jako zvýšenou bronchokonstrikční odpověď. Je to sklon k bronchokonstrikci, ne bronchokonstrikce sama. Vyskytuje se u všech astmatiků, i když může postihnout i lidi bez astmatu. To znamená, že tyto dva stavy musíme od sebe odlišovat, a ne je považovat za stejnou nemoc.
Podněty, které vyvolávají zvýšenou bronchokonstrikční odpověď, můžeme rozdělit na endogenní a exogenní, nebo na podněty imunologického charakteru (IgE-závislé) a fyzikálního charakteru (IgE-nezávislé). V poslední době výzkum prokázal i genetickou predispozici k BH.
Klíčovým faktorem vedoucím ke vzniku BH je zánět. Ten usnadňuje kontrakci hladkého svalstva. I když hyperreaktivitu odstranit neumíme, můžeme aspoň potlačit známky zánětu. Všechny stupně BH (žádná, lehká, střední a těžká) korelují s tíží astmatu, se zánětem v dýchacích cestách i s úspěšností léčby.
Laboratorně se BH vyšetřuje bronchokonstrikčními testy, kde hodnotíme plicní funkce před a po podání inhalační látky. Mezi tyto látky řadíme např. histamin, acetylcholin, metacholin, které nespecificky přímo stimulují hladké svaly, nebo podáváme specifické látky vnějšího anebo pracovního prostředí, které upřesňují etiologii BH. Z nepřímých bronchokonstrikčních faktorů lze využít hyper- a hypotonické roztoky. Další možností je bicyklová ergometrie, hyperventilace chladného vzduchu aj. Pokles hodnoty FEV1 o 20 % znamená pozitivní reakci.
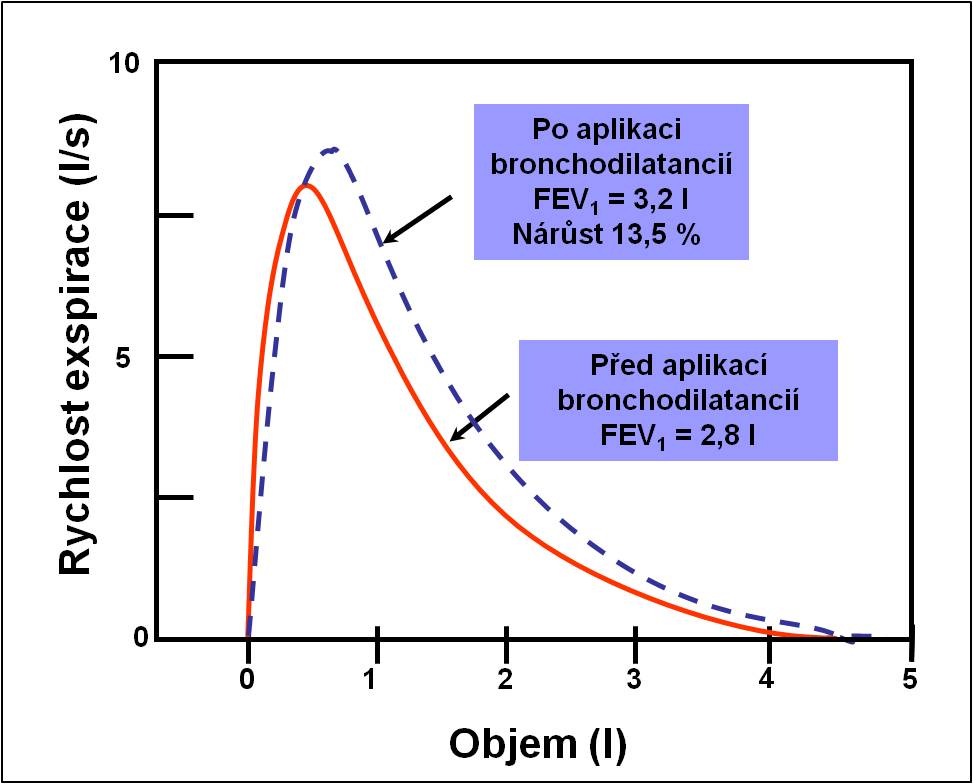
Obráceně hodnotíme vratnost bronchokonstrikce pomocí bronchodilatačních testů (obr. 11).
Obr. 11. Bronchodilatační test. Diagnóza podílu reverzibilní obstrukce u astmatu.
Obstrukce dýchacích cest u astmatu
Mezi faktory, které způsobují obstrukci u astmatu, řadíme:
- bronchokonstrikce
- edém sliznice průdušek
- tvorba hlenu a hlenových zátek
- chronická remodelace dýchacích cest
Akutní bronchokonstrikce jako fyziologická obranná reakce je u astmatiků porušena. Dochází k bronchiální hyperreaktivitě. Nějčastěji se tento stav spouští po degranulaci žírných buněk cestou závislou na IgE (po expozici alergenem). Jedná se o časnou astmatickou reakci. Mediátory, které se uvolňují (histamin, leukotrieny, prostaglandiny), vyvolávají kontrakci hladkých svalů. Přímo nebo nepřímo mohou hladké svaly stimulovat též nealergické podněty, jako jsou tělesná námaha nebo inhalace studeného vzduchu.
Edém sliznice průdušek je významný mechanismus obstrukce u pozdní astmatické reakce. Typicky nastává 6-20 hod. po kontaktu s alergenem.
Tvorba hlenu je z důvodu zánětu zvýšená. Tato zvýšená sekrece vytváří společně s odloupanými epiteliemi dýchacích cest zahuštěné zátky, které uzavřením periferních průdušek nejenže zhoršují dýchání, ale také zabraňují průniku inhalovaného léku.
Chronická remodelace dýchacích cest je výsledkem dlouhodobě probíhajicího zánětu a vede k fixaci daného patologického místa v dýchacích cestách, které mohlo být původně postiženo jen reverzibilní obstrukcí. Jedná se o ukládání kolagenu a fibronektinu do interstricia těsně pod epitelem. Dalšími strukturními změnami jsou hyperplázie pohárkových buněk i slizničních žlázek a hypertrofie hladkých svalů.
Reakce přecitlivělosti, atopie, časná a pozdní astmatická odpověď
Anafylaktická reakce vzniká při opakovaném kontaktu s alergenem. Je to reakce časného typu přecitlivělosti, která se rozvíjí po vazbě komplexů alergenů a IgE protilátek na specifické receptory na povrchu žírných buněk a bazofilů. Po degranulaci těchto buněk se uvolňuje řada mediátorů.
Za fázi senzibilizace považujeme vazbu IgE protilátek na receptory žírných buněk a bazofilů, která vznikne při prvním kontaktu s alergenem. Anafylaktická reakce se spouští vždy stejným způsobem, pokud se jedná o ten samý alergen. Při opakovaném setkání organismu s alergenem jsou IgE už navázané na dané buňky a degranulace buněk proběhne velmi rychle. Někteří lidé mají kromě toho určitou genetickou predespizici pro tento typ reakcí (atopie).
Atopickou reakci a anafylaktickou reakci nelze ztotožňovat. Atopie je genetická predispozice pro reakci přecitlivělosti časného typu na alergen nebo skupinu alergenů. Podstatou je zvýšená produkce protilátek typu IgE. Pacient s atopií reaguje uvolněním mediátorů anafylaxe již na velmi nízké množství alergenu. U těchto pacientů nalézáme zvýšené hladiny specifických i celkových hladin IgE abnormálně dlouho i bez další stimulace alergenem. Atopie se týká i bronchiální hyperreaktivity na histamin a jiné mediátory anafylaktické reakce.
I u astmatiků rozlišujeme dvě fáze anafylaktické reakce – časnou a pozdní astmatickou odpověď. Časnou astmatickou odpověď charakterizuje rychlé uvolnění mediátorů z mastocytů. Hlavním účinkem mediátorů je bronchokonstrikce. Pozdní astmatická odpověď se projevuje za několik hodin po časné odpovědi. Symptomy mohou být výraznější a trvat několik hodin nebo dnů. Kromě bronchokonstrikce se zvyšuje produkce hlenu, je zhoršený jeho mukociliární transport, zvyšuje se permeabilita kapilár a vzniká edém. Chemotaktické faktory vedou k zvýšenému přísunu eozinofilů, neutrofilů, trombocytů do místa stimulace žírných buněk. Eozinofily zase zpětně stimulují žírné buňky k uvolňování histaminu a chemotaktických faktorů, čímž vzniká bludný kruh.
Astmatický záchvat je vleklý záchvat nereagující na obvyklou terapii. V průběhu záchvatu se zjišťuje hypoxie, hyperkapnie (monitorují se krevní plyny) a změna acidobazické rovnováhy. Tento stav je nutné odlišit od jiných onemocnění, která doprovází dyspnoe. Záchvat u astmatika může připomínat záchvat kardiaka s akutním selháním levé komory. U kardiaka bývá přítomný galop a narůžovělé sputum (s příměsi krve).
Patofyziologie symptomů astmatu
Obstrukce bronchů, kašel, hyperinflace a respirační selhání jsou z patofyziologického hlediska vysvětleny v podkapitole Patofyziologie symptomů CHOPN.
Noční projevy dušnosti a kašle jsou typické projevy astmatu, zvláště po druhé hodině v noci. Tyto symptomy jsou odvozeny od vyššího účinku vagotonie v rámci kolísání během cirkadiánního rytmu a značného poklesu hladiny kortisolu. S kortisolem klesá protizánětlivá aktivita, což vede k zvýšené aktivitě zánětlivých procesů v dýchacích cestách a následně k zvýšené reaktivitě bronchů. Svoji roli sehrávají také alergeny v ložnici (roztoči, peří), ochlazení vzduchu v místnosti i pokles tělesné teploty ve spánku, gastroezofageální reflex, sinusitidy, pokles až vymizení účinku léků nad ránem aj.
BRONCHIEKTÁZIE
Pod tímto termínem rozumíme trvalé rozšíření bronchů a bronchiolů, které je obvykle provázeno chronickým zánětem. U bronchiektázií dochází k poškozování svalové a elastické vrstvy dýchacích cest. Kromě přetrvávající infekce, která vyvolává zánět, se na ucpání části průdušek podílí také obstrukce cizím tělesem nebo tumorem.
Bronchiektázie se někdy vyskytují i u chronické bronchitidy nebo atopickém astmatu. Za předisponující faktor se považují kongenitální a hereditární podmínky. Klinickým projevem je chronický kašel s tvorbou hlenu, který se vyskytuje v největší intenzitě v ranních hodinách. Při namáhavém kašli může dojít i k vykašlávání krve.
CYSTICKÁ FIBRÓZA PLIC
Je jedno z nejčastějších dědičných onemocnění s poruchou funkce exokrinních žláz. Jedná se o multisystémové onemocnění, které postihuje hlavně dýchací a zažívací systém. Charakteristická je tvorba abnormálně hustého hlenu. Hlavní příčinou vzniku cystické firbózy (CF) je mutace genu pro protein CFTR (CF transmembránový regulátor konduktance), který je základní součástí chloridového kanálu a ovlivňuje i epitelové natriové kanály, čímž se podílí na regulaci koncentrace Cl- a Na+. Na povrchu buňky dochází k poruchám transportu iontů. Sodík s vodou se nadměrně resorbuje a slizniční hlen je mimořádně vazký, co se odráží na sníženém mukociliárním očišťování. Obsah chloridu a sodíku v ASL (airway surface liquid) je ve srovnání s plazmou vysoký (za fyziologických okolností je ASL hypotonická). Tento stav se následně odráží v poškozené funkci faktorů protibakteriální obrany.
Z respiračních symptomů dominuje kašel a opakované respirační infekce. V plicích je přítomná hyperinflace, bronchitida s postupným vývojem bronchiektázií. Obstrukce hlenem v malých dýchacích cestách vede časem až k atelektáze a k snížené oxygenaci. Vyvíjí se plicní hypertenze, která postupně přechází do cor pulmonale.
RESTRIKČNÍ PORUCHY PLIC
Restrikční poruchy (obr. 2 a 3) plic můžeme rozdělit do několika skupin. Z patofyziologického hlediska považujeme za významné následující členění těchto poruch:
- akutní a chronické restrikční poruchy plic
- parenchymové a extraparenchymové restrikční poruchy plic
Do skupiny akutních restrikčních nemoci řadíme:
- ARDS – adult/acute respiratory mistress syndrome (hypertextový odkaz)
- RDS – respiratory distress syndrome (hypertextový odkaz)
- Akutní poškození plic
Do skupiny chronických restrikčních nemoci řadíme:
- Intersticiální nemoci plic
- Idiopatická pulmonální fibróza
- Fibróza plic při systémovém onemocnění
Parenchymové restrikční nemoci zahrnují:
- Sarkoidózu
- Idiopatickou pulmonální fibrózu
- Pneumokoniózy
- Poléková plicní fibróza
- Postradiační plicní fibróza
Extraparenchymové restrikční nemoci zahrnují:
- Nemocí s neuromuskulárním postižením (myasthenia gravis, poškození cervikální míchy, muskulární dystrofie)
- Nemocí s postižením hrudní stěny (obezita, kyfoskolióza)
Charakteristika restrikčních poruch plic
Podstatou tohoto onemocnění je ventilační porucha, která spočívá v omezení či ztrátě dýchací plochy pro výměnu dýchacích plynů. Ztráta dýchací plochy môže být buďto z důvodu anatomického nebo funkčního. Anatomická ztráta nastává po resekci nebo vytlačení plicní tkáně. Mezi funkční ztráty plochy řadíme např. plicní edém, plicní fibrózu aj. Fibrotické změny vedou k porušení poddajnosti plic, která hraje důležitou roli hlavně při inspiriu. Při nádechu se plíce pasivně roztahují. Toto roztažení plic je ideální tehdy, pokud mají plíce optimální elastické vlastnosti. Tyto elastické vlastnosti se dají vyjádřit jako velikost objemové změny plic v závislosti na tlaku – compliance. Pro lepší představu těchto nemocí uvedeme konkrétně jeden příklad.
Důsledky restrikčních onemocnění plic
jsou:
- Snížení compliance
- Snížení vitální kapacity
- Snížení funkčního reziduálního objemu
- Snížení difuzní kapacity
- FEV1/FVC normální nebo zvýšená
INTERSTICIÁLNÍ NEMOCI PLIC
Intersticiální nemoci plic zahrnují všechny poruchy plic, pro které jsou společné zánětlivé změny terminálních částí plic, ale i dýchacích cest. Jedná se o difuzní postižení plicního parenchymu. V důsledku fibrotických změn dochází v tkáni mezi výstelkou alveolů a endotelem plicních kapilár k zesílení intraalveolárních sept. Rozvíjí se porucha difuze pro kyslík, klesá jeho propustnost a v krvi nalézáme pokles parciálního tlaku pro kyslík. Současné se snižuje poddajnost plic. V prvotním stadiu nemusejí být přítomné výrazné symptomy. Potíže se objevují zvláště při námaze a to v důsledku hypoxémie, na kterou organismus reaguje hyperventilací s tendencí k respirační alkalóze. V pokročilém stádiu (větší úbytek dýchací plochy) vzniká u pacientů už klidová hypoxémie a hypoventilace jako následek značně snížené poddajnosti plic → malé dechové objemy. Postupnou progresí tohoto onemocnění dochází k zániku alveolokapilární jednotky. Jedná se o ireversibilní proces. Větší ztráta kapilár vede ke zvýšení tlaku ve zbylých cévách, čímž vzniká v malém oběhu plicní hypertenze, která může vyústit až do cor pulmonale a následně vést až ke smrti pacienta. Další možnou příčinou smrti by mohla být těžká respirační insuficience.
Klinickým projevem intersticiálních plicních nemoci jsou subjektivní a objektivní známky. Ze subjektivních je nutné zdůraznit dyspone a kašel, z objektivních tachypnoe, chrůpky, abnormální spirometrický nález, hypoxémii, cor pulmonale aj.