Charakteristika onemocnění
Ledviny kontrolují objem a složení tělních tekutin. Vylučují nadbytečné složky anebo toxické produkty metabolismu. Náhlé přerušení výkonu těchto funkcí se dříve nazývalo akutním ledvinovým selháním.
Je charakterizováno těžkým výpadkem ledvinových funkcí. Ledviny pak nedovedou udržen normální objem anebo složení tělesných tekutin ani za bazálních podmínek. Charakteristickými příznaky jsou oligurie až anurie, rozvrat vodního a iontového hospodářství a vzestup hodnot neproteinového dusíku (kreatinin, urea, kyselina močová) a dalších odpadních produktů v plazmě. Na rozdíl od chronického selhání je tento stav často přechodný, a tedy nemusí nutně mít podobu konečného neboli terminálního selhání ledvin; může dojít k hojení a úplnému, nebo téměř úplnému obnovení ledvinových funkcí.
Pro nejasné vymezení původního termínu akutní selhání ledvin se nově upřednostňuje označení akutní poškození ledvin. Akutní selhání vždy vzniká jako sekundární následek prvotního poškození, takže nové označení může lépe obsáhnout celé spektrum stavů vedoucích od prvních příznaků až k akutnímu ledvinovému selhání.
Mezi hospitalizovanými pacienty se akutní poškození ledvin vyskytuje asi v 5 %. Na jednotkách intenzivní péče a ARO však dosahuje až 30 – 50 %. Akutní poškození ledvin je provázeno vysokou mortalitou. Navíc se u části pacientů renální funkce neobnovují v potřebné míře a jejich stav progreduje až do některé z konečných forem ledvinových onemocnění.
Klasifikace akutního poškození ledvin
Akutní poškození ledvin se s ohledem na příčiny tradičně klasifikuje do tří hlavních skupin:
- Prerenální;
- Intrarenální;
- Postrenální.
Prerenální poškození vzniká následkem hypoxie z kritického omezení dodávky krve do ledvin, obvykle následkem cirkulačního selhání. Termín zdůrazňuje skutečnost, že vyvolávající příčina se nachází před ledvinami.
Intrarenální poškození je způsobeno procesy, které se rozvíjejí přímo v ledvinách. Mohou postihovat glomeruly, tubuly, krevní cévy anebo ostatní složky ledvinového parenchymu.
Postrenální poškození má příčinu v obstrukci vývodných močových cest, nejčastěji močovými kameny.
Patofyziologie akutního prerenálního poškození ledvin
Ledviny mohou být poškozeny sníženou dodávkou krve z důvodu snížení srdečního výdeje (hypovolémie, šok) anebo z důvodu cévního onemocnění (např. ateroskleróza renální tepny).
Ledviny dostávají téměř 1/4 (22 %) srdečního výdeje, a jsou tedy v tomto ohledu na druhém místě za játry (27 % srdečního výdeje). Po přepočtu na jednotku hmotnosti ovšem zjišťujeme, že ledviny jsou krví zdaleka nejlépe zásobeným orgánem v těle (3,5 ml/g tkáně/min; játra asi 1,0 ml/g tkáně/min). Ledvinový parenchym nepotřebuje toto množství krve pro zajištění základní životaschopnosti buněk, ale pro výkon funkcí. Hustota mitochondrií v tubulárních buňkách dosahuje hustoty mitochondrií v neuronech. Proximální tubuly, bohatě vybavené mitochondriemi, jsou mnohem vnímavější k hypoxii než tubuly distální, jejichž pracovní zatížení je menší. Krevní tlak v glomerulárních kapilárách je nezvykle vysoký (kolem 60 mm Hg). Hlavním odporovým článkem ledvinové cirkulace jsou eferentní arterioly – odpovídají za více než 40 % jejího cévního odporu. Lokální autoregulace zajišťuje, že krevní průtok ledvinami je v širokém rozmezí změn arteriálního tlaku konstatní – v rozmenzí mezi 75 – 160 mm Hg arteriálního tlaku jsou změny průtoku pouze několik procent. Neméně efektivně, ne-li efektivněji, je v uvedeném tlakovém rozmezí také regulována rychlost glomerulární filtrace. Vystupňovaná vazokonstrikce v ledvinách, provázející poplachovou redistribuční reakci, dovede omezit průtok krve parenchymem na 1/2 normálního množství.
Na rozdíl od jiných tkání se ledviny dovedou přizpůsobit poklesu krevního zásobení až do 1/5 normálních hodnot. S poklesem množství přiváděné krve klesá rychlost glomerulární filtrace, a s ní i nálož iontů Na+, vody a ostatních složek, které se z tubulů transportují zpět do krve. Proto se při omezení přítoku krve a při cirkulačním selhání při šoku, MODS anebo SIRS zároveň snižuje i spotřeba kyslíku v ledvinách. Pokud je postižení mírné, rozvíjí se ischemická nefropatie (při chronicky sníženém přívodu krve se může vyvíjet i po dobu několika let). Pokud je omezení přísunu krve těžké, glomerulární filtrace prakticky ustane a buňky spotřebovávají kyslík jen pro své přežití. Při poklesu přívodu krve pod hranici 20 % normální úrovně buňky čelí kritické hypoxii a po několika hodinách umírají. Nejcitlivější k nedostatku kyslíku jsou tubulární buňky bohaté na mitochondrie – zejména buňky proximálního tubulu, silného vzestupného raménka Henleovy kličky a proximálního sběrného kanálku na rozhraní mezi kůrou a dření. K hypovolémii a vazokonstrikci, omezujícím dodávku kyslíku, se navíc přidá intraparenchymový edém. Rozvine se akutní tubulární nekróza – původní prerenální poškození pak pokračuje jako intrarenální.
Nově byla zpochybněna dosud všeobecně přijímaná představa o přítomnosti ledvinové vazokonstrikce za stavu všeobecné periferní vazodilatace při sepsi (infekční SIRS). Je možné, že na poškození ledvin při sepsi se podílí vazodilatace a hyperémie provázená otokem s následným postižením tubulární výstelky a apoptózou.
Patofyziologie akutního postrenálního poškození ledvin
Překážka v močových cestách vede k zadržování moči a vzestupu hydrostatického tlaku nad překážkou. Jakmile tento tlak vyrovná hodnoty tlaku v tubulárním systému a v glomerulech, ledvina přestává fungovat. Pokud je postižení jednostranné, může výpadek kompenzovat kontralaterální ledvina. Obstrukce obou močovodů, močového měchýře, nebo uretry (hypertrofie prostaty) způsobí klinicky manifestované akutní selhání ledvin. Původní postobstrukční poškození se manifestuje jako intrarenální a při obstrukci protahující se na řadu dní nebo týdnů mohou být změny v postižené ledvině ireverzibilní.
Patofyziologie akutního intrarenálního poškození
Intrarenální poškození lze rozdělit do skupin podle toho, která ze složek ledvinového parenchymu je postižena nejvíce. Tubulární a intersticiální poškození, které obvykle nejsou navzájem oddělitelné, se spolu sdružují pod názvem tubulointersticiální poškození (tubulointersticiální nefritis). Druhou skupinu reprezentují poškození glomerulů.
Tubuly mohou být rovněž postiženy selektivně, např. defektem transportních systémů pro glukózu a jiné soluty (renální glykosurie, aminoacidurie, fosfáturie atd.), pro ionty (renální tubulární acidózy, Liddleův syndrom, Barterův syndrom aj.) atd. V těchto případech většinou jde o chronická anebo vrozená onemocnění.
Ischemická nefropatie a akutní tubulární nekróza
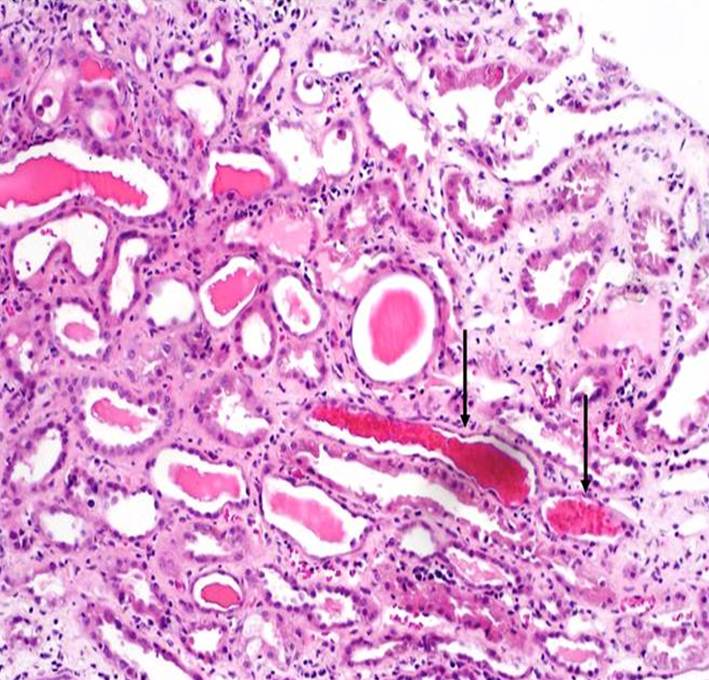
Akutní poškození ledvin je v 80 % provázeno nekrózou tubulárních epitelií různého rozsahu, aniž jsou přítomny změny glomerulů nebo parenchymu. Akutní tubulární nekróza tak je nejčastějším morfologickým korelátem akutního poškození ledvin. Odloupané epitelie ucpávají kanálky (obr. 1). Výkon ledvinových funkcí potom spočívá na činnosti zbývajících méně poškozených a nepoškozených nefronů. Pokud je frakce fungujících nefronů příliš malá, dochází k manifestnímu selhání ledvin. Pacient může zemřít během jednoho nebo dvou týdnů. Je vhodné mít na paměti, že termín akutní tubulární nekróza by se měl používat pouze v případech ověřených renální biopsií; u kriticky nemocných pacientů, kterých se toto téma dotýká nejvíce, toto vyšetření často nelze provést.
Obr. 1. Akutní tubulární nekróza – histologický obraz. Na snímku jsou v některých tubuolech zachyceny hemosiderinové válce (šipky) a jednotlivé deskvamované epitelie (horní třetina snímku). Edém intersticia je mírný s nevýraznou lymfocytární infiltrací. Barvení HE, zvětšení 100x. Dokumentaci laskavě poskytl MUDr. K. Krejčí, PhD, 3. interní klinika – nefrologická a revnatologická LF UP a FN v Olomouci.
Akutní tubulární nekróza může být:
- Ischemická – provází ischémii ledvin (součást prerenálního ledvinové selhání);
- Nefrotoxická – zahrnuje:
- Toxiny, otravy (houby, ethylenglykol, soli těžkých kovů, jako jsou rtuť nebo olovo, insekticidy, tetrachlórmetan);
- Toxické anebo alergické účinky léků (např. tetracykliny, cis-platina);
- Toxické anebo alergické vlivy exogenních biologických činitelů (viry, bakterie, plísně);
- Toxické vlivy endogenních složek organismu (hyperkalcémie, krevní barvivo, myoglobin).
Nefrony přechodně ucpané epiteliemi se na tvorbě moči mohou začít podílet až dlouho po odeznění prvotní příčiny nekrózy. Odloupané epitelie jsou pomalu odklízeny a uvolňují lumen kanálků. Namísto buněk epitelu lemuje lumen kanálků obnažená bazální membrána, takže primární moč, která do kanálků vstupuje, jimi protéká bez úpravy (chybí koncentrační funkce). Bazální membrána se však postupně rekolonizuje ze zachovaných ostrůvků epitelových buněk, které proliferují, kloužou po bazální membráně a ze stran zakrývají defekty. Podmínkou pro zdárný průběh tohoto procesu je zachovaná integrita bazální membrány. Doba potřebná pro kolonizaci se udává mezi jedním a čtyřmi týdny, konečná úprava funkcí však nastává po měsících až jednom roce.
Tubulointersticiální nefritidy
Typickými reprezentanty této formy akutního renálního poškození jsou akutní polékové intersticiální nefritidy, akutní infekční intersticiální nefritidy a pyelonefritidy.
Poškozené tubuly jsou neschopné upravovat náležitým způsobem moč, zejména trpí jejich koncentrační schopnost. V symptomatologii převažuje negativní vodní bilance způsobená vodní a osmotickou diurézou a provázená hypernatrémií (vysoká FENa+, vysoká koncentrace Na+ v definiteinví moči).
Akutní poléková intersticiální nefritis se rozvíjí na alergickém anebo toxickém podkladě. Zatímco alergická tubulointersticiální nefritis se obvykle manifestuje v průběhu několika dnů až týdnů po podání farmaka a její intenzita není závislá na přijaté dávce, toxické tubulointersticiální nefritidy se mohou vyvíjet postupně (např. při podávání aspirinu anebo jiných nesteroidních antiflogistik) během až 18 měsíců. Onemocnění může mít řadu celkových anebo extrarenálních projevů (teplota, kožní exantém, artralgie, poškození jater).
Funkce ledvin bývají postiženy v různé míře; téměř vždy bývají přítomny
- Mírná proteinurie (< 1 g/24 hod.) a
- Mikroskopická hematurie.
Akutní infekční intersticiální nefritis je vyvolána přímým průnikem infekčního agens do renálního parenchymu. Infekce se může šířit per continuitatem z okolí nebo z dolních močových cest, zejména při stagnaci moči, nebo hematogenně (při virémii, bakteriémii, sepsi, nebo plísněmi kolujícími v krvi).
Klinický obraz akutní infekční intersticiální nefritidy zahrnuje:
- Horečku se zimnicí a třesavkou;
- Bolesti v bedrech;
- Obtíže při močení.
V moči bývá:
- Bakteriurie;
- Leukocyturie (pyurie).
Tento obraz také odpovídá akutní pyelonefritidě způsobené infekcí vývodných močových cest. Infekce se odtud šíří ascendentně do ledvinového parenchymu.
Akutní tubulointersticiální nefritidy infekčního původu mohou být zdrojem sepse (infekční SIRS).
Glomerulonefritis
Druhá forma intrarenálního poškození primárně postihuje glomeruly (asi 10 % všech případů). Typickými příklady jsou druhotná poškození ledvin při celkových anebo metabolických onemocněních (diabetická nefropatie, hypertenze), primární glomerulonefritidy (např. primární IgA nefropatie), postinfekční glomerulonefritidy (např. akutní poststreptokoková glomerulonefritis) anebo rychle progredující glomerulonefritidy (např. Goodpastureův syndrom).
Akutní glomerulonefritidy se projeví akutním nefritickým syndromem. Klasickými složkami akutního nefritického syndromu jsou:
- Hematurie a proteinurie (proteinurie obvykle < 3,5 g/den);
- Hypertenze;
- Otoky.
Pokud je poškození glomerulů masívní, mají za následek akutní selhání ledvin. Onemocnění charakterizuje zřetelná oligurická fáze. Pozitivní vodní bilance obvykle vede k hyponatrémii. Pacient může zemřít během jednoho až dvou týdnů. Pokud přežije, obnovují se ledvinové funkce týdny až měsíce. Část nefronů bývá ztracena nenávratně. U části nemocných se na základě akutního zánětu glomerulů rozvíjí chronická glomerulonefritida (chronický nefritický syndrom), která po čase může vyústit do chronického selhání ledvin.
Jindy se poškození glomerulů projeví nefrotickým syndromem. Akutní nefrotický syndrom charakterizují jiné tři klasické příznaky, a to:
- Masívní proteinurie (> 3,5 g/den);
- Hypoproteinémie;
- Masívní otoky.
Při chronickém průběhu se hypoproteinémie se sdružuje s hyperlipoproteinémií. Sekundární poškození ledvin při diabetu anebo hypertenzi se rovněž vyznačuje chronickým průběhem a ve svých počátečních fázích se často projevují jen mikroalbuminurií.
IgA nefropatie je většinou imunokomplexové onemocnění (hypersenzitivní reakce typu III) neznámého původu. je charakterizováno nadprodukcí atypických IgA shlukujících se do velkých nerozpustných komplexů. Imunokomplexy se ukládají v mesangiu glomerulů, kde aktivují zánětlivou odpověď. Konstantním příznakem je hematurie, často provázená proteinurií. Diagnóza se zakládá na průkazu imunodepozit v bioptickém materiálu. Jinak onemocnění probíhá chronicky, ve vysokém procentu případů však končí jako chronické selhání ledvin. Pouze asi 10 % případů je provázeno akutním poškozením ledvin, které je obvykle reverzibilní a přechodné.
Akutní poststreptokoková glomerulonefritis je – stejně jako předchozí – akutní proliferativní glomerulonefritidou vyvolanou abnormální imunokomplexovou reakcí (hypersenzitivní reakce typu III). Může být součástí revmatické horečky (endokarditis, glomerulonefritis).Ve více než 90 % následuje s odstupem 1 – 3 týdnů po infekci streptokoky A-beta proběhlé na jiném místě těla (tonzily, kůže). V časných stadiích infekce je protilátek málo, a imunokomplexy zůstávají rozpustné. Později, když se koncentrace protilátek a antigenů vyrovnávají, vznikají velké nerozpustné komplexy, které se ukládají ve tkáních. Jedním z takových míst, kde se imunokomplexy ukládají přednostně, je bazální membrána glomerulů. Depozita místně aktivují imunitní systém. Rozvíjí se zánětlivá reakce s hyperemií, edémem a hromaděním leukocytů. Buněčné složky glomeruloární bariéry, zejména epitelové buňky glomerulů a mesangiální buňky, které z vnější strany lemují glomerulární kapiláry, proliferují. Ztluštělá tkáň částečně anebo úplně obturuje glomeruly a vyřazuje je z funkce. Přetrvávající funkční glomeruly poškozené zánětem mají porušenou permeabilitu, takže krev jimi prosakuje do moče. Zánět odeznívá asi po dvou týdnech.
Goodpastureův syndrom je způsoben aktivací tvorby IgG protilátek zaměřených proti jedné z antigenních domén kolagenu IV (Goodpastureův antigen). Antigen je přítomen v bazálních membránách plicních alveolů a glomerulů ledvin. Příčiny produkce protilátek nejsou známy. Onemocnění často vzniká nepozorovaně. Může roky stagnovat v mírnější formě, nebo už po prvních projevech fulminantně progreduje k fatálnímu konci.
V mechanismech vývoje onemocnění dominuje hypersenzitivní reakce typu II (cytotoxická). Destrukce glomerulární bazální membrány vede k hematurii, zánětu a obstrukci glomerulů. Podobně destrukce alveolární bazální membrány je spojena s hemoptýzou a restrikcí dýchací plochy, v pokročilých formách onemocnění s prokrvácením plicní tkáně. Onemocnění je možno diagnostikovat vyšetřením bioptického materiálu.
Klinický průběh akutního poškození ledvin
Klinický průběh akutního poškození ledvin se klasicky dělí na čtyři fáze:
- Fáze počátečního poškození (fáze oligurická až anurická)
- Fáze diuretická
- Fáze časné diurézy
- Fáze pozdní diurézy
- Fáze reparace (úzdravy)
Pozitivní vodní bilance při oligurickém selhání zpravidla způsobuje hyponatrémii. Naproti tomu non-oligurické selhání ledvin s relativně zachovanou glomerulární filtrací a osmotickou diurézou často provází hypernatrémie.
Akutní selhání ledvin by se mělo odlišovat od konečného (terminálního) selhání ledvin, jehož původ může být jak v chronickém, tak v akutním poškození ledvin. Při konečném selhání, bez rozdílu, zda akutním nebo chronickém, je kapacita ledvin snížena natolik, že ledviny nejsou schopny udržet složení vnitřního prostředí v mezích slučitelných se životem ani za speciálních dietních a medikamentózních opatření a při vyrovnané energetické situaci v organismu. V této fázi je pro zachování života nutná dialýza nebo transplantace.
1. Fáze oligurie až anurie
Trvá 1 – 2 týdny. V jejich průběhu může pacient zemřít. Potom je akutní selhání zároveň konečným neboli terminálním selháním ledvin. Podílejí se na tom hlavně následující faktory (jednotlivě anebo v kombinaci) (obr. 2,3):
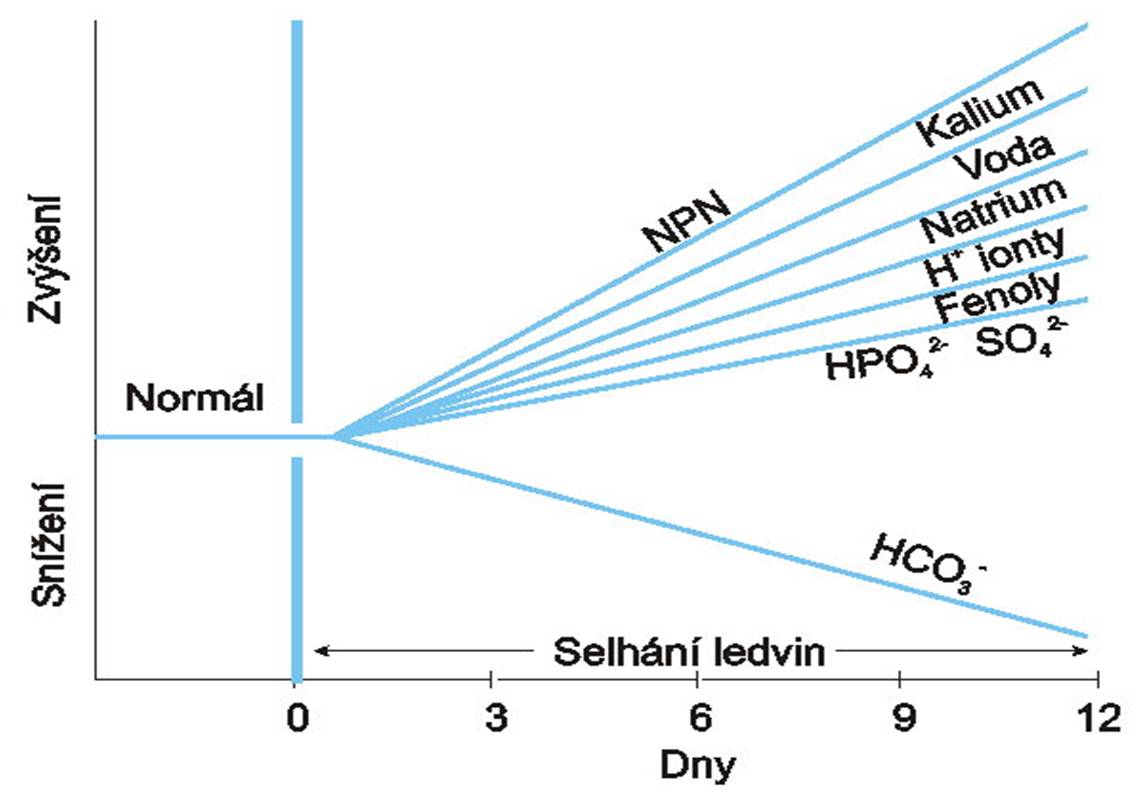
- Nedostatečná diuréza a natriuréza vedou k hyperhydrataci. Zvyšuje se střední cirkulační plnicí tlak a venózní návrat. Proto roste srdeční výdej a systémový arteriální tlak. Objevují se otoky (roste tělesná hmotnost). Otoky mohou být zprvu patrné ve tkáních s řídkým podkožním vazivem (v obličeji, kolem očí). Srdce je zatěžováno jak zvýšeným plněním (preload), tak obtížnějším vyprazdňováním (afterload). Smrtící selhání levé srdeční komory se manifestuje plicním otokem.
- Nedostatečné vylučování kaliových iontů vede k hyperkalémii. Hyperkalémie se projeví zpomalením depolarizace (široké QRS) a zrychlenou repolarizací (vysoké T) a může být smrtící (srdeční arytmie).
- Váznoucí vylučování silných netěkavých kyselin (kyseliny močové z metabolismu purinů, fosforečné z metabolismu fosforečných esterů přijímaných potravou a sírové z metabolismu aminokyselin) vede k těžké metabolické acidóze. Pacient zemře v acidotickém komatu.
- Zvyšují se plazmatické složky zahrnované pod termín neproteinový dusík (NPN; kreatitin, urea, kyselina močová, může se měnit i zastoupení aminokyselin) a další produkty metabolismu. Mohou v různé míře působit toxicky a přispívat ke komplikacím stavu.
Obr. 2. Poruchy vnitřního prostředí při poškození a selhání ledvin. NPN – neproteinový dusík. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.) Schéma je možno zhlédnout v animované podobě.
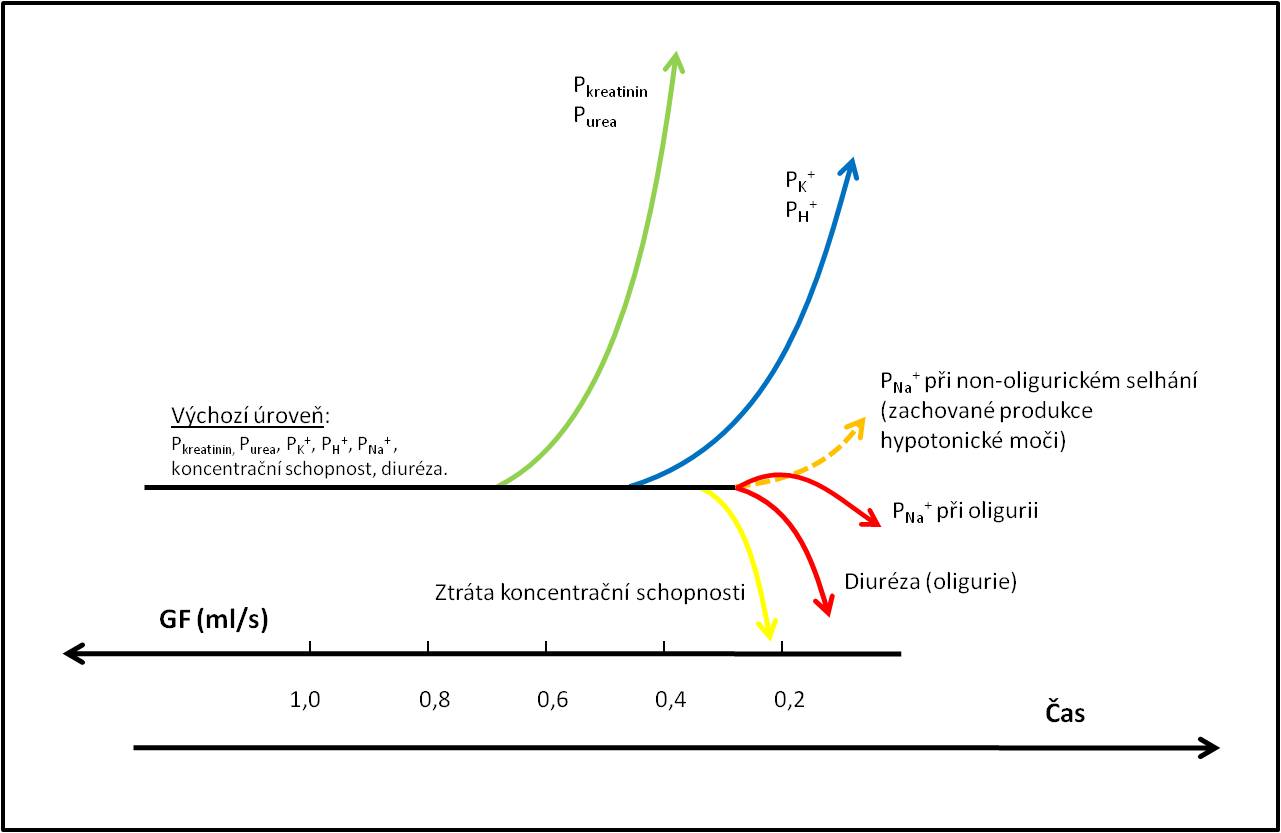
Obr. 3. Změny biochemických ukazatelů v čase v závislosti na velikosti glomerulární filtrace. Pkreatinin, Purea, PK+, PH+ a PNa+ jsou plazmatické koncentrace uvedených solutů a iontů. (Podle T. Zima a kol.: Laboratorní diagnostika, 2. vyd. Galén, Praha. 2007.) Schéma je možno zhlédnout v animované podobě.
Jak je patrné ze schématu na obr. 3, koncentrace kreatininu a urey v plazmě se začínají zvyšovat při poklesu GF pod asi 0,7 ml/s. Při poklesu GF pod asi 0,45 ml/s rostou koncentrace K+ a rozvíjí se metabolická acidóza. Při poklesu GF pod asi 0,3 ml/s ledviny ztrácejí koncentrační schopnost. Při oligurickém selhání zároveň ustává tvorba hypotonické moči, což je spojeno s přechodným zvýšením PNa+. Hodnota PNa+ se pak zpravidla s pozitivní bilancí tekutin snižuje, takže oligurické selhání bývá provázeno hyponatrémií. Při non-oligurickém selhání pokračuje tvorba hypoosmolální moči, takže non-oligurický stav může být provázen hypernatrémií.
2. Fáze časné a pozdní diurézy
U pacientů, kteří přežijí, se začíná tvořit primární moč, obnovují se funkce nefromů a zvyšuje se diuréza.
2a. Fáze časné diurézy
Ve fázi časné diurézy už je diuréza větší než 300 ml/24 hod., ale stále zůstává nedostatečná. Přetrvávají zvýšené plazmatické hladiny výše uvedených komponent. Ke konci prvního týdne anebo později se mohou objevit uremické komplikace.
2b. Fáze pozdní diurézy
Ve fázi pozdní diurézy nastává polyurie. Je vyjádřená tím více, čím více byly postiženy tubuly. Zatímco v prvním, oligurickém stadiu ohrožovala pacienta hyperhydratace, nyní je to dehydratace a hypovolémie z vodní a osmotické diurézy, provázená hypernatrémií. Na ně se teď musí zaměřit terapie.
3. Fáze reparace
Fáze reparace zahrnuje úplné uzdravení anebo adaptaci na úbytek nefronů. Dlouhodobě přetrvává porucha tubulárních funkcí, koncentrační schopnost se může pomalu zlepšovat ještě v průběhu celého následujícího roku. Vývoj však může vyústit i v chronické onemocnění.
Prognóza závisí na včasné diagnóze a účinné léčbě jak ledvinového poškození, tak základního onemocnění. Může být ohrožena komplikacemi v jednotlivých fázích selhání (dehydratace, sepse, krvácení apod.).
Urémie
Se selháním ledvin se spojuje urémie. Klinický termín uremický syndrom neboli urémie („moč v krvi“) nevyjadřuje totéž co selhání ledvin. Urémie je způsobena selháním ledvin, ale nemusí je vždy provázet. Zahrnuje klinické příznaky ze zaplavení organismu odpadními látkami:
- Nervové (únavnost, slabost, apatie, somnolence až letargie, nebo naopak podrážděnost, zmatenost, křeče, bolesti hlavy);
- Respirační (dušnost, pleuritida);
- Kardiální (perikarditida, bolesti na hrudi);
- Gastrointestinální (zvracení, průjmy, erozivní gastritida, stresový vřed, membranózní enteritida, kolitida, krvácení);
- Hematologické (normochromní normocytární anémie z hemolýzy, krvácení anebo hemodiluce, poruchy hemostázy z trombocytopatie, trombocytopenie anebo poruch hemokoagulace);
- Kostní, kloubní a svalové (osteomalacie, osteitis fibrosa, osteoporóza, bolesti kloubů, artritida);
- Kožní (bledost, žlutá pigmentace, svědění);
- Metabolické a laboratorní.
Vyšetření ledvinových funkcí a diagnostika akutního poškození ledvin
Diagnóza akutního poškození ledvin se dosud hlavně zakládá na zjištění oligurie až anurie a hyperazotémie (zvýšené koncentrace kreatininu, případně močoviny a kyseliny močové) v séru. O ledvinových funkcích informují vyšetření sérových a močových ukazatelů a z nich odvozené veličiny.
Vyšetření funkce glomerulů
Kreatinin
Laboratorní posuzování ledvinových funkcí vychází z určení rychlosti glomerulární filtrace (GFR). Glomerulární filtrace se rutinně hodnotí na základě stanovení clearance kreatininu. Opírá se o bilanční rovnici
CKr x PKr = VU x UKr,
kde CKr je cleaarance kreatininu, PKr je plazmatická koncentrace kreatininu, VU je rychlost tvorby moči (objem definitivní moči za časové období), UKr je koncentrace kreatininu v moči. Odtud je potom
GFR ≈ CKr = (VU . UKr)/PKr.
Toto určení GFR je ovšem zatíženo vážnými nepřesnostmi:
- Hodnoty sérového kreatininu jsou výrazně závislé na svalové hmotě a dalších faktorech (svalový metabolismus, tělesná hmotnost, příjem proteinů, věk, pohlaví atd.) ;
- Hodnoty sérového kreatininu jsou výrazně závislé na objemu tekutin v těle. Při zvětšování (distribučního) objemu extracelulární tekutiny v těle dochází ke snižování plazmatické koncentrace kreatininu – to může vést k významnému přecenění vypočítané velikosti clearance kreatininu, a tedy GFR;
- Je přítomna tubulární sekrece kreatininu (normálně nadhodnocuje GFR o nejméně 5 – 10 %), která se při poklesu GFR dále zvyšuje, takže může odpovídat až za 50 % zjištěné GFR;
- Ledviny různých jedinců se mohou významně lišit velikostí rezervy pro vylučování anebo tubulární sekreci kreatininu; tubulární sekrece kreatininu může být blokována některými léky;
- Mohou být vneseny nepřesnosti vyplývající z 24hodinového sběru moči.
S cílem omezit chyby z 24hodinového sběru moči se určení kreatininové clearance nahrazuje výpočtem z výsledku měření v jednorázově odebraném vzorku krve podle vzorce
GFR (ml/s) = (140 – věk) x hmotnost (kg)/48,9 x kreatinin v séru (μmol/l).
Vzorec přihlíží k věku, hmotnosti a také – po vynásobení výsledku faktorem 0,85 u žen – k pohlaví vyšetřované osoby.
Vzhledem k výrazné variabilitě hodnot sérového kreatininu v katabolických stavech a při zvětšování distribučního objemu se použití výše uvedeného vzorce nedoporučuje u kriticky nemocných. Chyba vypočítané GFR zde může dosahovat až 100 % (čím těžší stav, tím vyšší vypočtená GFR), a zakrývat tak skutečné postižení ledvin. Proto se zde nadále spoléhá spíše na určení ze vzorků 24hodinového anebo alespoň 8hodinového sběru moči.
Močovina (urea)
Močovina je produktem katabolismu proteinů. Její koncentrace v plazmě se zvyšuje při:
- Katabolických stavech;
- Příjmu proteinů potravou;
- Snížené glomerulární filtraci;
- Vystupňované zpětné resorpci močoviny v tubulech, např. při poklesu krevního zásobení ledvin.
U akutního selhání ledvin z prerenálních příčin, kdy urea roste mnohem více než kreatinin díky její vystupňované reabsorpci v tubulech, dochází k disociaci mezi vzestupem urey a kreatininu. Tento příznak trvá, pokud není přítomna akutní tubulární nekróza. Přítomnost disociace tak může přispět k diferenciální diagnóze závažnosti postižení ledvin. U nemocných s terminálním postižením ledvin a u dialyzovaných pacientů urea lépe odráží závažnost urémie než kreatinin a slouží jako jeden ze sledovaných parametrů úspěšné dialýzy.
Kreatinin a urea jsou málo citlivými a zároveň i málo specifickými ukazateli. Sérový kreatinin se nezvyšuje nad horní hranici normálních hodnot, pokud kapacita ledvin nebyla postižena z více než z 50 %, a urea se zvyšuje nad normu ještě později – až při poklesu GFR o 75 %. Další podstatnou nevýhodou kritérií diagnózy založených na vzestupu nebílkovinných dusíkatých složek plazmy je jejich opožděný nástup. Zvýšení standardně používaného indikátoru – kreatininu – často následuje až za 48 – 72 hodin po prvotním inzultu, takže se zjistí až dlouho poté, co se významně snížila rychlost glomerulární filtrace. Nepřekvapuje, že se intenzívně hledají nové markery, o něž by se včasná diagnóza akutního poškození ledvin mohla lépe opřít.
Proteinurie z postižení glomerulů
Albuminurie a závažnější neselektivní proteinurie jsou dalšími klinicky přijatými ukazateli onemocnění ledvin. Vypovídají o stavu glomerulární bariéry, a dovolují tedy posoudit postup poškození glomerulů. Stanovení proteinurie donedávna rovněž vyžadovalo 24hodinový sběr moči. Nově se od této praxe ustupuje podobně jako při stanovení GFR. Nahrazuje se poměrem koncentrací proteinurie/kreatinin měřených v jednorázově odebraném vzorku.
Pokud se do moči nevylučuje více než 300 mg albuminu/24 hodin, hovoří se o mikroalbuminurii. Je počátečním příznakem poškození glomerulů, zejména u osob trpících diabetem anebo hypertenzí. O poškození v tomto stadiu se soudí, že je reverzibilní, a její výskyt proto vyžaduje urgentní účinnou léčbu základní nemoci.
Vyšetření funkce tubulů
Proteinurie z postižení tubulů
Nové markery akutního poškození ledvin
Kandidátské molekuly, jejichž laboratorní vyšetření by v budoucnu mohlo ohlásit hrozící anebo už začínající akutní poškození ledvin o 24 – 48 hodin dříve než měření sérového kreatininu, jsou podrobněji uvedeny v kapitole Proteinurie a v kapitole Laboratorní vyšetření ledvinových funkcí. Vesměs jde o proteiny. Je pravděpodobné, že nebude vybrán jediný z nich, ale že bude sestaven panel vyšetření, který bude nejlépe odpovídat diagnostickým potřebám. Lze rozlišovat markery přecházející do moči skrze glomeruly a reabsorbované v tubulech (např. cystatin C, vazebný protein retinolu RBP, vazebný protein mastných kyselin 1 FABP1, α1-mikroglobulin, β2-mikroglobulin) a markery produkované v tubulech (např. protein Na+/H+ antiportu NHE-3, F-aktin, dále enzymy pocházející z tubulů, molekula poškozenáí ledvin č. 1 KIM-1, interleukin 18 anebo lipokalin spojený s gelatinázou neutrofilů NGAL) (blíže viz kapitola Proteinurie a kapitola Laboratorní vyšetření ledvinových funkcí).
Terapie akutního poškození ledvin
Při péči o pacienta postiženého akutním selháním ledvin je důležité:
- Měřit arteriální i centrální žilní tlak;
- Zavést močový katetr;
- Monitorovat bilanci tekutin, iontů a acidobazickou rovnováhu.
Zpracovali: Jaroslav Veselý a Květoslava Dostálová, Ústav patologické fyziologie LF UP v Olomouci