Základní veličiny acidobazické rovnováhy. Jejich postavení v diagnostice a terapii.
Veličiny acidobazické rovnováhy jsou klinickému pracovníkovi přístupné k měření ze vzorků krve pacienta. O systému acidobazické rovnováhy a o klasifikaci jeho poruch se proto vždy hovoří v jejich vztahu ke složení extracelulární tekutiny.
pH je základní veličinou acidobazické rovnováhy. V praktické klinické diagnóze a terapii poruch acidobazické rovnováhy má zcela určující postavení. Léčit pacienta podle hodnot jiných veličin acidobazické rovnováhy bez zřetele na pH je nepřípustné.
V systému acidobazické rovnováhy je veličina pH výslednicí nezávisle proměnných veličin acidobazické rovnováhy, a je proto závisle proměnnou veličinou acidobazické rovnováhy.
Dalšími závisle proměnnými veličinami acidobazické rovnováhy jsou:
- Koncentrace hydrogenuhličitanů;
- Koncentrace nárazníkových bazí (BB, Buffer Base);
- Výchylka bazí (BE, Base Excess);
- Další veličiny (schodek aniontů atd.).
Nezávisle proměnnými veličinami acidobazické rovnováhy jsou:
- paCO2;
- Koncentrace silných kationtů a silných aniontů krve, přesněji řečeno, rozdíl koncentrací silných kationtů a aniontů krve (SID, Strong Ion Difference);
- Koncentrace nehydrogenuhličitanových komponent nárazníkových soustav krve, tzn. aniontů tzv. netěkavých slabých kyselin plazmy – proteinů a fosforečnanů.
Denní produkce H+ v lidském těle
Lidské tělo denně produkuje:
- Těkavé (prchavé) kyseliny, které můžeme vyloučit plícemi.
- Hlavní prchavou kyselinou je H2CO3 (CO2).
- Netěkavé kyseliny, které se musí vyloučit ledvinami. Hlavní jsou:
- Kyselina fosforečná;
- Kyselina močová;
- Kyselina sírová.
| Produkce H+ | H+ z těkavých kyselin z tkáňového dýchání | 20 000 mmol |
| H+ z netěkavých kyselin | 30 – 80 mmol | |
| Pufry | Celotělové pufrové systémy | 2400 mmol |
| Eliminace H+ | Plíce (CO2) | 20 000 mmol |
| Ledviny (netěkavé kyseliny) | 30 – 80 mmol |
Tabulka 1. Denní rovnovážná bilance H+.
Metabolické reakce se z hlediska produkce H+ dělí na proton-neutrální, proton-produktivní a proton-konzumpční.
- Proton-neutrální (elektroneutrální) reakce:
- Elektroneutrální substrát se mění na elektroneutrální produkt.
- Příklady jsou:
- Kompletní oxidace glukózy:
- Glukóza → CO2 + H2O.
- Lipogeneze z glukózy:
- Glukóza → triacylglyceroly.
- Tvorba glutaminu z glutamátu:
- NH4+ + (glutamát)‾ → glutamin + H2O.
- Tvorba glutaminu z laktátu:
- 4NH4+ + 4(laktát)‾ + 3O2 → glutamin + 2CO2 + 8H2O.
- Kompletní oxidace glukózy:
- Proton-produktivní reakce:
- Elektroneutrální substrát se mění na produkt s negativním nábojem a proton(y).
- Příklady jsou:
- Anaerobní glykolýza:
- Glukóza → 2(laktát)‾ + 2H+.
- Lipolýza:�
- Triacylglycerol → glycerol + 3(anion mastné kyseliny)‾ + 3H+.
- Ketogeneze:
- (Palmitát)‾ + 6O2 → 4(anion ketokyseliny)‾ + 2H2O + 3H+
- Syntéza urey z NH4+:
- CO2 + 2NH4+ → CO(NH2)2 + H2O + 2H+.
- Kompletní oxidace aminokyselin obsahujících síru:
- Aminokyseliny → 2SO42‾ + 4H+.
- Kompletní oxidace dibazických aminokyselin:
- Aminokyseliny → H+.
- Anaerobní glykolýza:
- Proton-konzumpční reakce:
- Substrát s negativním nábojem se mění na elektroneutrální sloučeninu.
- Příklady jsou:
- Glukoneogeneze z laktátu:
- 2(Laktát)‾ + 2H+ → glukóza.
- Kompletní oxidace laktátu a ketokyselin
- (Anion kyseliny)‾ + nO2 + H+ → nCO2 + nH2O.
- Kompletní oxidace neutrálních a dikarboxylových aminokyselin
- (Anion kyseliny)¯ + nO2 + 2H+ → nCO2 + nH2O (+ NH4+).
- Glukoneogeneze z laktátu:
| Metabolická reakce | Produkce H+ | Konzumpce H+ | ||
| Orgán | mmol/den | Orgán | mmol/den | |
| Glukóza → laktát | Mozek, erytrocyty, svaly, střevo, kůže | 1300 | ||
| Laktát → glukóza Laktát → CO2 + H2O | Játra, ledviny | 1300 | ||
| Produkce ketolátek | Játra | 300 – 400 | ||
| Utilizace ketolátek | Myokard, mozek, svaly, aj. | 300 – 400 | ||
| Tvorba močoviny | Játra | 1130 | ||
| Oxidace aminokyselin | Játra, svaly | 1100 | ||
| Exkrece pufrovatelných H+ močí | Ledviny: 30 – 80 mmol/den | |||
Tabulka 2. Produkce a spotřeba iontů H+ při metabolismu hlavních živin. Exkrece silných kyselin močí.
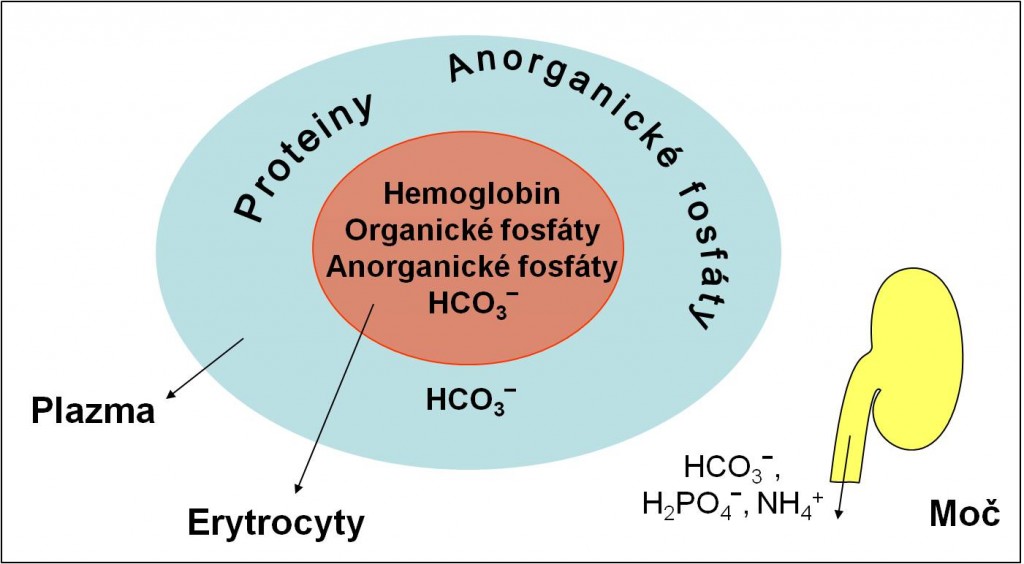
Pufrové baze, BB (Buffer Base)
Pufrové baze (BB) krve zahrnují konjugované baze slabých kyselin v krvi (slabé anionty) (obr. 1). Hodnota BB je dána součtem koncentrací všech nárazníkových bazí v 1 l krve nebo plazmy. Je součtem koncentrací hydrogenuhličitanů a nehydrogenuhličitanových bazí:
[BB] (mmol/l) = [HCO3- ] + [nonHCO3- ].
Normální hodnota bazí v plazmě je 42 mmol bazí/l plazmy. Normální hodnota bazí v plné krvi je zvětšena o koncentraci hemoglobinové baze, takže je 48 mmol bazí/l krve:
[BB krve] = [BB plazmy] + [Hb].
Obr. 1. Schéma pufrových bazí plazmy a krve. Rovněž jsou připomenuty pufrové součásti moče.
Jak je patrné z tabulky 3, největší pufrovací kapacitu má hydrogenuhličitanový systém. Hlavními nehydrogenuhličitanovými bazemi plazmy jsou anionty plazmatických proteinů. V plné krvi ovšem je hlavní nehydrogenuhličitanovou bazí anion hemoglobinový. Tvoří 75 % všech nehydrogenuhličitanových bazí krve.
| Systém | Koncentrace aniontů (mmol/l) | Nárazníková kapacita (podíl v %) |
| HCO3‾ : | 24 mmol/l | 53 % |
| Plazmatické HCO3‾ | 35 % | |
| Erytrocytární HCO3‾ | 18 % | |
| nonHCO3‾ : | 24 mmol/l | 47 % |
| Plazmatické proteiny | 16 | 7 % |
| Fosforečnany (anorg. a org.) | 2 | 5 % |
| BB plazmy celkem: | 42 mmol/l | 65 % |
| Hemoglobin | 6 | 35 % |
| BB krve celkem: | 48 mmol/l | 100 % |
Tabulka 3. Přehled nárazníkových systémů plazmy a krve souhrnně udávaných hodnotou BB (mmol/l).
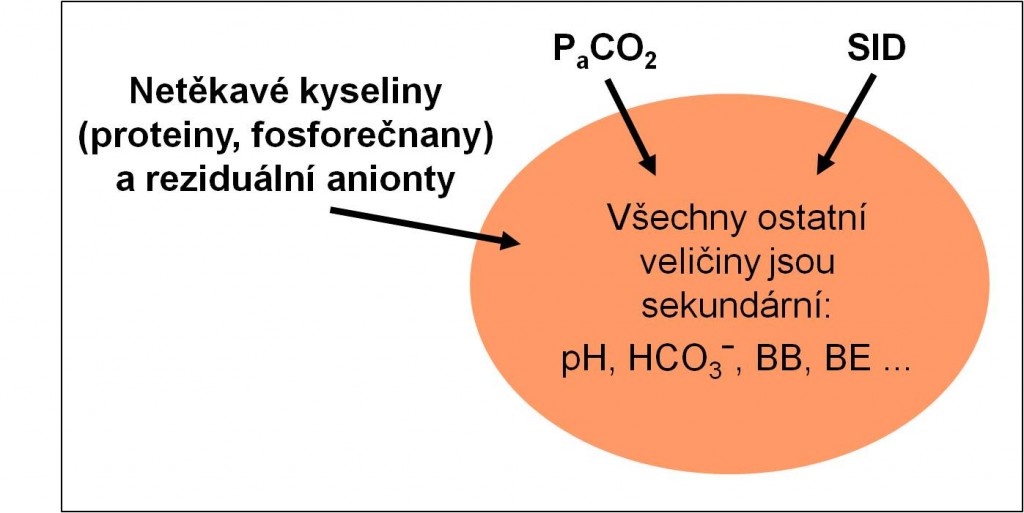
Nehydrogenuhličitanové baze plazmy jsou proteiny a fosforečnany. Jejich koncentrace v plazmě, podobně jako koncentrace hemoglobinu v krvi, jsou regulovány nezávisle na řízení acidobazické rovnováhy. Naopak, samy ji determinují. Jsou jí nadřazeny, tzn. že koncentrace nehydrogenuhličitanových bazí je nezávislou neboli primární proměnnou acidobazického systému (podobně jako dále paCO2 a SID) (obr. 2).
Pufrační vlastnosti proteinů jsou podmíněny přítomností kyselých a bazických skupin ve struktuře proteinů. Uplatňují se koncová karboxylová skupina a karboxyly postranních řetězců kyseliny asparagové a glutamové (pK kolem 2 – 4), aminoskupiny postranních řetězců lysinu, argininu (pK 10 – 12), sulfhydrylové skupiny cysteinu (pK 10), hydroxyly postranních řetězců threoninu a tyrosinu (pK 10), serinu (pK 9), koncová aminoskupina polypeptidu (pK 8 – 9) a – pravděpodobně daleko nejvíce – imidazolové jádro histidinu (pK 8 – 9). Výčet možných vazebných míst zde nebere v úvahu možné posttranslační modifikace sérových proteinů.
Anionty silných kyselin (silné anionty) jsou vzhledem k pH ECT příliš slabé konjugované baze, a tudíž nefungují jako nárazníkové baze ECT.
Kationty Na+, K+, Ca2+ a Mg2+ jsou kationty silných hydroxidů – silných bazí, které samozřejmě nejsou nárazníkovými bazemi. Jak už bylo uvedeno, rozdíl koncentracích silných kationtů a silných aniontů, SID (strong ion difference), je nezávisle proměnnou veličinou acidobazické rovnováhy.
Normální koncentrace bazí (normální BB, NBB)
Definiční hledisko normální hodnoty pufrových bazí má dvě stránky:
Za prvé, normální BB jsou definovány vzhledem k normální situaci v hydrogenuhličitanovém nárazníku. Jde o takovou koncentraci BB v krvi (plazmě) pacienta, kdy je normální pH (7,4) a paCO2 (5,33 kPa), a tedy – podle rovnice Henderson-Hasselbalchovy – i normální [HCO3-] (24 mmol/l). Každá taková krev (plazma) potom má i normální BB.
Za druhé, i když koncentrace hemoglobinu je významnou složkou BB, zároveň patří k běžně měřeným veličinám. Proto se konvencí ustanovilo, že normální hodnoty BB budou zároveň definovány s přihlédnutím ke koncentracím hemoglobinu. Normální hodnoty BB pro jednotlivé vzorky krve jsou individuálně definovány podle koncentrace hemoglobinu v nich. Při normální hodnotě hemoglobinu 150 g/l je normální hodnota BB krve 48 mmol/l. Při vyšší koncentraci hemoglobinu je normální hodnota BB vyšší, při nižší naopak. Ukazuje to tabulka 4.
| pH krve | HCO3‾ (mmol/l) | Hb (g/l) | Normální BB (mmol/l) |
| 7,4 | 24,0 | 80 | 45,0 |
| 7,4 | 24,0 | 130 | 47,0 |
| 7,4 | 24,0 | 150 | 48,0 |
| 7,4 | 24,0 | 200 | 50,0 |
Tabulka 4. Vztah mezi koncentrací hemoglobinu (Hb) v krvi a normální hodnotou BB.
Výchylka bazí, BE (Base Excess)
Hodnota výchylky vbazí, BE, je dána aktuální změnou BB oproti normální hodnotě BB:
[BE] (mmol/l) = ([aktuální BB] – [normální BB]).
Definování hodnoty normálních BB ve vztahu ke koncentraci hemoglobinu (tabulka 2) znamená, že například hodnota aktuálních BB = 45 bude pro jednoho pacienta výchylkou BE = – 3 (pacient s koncentrací hemoglobinu 150 mmol/l), pro jiného pacienta BE = 0 (při hemoglobinu 80 g/l – v tomto případě je normální BB rovno 45 mmol/l) a ještě jiného pacienta BE = – 5 (při hemoglobinu 200 g/l – normální BB jev tomto případě rovno 50 mmol/l).
Vzhledem k uvedené konvenci se abnormální koncentrace hemoglobinu neprojeví jako abnormální BE, a tedy není diagnostikována jako porucha acidobazické rovnováhy (rutinně se diagnostikuje v jiném vztažném systému – anémie). Nicméně neznamená to, že se hemoglobin přestává účastnit acidobazických dějů. Jeho nedostatek zmenšuje kapacitu nárazníkových systémů krve.
Na rozdíl od hemoglobinu se abnormální hladina plazmatických proteinů projeví jako abnormální BE.
Rozdíl koncentrací silných kationtů a silných aniontů (SID, Strong Ion Difference)
Normální rozdíl plazmatických koncentrací silných kationtů a silných aniontů v plazmě (SID = [silné kationty] – [silné anionty]) je kladné číslo přibližně rovné koncentraci plazmatických BB:
[SID] ≈ ([Na+ ] + [K +]) – [Cl-] ≈ (137 + 5) – 100 = 42 mmol/l ≈ [BB plazmy].
Malý rozdíl mezi přesnými číselnými hodnotami normálního SID (38 mmol/l) a normálních BB (42 mmol/l), který se ve zde prezentovaném výkladu zanedbává, se vysvětluje rozdílným stupněm disociace nehydrogenuhličitanových bazí v koncepcích BB, BE a SID. Navíc přesná rovnice musí vzít v úvahu i další kationty a anionty (Ca2+,Mg2+, anionty organických kyselin v plazmě atd.). Je však evidentní, že rovnice na straně kationtů neobsahuje proton (H+).
Veličina SID je definována pro plazmu. Koncentrace silných kationtů a aniontů v plazmě jsou regulovány nezávisle na řízení acidobazické rovnováhy. Naopak, samy ji řídí spolu s ostatními nezávislými veličinami (paCO2 a nehydrogenuhličitanovými bazemi). Jsou jí nadřazeny, tzn. že SID je nezávisle neboli primární proměnnou acidobazického systému (obr. 2). Její určující role v acidobazické rovnováze vyplývá ze zákonitostí elektrolytické disociace a hydrolýzy solí. Právě zákonitosti hydrolýzy diktují mírně bazické pH plazmy a krve.
Struktura acidobazické rovnováhy
Změnám a poruchám v systému acidobazické rovnováhy lze lépe porozumět, když ho rozdělíme na dvě složky – složku respirační a složku nerespirační neboli metabolickou. Obě složky propojuje systém pufrových bazí krve. K pufrování extracelulárních tekutin přispívají také tkáně, kde se přes buněčné plazmatické membrány mohou vyměňovat protony za silné kationty Na+ a K+.
Respirační složku reprezentuje respirační systém. Je odpovědný za bilanci těkavé kyseliny, kterou je oxid uhličitý (H2CO3). Respirační komponenta acidobazické rovnováhy je definována hodnotami paCO2. Parametr paCO2 je primární, nezávislou veličinu systému acidobazické rovnováhy (obr. 2). Změny tkáňové produkce CO2 jsou efektivně kontrolovány změnami oběhu a respirace. Na druhé straně oxid uhličitý ovlivňuje řídicí respirační centrum, takže tato kontrola se může poměrně rychle přizpůsobit potřebám acidobazické regulace. Každá abnormální změna, k níž dojde v respirační složce, se zobrazí jako patologická hodnota paCO2. Pokud zůstávají hodnoty paCO2 v normálních mezích, respirační složka acidobazické rovnováhy se nemění. Veličina paCO2 sama o sobě nic nevypovídá o nerespirační (metabolické) složce acidobazické rovnováhy, ani o celkových BB nebo BE, ani o výsledném pH systému.
Hodnota paCO2 určuje – podle disociační rovnice H2CO3 – koncentraci hydrogenuhličitanů. Koncentrace hydrogenuhličitanů proto není nezávisle proměnnou, nýbrž závisle proměnnou acidobazické rovnováhy. Její hladinu nastavuje respirační systém. Ovlivňují ji ostatní nezávisle proměnné acidobazické rovnováhy.
Nerespirační (metabolická) složka se na acidobazické homeostáze podílí především vylučováním netěkavých kyselin ledvinami. Kromě ledvin se regulace acidobazické rovnováhy v postavení fyziologických pufrů významně účastní játra a kosti, ale svými proton-konzumpčními anebo proton-produktivními reakcemi se na ní podílejí všechny tělesné tkáně.
Nerespirační složku charakterizuje veličina BE. Každá abnormální acidobazická změna v metabolické složce se zobrazí jako patologická hodnota BE. Pokud zůstávají hodnoty BE v normálních mezích, metabolická složka se nezměnila. Veličina BE sama o sobě nemá vliv na pCO2.
Veličina BE nic nevypovídá o respirační složce acidobazické rovnováhy, protože respirační alterace jsou – podle definice – indikovány změnou paCO2. Abnormání hodnoty BE pouze ukazují, že v extracelulárním prostředí došlo ke změně nárazníkových bazí, popř. rozdílu silných iontů, oproti normě. Hodnoty BE neprozrazují, které ze složek BB byly změnou primárně postiženy a ani neukazují mechanismus jejich změny. Samotná veličina BE stejně jako samotná veličina paCO2 nevypovídá ani o hodnotě pH systému. Proto je nutno vždy na prvním místě věnovat pozornost hodnotám pH. Může se stát, že za abnormálními hodnotami BE, SID anebo paCO2 stojí protichůdné acidobazické procesy, které se navzájem kompenzují, takže hodnota pH zůstane achována v mezích normy. Neuvážená izolovaná úpravou BE, SID nebo paCO2 může v takových případech způsobit smrtelnou změnu pH. Proto nikdy nelze léčit pouze podle hodnot BE, SID anebo paCO2 bez zřetele na hodnotu pH a další parametry vnitřního prostředí.
Změny pCO2 nemají vliv na celkovou velikost plazmatických BB nebo BE a SID. Podobné tvrzení však není zcela přesné, pokud jde o plnou krev. I když jsou hodnoty normálních bazí a BE redefinovány pro individuální koncentrace hemoglobinu (a SID pouze pro plazmu), hemoglobin v krvinkách je přece jen v určité míře ovlivňuje. Deoxygenovaný hemoglobin (hemoglobin v T-konformaci) je silnější baze než oxygenovaný(v R-konformaci) , a lépe váže protony (Bohrův efekt). Zároveň při tom z erytrocytů vystupují hydrogenuhličitany výměnou za chloridové ionty (chloridový posun, Hamburgerův efekt). Proto, zcela přísně vzato, v krvi s nízkým pO2 díky deoxygenaci hemoglobinu „přibývá“ nehydrogenuhličitanových BB, které redefinice vztažená k individuální koncentraci celkového hemoglobinu nezohledňuje. Zdánlivě jde o přírůstek plazmatických bází s jeho nezbytným promítnutím do zvýšení hodnoty BE a SID (úbytek chloridů). Acidobazická rovnováha tak je v malé míře definována také hodnotami pO2. Rovněž vzestup pCO2 v krvi snižuje afinitu hemoglobinu ke kyslíku, a způsobuje nárůst frakce deoxygenovaného hemoglobinu s právě popsanými důsledky. Nové koncepce acidobazické rovnováhy proto navíc k BE zavádějí tzv. standardizovanou oxyhodnotu BEox. Hodnota BEox je taková hodnota BE, která by v daném vzorku krve byla přítomna při 100% saturaci hemoglobinu kyslíkem. Standardizovaná BEox už potom není závislá na ani pCO2, ani na O2. Nicméně pO2 se potom stává (při zadané koncentraci hemoglobinu) další nezávislou stavovou proměnnou acidobazické rovnováhy.
Obr 2. Struktura acidobazické rovnováhy. Primární (nezávislé) a sekundární (závislé) stavové veličiny acidobazické rovnováhy. O postavení další veličiny, pO2, v systému acidobazické rovnováhy stručně informuje předchozí text.
Terminologii odchylek veličin pH, BE, SID a paCO2. od normy ukazují tabulky 5a-c.
| Veličina | pH |
| Nižší než normální | Acidémie |
| Vyšší než normální | Alkalémie |
Tabulka 5a. Terminologie poruch acidobazické rovnováhy. Veličina pH.
| Veličina | BE (Nerespirační, metabolická porucha) | SID (nerespirační, metabolická porucha) |
| Nižší než normální | Metabolická acidóza, hypobazémie (– BE) | Metabolická acidóza |
| Vyšší než normální | Metabolická alkalóza, hyperbazémie (+ BE) | Metabolická alkalóza |
Tabulka 5b. Terminologie poruch acidobazické rovnováhy. Veličiny BE a SID.
| Veličina | paCO2 (Respirační porucha) |
| Nižší než normální | Hypokapnie (↓ paCO2), respirační alkalóza |
| Vyšší než normální | Hyperkapnie (↑ paCO2), respirační acidóza |
Tabulka 5c. Terminologie poruch acidobazické rovnováhy. Veličina paCO2.
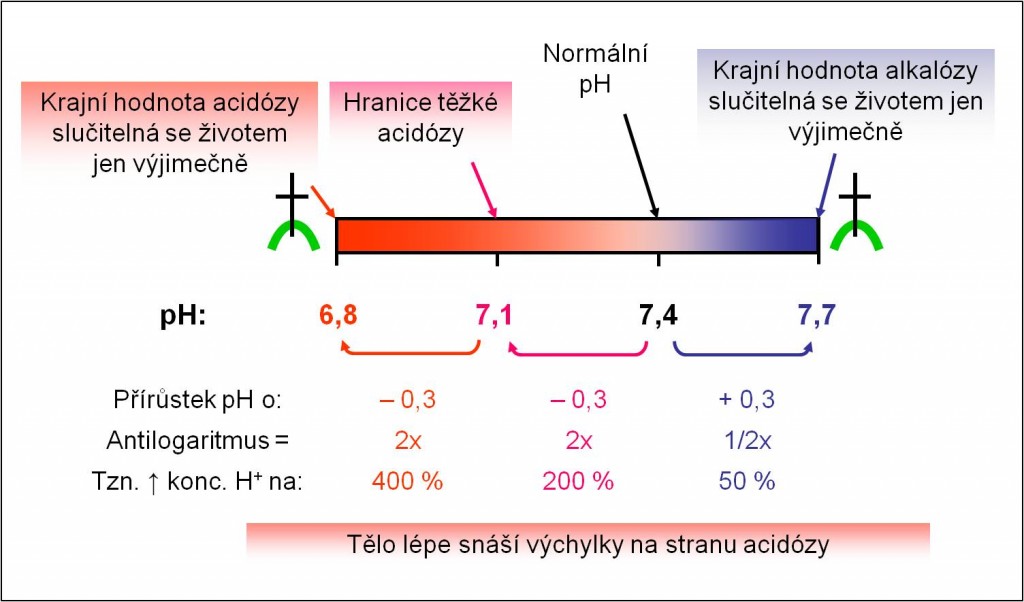
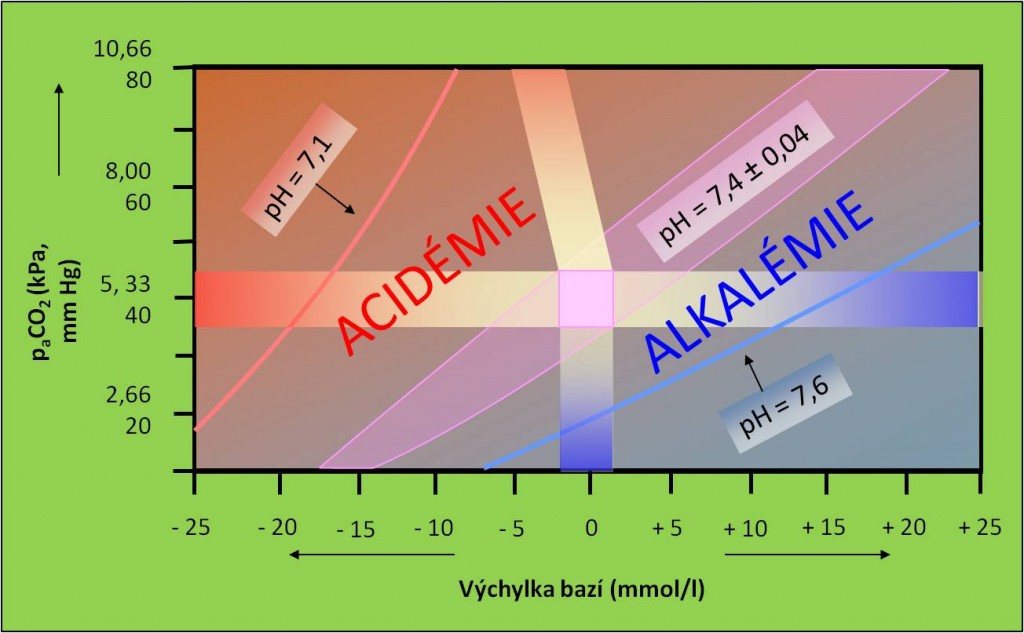
Normální hodnoty pH krve:
- 7,4 ± 0,04.
O mezních změnách pH krve informuje obrázek 3.
Obr. 3. Stupnice změn acidobazické rovnováhy a mezní hodnoty změn. Schéma je možno zhlédnout i v animované podobě.
V této souvislosti je vhodné pro srovnání připomenout normální hodnoty pH moči:
- Normální hodnoty moči jsou pod 6,5;
- Na pH moči má vliv acidifikující anebo alkalizující strava, popř. terapie. Fyziologický rozsah variací pH moči je 4,5 – 8,0.
Ze skutečnosti, že běžně vylučujeme kyselou moč, je jasně patrné, že naše vnitřní prostředí se neustále acidifikuje. Nejde jen o produkci CO2, kterého se zbavujeme plícemi. V našem metabolismu převažují procesy, které produkují silné metabolické kyseliny, při jejichž vyloučení jsme závislí na správné funkci ledvin. V evoluci se nevyhnutelně vyvinuly mechanismy, které naše tělo vybavily větší tolerancí k acidóze než k alkalóze. Co do frekvence výskytu, jsou acidózy častější než alkalózy a metabolické poruchy acidobazické rovnováhy jsou častější než respirační.
Schodek aniontů (AG, Anion Gap)
Schodek aniontů je rozdíl mezi koncentracemi nejvíce zastoupených a rutinně stanovovaných kationtů a aniontů v plazmě. Je definován následující rovnicí:
Schodek aniontů (AG, mmol/l) = ([Na+] + [K+]) – ([Cl‾] + [HCO3‾]) ≈ (137 + 5) – (100 + 24) = 18 mmol/l.
Tento rozdíl spolu tvoří:
- Anionty netěkavých slabých kyselin, tzn. nehydrogenuhličitanové baze:
- Proteiny;
- Fosforečnany.
- Reziduální anionty, tzn. ty anionty silných kyselin plazmy, které se rutinně nestanovují:
- Anionty silných anorganických kyselin:
- (Fosforečnany – disociace do 1. stupně);
- Sírany.
- Anionty silných organických kyselin:
- Endogenních, vzniklých metabolismem přirozených živin (sacharidů, lipidů, proteinů);
- Exogenních, vznikajících jako metabolity při intoxikacích.
- Anionty silných anorganických kyselin:
Proteiny plasmy jsou za fyziologických podmínek přítomné jako anionty (většina jich má pI mezi 5 – 6). Podmiňují normální schodek aniontů. Mohou být příčinou acidózy i alkalózy extracelulární tekutiny. Hypoproteinémie má za následek vzestup HCO3¯, snížení schodku aniontů a poruchu acidobazické rovnováhy. Pokles koncentrace sérových proteinů o 10 g/l vede k nárůstu BE přibližně o +3 mmol/l. Alkalóza z hypoproteinémie spolu s hypochlorémií patří k nejčastějším acidobazickým poruchám u kriticky nemocných. (Jinou velmi častou poruchou u takových nemocných je laktátová acidóza při šoku a sepsi.)
Hyperproteinémie znamená acidózu. Při ztrátách ECT průjmy u cholery např. vziká normochloremická acidóza, podmíněná z největší části hemokoncentrací.
Pokud jde o fosforečnany, z hlediska acidobazických poruch je významná jen hyperfosfátémie. Hypofosfátémie vzhledem k nízké fyziologické hladině (1 mmol/l) nebývá příčinou acidobazických poruch, i když se může klinicky uplatňovat jinak.
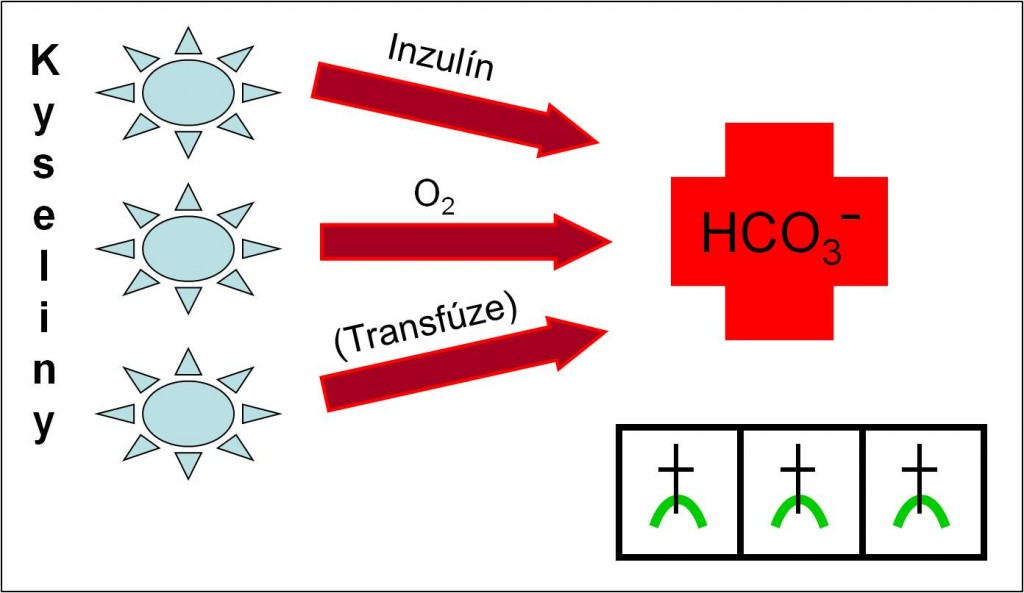
Potenciální hydrogenuhličitany
Ve skupině reziduálních aniontů je důležité pamatovat na tzv. „potenciální hydrogenuhličitany“. Potenciálními hydrogenuhličitany jsou reziduální anionty silných organických kyselin, jejichž hromaděním vznikají normochlorémické acidózy provázené zvýšeným schodkem aniontů na úkor hydrogenuhličitanů. Přívlastek „potenciální“ je odvozen z faktu, že tyto reziduální anionty se při léčbě nebo při spontánní úpravě poruchy metabolizují (aerobně) za spotřeby H+ iontů, takže jsou v plazmě opět nahrazeny hydrogenuhličitany (obr. 4). Běžnými potenciálními hydrogenuhličitany jsou anionty následujících kyselin:
- Kyseliny mléčné (laktát);
- Ketokyselin (acetoacetát, 3-hydroxybutyrát);
- Kyseliny citrónové (citrát), např. z krevních konzerv;
- Většiny organických kyselin obsažených v ovoci;
- Kyseliny octové (acetát) aj.
Rychlá přeměna potenciálních hydrogenuhličitanů na hydrogenuhličitany ohrožuje pacienta smrtícím zvratem acidózy do alkalózy. Proto je při léčbě zapotřebí náležité ostražitosti.
Obr. 4. Schéma životu nebezpečné přeměny potenciálních hydrogenuhličitanů na hydrogenuhličitany vyvolané terapeutickými zásahy. Schéma je možno zhlédnout i v animované podobě.
Účinky acidobazických poruch na organismus
Sekundární procesy při acidobazických poruchách
Systém acidobazické rovnováhy není uzavřený anebo izolověný od ostatních tělních soustav. Sekundární procesy se při pohybu koncentrací iontů H+ v plazmě rozvíjejí ve dvou rovinách – jednak v rovině chemické a jednak v rovině fyziologické. Přitom pufrové chemické reakce propojují obě základní komponenty acidobazické soustavy – komponentu respirační a komponentu nerespirační (metabolickou).
V chemické úrovni má reakce na změnu koncentrace vodíkových iontů podobu reakcí chemických pufrů extracelulárních tekutin. Reakce se liší podle příčiny a typu změny. Níže jsou popsány tři základní situace, k nimž dochází při acidóze.
- Nahromadění silných kyselin (H+) v extracelulární tekutině (nepřímé ztráty hydrogenuhličitanů).
- Obranná sekundární nárazníková reakce na tuto změnu přímo zahrnuje jak hydrogenuhličitanový, tak nehydrogenuhličitanové pufry (z nich hlavně proteiny):
- 2H++ HCO3‾ + Prot‾ → H2O + CO2 + ProtH.
- Dochází k poklesu bazí do negativních hodnot BE. Zmenšuje se SID.
- Obranná sekundární nárazníková reakce na tuto změnu přímo zahrnuje jak hydrogenuhličitanový, tak nehydrogenuhličitanové pufry (z nich hlavně proteiny):
- Přímé ztráty HCO3‾ z extracelulární tekutiny. Porucha se primárně rozvíjí v hydrogenuhličitanovém pufru.
- Vznikající přebytek H2CO3 nad ubývajícími HCO3‾ okamžitě interaguje s nehydrogenuhličitanovými bázemi, hlavně proteiny, takže na rozdíl od první příčiny porucha sekundárně zasahuje pouze nehydrogenuhličitanové nárazníky. Spotřebovaná H2CO3 se doplňuje na úkor CO2 plazmy:
- H2O + CO2 → H2CO3 + Prot‾ → HCO3‾ + ProtH.
- Interakční děj vede ke zmírnění rozsahu ztrát HCO3‾ v extracelulární tekutině za cenu poklesu koncentrace nehydrogenuhličitanových bazí a snížené dodávky CO2 do plic.
- Snížením nehydrogenuhličitanových bazí nicméně opět dochází k poklesu bazí do negativních hodnot BE a snížení SID, jak to vyžaduje definice změn v nerespiračním (metabolickém) systému.
- Vznikající přebytek H2CO3 nad ubývajícími HCO3‾ okamžitě interaguje s nehydrogenuhličitanovými bázemi, hlavně proteiny, takže na rozdíl od první příčiny porucha sekundárně zasahuje pouze nehydrogenuhličitanové nárazníky. Spotřebovaná H2CO3 se doplňuje na úkor CO2 plazmy:
- Respirační acidóza.
- Příčinou respirační acidózy je hromadění CO2 – snížený výdej CO2 plícemi při zachované produkci CO2 ve tkáních. Dochází k vzestupu paCO2, takže primárně se rozvíjí porucha v hydrogenuhličitanovém pufru.
- Sekundárně proti ní vystupují jen nehydrogenuhličitanové pufry, stejně jako v případě úbytku HCO3‾:
- H2O + CO2 → H2CO3 + Prot‾ → HCO3‾ + ProtH.
- Výsledkem sekundárních interakčních reakcí při respirační acidóze je snížení pCO2. Cenou je zvýšení koncentrace HCO3‾ při stechiometricky stejném poklesu nehydrogenuhličitanových bazí. Celková suma BB plazmy, BE a SID proto zůstávají nezměněny, jak to ostatně vyžaduje i definice respirační poruchy.
- Navíc dochází k difúzi hromadícího se HCO3‾ stěnami kapilár do intersticiálního mezibuněčného prostoru. Níže na křížovém grafu acidobazické rovnováhy uvidíme, že tento proces se projeví odklonem pásu prosté respirační acidózy doleva.
V úrovni fyziologické má odpověď na primární změnu acidobazické rovnováhy podobu kompenzačních anebo korekčních reakcí zprostředkovaných specifickými orgány anebo orgánovými systémy regulace acidobazické rovnováhy.
- Kompenzační reakce na acidobazickou poruchu jsou definovány třemi znaky:
- Jsou sekundární, rozvíjejí se jako následek primární poruchy;
- Jsou zprostředkovány specifickými orgány anebo orgánovými systémy – hlavně ledvinami a plícemi.
- Kompenzační reakce jedné složky acidobazické rovnováhy jsou vždycky namířeny proti primárním změnám, které nastaly v druhé složce (metabolické proti respiračním a naopak).
- O nekompenzovaném stavu se hovoří do té doby, dokud se ještě nerozvinula žádná kompenzační odpověď, a není tedy přítomen žádný sekundární kompenzační efekt (změna paCO2 v odpověď na primární metabolickou poruchu, nebo změna BE a SID v odpověď na primání respirační poruchu).
- Korekční reakce jsou definovány stejnými znaky jako kompenzační reakce, až na to, že se sekundárně rozvíjejí ve stejné složce, v níž došlo k primární poruše; jsou namířeny proti primárním změnám v téže složce acidobazické rovnováhy – metabolické proti metabolickým a respirační proti respiračním.
- Také infúzní léčba je korekcí (primárních metabolických poruch) a také umělá ventilace je korekcí (primárních respiračních poruch).
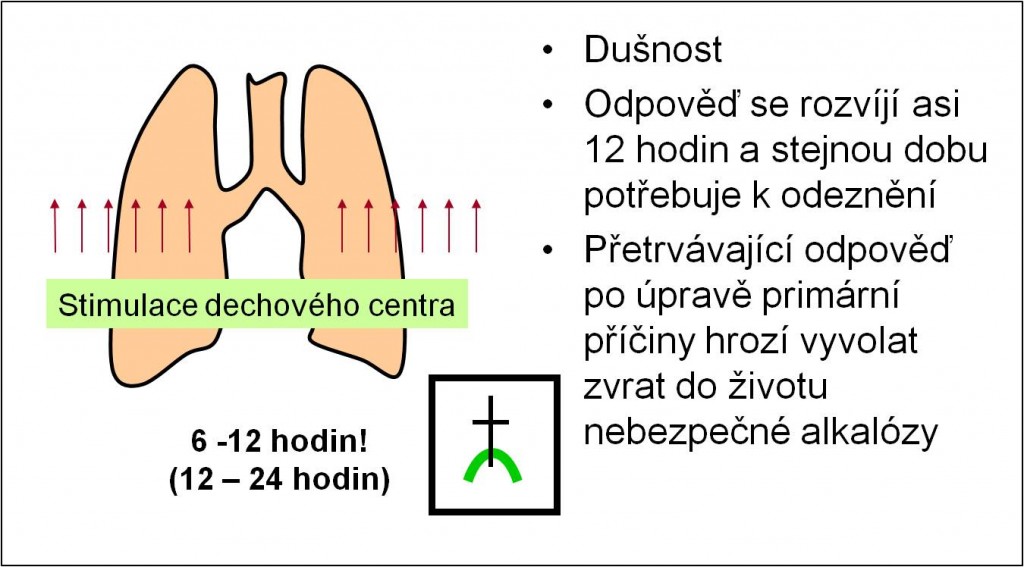
Respirační adaptace na poruchy acidobazické rovnováhy
Acidóza má stimulační účinky na dechové centrum. Odpověď dechového centra se rozvíjí do plné síly v průběhu 12 – 24 hodin, za asi 6 – 12 hodin je rozvinuta do 70 % maximální intenzity. Stejná doba je potřebná k odeznění odpovědi po úpravě poruchy (obr. 5).
Přetrvávající hyperventilace po odstranění primární příčiny acidózy může vést ke zvratu do životu nebezpečné alkalózy. Typickými příklady vysokého rizika takového zvratu jsou
- Rychlá úprava diabetického komatu po podání inzulínu
- Účinná léčba kyslíkem u hypoxických stavů s laktacidémií
Uvedené nebezpečí zvratu je zesíleno přetrvávajícími renálními kompenzačními ději, jejichž odeznění vyžaduje přinejmenším 3 – 5 dní.
Na alkalózu reaguje respirační systém hypoventilací. Kompenzace metabolické alkalózy respiračně zvýšením paCO2 nikdy není úplná. Hodnota paCO2 se zvyšuje se asi o 1 mm Hg na každé zvýšení BE o 1 mmol/l. Hodnota pH ale zůstává nad 7,44.
Obr. 5. Shrnutí kritických účinků acidózy na respirační systém. Přetrvávající odpověď po úpravě primární poruchy hrozí vyvolat zvrat do poruchy opačné (6 – 12 hodin!). Schéma je možno zhlédnout i v animované podobě.
Renální adaptace na poruchy acidobazické rovnováhy
Odpověď ledvin na acidobazickou poruchu se rozvíjí do plné síly v průběhu 5 – 7 dnů, za asi 3 – 5 dnů je rozvinuta do 70 % maximální intenzity. Stejná doba je potřebná k odeznění odpovědi po úpravě poruchy.
Přetrvávající ledvinové děje po odstranění primární příčiny acidózy mohou vést ke zvratu do životu nebezpečné alkalózy. Uvedené nebezpečí zvratu je v prvních 12 – 24 hodinách zesíleno přetrvávajícími respiračními kompenzačními ději, jejichž odeznění vyžaduje přinejmenším 6 – 12 hodin.
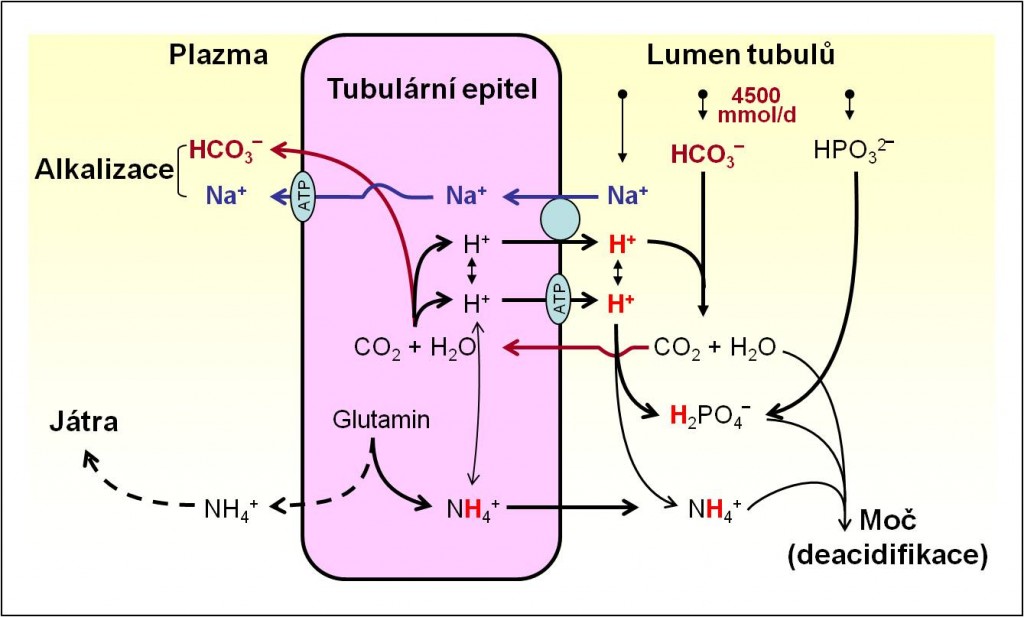
Množství hydrogenuhličitanů, vytvořených v ledvinách v procesu acidifikace moči a vrácených do organismu, je rovno součtu titrovatelné acidity a množství kationtu NH4+ v moči. Titrovatelná acidita moči je acidita stanovená titrací vzorku moči silnou zásadou zpět do hodnoty pH plazmy. Při titraci jde vlastně o obrácený proces vzniku titrovatelné kyseliny. Titrovatelnou aciditu reprezentují hlavně dihydrogenfosforečnany. Iont NH4+ prakticky není v popsaných podmínkách „titrovatelný“, protože jeho pK (ležící nad pH 9,0) zůstává vysoko nad bodem ekvivalence.
Kompenzační odpověď ledvin na acidózu zahrnuje jak zvýšené vylučování titrovatelné kyseliny, tak zvýšenou exkreci NH4+. Protože vylučování titrovatelné kyseliny se zvyšuje rychle, ale málo, spočívá mechanismus adaptace především v rozvoji sekrece NH4+ (obr. 6). Zatímco při alkalóze klesá vylučování NH4+ prakticky na nulu, při acidóze může vzestup sekrece NH4+ dosahovat velikosti dvou řádů.
Obr. 6. Schéma renální adaptace na acidobazické poruchy. Schéma je možno zhlédnout i v animované podobě.
V popředí účinků acidobazických poruch na organismus je působení na centrální nervový systém, na srdce, vény a arterie, na plíce a na elektrolyty, zejména K+ a Ca2+. Přetrvávající odpověď po úpravě primární poruchy hrozí vyvolat zvrat do poruchy opačné (3 – 5 dní!).
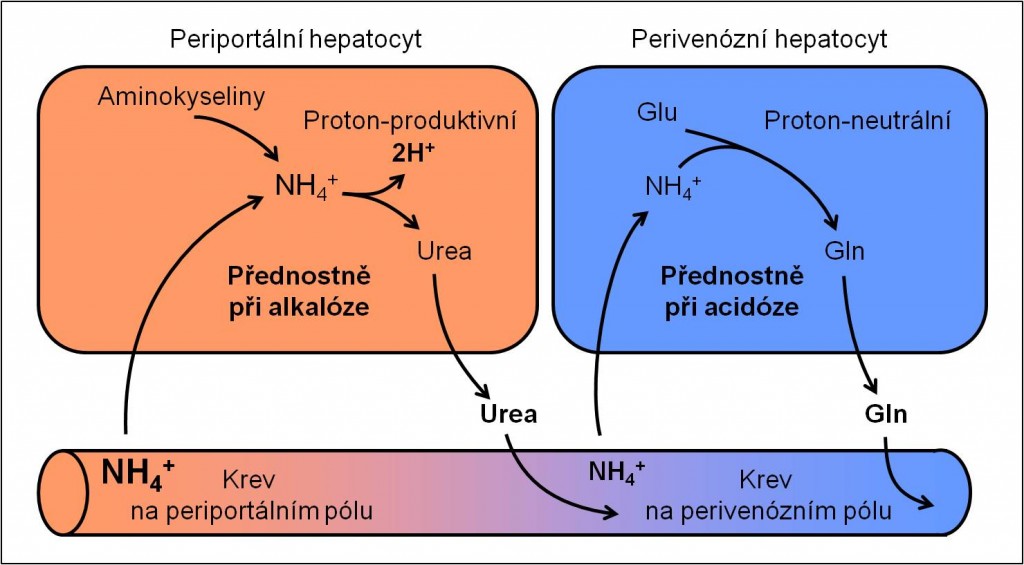
Jaterní adaptace na poruchy acidobazické rovnováhy
Jaterní adaptaci na poruchy acidobazické poruchy ilustruje obrázek 7.
Obr. 7. Schéma jaterní adaptace na acidobazické poruchy. Přetrvávající odpověď po úpravě primární poruchy hrozí vyvolat zvrat do poruchy opačné (3 – 5 dní!). Schéma je možno zhlédnout i v animované podobě.
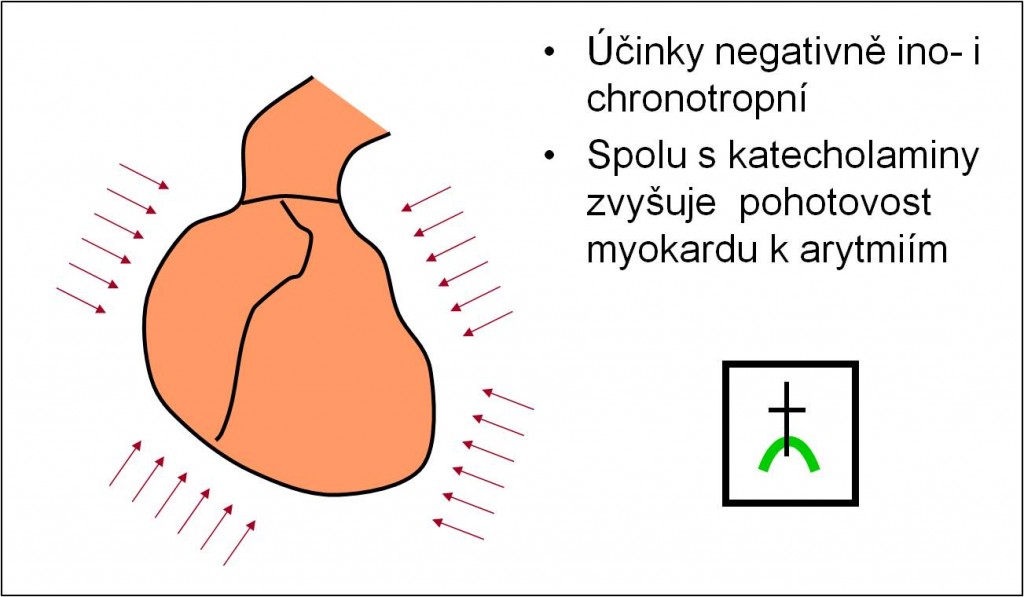
Účinky acidózy na kardiovaskulární systém
Acidóza má negativně ino- i chronotropní účinky na myokard. Tyto účinky jsou zčásti kompenzovány vyplavením katecholaminů; u pacientů s β-blokátory však jsou účinky katecholaminů potlačeny a vliv acidózy na myokard se rozvíjí naplno.
Acidóza spolu s katecholaminy zvyšuje pohotovost myokardu k arytmiím. Je dobře známo, že korekce acidózy velmi usnadňuje úpravu arytmií včetně defibrilace (obr. 8).
Obr. 8. Shrnutí kritických účinků acidózy na srdce.
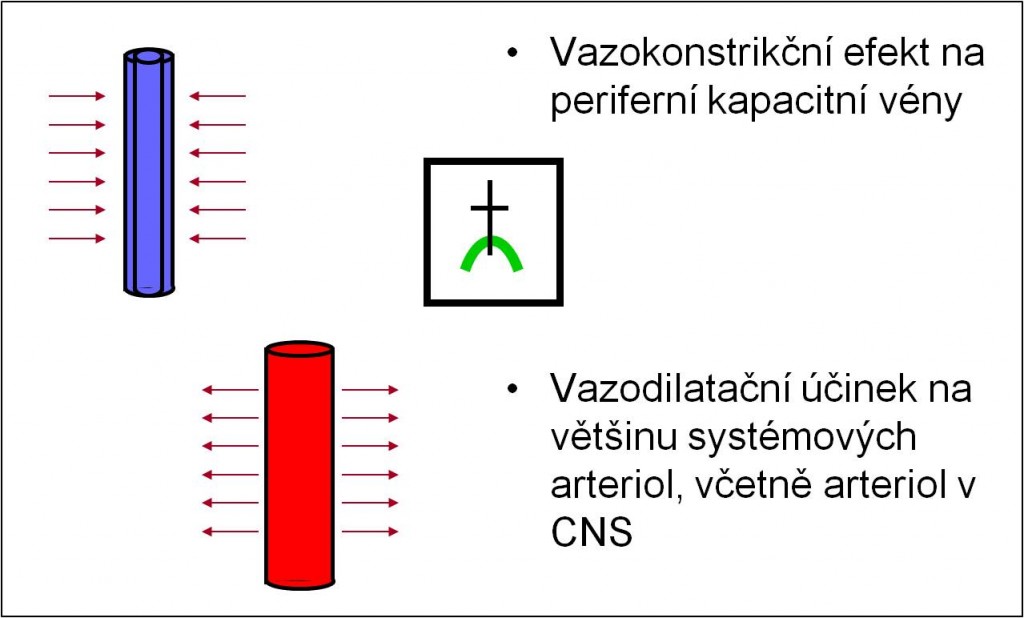
Acidóza má vazokonstrikční efekt na periferní kapacitní vény. Proto infúzní terapie hrozí vysokým rizikem objemového přetížení a vyvoláním edému plic. Zároveň má vazodilatační účinek na většinu systémových arteriol, včetně arteriol v CNS (obr. 9).
Obr. 9. Shrnutí kritických účinků acidózy na cévy. Schéma je možno zhlédnout v animované podobě.
Účinky acidózy na centrální nervový systém
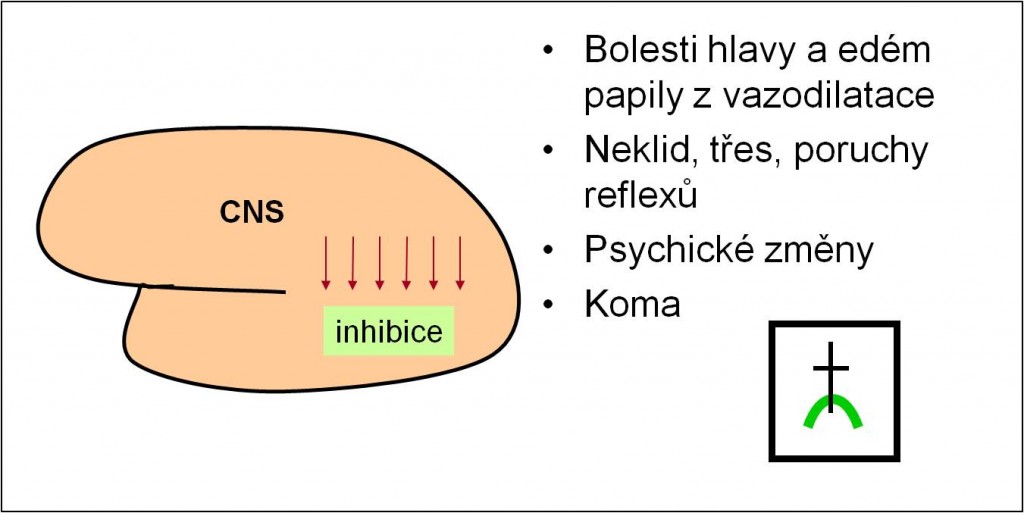
Při acidóze bývají přítomny následující známky toxického poškození neuronů H+ ionty (obr. 10):
- Neklid, třes, poruchy reflexů;
- Psychické změny;
- Kóma.
Acidóza také má vazodilatační účinky na arterioly v centrálním nervovém systému. Tyto účinky jsou u respirační acidózy ještě zesíleny hyperkapnií, jejíž přítomnost přispívá k vysvětlení dalších příznaků ze strany centrálního nervového systému:
- Bolesti hlavy;
- Edém papily.
Obr. 10. Shrnutí kritických účinků acidózy na centrální nervový systém.
Účinky acidózy na hospodaření s ionty K+
Zvýšení koncentrace H+ iontů v extracelulární tekutině má za následek vstup iontů H+ do buněk a přesun iontů K+ do extracelulárního prostředí. Normální hodnoty sérových koncentrací K+ se při acidémii redefinují, jak ukazuje tabulka 6.
| pH | Normální hodnoty K+ (mmol/l) |
| 6,8 | 6,5 – 8,0 |
| 7,1 | 5,5 – 6,5 |
| 7,3 | 5,2 |
| 7,4 | 4,5 |
| 7,7 | 3,5 |
Tabulka 6. Normální hodnoty koncentrace K+ v séru při acidémii.
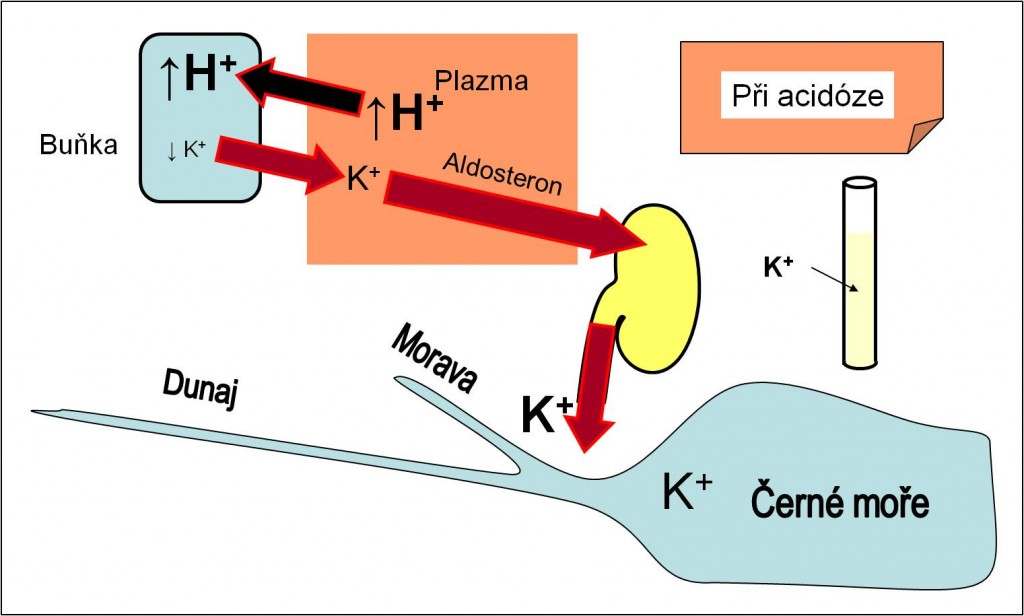
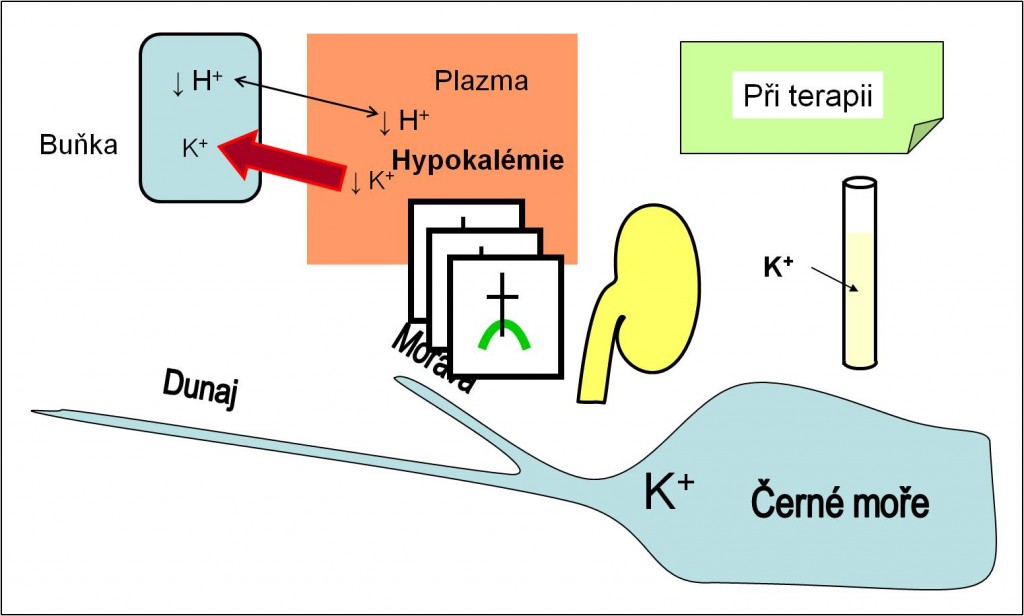
Rozvíjející se hyperkalémie stimuluje sekreci aldosteronu. Proto po dobu acidózy dochází k vysokým ztrátám K+ iontů močí. V těle se rozvíjí těžký deficit K+, a to přes přítomnost hyperkalémie (obr. 11). Při terapeutické úpravě acidózy pak nastává rychlý návrat K+ iontů zpět do buněk. Ubývá iontů K+ v plazmě, a pacient je ohrožen těžkou hypokalémií, která může být smrtící (obr. 12). Proto musí terapii acidóz provázet úhrada ztrát K+ iontů jako součást infúzí. Věnujte prosím také náležitou pozornost podrobnější diskuzi této složité problematiky v kapitole Draselný iont a poruchy jeho homeostázy.
Obr. 11. Účinky acidózy na bilanci K+ iontů. V průběhu acidózy se vyvíjí těžká intracelulární deplece iontů K+ a deficit K+ iontů v organismu. Schéma je možno zhlédnout i v animované podobě – jednak stav před acidózou, jednak procesy při acidóze.
Obr. 12. Účinky léčby acidózy na koncentraci K+ iontů v plazmě. Ionty K+ se v průběhu léčby transportují zpátky do buněk. Při terapii acidóz hrozí smrtící hypokalémie. Schéma je možno zhlédnout i v animované podobě.
Účinky alkalózy na hospodaření s ionty K+
Alkalóza, zejména chronická, rovněž bývá spojena s deplecí zásob K+ iontů v těle. Zvracení nebo alkalizující (thiazidová) diuretika mohou vyvolat hypochlorémickou (chloropenickou) alkalózu, která vede k závažné depleci iontů K+. Při depleci K+ se v moči objeví „paradoxní acidurie“ (při alkalóze očekáváme alkalickou moč, ne kyselou), kdy ledvina nahrazuje vylučování kationtů K+ kationty H+. Komplikací hypokalémie může být těžké poškození tubulárních epitelů - hypokalémická nefróza.
Účinky acidózy na hospodaření s ionty Ca2+
Ionty Ca2+ se při acidóze uvolňují z kostí. Vyplavují se společně s HCO3¯ (výměnou za fosforečnany). Následkem chronické acidózy je deficit Ca2+ a osteoporóza.
Účinky alkalózy na hospodaření s ionty Ca2+
Alkalóza způsobuje disociaci H+ iontů z proteinů – jak z funkčních skupin vedlejších řetězců aminokyselin, tak z fosforečnanových a jiných skupin, které je modifikují. Na obnažené negativní skupiny se vážou ionty Ca2+ a vzniká akutní kritický pokles hladiny ionizovaného kalcia v plazmě. Pokles ionizovaného kalcia se projevuje tetanií až křečemi, které mohou být smrtící.
Finální stádia acidózy
Finálním stádiem acidózy je acidotické koma (obr. 13). Mají na něm hlavní podíl denaturační účinky H+ iontů na proteiny neuronů v centrálním nervovém systému. Často k němu přispívají další faktory, např. dehydratace a selhání oběhu u diabetických hyperosmolárních stavů.
Obr. 13. Finální stádium acidózy. Schéma je možno zhlédnout i v animované podobě.
Finální stádia alkalózy
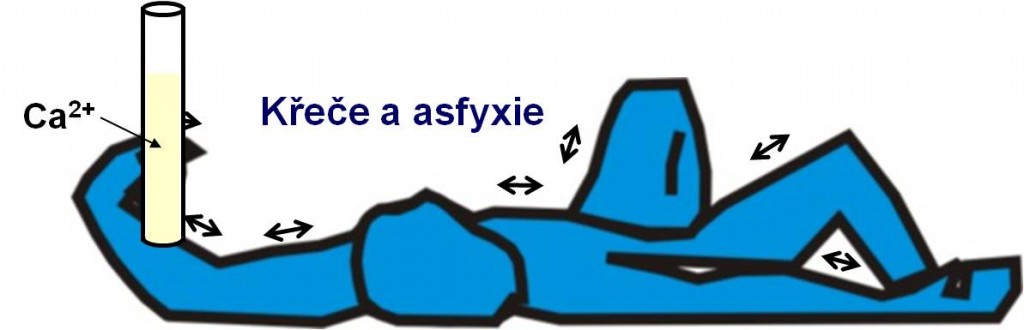
Finálním stádiem alkalózy jsou křeče a smrtící asfyxie s cyanózou z křečí dýchacího svalstva a laryngeální štěrbiny (obr. 14). Jsou způsobeny poklesem hladiny ionizovaného kalcia při alkalóze (ionty Ca2+ se vážou na záporně nabité skupiny proteinů obnažené po disociaci protonů.
Obr. 14. Finální stádium alkalózy. Schéma je možno zhlédnout i v animované podobě.
Příčiny primárních poruch acidobazické rovnováhy
Následující přehled je stručným schématem etiopatogenetické klasifikace acidobazických poruch. Použité zkratky jsou: AG, schodek aniontů; MAC, metabolická acidóza; MAL, metabolická alkalóza; RAC. respirační acidóza; RAL, respirační alkalóza; SID, rozdíl silných iontů. Itotonická v názvu znamená, že nejde o relativní snížení anebo zvýšení koncentrace Na+ vzhledem k objemu vody.
PŘEHLED PRIMÁRNÍCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY
I. Metabolické (nerespirační) poruchy:
- Změny v BE anebo v rozdílu (silné kationty – silné anionty): Snížení BE anebo SID = MAC, zvýšení BE anebo SID = MAL.
- Izotonická iontová nerovnováha:
- Zvýšené reziduální anionty = MAC z hromadění H+ = snížení BE anebo SID; zvýšený AG;
- Hyperchlorémie = hyperchloremická MAC (snížená schopnost vylučovat H+) = snížení BE anebo SID; normální AG;
- Hypochlorémie = hypochloremická MAL (hromadění HCO3¯) = zvýšení BE anebo SID; normální AG.
- Neizotonická iontová nerovnováha – nadbytek/nedostatek čisté vody:
- Diluce = MAC = diluční acidóza = snížení BE anebo SID; nezvýšený AG;
- Koncentrace = MAL = kontrakční alkalóza = zvýšení BE anebo SID; nesnížený AG.
- Izotonická iontová nerovnováha:
- Změny v koncentraci netěkavých slabých kyselin:
- Zvýšení (hyperfosfatémie, hyperproteinémie) = MAC; snížení BE, zvýšený AG;
- Snížení (hypoproteinémie) = MAL; zvýšení BE, snížený AG.
II. Respirační poruchy:
- Hyperkapnie = RAC.
- Hypokapnie = RAL.
KOMENTÁŘ K PŘEHLEDU PRIMÁRNÍCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY
Ia. Metabolické acidózy
Z přehledu vyplývá, že lze rozlišit čtyři hlavní cesty vzniku metabolické acidózy:
- Zvýšený příjem exogenních kyselin anebo jejich prekurzorů. Příklady:
- Intoxikace etanolem (metabolizuje se na kyselinu octovou) (patří do skupiny acidóz uvedených sub 1.1.1);
- Otravy léky (kyselina acetylsalicylová) (patří do skupiny acidóz uvedených sub 1.1.1);
- Diluční acidóza (přívodem fyziologického roztoku nebo čisté vody vzniká v extracelulární tekutině relativní přebytek chloridů nad hydrogenuhličitany) (acidóza uvedená sub 1.2.1).
- Chybná acidifikační terapie.
- Zvýšená tvorba endogenních kyselin. Příklady:
- Ketoacidóza (patří do skupiny acidóz uvedených sub 1.1.1);
- Laktátová acidóza (skupina acidóz uvedená sub 1.1.1);
- Zvýšení koncentrace netěkavých slabých kyselin – hyperfosfatémie, hyperproteinémie (skupina acidóz uvedených sub 2.1).
- Snížené vylučování silných kyselin z organismu. Příklady:
- Selhání ledvin (hromadění kyseliny fosforečné, sírové a močové) (patří do skupiny acidóz uvedených sub 1.1.1);
- Distální tubulární acidóza (patří do skupiny hyperchloremických acidóz uvedených sub 1.1.2).
- Zvýšené přímé ztráty bazí s průvodním deficitem HCO3¯ v těle (přímá hypobazémie); všechny předchozí případy lze chápat i jako acidózy z nepřímých ztrát bazí. Příklady:
- GIT: Zvracení duodenálního obsahu, průjem, ztráty pankreatické a střevní šťávy nebo žluče při odsávání střevního obsahu, střevní píštělí, dreny apod. (patří do skupiny acidóz uvedených 1.1.2).
- Ledviny: Proximální tubulární acidóza (patří do skupiny acidóz uvedenýchsub 1.1.2);
- Ledviny: Diuretika – inhibitory karbonátdehydratázy (patří do skupiny acidóz uvedenýchsub 1.1.2).
- Kůže: Při ztrátách tekutin z popálených ploch (patří do skupiny acidóz uvedenýchsub 1.1.2).
Ib. Metabolické alkalózy
Z přehledu vyplývá, že lze rozlišit čtyři hlavní cesty vzniku metabolické alkalózy:
- Zvýšený příjem exogenních zásad anebo jejich prekurzorů. Příklady:
- Nadměrný perorální příjem hydrogenuhličitanů k neutralizaci žaludečního obsahu (patří do skupiny alkalóz uvedenýchsub 1.1.3);
- Metabolizace exogenních potenciálních hydrogenuhličitanů (citrátu po transfúzích krve a pod.) (patří do skupiny alkalóz uvedenýchsub 1.1.3);
- Chybná alkalizační terapie.
- Zvýšená tvorba endogenních zásad. Příklady:
- Metabolizace endogenních potenciálních hydrogenuhličitanů (laktátu, ketokyselin apod.) (patří do skupiny alkalóz uvedenýchsub 1.1.3);
- Hypoproteinémie (uvedená sub 2.2).
- Snížené vylučování silných zásad z organismu. Příklad:
- Diuretika šetřící kalium (patří do skupiny alkalóz uvedenýchsub 1.1.3).
- Zvýšené ztráty kyselin. Příklady:
- GIT: Zvracení žaludečního obsahu (patří do skupiny alkalóz uvedených1.1.3);
- Ledviny: Saluretika (ztráty iontů Cl¯) (patří do skupiny alkalóz uvedenýchsub 1.1.3);
- Ledviny: Bartterův syndrom (renální tubulární alkalóza) (patří do skupiny alkalóz uvedenýchsub 1.1.3);
- Ledviny: Hypokalémie („paradoxní acidurie“) (patří do skupiny alkalóz uvedenýchsub 1.1.3);
- Kůže: Silné pocení neadaptovaného organismu (patří do skupiny alkalóz uvedenýchsub 1.1.3);
- Kontrakční alkalóza (při ztrátách čisté vody anebo tekutiny s poměrem Na+ : Cl¯ blízkým poměru ve fyziologickém roztoku vzniká relativní přebytek hydrogenuhličitanů nad chloridy) (alkalóza uvedená sub 1.2.2);
- Hypoproteinémie (alkalóza uvedená sub 2.2).
IIa. Respirační acidóza
Repirační acidóza je definována hyperkapnií. S růstem PCO2 se zvyšují hydrogenuhličitany, návazně klesají chloridy (kompenzační hypochloremická alkalóza); schodek aniontů se nemění. Synonymem je globální respirační selhání. Může k němu dojít:
- Z centrálních příčin (přímý útlum respiračního centra);
- Z postižení hrudní stěny a dýchacího svalstva;
- Z postižení dýchacích cest a plic;
- Z poruch poměru ventilace/perfúze.
Hyperkapnie nemůže předcházet hypoxii, pokud hypoxie byla způsobena:
- Hypoventilací (poruchou ventilace/perfúze);
- Selháváním oběhu.
Hyperkapnií nemusí být provázena ani těžká hypoxie, pokud hypoxie byla způsobena:
- Nedostatečným objemem kyslíku ve vdechovaném vzduchu;
- Nedostatečným množstvím hemoglobinu;
- Tkáňovou otravou.
Hyperkapnii zpravidla nezpůsobí ani hypoxie z omezené difúze.
IIb. Respirační alkalóza
Respirační alkalóza je definována hypokapnií. Je spojena s hyperventilací. S poklesem PCO2 se snižují hydrogenuhličitany, návazně se zvyšují chloridy (kompenzační hyperchloremická acidóza); schodek aniontů se nemění. Ke zvýšenému výdejí CO2 z plic může dojít:
- Z centrálních příčin (přímé dráždění respiračního centra);
- Z dráždění chemoreceptorů velkých cév;
- Z dráždění intrathorakálních receptorů, receptorů v dýchacích cestách anebo receptorů v plicním parenchymu;
- Umělou hyperventilací.
Hyperchloremické acidózy
Hyperchlorémie bývá přítomna při metabolických acidózách a při chronické respirační alkalóze. Hyperchloremické metabolické acidózy vznikají vždy, když vzhledem k fyziologickému poměru iontů v extracelulární tekutině odchází s kationty z těla více iontů HCO3¯ než iontů Cl¯. Typicky se tak děje při acidózách z přímého deficitu bazí.
Hyperchloremické acidózy také vznikají vždy, když vzhledem k fyziologickému poměru iontů v extracelulární tekutině se spolu s kationty přivádí více Cl¯ než HCO3¯. Výsledkem je diluční acidóza. Typicky se tímto způsobem vnitřní prostředí mírně okyseluje při infúzi fyziologického roztoku (poměr Na+ : Cl¯ ve fyziologickém roztoku je 1 : 1, zatímco v extracelulární tekutině je 137 : 100 ≈ 1,4 : 1); acidifikační účinek fyziologického roztoku, podobně jako vody, ostatně lze odvodit i z jich neutrálního pH (vnitřní prostředí je mírně alkalické, takže obě tekutiny jsou vzhledem k němu kyselinou). Tento poznatek se využívá i terapeuticky.
Hypochloremické alkalózy
Hypochlorémie bývá přítomna při metabolických alkalózách anebo při chronické respirační acidóze.
Při izotonické iontové poruše, kdy nejde o snížení či zvýšení koncentrace Na+ anebo úbytek či nadbytek vody, může dojít k relativnímu nedostatku Cl¯ jen absolutním úbytkem Cl¯ (ne zvýšením koncentrace silných kationtů, jejichž primární regulace je nezávislá na acidobazické rovnováze).
Hypochloremické metabolické alkalózy proto vznikají vždy, když vzhledem k fyziologickému poměru iontů v extracelulární tekutině odchází s kationty z těla více iontů Cl¯ než iontů HCO3¯ . Typicky se tak děje při alkalózách z přímých ztrát kyselin (zvracení žaludečního obsahu atd.).
Hypochloremické alkalózy také vznikají vždy, když vzhledem k fyziologickému poměru iontů v extracelulární tekutině se spolu s kationty přivádí více HCO3¯ než Cl¯ (např. infúze nebo perorální příjem NaHCO3, metabolizace „potenciálních hydrogenuhličitanů“ apod ).
Na podobném pozadí se rozvíjí i kontrakční alkalóza. Alkalizační účinky ztrát Na+/K+ a Cl¯ iontů v poměru blízkém 1:1 nebo ztrát čisté vody ostatně lze odvodit z jejich neutrálního pH – vzhledem k vnitřnímu prostředí vlastně jde o ztráty kyselin.
Klinická diagnóza acidobazické poruchy
Diagnóza acidobazické poruchy se opírá o laboratorní výsledky. Je však nepřípustné – a v zásadě i nemožné – stanovit klinickou diagnózu acidobazické poruchy pouze na základě údajů biochemické laboratoře. Diagnóza musí být závěrem z informací nejméně dvojího druhu:
- Biochemických, a to nikoliv z jednorázových dat, ale z opakovaných informací o dynamických posunech laboratorních parametrů acidobazické rovnováhy.
- Klinických, spočívajících v identifikaci procesu, který vyvolává změny laboratorních parametrů.
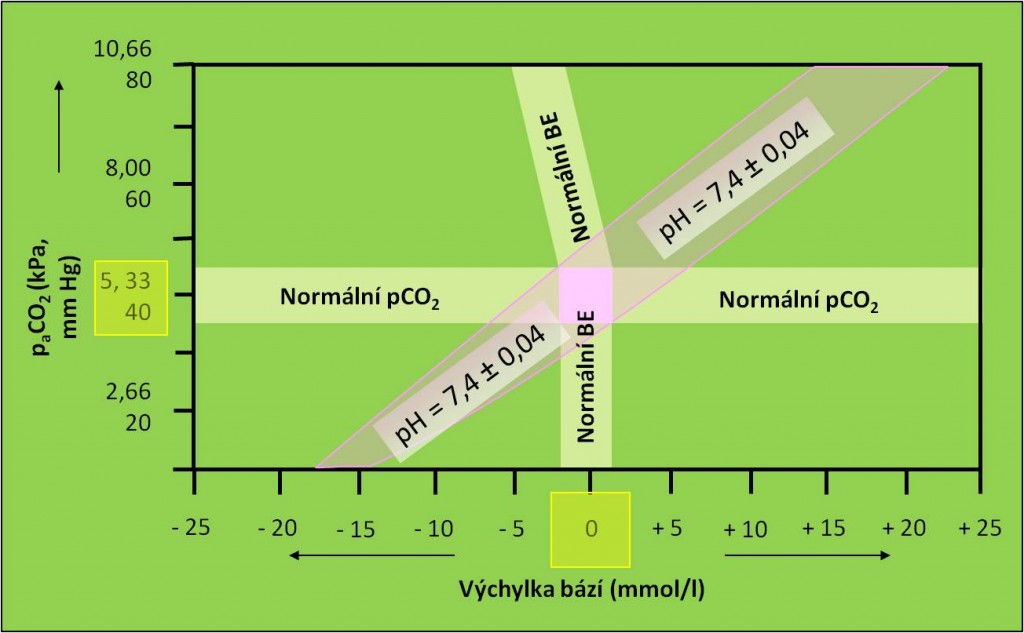
Pomůckou k diagnóze je tzv. acidobazický kříž (obr. 15 – obr. 18).
Obr. 15. Křížový graf acidobazické rovnováhy – pomůcka diagnózy a terapie acidobazických poruch. Schéma je možno zhlédnout i v animované podobě.
Obr. 16. Křížový graf acidobazické rovnováhy. V grafu jsou vyznačeny oblasti acidémie a bazémie (alkalémie). Schéma je možno zhlédnout i v animované podobě.
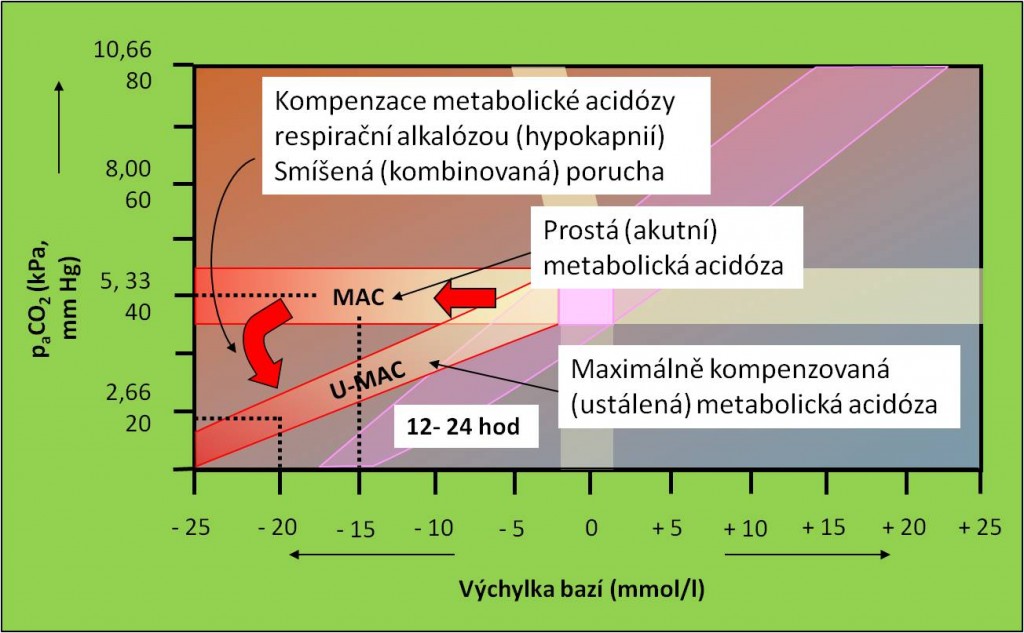
Obr. 17. Křížový graf acidobazické rovnováhy. Postup rozvoje primární metabolické acidózy od prosté (akutní) poruchy přes smíšenou až k ustálené poruše. Schéma je možno zhlédnout i v animované podobě.
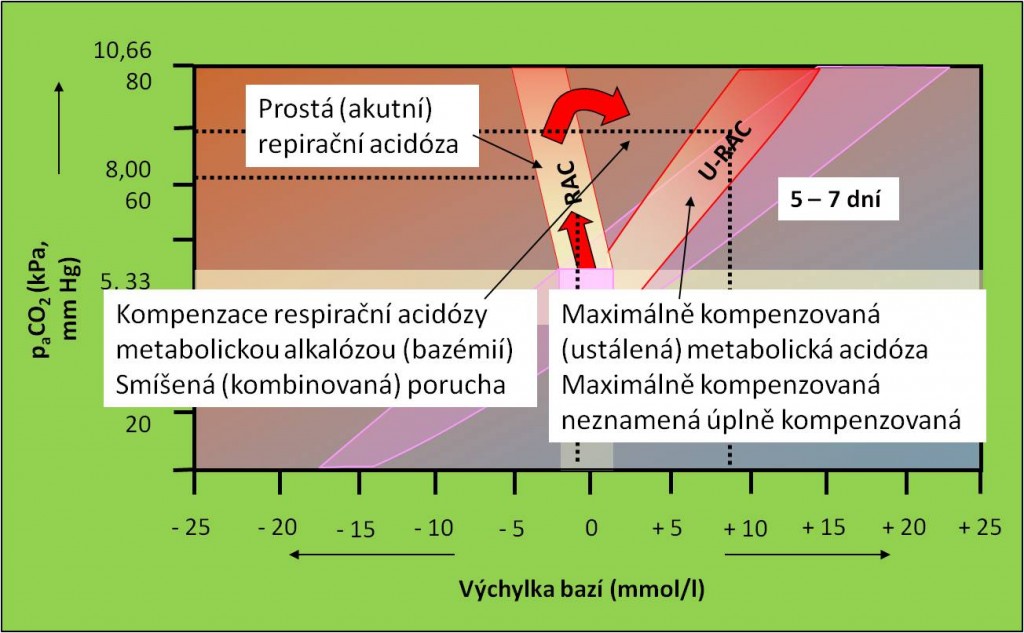
Obr. 18. Křížový graf acidobazické rovnováhy. Postup rozvoje primární respirační acidózy od prosté (akutní) poruchy přes smíšenou až k ustálené poruše. Schéma je možno zhlédnout i v animované podobě. Rovněž jsou dostupná animovaná schémata rozvoje metabolické alkalózy a respirační alkalózy.
Shrnutí příspěvků acidobazického kříže ke klasifikaci poruch a jejich výstupů pro diagnostiku shrnují s-abr-animace 1, s-abr-animace 2, s-abr-animace 3 a s-abr-animace 4.
Základy terapie poruch acidobazické rovnováhy
Základní pravidlo terapie
Základní pravidlo terapeutického přístupu říká, že terapie musí být kauzální.
Proto je při léčebných úkonech třeba dodržovat obecná pravidla pořadí jejich důležitosti, jak se učí v kurzech první pomoci. Patří k nim:
- Obnovení funkci životně důležitých orgánů, v první řadě srdce, oběhu a plic;
- Zajistit funkci oběhu zahrnuje i úpravu hypovolémie, která tak je nadřazena řadě jiných úkonů.
- Zjištění a – pokud to lze – odstranění příčiny poruchy nebo aspoň zmírnění jejího působení.
- Péče o:
- Dostatečné okysličování krve v plících;
- Dobrou funkci oběhu;
- Vyrovnanou energetickou bilanci a bilanci iontů a tekutin.
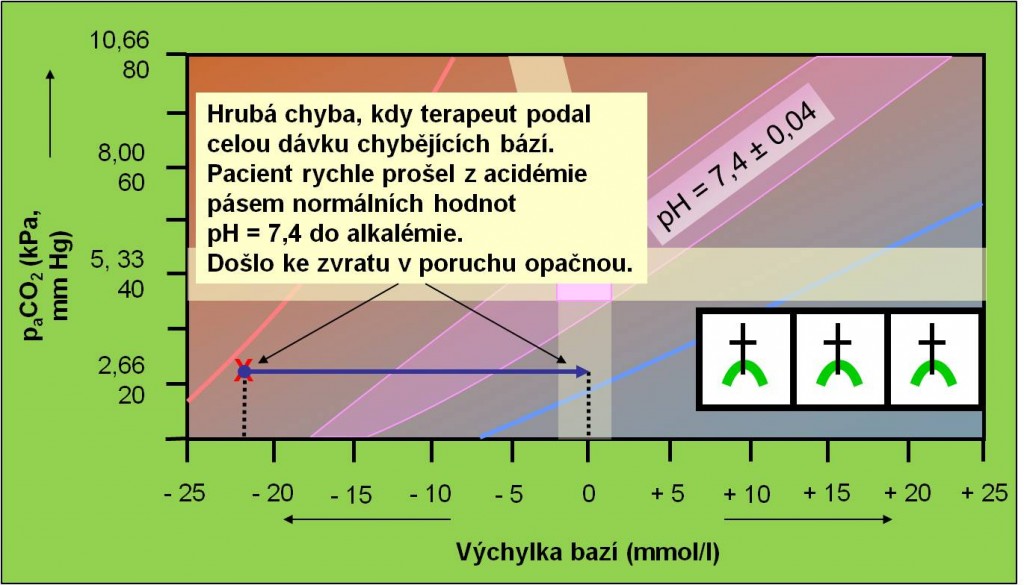
Dále z pravidla kauzálního přítupu ve vztahu k léčbě poruch acidobazické rovnováhy vyplývá, že pacienta zásadně „netitrujeme“ (obr. 19).
- Nasazujeme korekční terapii acidózy hydrogenuhličitany jen tam, kde skutečně jde o deficit HCO3‾.
- Podobně nasazujeme korekční terapii alkalózy chloridy jen tam, kde skutečně jde o deficit Clˉ.
Obr. 19. Ilustrace náhlého zvratu z acidózy do alkalózy vyvolaného nesprávným podáním dávky hydrogenuhličitanů. Schéma je možno zhlédnout i v animované podobě.
Pokud právě uvedená pravidla nerespektujeme, vzrůstají rizika:
- Přetížení oběhu;
- Náhlých zvratů:
- Jedné acidobazické poruchy v opačnou;
- Z manifestace poruch iontového hospodářství.
Obecná nebezpečí infúzní terapie
Při infúzní terapii máme na paměti zejména dvě rizika:
- Objemové přetížení oběhu (srdce) se vznikem plicního edému. Toto nebezpečí je zvláště zvýšeno při léčbě acidóz, a to zejména ze dvou důvodů:
- Konstrikce kapacitních vén;
- Negativního působení acidózy na myokard.
- Vznik edému mozku při úpravě hyperosmolality normoosmolálními roztoky anebo při podávání hypoosmolálních roztoků. Příkladem může být situace u ketoacidotického hyperglykemického stavu. Hyperosmolální prostředí za krevně mozkovou bariérou, které se vytvořilo během rozvoje poruchy, přetrvává déle, než nám může trvat terapeutická úprava osmolality plazmy. Voda se osmoticky pohybuje za krevně mozkovou bariéru a vyvolává edém s herniací a útlakem mozkové tkáně.
Biochemická laboratoř nemůže signalizovat překročení objemu extracelulární tekutiny.
Prevence komplikací léčby a náhlých zvratů
Kromě možného objemového přetížení a vzniku osmotických dysbalancí je během úpravy poruch acidobazické rovnováhy nutno brát v úvahu další velmi vážná rizika. Vyplývají z přítomnosti následujících faktorů:
- Z léčebné eliminace příčin acidobazické poruchy, a tím zástavy hromadění kyselých nebo zásaditých ekvivalentů;
- Z přetrvávání účinků rozvinutých kompenzačních acidobazických mechanismů (interval nejméně 6 – 12 hodin pro respirační odezvu, 3 – 5 dnů pro nerespirační odezvu);
- Z možností průvodních poruch iontového hospodářství, zejména iontů K+ a Ca++ .
Pro prevenci náhlých komplikací anebo zvratů je naprosto nezbytné průběžně monitorovat:
- Bilanci tekutin;
- Parametry acidobazické rovnováhy;
- Rovnováhu ostatních iontů, zejména K+ a Ca2+.
Biochemická laboratoř nemůže signalizovat deficit anebo překročení množství iontů ve tkáních. Dokáže informovat pouze o koncentracích složek v extracelulárních tekutinách. Koncentrace samo o sobě nic nevypovídají o objemech tekutin anebo zásobách iontů nebo solutů v těle.
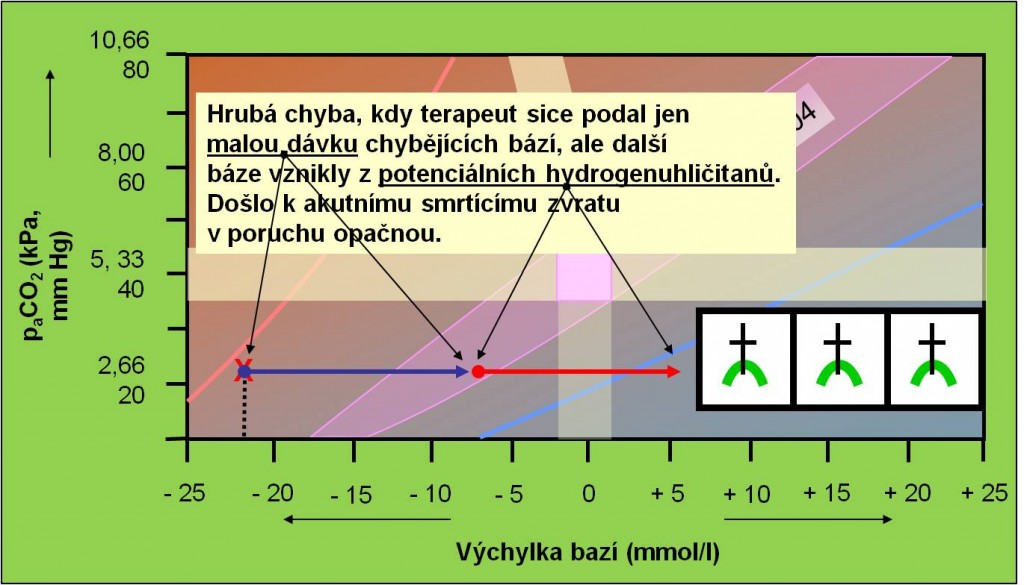
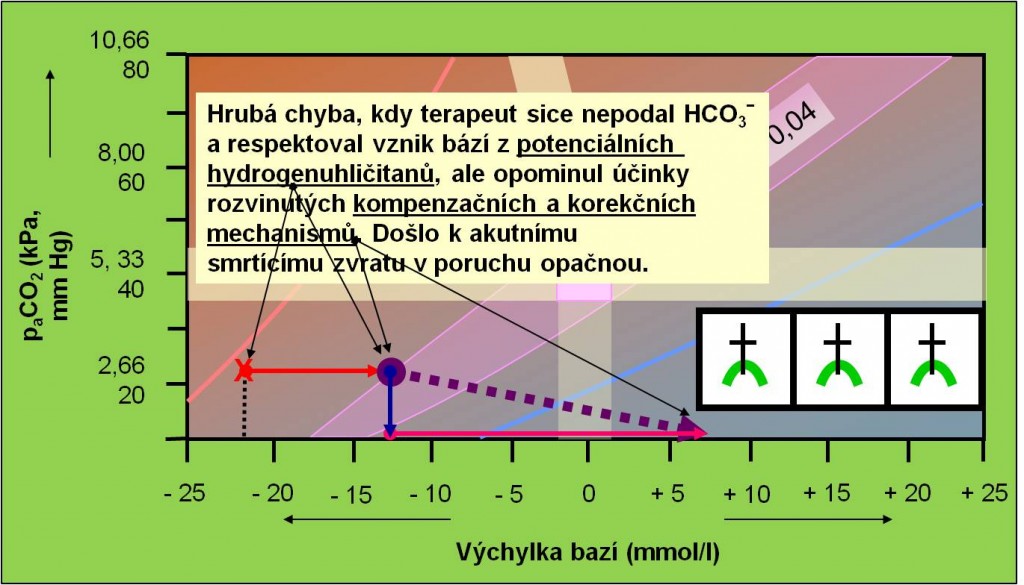
Náhlý zvrat do alkalózy hrozí zejména při nesprávné terapii acidóz s vysokým schodkem aniontů vyvolaných hromaděním „potenciálních hydrogenuhličitanů“ (obr. 20). U těchto poruch je podání hydrogenuhličitanů kontraindikováno (porucha není způsobena deficitem hydrogenuhličitanů, kauzálně tedy není žádný důvod k jejich podání; pacienta zásadně netitrujeme!). Nesprávné nasazení alkalizační terapie u acidóz způsobených hromaděním „potenciálních hydrogenuhličitanů“ mimořádně ohrožuje pacienta následným zvratem do alkalózy. Základem terapie musí být opatrné odstranění příčiny poruchy za neustálé kontroly parametrů vnitřního prostředí. Další nebezpečí zvratu do opačné poruchy vyplývá z podcenění účinků rozvinutých kompenzačních a korekčních mechanismů (obr. 21).
Obr. 20. Ilustrace náhlého zvratu z acidózy do alkalózy vyvolaného nesprávným podáním dávky hydrogenuhličitanů, která se sečetla s anionty vzniklými při metabolizaci potenciálních hydrogenuhličitanů. Schéma je možno zhlédnout i v animované podobě.
Obr. 21. Ilustrace náhlého zvratu z acidózy do alkalózy, kdy lékař sice nepodal hydrogenuhličitany (SPRÁVNĚ!) a vzaĺ v úvahu metabolizaci potenciálních hydrogenuhličitanů (SPRÁVNĚ!), ale opomnněl přetrvávající účinky rozvinutých kompenzačních a korekčních mechanismů (respirační systém: 6 – 12 hodin, metabolický systém: 3 – 5 dnů!). Schéma je možno zhlédnout i v animované podobě.
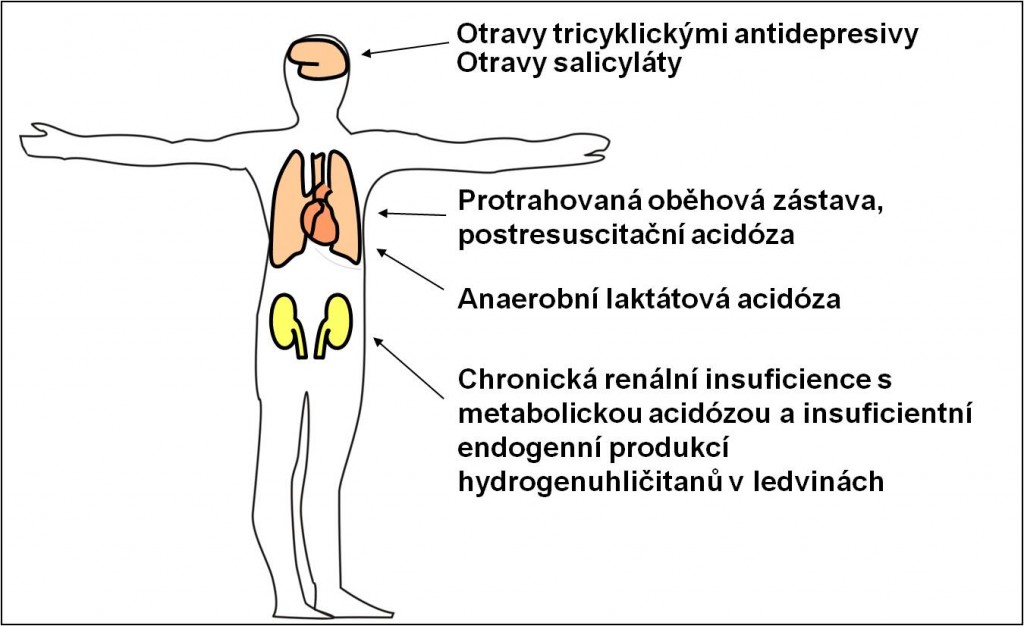
Výjimky použití hydrogenuhličitanů
Použití infúze hydrogenuhličitanů se osvědčilo v některých výjimečných případech, kde příčinou acidobazické poruchy není deficit HCO3‾. Použití hydrogenuhličitanů zde má svá přísná kritéria. Tyto výjimečné případy zahrnují (obr. 22):
- Otravy tricyklickými antidepresivy;
- Otravy salicyláty;
- Protrahovanou oběhovou zástavu anebo postresuscitační acidózu s anaerobní laktátovou acidózou, kde nehrozí překotná tvorba hydrogenuhličitanů z oxidace laktátu;
- Chronickou renální insuficienci s metabolickou acidózou a insuficientní endogenní produkcí hydrogenuhličitanů v ledvinách.
Obr. 22. Shrnutí výjimek z pravidla o přísně limitovaném použití hydrogenuhličitanů k léčbě stavů s hydrogenuhličitanovým deficitem. Schéma je možno zhlédnout i v animované podobě.
Nebezpečí iontových zvratů
Na riziku poškození pacienta léčbou se dále podílejí zvraty z poruch iontového hospodářství, zejména K+ a Ca2+. Zejména jde o následující rizika:
- Nebezpečí náhlé hypokalémie z následného přesunu K+ do buněk při úspěšném postupu léčby acidózy:
- Deprese myokardu, snížení citlivosti myokardu na digitalis z hypokalémie.
- Nebezpečí náhlého snížení hladiny ionizovaného Ca2+ při zvratu do alkalózy:
- Riziko tetanie a spasmů; riziko asfyxie.
- Nebezpečí arytmií z obou právě uvedených důvodů a navíc z důvodu aktivace sympatického autonomního systému.
Při léčbě acidóz nesmějí v podávané infúzi chybět ionty K+. Jestliže je pacient v acidóze a přitom má nízkou koncentraci K+ v plazmě (např. u renální tubulární acidózy), je nezbytné začít podávat K+ ještě PŘED zahájením vlastní kauzální terapie acidobazické poruchy. Autority upozorňují, že v opačném případě hrozí srdeční zástava z dalšího poklesu koncentrace K+ iontů v plazmě. Jediným nezbytným předpokladem bezpečného podání iontů K+ jsou fungující ledviny (aldosteron), které mohou vyloučit případný nadbytek K+. Ionty K+ je možno podat v infúzích s těmito parametry:
- Maximální koncentrace K+ v roztoku: 40 mmol/l (3 g/l).
- Maximální rychlost podání K+: 20 mmol/hodinu.
- Kontraindikace podání K+: Selhání ledvin
Základy terapie respirační insuficience
Respirační acidózu provází hypochlorémie vynucená zvýšenou koncentrací hydrogenuhličitanů. Obligátní součástí respirační acidózy (globálního respiračního selhání) je anaerobní laktátová acidóza. Základem správné léčby kombinované acidózy z chronické respirační insuficience proto je:
- Opatrné zlepšování ventilace (O2) spolu s podáním Cl‾, aby se zabránilo hromadění HCO3‾ z metabolizovaného laktátu. Jinak hrozí alkalóza, hypokalémie a tetanie.
- Podání hydrogenuhličitanů by bylo hrubou chybou s možným smrtícím zakončením. (Je namístě si uvědomit, že hydrogenuhličitany v extracelulární tekutině jsou při zvýšeném pCO2 vždy vyšší!).
- Pozor na odstranění hypoxie jako hybného faktoru ventilace. Pacient je adaptován na vysoké paCO2! Než se paCO2 po výdechu dostatečně zvýší na úroveň, která by navodila spontánní nádech, může hypoxie dosáhnout kritické meze.
Souběžným výsledkem dobře provedené terapie je vyhasnutí kompenzačních mechanismů, které provázely respirační acidózu. Při novém vzplanutí respirační insuficience pak je pacient znova ohrožen strmě narůstající acidózou, protože kompenzačřní mechanismy se musí znovu rozvinout (minimálně 3 – 5 dní pro metabolické kompenzační mechanismy).
Základy terapie alkalóz
Základem léčby alkalózy ze ztrát Cl‾ je:
- Podání NaCl, je-li současně deplece Na+ anebo extracelulární tekutiny
- Podání KCl, je-li současně deficit K+;
- Podání MgCl2 nebo CaCl2.
- Podání NH4Cl per os.
- Intravenózní podávání NH4Cl je kontraindikováno pro nebezpečí encefalopatie z vysoké hladiny amoniaku.
- Látka vůbec nesmí být podána u hrozícího selhání jater.
- Při předávkování NH4Cl hrozí metabolická acidóza: –NH4+ se metabolizuje (na močovinu) a hromadí se Cl‾, při tom z důvodu elektroneutrality zanikají HCO3‾.
- Jestliže hrozí nebezpečí komplikací z nadměrného zvětšení objemu extracelulární tekutiny, lze podat HCl zředěnou v roztoku dextranu do některé z centrálních vén.
Specifická acidobazická rizika transfúzní terapie
Transfúze krve ohrožuje pacienta jednak alkalózou z metabolizovaného citrátu, jednak hyperkalémií z iontů K+ uvolňovaných erytrocyty dárce. Velké objemy tranfúzí dále ohrožují pacienta nadměrnými dodávkami iontů železa.
Pravidla pro odběr kontrolních vzorků v průběhu infúzní léčby acidobazických poruch
Před odběrem kontrolních vzorků krve pacienta musíme při úpravách poruch acidobazické rovnováhy přerušit terapeutickou infúzi a nahradit ji na 20 – 30 minut infúzí, která nemění pH krve. Při monitorování stavů s poruchami periferního prokrvení je namístě pamatovat na zvýšené arteriovenózní rozdíly hodnot veličin acidobazické rovnováhy.
Zpracoval: Jaroslav Veselý, Ústav patologické fyziologie LF UP v Olomouci
Použitá literatura a literatura k dalšímu studiu:
Kofránek J.: Komplexní model acidobazické rovnováhy (http://physiome.cz/acidbase).
Kofránek J, Matoušek S, Mateják M.: Modelování acidobazické rovnováhy. In MEDSOFT 2010 (M. Zeithamlová, Ed.), str. 66-88. Agentura Action M, Praha 2010. ISSN 1803-8115.
Masopust J.: Klinická biochemie (https://www.zdravcentra.cz/index.php?act=k-10&did=1035&page=kapitoly%2Fuvod%2Fuvod.htm).
Nejedlý B a spol.: Vnitřní prostředí, klinická biochemie a praxe. Avicenum, Praha 1980.
Těšínský P, Kazda A., Sobotka L.: Hydrogenuhličitan v léčbě metabolické acidózy: ano či ne? Klin. Biochem. Metab. S(29) 258-263, 2000.