Ateroskleroza
Ateroskleróza (AT) je nejčastější příčinou úmrtí ve vyspělých státech Evropy a USA, tvoří více než 50% všech úmrtí. I v České republice patří úmrtnost na choroby způsobené aterosklerózou mezi jednu z nejvyšších ve světě. Má na svědomí 55% úmrtí ročně a je příčinou každého druhého úmrtí u mužů.
Ateroskleróza je podle WHO definována jako variabilní kombinace změn intimy arterií spojené s ukládáním lipidů (cholesterolu), polysacharidů a krevních elementů a v dalším vývoji tvorbou fibrózní tkáně provázené ukládáním vápenatých sloučenin, se změnami v medii arterií. Je to pomalu progredující onemocnění začínající již v mládí.
Oficiální stránky České společnosti pro aterosklerozu: http://www.athero.cz/
Postihuje velké a střední artérie tvorbou subintimálního ztluštění – aterómu, které může vést k redukci nebo až úplné obstrukci krevního průtoku. Stěna cév pak klade průtoku krve velký odpor a dochází k rozvoji arteriální hypertenze. Z klinického hlediska mají největší význam léze srdečních věnčitých tepen a vznik ischemické choroby srdeční, anginy pectoris, infarku myokardu, extrakraniálních tepen zásobujících mozek vedoucích k cévní mozkové příhodě, event. postižením cév a tím ischemie dalších orgánů a tkání (ledviny, tepny DKK atd .).
Odkaz na obrázek vzniku ateromového plátu v cé stěně.
Javier Sanz & Zahi A. Fayad, Nature 451, 953-957(21 February 2008)http://www.nature.com/nature/journal/v451/n7181/fig_tab/nature06803_F1.html
Na patogenezi aterosklerózy se podílí komplex po sobě jdoucích událostí, vznikající jako odpověď na poškození cévního endotelu, které vedou k rozvoji chronického zánětlivého procesu stěny arterií. To způsobuje dysfunkci endotelu s tvorbou cytokinů, adhezních molekul a růstových faktorů. Aktivované endotelové buňky přitahují do místa léze monocyty, které se zde mění na makrofágy, dále sem vnikají T-lymfocyty z krevní cirkulace a buňky vaskulární hladké svaloviny z medie. Subendotelový prostor se postupně zvětšuje a zvyšuje se i permeabilita endotelové výstelky umožňující pronikání lipoproteinových částic do tohoto prostoru, kde působením kyslíkových a dusíkových radikálů dochází k jejich lipoperoxidaci a uvolněný oxidovaný cholesterol je pohlcován makrofágy za vzniku pěnových buněk. K lepšímu vychytávání cholesterolu do makrofágů slouží tzv. scavengerové neboli úklidové receptory na jejich povrchu. Jejich aktivita však není regulována množstvím přijatého cholesterolu. Přeplněné pěnové buňky proto postupně praskají a cholesterol se tak dostává do extracelulárního prostoru a stává se základem tzv. lipidového jádra. Postupně dochází také k proliferaci hladkých svalových buněk a vaziva, ukládá se zde kalcium. Stěna cévy se postupně ztlušťuje, zužuje lumen a stává se více trombogenní a náchylnější k poškození. Celý tento proces vede k tvorbě aterómu (aterómového plátu).
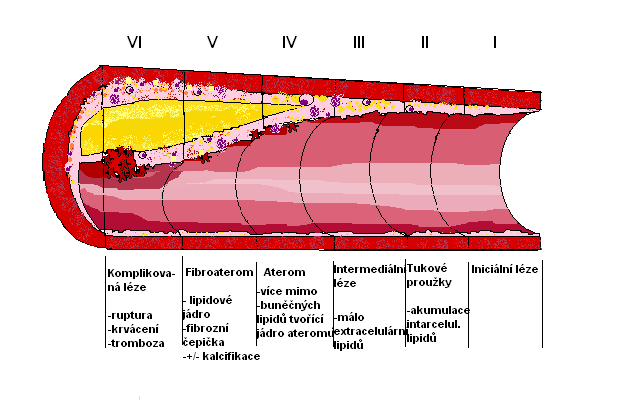
Z hlediska morfologického lze rozlišit 6 stupňů rozvoje aterosklerotické léze:
Typ I – Izolované pěnové buňky. Intima je excentricky ztluštělá a jsou v ní přítomny skupiny makrofágů, obsahujících v cytoplazmě kapénky lipidů. Tyto léze byly nalezeny již u dětí v1.roce života.
Typ II – Tukové proužky jsou zde makroskopicky patrné. Vzniká hromaděním pěnových buněk z intracelulárně akumulovaných lipidů. Dále jsou ve stěně tepny přítomny makrofágy, pěnové buňky a T-lymfocyty.
Typ III – Intermediární léze. Vystupňováním předchozích pochodů dochází k akumulaci velkého množství pěnových buněk a makrofágů, jejichž prasknutím se uvolňují lipidy i do extracelulárního prostoru.
Typ IV – Aterom. Jde o dále vyvinuté stádium III s hustým nahromaděním extracelulárních lipidů, nazývaným lipidové jádro, obsahující krystaly cholesterolu a depozity kalcia. Vedou postupně k zúžení vnitřního průsvitu tepny.
Typ V – Fibroaterom. Ateromy se postupně zvětšují, v jejich okolí se množí hladké svalové buňky a vazivo, které vytvářejí vazivovou vrstvu nad lipidovým jádrem. Tyto léze obsahují vystupující pojivovou tkáň, kolagen a hladké svalové buňky ve větším množství. Mohou již poměrně výrazně zužovat arterie a způsobovat subjektivní potíže.
Typ VI – Komplikovaná léze. Jde o lézi typu IV nebo V, která je modifikována dalším poškozením fibroateromu – jeho prasknutím, tvorbou hematomu s krvácením, vytvořením krevní sraženiny tzv. trombózou, která může vést k částečné nebo úplné cévní okluzi. Důsledkem může být zablokování přítoku do životně důležitých orgánů.
obr. 1: Vývoj aterosklerotického plátu
Obrázek popisuje jednotlivé fáze vývoje aterosklerotického plátu z morfologického hlediska, které jsou podrobně popsány v textu. Při tvorbě obrázku jako předlohy využito obrazové předlohy ze stránek wikiskripta.eu.
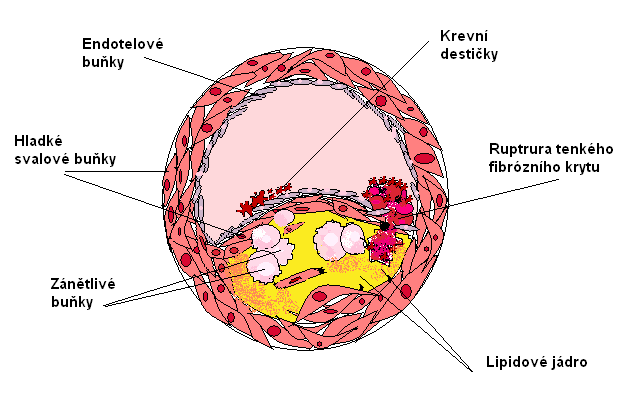
Aterosklerotický plát
Aterosklerotický plát sestává z měkkého lipidového protrombogenního jádra, pokrytého směrem k cévnímu lumen fibrózním krytem, který obsahuje hladké svalové buňky a zánětlivé buňky, především makrofágy. Makrofágy, obsahující převážně oxidované LDL. Podle stability můžeme pláty rozdělit na stabilní a nestabilní (vulnerabilní).
Obr.2: Aterosklerotický plát – složení. Při tvorbě obrázku bylo využito obrazové předlohy int2.lf1.cuni.cz.
Stabilní plát obsahuje hlavně hladké svalové buňky a velké množství kolagenu v silné fibrózní čepičce, malé lipidové jádro a malé množství zánětlivých buněk. Tyto pláty bývají starší, ale po řadu let stálé.
Nestabilní plát bývá měkký s velkým lipidovým polotekutým jádrem, složeným hlavně z esterů cholesterolu, pěnových buněk a T-lymfocytů, obsahuje také velké množství zánětlivých buněk. Na povrchu je jen tenký kryt s malým množstvím kolagenu a hladkých svalových buněk. Tyto pláty bývají spíše mladší.
Stabilní a nestabilní pláty v sebe mohou navzájem přecházet v závislosti na tom, které procesy převáží. Komplikace jsou výsledkem nerovnováhy mezi mechanickou odolností fibrózní čepičky plátu a velikostí hemodynamických sil, které na ni působí (tlak krve, pulzová vlna, srdeční kontrakce).
http://journals.cambridge.org/fulltext_content/ERM/ERM3_25/S1462399401003696sup002.htm Odkaz na obrázek struktury nestabilního aterosklerotického plátu a prásklého plátu.
V pokročilých stádiích AT plátu (typ IV až VI) jsou charakteristickou součástí i depozita vápníku, pro které bylo vypočítáno „kalciové skóre“, udávající závislost mezi množstvím vápníku a závažností koronární aterosklerózy (viz níže – vyšetřovací metody).
Teorie vzniku aterosklerózy
Teorie vzniku aterosklerózy není stále jednotná.
Lipidová teorie předpokládá, že primární příčinou aterosklerózy je akumulace lipidů (především LDL, ale i IDL a VLDL) v cévním epitelu ve formě tzv. pěnových buněk. LDL částice zároveň potencují hyperplazii buněk hladké svaloviny a jejich migraci do subintimálních a intimálních oblastí, kde dochází k oxidaci LDL.
Teorie chronického poškození endotelu říká, že poškození endotelu nejrůznějšími mechanismy vede k poruše jeho funkce, adhezi destiček na obnažený subendoteliální povrch, jejich následné agregaci, chemotaxi monocytů, T-lymfocytů a zvýšení PDGF („platelet-derivated growth factor“), který způsobuje migraci buněk hladké svaloviny z medie do intimy, kde se tyto buňky dělí, syntetizují kolagen a proteoglykany a vytvářejí tak fibrózní plát.
Sjednocená teorie aterosklerózy neboli teorie endoteliální dysfunkce, vychází z předpokladu, že základním krokem v rozvoji aterosklerózy je diskrétní poškození endotelu, tedy endoteliální dysfunkce. Tak vzniká nerovnováha mezi vazoaktivními mechanismy a hemokoagulačními působky, jejíž výsledkem je převaha vazokonstrikčních a protrombických pochodů a aktivace zánětlivých a proliferačních pochodů. Poškozeným epitelem pak snáze procházejí lipoproteiny a masivně infiltrují cévní stěnu, kde jsou oxidovány. Oxidované lipoproteiny dále aktivují makrofágy a rozvíjí tak proces aterosklerózy.
Infekční teorie aterosklerózy předpokládá, že základním etiologickým agens, vyvolávajícím endoteliální dysfunkci a zánětlivou reakci cévní stěně, jsou chronické bakteriální a virové infekce (např. Chlamydia pneumoniae, cytomegalovirus). Ty mohou aktivovat imunitní systém a vést ke zvýšené tvorbě imunitních komplexů, které kromě dysfunkce endotelu způsobují i aktivaci zánětlivého procesu v cévní stěně. Na tok poškození nasedají další procesy, které hrají důležitou úlohu při rozvoji aterosklerózy.
Rizikové faktory aterosklérozy
Při rozvoji AT a jejich komplikací se uplatňuje řada tzv. rizikových faktorů, které podporují vlastní aterogenezi a trombogenezi. Faktory můžeme rozdělit:
- neovlivnitelné (endogenní) jako je věk, pohlaví, genetické vlohy
- ovlivnitelné – kouření, alkohol, pohyb …
1. Dyslipidémie – zejména vysoká hladina LDL a nízká hladina HDL cholesterolu.
2. Hyperfibrinogenémie – fibrinogen zvyšuje viskozitu krve, stimuluje buněčnou proliferaci a také podporuje agregaci trombocytů a vznik tvorbu = trombogenní efekt.
3. Homocystein – jeho zvýšená hladina je riziková, protože tvoří vysoce reaktivní radikály, které poškozují buňky.
4. Kouření
5. Arteriální hypertenze
6. Zvýšená hladin C – reaktivního proteinu
7. Obezita a nízká aerobní aktivita
8. Diabetes mellitus
9. Insulinová rezistence
10. Pokročilý věk
11. Mužské pohlaví
12. Pozitivní rodinná anamnéza s předčasným výskytem aterosklerozy
13. Chronická systémová infekce
14. Stres
15. Hypothyreoza
ad 1) Dyslipidémie:
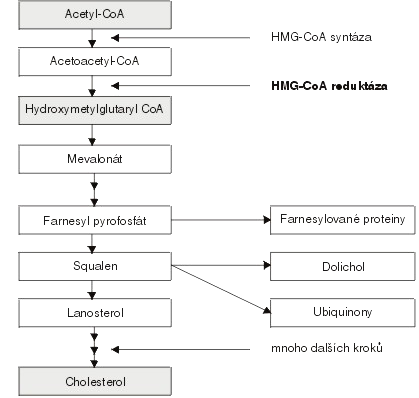
Cholesterol tvoří nezbytnou součást buněčných a organelových membrán, je prekurzorem pro tvorbu steroidů, žlučových kyselin a vitamínu D. V těle se vyskytuje jako volný cholesterol nebo ve vazbě s dlouhými řetězci mastných kyselin (MK) jako ester cholesterolu. Je syntetizován z acetylkoenzymu A ve všech živočišných buňkách. Klíčovým enzymem v syntéze je3-hydroxymetyl-3-glutaryl-koenzym A reduktáza (HMG-CoA), jehož aktivita je regulována především množstvím cholesterolu v buňce. Z organismu je cholesterol vylučován cestou žluče, buď nativní, nebo přeměněný na žlučové kyseliny, přičemž polovina ze žluče a asi 95 % žlučových kyselin je zpět reabsorbována.
Obr.3 : Schéma syntézy cholesterolu
Triacylglyceridy (TAG) jsou látky exogenního i endogenního původu, vznikající vazbou 3 MK na glycerol. Syntéza „de novo“ probíhá hlavně v játrech a zdrojem pro MK je glukóza.
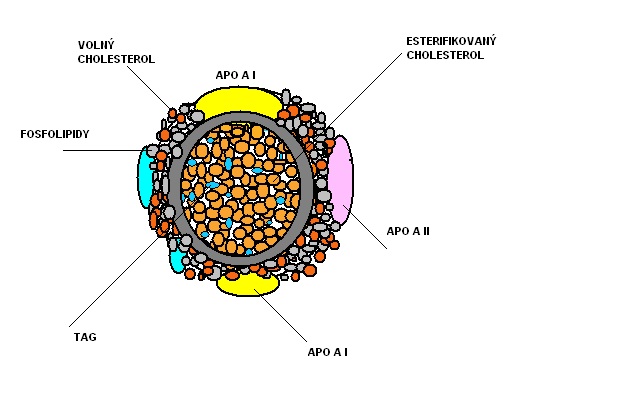
Lipidy (cholesterol, TAG) jsou v krevní plazmě transportovány ve formě makromolekulárních komplexů –lipoproteinů (LP), částic sestávajících z TAG, fosfolipidů, cholesterolu a nosičových proteinů – apoproteinů.
Rozdělení lipoproteinů podle hustoty, místa vzniku, funkce a rizika aterosklerózy jsou v tabulce níže.
Tab.1: Přehled základních lipoproteinů.
| Lipoprotein (LP) | zdroj | složení * | funkce | riziko aterosklerózy |
| Chylomikra -CL | střevo | TAG (90%), FL, CH, CHE, ApoA, B48 C, E | Transport exogenních lipidů přijatých v potravě | neovlivňují |
| CL remnants | CL | TAG(70%), FL, CH, CHE | - | zvyšují ++ |
| LP o velmi nízké hustotě (VLDL) | játra | TAG(55%), FL, CH, CHEApoB100, C, E | Transport endogenních lipidů | mírně zvyšují + |
| LP o střední hustotě (IDL) | VLDL | TAG(23%), CH (38), FL, CHeApoB100, E | - | silně zvyšují +++ |
| LP o nízké hustotě (LDL) | IDL | TAG, CH(50%), CHE. FLApoB100 | Transport CH do jater a ostatních tkání | silně zvyšují +++ |
| LP o vysoké hustotě (HDL) | játra, střevo | CH(19%), CHE, FL, TAGApoAI, AII, C, E | Transport CH z extrahepatálních tkání do jater | silně snižují – - - |
*Pozn. CH-cholesterol, CHE –cholesterolester, TAG-triacylglyceroly, FL-fosfolipidy, Apo-apoprotein
Metabolismus lipoproteinů: podrobněji a obrázek viz. téma dyslipidémie.
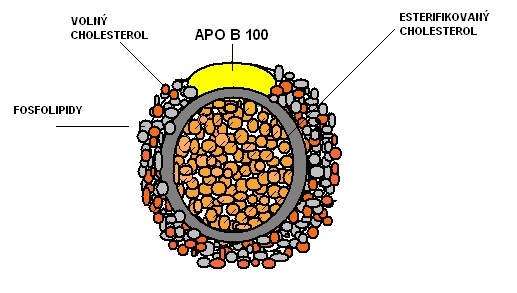
LDL částice obsahují vysoký podíl cholesterolu. Na svém povrchu nesou bílkovinou strukturu tzv. apolipoprotein B 100. V průběhu normálního metabolismu se LDL částice katabolizují prostřednictvím LDL receptorů lokalizovaných zejména na povrchu jaterních buněk. Jsou zastoupeny několika podtřídami podle velikosti a hustoty. Nejvíce aterogenní jsou LDL – IV označované jako malé denzní LDL, které jsou charakteristické obsahem menšího množství cholesterolu. Proto při jejich výrazném zvýšení může být celková hladina cholesterolu v normě.
Obr.4: LDL částice
HDL částice zajišťují tzv. reverzní transport cholesterolu z periferie zpět k játrům. Chrání LDL částice před oxidací, mají protizánětlivé účinky, zlepšují endotelovou dysfunkci a také mají antiagregační efekt. Zásadní význam v HDL má enzym lecitin-cholesterolacyltransferáza(LCAT), který esterifikuje volný cholesterol a umožňuje tak jeho transport z tkání a z povrchu cévní stěny.
Obr.5 : HDL částice
Lipoprotein (a) má na svém povrchu navázán další glykoprotein – apolipoprotein(a), který je strukturálně homologní s plazminogenem, základní bílkoviny fibrinolytického systému. Soutěží s ním o vazbu na plazmin a potlačuje tak fibrinolýzu. Navíc podporuje proliferaci buněk hladké svaloviny cévní stěny. Jeho zvýšená koncentrace je samostatným rizikovým faktorem AT.
Viz také téma Dyslipoproteinemie.
Klinické projevy:
Ateroskleróza může vyvolat 2 základní problémy. Zaprvé tvorbu ateromu, který postupně zužuje průsvit tepny. Ačkoliv tepny dlouhodobě kompenzují toto zúžení, nakonec plát vede k oblenění průtoku a způsobuje tak nedostatečné zásobení orgánů a tkání. Pokud však jsou kompenzační procesy tepny příliš silné, může tento efekt vyústit až v tvorbu přílišného rozšíření tepny tzv. aneurysma. Ateroskleróza je chronické onemocnění, vyvíjí se postupně a pomalu zhoršuje krevní zásobení orgánů a způsobuje jejich ischemii (např. AP, ICHDKK). Častou komplikací však může být ruptura plátu s nasedající trombózou a akutním uzávěrem tepny vedoucí ke kritickému nebo úplnému zastavení průtoku tepnou i s možností rychlé smrti např. na infarkt myokardu. Klinické projevy jsou dány podle tíže zúžení průsvitu tepny a podle orgánu, který vyživují postižené cévy.
*50% zúžení tepny se často neprojevuje ani poruchou průtoku, většina potíží se projevuje až od zúžení nad 75% průsvitu.
http://medillustrations.com/Search.aspx?srh=Circulatory
Odkaz na webovou stránku se zdravotnickými ilustracemi, sekce cirkulace je zaměřena na zobrazení cévního zásobení zejména dolních končetina a břicha. Ukazují obrazy zdravých tepen bez aterosklerozy, vývoj ateromového plátu a jeho možných komplikací – okluze tepen trombem, embolií např. v dolních končetinách, srdci, tak např.střevní ischemii. 2 obrázky se také ukazuují arteriogram tepenného řečiště dolních končetin s bypassy (umělým přemostěním cév) femoropopliteálním, femorotibiálním a aortobifemorálním.
Srdce
Zúžení koronárních arterií a nedostatečné zásobení srdce, vede k ischemické chorobě srdeční (ICHS) s projevy námahové nebo klidové dušnosti (anginy pectoris – AP) nebo akutně k infarktu myokardu (IM), dále poruchy rytmu (arytmie), srdeční selhání.
Obr.6: Koronarografie, zdroj IMPAX, FNOL.
http://www.stefajir.cz/?q=koronarografie
Odkaz na stránky popisující význam, princip a využití koronarografie v praxi.
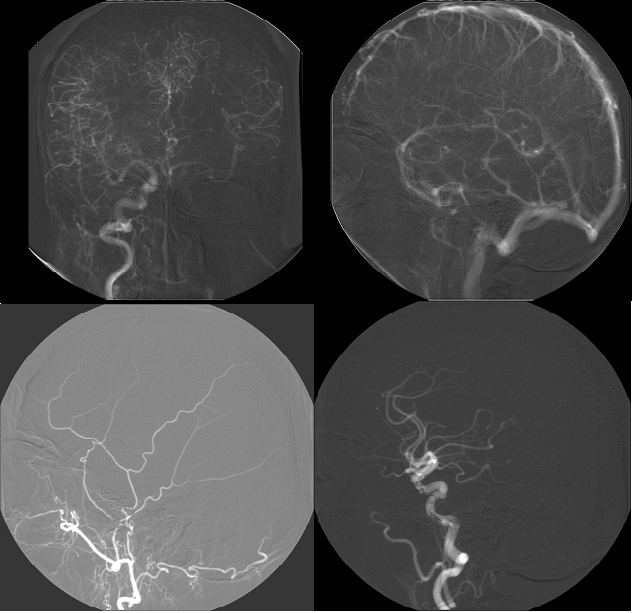
Mozek
Okluze mozkových tepen se může projevit dle závažnosti jen přechodnou ischemií (transitorní ischemická ataka – TIA) nebo úplnou ischemií jako ischemická cévní mozková příhoda (CMP). Prasknutí mozkového aneurysmatu může způsobit hemoragickou CMP. Chronická opakovaná ischemie může vést k postižení mozku až s projevy demence v rámci tzv. aterosklerotické encefalopatie.
obr.7: Panangiografie mozku, přiměřený nález, bez patologie. zdroj IMPAX, FNOL.
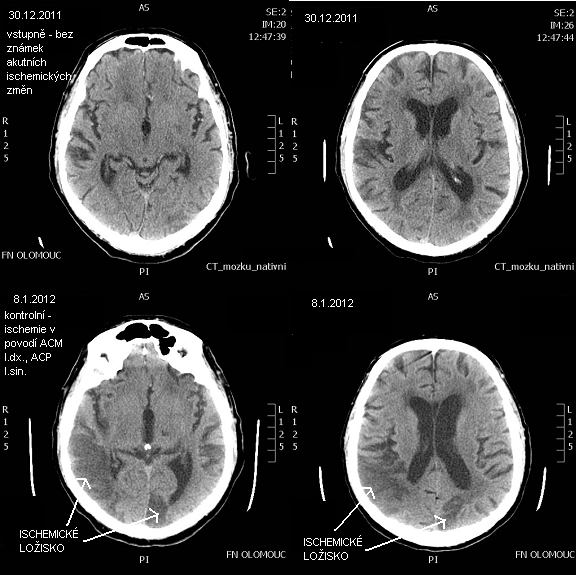
obr. 8: CT zobrazení ischemické CMP (CT nativ) – zdroj IMPAX, FNOL.
CT obraz pacienta v době přijetí (horní snímky) s klinickými zprojevy ischemie, ale ještě bez známek na CT. Na kontrolním CT s odstupem několika dnů (dolní snímky) jsou již patrná ložiska ischemie – ischemie v povodí ACM l.dx. a ACP l.sin.
http://www.cmp-brno.cz/Co-je-mozkova-prihoda-mrtvice.html
Odkaz na webové stránky, které se vyčerpávájícím způsobem věnují cévním mozkovým příhodám – od epidemiologických faktorů, přes rizikové faktory, projevy až po léčbu. Součástí je také spousta obrázků i videí ukazující metody používaných k vyšetření nebo přímo léčbě cémví mozkové příhody.
Dolní končetiny
Nedostatečné dodávky krve do dolních končetin, často kombinací stenóz a aneurysmat, vedou k projevům ischemické choroby dolních končetin (ICHDKK). Patří k nim např. klaudikace, bolesti dolních končetin, defekty, komplikované infekcí až gangrénou, vedoucím někdy až k amputaci. I zde může dojít k akutnímu uzávěru z embolizace nebo trombózy tepny.
Obr.9: Angiografie aorty a tepen dolních končetin, IMPAX, FNOL.
Pac. se zavedeným aortobiilickým stentgraftem s uzávěrem levého raménka, na obr. je vidět přerušení toku a kolaterální oběh, který zásobuje distální část řečiště a LDK.
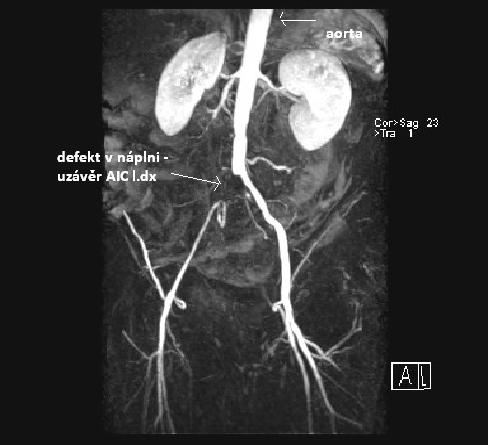
obr.10: MRAG aorty a tepen DKK, z databáze IMPAX, FNOL.
Obrázek uzávěru AIC vpravo u pac. s projevy ICHDKK. Na obr. je vidět defekt v náplni arteriální řečiště odpovídající uzávěru. Distální část řečiště je zásobena kolaterálami.
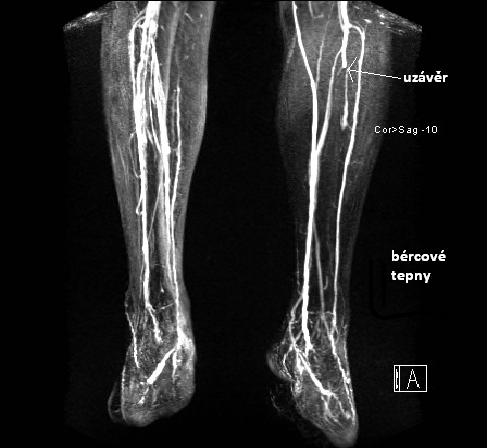
Obr. 11: MRAG bércových tepen. Zdroj IMPAX, FNOL.
Na obr. je patrné přerušení náplně tepny bércového řečiště odpovídající jejímu uzávěru, bez kolaterálního řečiště.
http://www.health.com/health/library/mdp/0,,zm2720,00.html Obrázek aortobifemorálního bypassu.
Ledviny
Ischemie ledvin může vést k obtížně korigovatelné arteriální hypertenzi a postupně až k renálnímu selhávání.
Obr. 12: MRAG aorty a ledvin, zdroj IMPAX, FNOL.
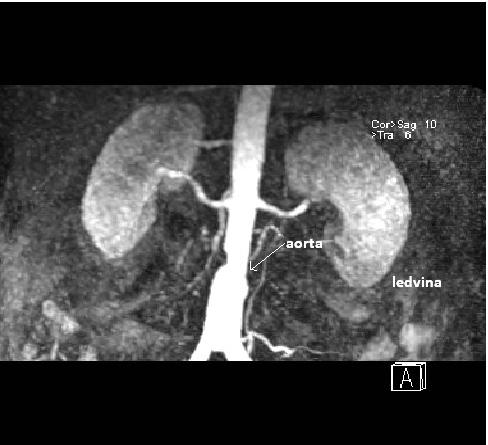 Subrenální aorta nerovných kontur a nepravidelného kalibru se stenozou ve střední části, která není hemodynamicky významná. Renální tepny bez stenoz.
Subrenální aorta nerovných kontur a nepravidelného kalibru se stenozou ve střední části, která není hemodynamicky významná. Renální tepny bez stenoz.
http://www.osel.cz/index.php?clanek=2752 Stránky popisují angiolastiku renálních tepen, ale upozorňují i na její rizika.
Střevo
Ischemie střeva se může projevit abdominálním dyskomfortem, tzv.abdominální angína. Akutní trombóza může vést až k nekróze střeva s akutní peritonitidou.
http://arteryvein.blogspot.com/ Obrázky zobrazují arteriogramy tepen.
Diagnostika:
- anamnéza osobní, rodinná, sociální, pracovní
- celkové fyzikální vyšetření pacienta, včetně měření krevního tlaku, určení výšky a hmotnosti pacienta,
- EKG, laboratorní vyšetření biochemické např. hodnoty lipidů, glykémie, TSH, renální funkce a další, viz výše lipoproteiny a u DLP
- vysoce senzitivní CRP k detekci chronického zánětu. Jedná se o nový ukazatel aterosklerotického postižení.
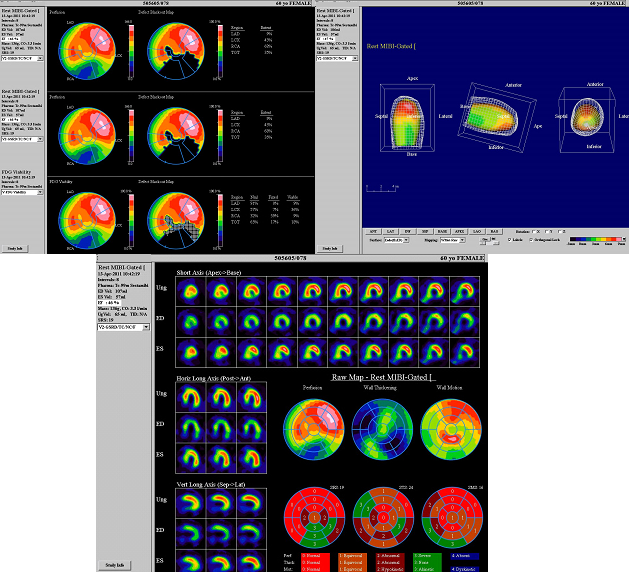
- neinvazívní diagnostické metody, např. rtg, sonografie tepen, echokardiografie, dlouhodobé monitorování EKG a krevního tlaku, zátěžové testy (např. bicyklová ergometrie, běhátko, zátěžová echokardiografie), izotopová vyšetření (SPECT)
Obr. 13: Klidový SPECT srdce
Neinvazivní angiografie - CT a MR angiografie sloužící k zobrazení řečiště.
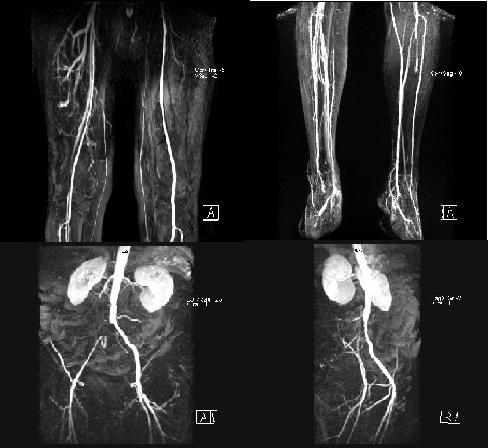
Obr. 15: MRAG tepen, IMPAX, FNOL.
Na obrázcích je magnetická rezonanční angiografie tepen v jednotlivých částech těla – tepny stehna, bérce, distální větvení aorty. Na horním obrazu vpravo je uzávěr bércové tepny, na spodních obrázcích je vidět defekt v náplni odpovídající uzávěru a. iliaky communis vpravo (větší formát obrazu viz výše – klinický obraz aterosklerózy – dolní končetiny).
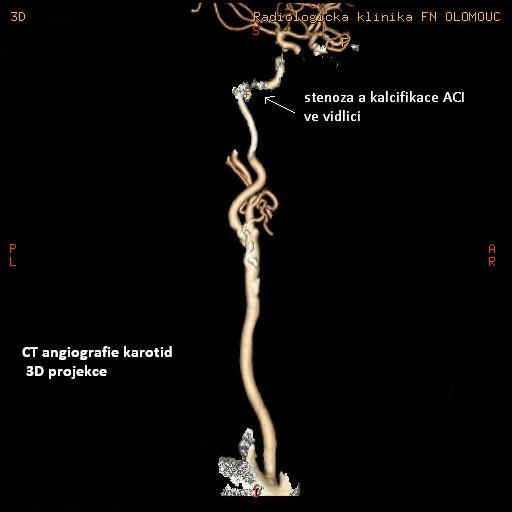
Obr. 16: CT angiografie – 3D obraz tepeného zásobení mozku, zdroj IMPAX, FNOL.
Hemodynamicky významná stenóza ACI l.dx. (dle NASCET asi 60%).
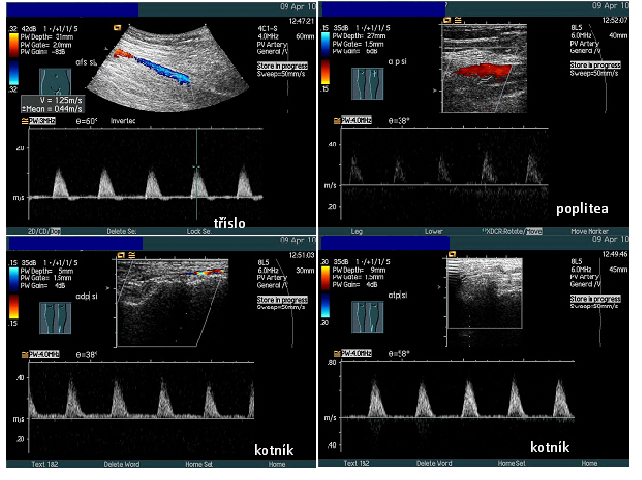
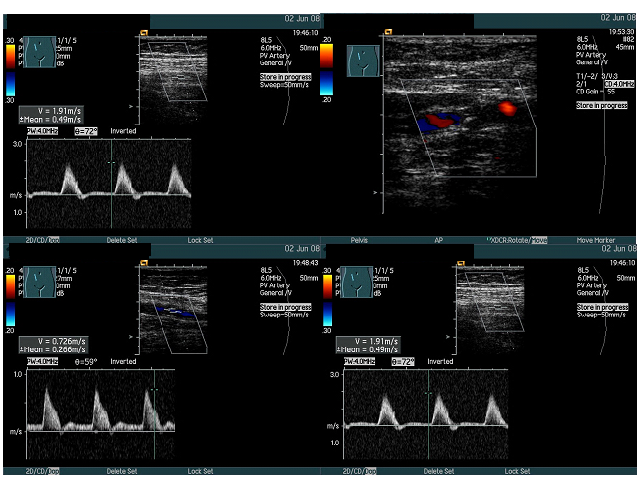
Ultrazvukové vyšetření – dokáže měřit tloušťku stěny cév, průtok krve a velikost zúžení. Lze získat informace o místě, velikosti a kvalitě aterosklerotického plátu.
Obr. 17: Obraz dopplerometrického vyšetření tepen. Zdroj IMPAX, FNOL.
 Obraz dopplerometrického vyšetření tepen DKK, na horním obrázku vpravo je vidět přerušení průtoku – barevné znázornění - uzávěr tepny.
Obraz dopplerometrického vyšetření tepen DKK, na horním obrázku vpravo je vidět přerušení průtoku – barevné znázornění - uzávěr tepny.
http://findmeacure.com/2008/12/29/carotid-ultrasound-carotid-doppler/ Odkaz na stránku popisující definici, indikace a princip dopplerovského vyšetření karotické tepny.
- Intimomediální tloušťka
http://www.cmp-brno.cz/Kardiovaskularni-riziko.html Obrázek ultrazvuku s označením intimomediální šířky karotické tepny.
Kalciové skóre se využívá k hodnocení tíže aterosklerózy v koronárním řečišti. V pokročilých aterosklerotických plátech jsou přítomny kalcifikace, které můžeme zachytit pomocí CT vyšetření. Jsou zachytitelné jako zvýšená radiografická hustota s hodnotou nad 130 jednotek Hounsfileda při CT vyšetření a jsou tak důkazem pokročilosti aterosklerózy i když lumen tepny je ještě často podle US nebo angiografie normální.
Obr.18: CT koronarografie – kalciové skóre.
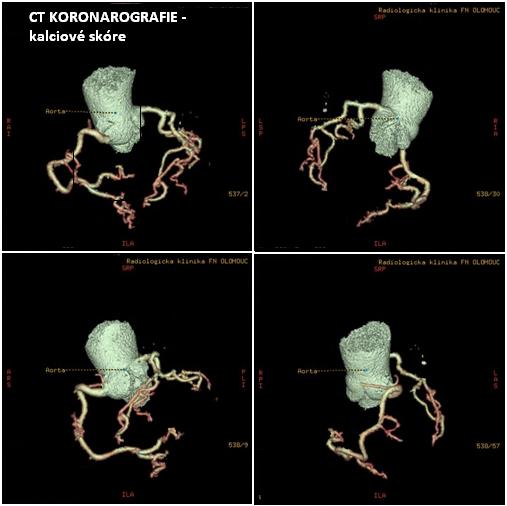 Ca skore 137, hlavní kmeny koronárních tepen bez stenos.
Ca skore 137, hlavní kmeny koronárních tepen bez stenos.
http://mediscan.sfactory.cz/files/CACS.pdf Text popisující indikace a princip provedení všetření kalciového skóre.
http://www.virtualmedicalcentre.com/healthinvestigations.asp?sid=68&title=CT-Calcium-Scoring Další text, tentokrát v anglickém jazyce, s popisem vyšetřéní kaciového skóre vč. obrázu CT.
- Měření indexu kotník/paže – ABI – Ankle-Brachial-Index
- používá se ke dg.aterosklerotického postižení tepen DKK, a tím predikci nejen ICHDKK, ale i celkově vyššího rizika kardiovaskulárního onemocnění způsobeného aterosklerózou
- při vyšetření se zárověn měří tlak na všech 4 končetinách a počítačový program rovnou vyhodnocuje tlaky a zpočítá index kotník/paže (poměr krevního tlaku kotníku a paže)
Obr. 19: ABI systém -přístroj k měření indexu kotník/paže
Obr. 20: ABI systém - výsledky měření zobrazené na obrazovce počítače – 4 hodnoty tlaku po jendotlivé končetiny i s grafickým znázorněním a z nich vypočítaný ABI index – v našem případě – ABI vpravo = 1,O8 , ABI vlevo 1,11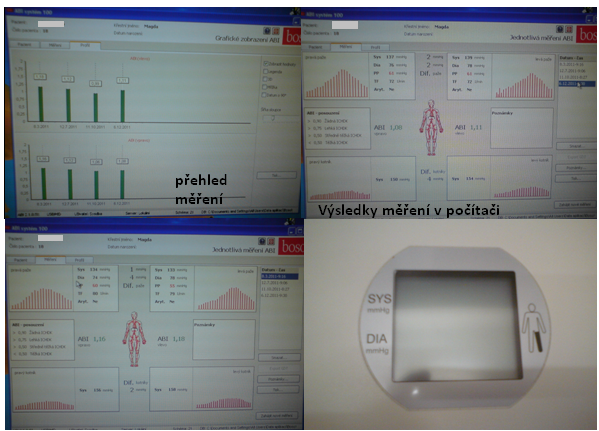
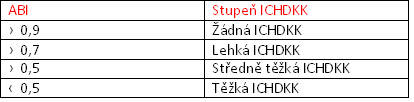
Tabulka 2: ABI vyhodnocení
- invazívní diagnostické metody, např. koronarografie včetně koronárního ultrazvuku, arteriografie
Angiografie – invazivní vyšetření, kdy můžeme nahlédnout přímo do tepny, dostat se k poškozenému místu a k uzávěru a popsat stěnu cév. Ve spojení s intervenčním zákrokem může sloužit i k terapii – dilataci stenóz, extrakci trombů, zavádění stentů. Nutný je přímý přístup do cévy.
Terapie:
- Konzervativní
- Nefarmakologická – minimalizovat rizikové faktory, režimová opatření k úpravě životního stylu (racionální dieta, dostatek pravidelného pohybu, nekouřit), vhodná i jako preventivní opatření
- Farmakologická – k co nejlepší kompenzaci přidružených onemocnění (např. DM, DLP).
- Léčba komplikací a projevů aterosklerózy k zastavení nebo zpomalení jejich dalšího rozvoje. Sem patří např. léčba hypertenze, antiagregační nebo antikoagulační terapie, vazodilatační terapie, hypolipidemika apod.
- Intervenční terapie zahrnuje dilataci stenóz, zaváděni stentů, odstraňování trombóz z arteriálního řečiště.
Obr. 21: Koronarografie. Zdroj IMPAX, FNOL.
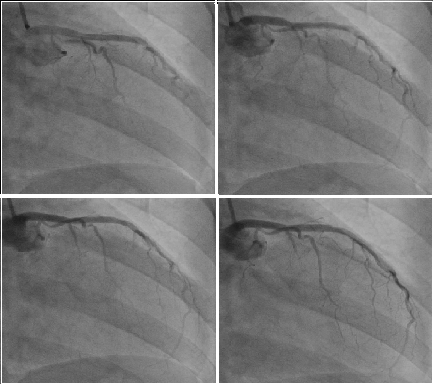
- PTA (perkutánní transluminální angioplastika), PCI, event, s implantací stentu, embolektomie, endarterektomie,
Obr. 22: Angiografie mozkových tepen - aplikace spirál do periferie a centra píštěle AV malformace. Zdroj IMPAX FNOL.
Na obr. je vidět katetr zavedený do mozkové tepny a vytvořený embolus ve fromě spirál v místě cévní malformace (nahoře vpravo).
Stránky odkazující na popis indikací a průběhu radiologických intervenčích metod:
- koronární angioplastika - http://www.nemlib.cz/web/tisk_stranky.php?menu=1_33_9_85
- průvodce pro pacienty podrobně popisující katetrizační vyšetření srdce – http://int2.lf1.cuni.cz/pruvodce-pro-pacienty-pred-katetrizacnim-vysetrenim-srdce
- Klasifikace, komplikace, klinické projevy a léčba infarktu myokardu – http://www.ikem.cz/www?docid=1005912
- Angiografie a angioplastika karotické tepny, poučení pro pacienty nemocnice IKEM. http://www.ikem-kardiologie.cz/pro-pacienty/vysetreni-a-zakroky/angiografie-a-angioplastiky-karotickych-tepen-krkavic.html
- Slovensky psaný článek o perspektivách slovenské kardiologie zahrnuje přehled zákroků endovaskulární intervenční radiologie. http://www.cardiology.sk/casopis/604/06/frame.htm
- Chirurgická terapie s přemostěním ischemických míst vlastní cévou nebo umělou cévní protézou. Bypass koronárních arterií nebo tepen dolních končetin (femoropopliteální bypass apod).
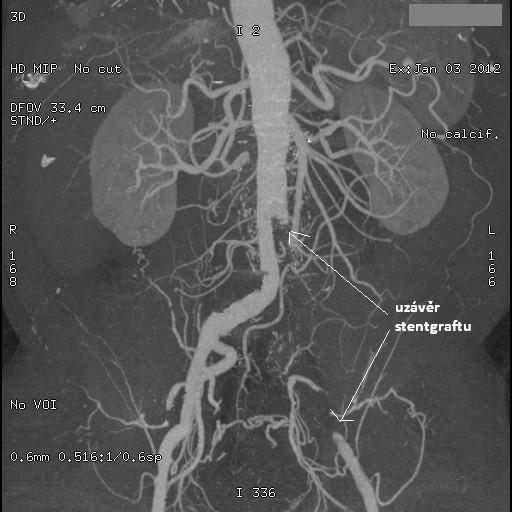
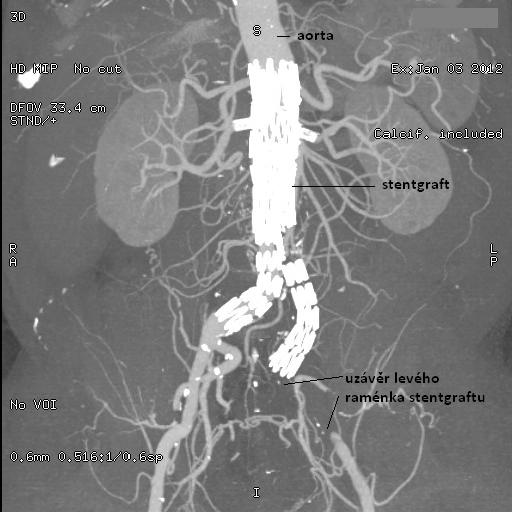
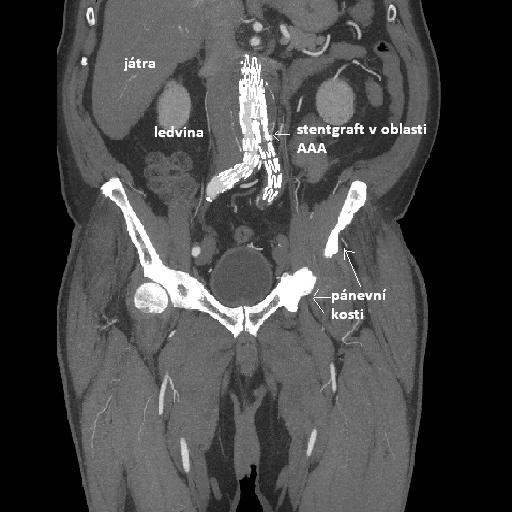
obr. 23: Stentgraft v místě AAA, IMPAX, FNOL
Na obrázku je patrný stentgraft aortobilický, překrývající aneurysma abdominální aorty. V místě odstupu renálních tepen jsou vidtě stenty v každé nich. Dále je znázorněn uzávěr levého raménka stenegraftu v místě AIC .dx.
http://www.ajronline.org/cgi/content-nw/full/191/2/569/FIG7 – 3D projekce aortobifemorálního bypassu.
Obr. 24: CT angiografie – stentgraft v místě AAA z jiného pohledu v rámci CT.
- Kombinovaná terapie.
Přehledová přednáška MUDr. Marie Tomečkové, CSc. (Ústav informatiky AV ČR – EuroMISE centrum) na téma ateroskleróza, součástí je také power-pointová prezentace.
http://www.veda.cz/article.do?articleId=13548
Obr. 25: CT angiografie tepen DKK. 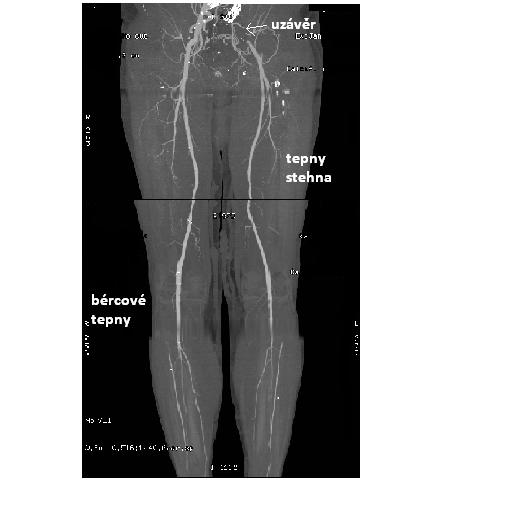 Na obr. je patrný v horní části konec stentgraftu a uzávěr jeho levého raménka, dále pak přiměřený nález na tepnách DKK.
Na obr. je patrný v horní části konec stentgraftu a uzávěr jeho levého raménka, dále pak přiměřený nález na tepnách DKK.
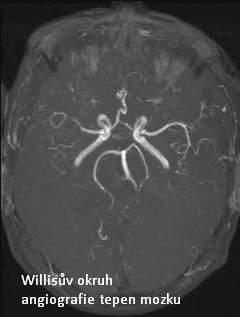
Obr. 26: MR angiografie mozkových tepen – Willisův okruh, bez patologie. Zdroj IMPAX, FNOL
Kazuistika:
1. Ischemická choroba DKK
2. Terapie AAA