Endotel a jeho základní funkce a charakteristiky
Endotel je jednovrstevná cévní výstelka, která v souhrnu dosahuje hmotnosti asi 1,5 kg a zaujímá plochu asi 700 m2. Mimo své bariérové funkce je největším sekrečním orgánem lidského těla.
Zdravý nesmáčivý endotel svou činností regulačně zasahuje jak do lumen cévy, tak směřem do cévní stěny. Na jedné straně obě prostředí odděluje, na druhé straně integruje vlivy a signály přicházející z lumen krevním proudem s těmi, které vznikají přímo v cévní stěně a jejím nejbližším okolí, takže přispívá k jejich harmonické součinnosti. Endotelové buňky jsou na svém luminálním povrchu kryty vrstvičkou glykokalyxu, do níž vylučují heparansulfátové glykosaminoglykany.
Endotel arterií vzniká z jiných šarží embryonálních pluripotentních buněk než endotel žil. Endotelie jsou vystaveny hemodynamickým vlivům pohybující se krve. Při pohybu krve vzniká smykové tření. Je přímo úměrné rychlosti a viskozitě krve a nepřímo úměrné třetí mocnině poloměru cévy.
Endotelové buňky jsou heterogenní v různých úsecích oběhu. V rovných úsecích cév jsou protáhlé a uspořádány podélně ve směru proudění krve. Podobně jsou uspořádány také na stěnách chlopní přivrácených do cévního lumen. V místech větvení a ohybů cév anebo také na stěnách chlopní přirácených do chlopenní kapsy mají endotelie polygonální tvar a jejich uspořádání je méně pravidelné.
Tato absence uniformity endotelu má nejen své morfologické, ale také funkční aspekty. Promítá se jak do normálních funkcí endotelu, tak do nerovnoměrného rozvoje a výskytu patologických procesů, které se v cévách objevují na predilekčních místech. Např. aortální chlopeň je mnohem častěji postižena lézemi na straně svých kapes obrácených do aorty, kde je polygonální endotel vystaven recipročním proudům a turbulencím, než na straně přivrácené do srdečních komor.
Endotelové buňky syntetizují více než dvě desítky faktorů, jimiž působí na své okolí. Zajišťují optimální permeabilitu. Umožňují a regulují transport iontů a tekutin, kontrolují přestup makromolekul a buněčných elementů. Mediátor NO a prostacykliny (PGI2), jejichž prostřednictvím endotel kontroluje cévní tonus a průsvit cév, působí vazodilatačně, antiagregačně a stabilizují tkáně. Jejich hlavní protihráči, angiotenzin II a endotelin spolu s volnými reaktivními částicemi a tromboxany působí vazokonstrikčně, proagregačně a destabilizačně.
Normální endotel je vysoce antitrombogenní. Uvolňuje vazodilatační a antiagregační mediátory, které jsou v rovnováze s lokálními vazokonstrikčními a prokoagulačními vlivy. Syntáza NO, eNOS, se v daleko větší míře exprimuje v arteriálním endotelu než ve venózním. Von Willebrandův faktor (WF) je naopak mnohem více zastoupen v žilním endotelu než v arteriálním. Heparansulfát slouží jako základna pro ukotvení přirozeného inhibitoru koagulace antitrombinu. Inhibiční působení antitrombinu je významně stimulováno heparinem, příbuzným svou strukturou heparansulfátu. Na povrchu endotelových buněk se nachází trombomodulin, který má vysokou afinitu k trombinu, jenž při aktivaci koagulační kaskády vzniká v jeho blízkosti. Naprosto největší hustota trombomodulinu je v kapilárách. Trombin navázaný na trombomodulin přestává působit v koagulační kaskádě a štěpit fibrinogen, naopak získává schopnost aktivovat jiný přirozený inhibitor koagulace – protein C. Protein C je vystaven působení trombinu po své vazbě na specifický povrchový endotelový protein EPCR (endothelial cell protein C receptor). Protein C aktivovaný trombinem (APC, activated protein C) pak ve spolupráci se svým kofaktorem proteinem S blokuje srážecí faktory V a VIII; k interakci mezi zúčastněnými proteiny je zapotřebí elektricky negativně nabitých fosfolipidových membrán buněčných povrchů. Poločas působení APC je asi 20 minut. Je pomalu inaktivován α1-antitrypsinem anebo inhibitorem proteinu C (PCI).
Endotel kromě vlivu na trombocyty a koagulační proces zasahuje také do třetí fáze hemostázy - syntetizuje jak tkáňový aktivátor plazminogenu (tPA), tak jeho inhibitor (PAI-1).
Endotel významně zasahuje do metabolismu volných reaktivních chemických částic kyslíku (ROS), dusíku (NO, nitrity/nitráty) a uhlíku (CO). Za normáních podmínek má vysokou antioxidační aktivitu.
Oxid dusnatý, NO
Oxid dusnatý, NO, po své syntéze difunduje do okolí a aktivuje nitrobuněčnou cytoplazmatickou guanylátcyklázu s následnou tvorbou sekundárního posla cGMP.
NO syntázy zodpovědné za tvorbu oxidu dusnatého jsou kódovány třemi geny. Gen pro neuronální NOS1 neboli nNOS je na chromozomu 12, gen pro indukovatelnou NOS2 neboli iNOS je na chromozomu 7 a gen pro endotelovou NOS3 neboli eNOS je na genu 17. Všechny NOS jsou vybaveny hemy, čímž se podobají cytochromům P450. Reduktázová katalytická doména NOS váže koenzymy FAD, FMN a NADPH. Oxygenázová doména aktivního místa NOS ale potřebuje pro svou funkci tetrahydrobiopterin. Tím se NOS odlišují od všech cytochromů P450. Zdrojem NO je aminokyselina arginin (mění se na citrulin; kromě své funkce při proteosyntéze arginin dále slouží jako substrát při syntéze kreatininu, močoviny – se vznikem ornitinu – a agmatinu, který z argininu vzniká dekarboxylací). Aktivita všech NOS v buňce kriticky závisí na kalmodulinu. Zatímco oba konstitutivně exprimované enzymy, NOS1 a NOS3, interagují s kalmodulinem až podle změn koncentrace Ca++ v buňkách, NOS2 (tj. iNOS) je po vazbě kalmodulinu plně aktivní i při nejnižších fyziologických koncentracích Ca++ – NOS2 je tedy nezávislá na Ca++. Expresi NOS2 ovládá většina stejných podnětů jako expresi jiného důležitého enzymu, cyklooxygenázy 2, včetně zánětlivých interleukinů.
NOS se aktivují ukotveny v plazmatických membránách. Endotelová NOS3 pro tento účel podléhá myristoylaci a palmitoylaci a váže se k cytoplazmatickým transportním měchýřkům vybaveným kaveolinem. S tímto procesem mohou z vnější strany membrány nepříznivě interferovat plazmatické lipoproteiny; jde o jeden z důležitých mechanismů, jimiž lipoproteiny vyvolávají endotelovou dysfunkci.
Interakce. Podněty, které aktivují endoteliální NOS3, mohou být chemické povahy (acetylcholin, bradykinin, endotelin, angiotenzin II, katecholaminy, puriny, hypoxie atd.), nebo fyzikální povahy (smykové tření, pnutí atd.). Mnohočetné vzájemné interakce například existují mezi produkcí NO a působením angiotenzinu II a endotelinu-1. Angiotenzin II stimuluje syntézu endotelinu-1 a endotelin-1 indukuje uvolnění NO z endoteliálních buněk. NO zpětně inhibuje působení endotelinu, syntézu angiotenzin-konvertujícího enzymu v endotelových buňkách a receptoru typu 1 pro angiotenzin II v buňkách cévního hladkého svalstva.
Meziorgánová cirkulace NO. Poločas volného NO ve tkáních je 0,5 – 5 s. Nově se ukázalo, že radikál NO ve tkáních nemusí pocházet jen z místní produkce, ale může být transportován v účinných množstvích také z plic. Jeho stabilitu zaručuje vazba na evolučně konzervovanou -SH skupinu cysteinu 93β v molekule hemoglobinu a na další thiolové sloučeniny obsažené v erytrocytech anebo v plazmě. Částice NO se z hemoglobinu a thiolových sloučenin uvolňuje ve tkáních. Tato zjištění demonstrují novou funkci molekuly hemoglobinu a jejích konformačních změn, které provázejí disociaci O2 a navázání CO2. Hemoglobin tak významně napomáhá průchodnosti cév a stabilizaci krevního tlaku. Tyto informace jsou zároveň důležitým obohacením znalostí o funkcích nízkomolekulárních plazmatických thiolů, jako jsou glutathion anebo cysteinylglycin, které s NO vytvářejí S-nitrososloučeniny (SNO-) a účastní se přenosu NO z erytrocytů do plazmy.
Volný hemoglobin, který vzniká hemolýzou v mikrocirkulaci, může vázat NO a fungovat jako jeho nežádoucí lapač. Tato skutečnost by mohla pomoci vysvětlit souvislost mezi fenotypem 1-1 haptoglobinu, který je transportním proteinem volného hemoglobinu, a zvýšeným krevním tlakem. Fenotyp 1-1 haptoglobinu je rizikovým faktorem zvýšené citlivostí krevního tlaku k příjmu soli.
Oxid uhelnatý, CO
Oxid uhelnatý, CO, má řadu vlastností i účinků společných s NO. Vzniká při degradaci hemové skupiny společně s biliverdinem. Reakci katalyzuje hemoxygenáza. Zatímco hemoxygenáza 2 se exprimuje konstitutivně, hemoxygenáza 1 je indukovatelný enzym, jehož exprese se zvyšuje při ischémii, ozáření anebo oxidačním stresu; jde o tepelný šokový protein známý jako Hsp-32. Oba enzymy jsou ve vysoké koncentraci v endotelových buňkách a v buňkách hladkého svalstva cév, kde je dostatek jejich substrátu.
Podobně jako NO je i CO aktivátorem cytoplazmatické guanylátcyklázy a působí vazodilatačně. Molekula CO má důležitou úlohu v regulaci napětí cévního svalstva a krevního tlaku.
Další funkce endotelu
Endotel produkuje růstové faktory, a významě ovlivňuje proliferaci a diferenciaci buněčných elementů v cévní stěně. Normálně převažuje antiproliferační a antimigrační působení endotelu na buněčné elementy, a tedy stabilizace cévní stěny.
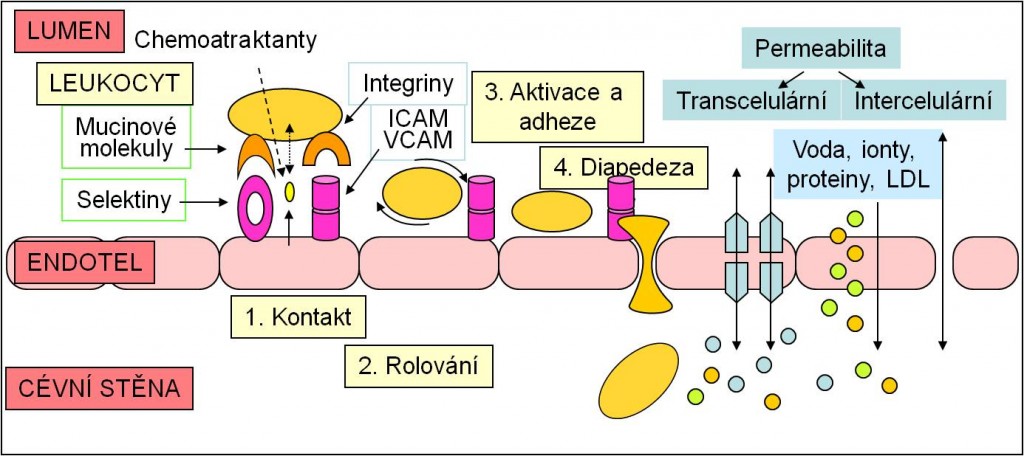
Endotel se účastní rozvoje a regulace zánětu. Endotelové buňky produkují adhezní a chemotaktické molekuly a uvolňují chemokiny a cytokiny. Endotelie v rovných úsecích cév s uspořádaným laminárním prouděním, s nízkým rizikem trombózy, mají větší povrchovou hustotu inhibitoru komplementu – proteinu C59, než je tomu v úsecích vystavených neuspořádanému proudění. Zdravé endotelové buňky jsou místem deaktivace mnohých vazoaktivních a zánětlivých mediátorů (např. bradykininu).
Endotel tvoří lipoproteinovou lipázu (LPL) a exprimuje receptory pro částice LDL. Hustota endotelové LPL je daleko vyšší v artériiích než ve vénách. Skutečnost, že zvýšená aktivita LPL může být provázena nízkým zastoupením částic HDL, může podporovat výskyt aterosklerózy v artériích. Spolu s LPL arteriální endotelie ve vysoké míře exprimují transmembránový glykoprotein CD44, který tím, že váže řadu ligandů, zprostředkovává různorodé funkce. Vyřazení genu pro CD44 výrazně snižuje riziko aterosklerózy.
Glykokalyx na povrchu endotelových buněk působí jako mechanosenzor. Rovnoměrné laminární proudění provázené stacionárním smykovým třením aktivuje buněčné geny a jejich produkty, které brání rozvoji aterosklerózy anebo trombózy. Nepravidelné anebo nerovnoměrné proudění charakterizované změnami směru nebo malým smykovým třením, recirkulující krev anebo toky mířící retrográdně nepříznivě odvlivňují složení a tloušťku glykokalyx. Naopak podporují vznik aterosklerotických plátů a trombů. Je zajímavé, že dlouhodobá stálá změna smykového tření vyvolaná přírůstkem krevního proudu anebo viskozity vede k přestavbě cévy. Tato tzv. pozitivní kompenzační remodelace, k níž dává primární podnět právě intaktní endotel, a ne svalová vrstva, nastává v několika týdnech až měsících a směřuje k obnovení původní velikosti tření. Pozitivní remodelace spočívá v eutrofickém rozšíření průsvitu cévy bez změny tloušťky její stěny. Naproti tomu dlouhodobý pokles smykového tření vede k negativní remodelaci cévy, která má za následek zúžení cévy. Přestavba v tomto případě není eutrofická, nýbrž hyperplastická. Provází ji hypertrofie intimy a medie.
Endotelová dysfunkce
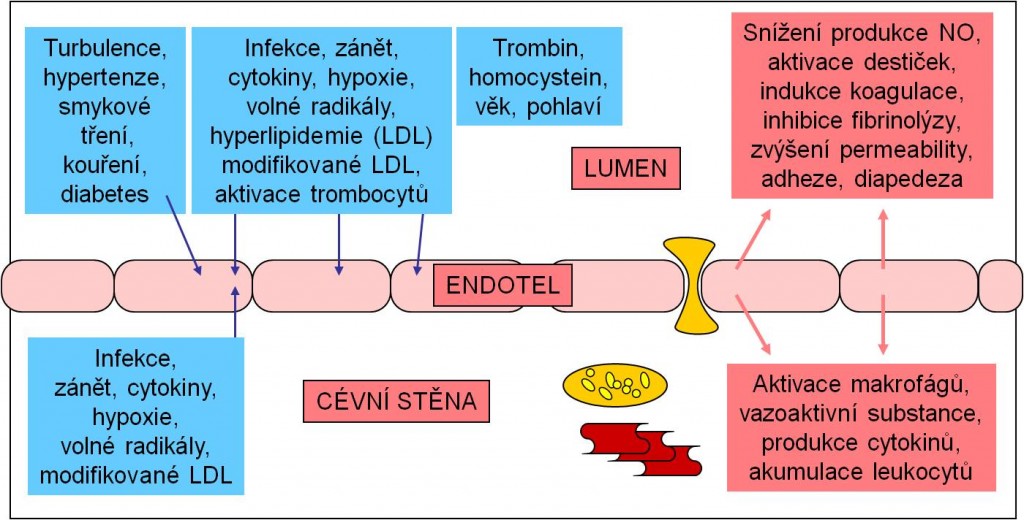
Fyziologické procesy v endotelu a ve stěnách srdečně cévní soustavy závisí spíše na vzájemném poměru skupin antagonistických mediátorů než na absolutní koncentraci každého z nich. Dysfunkce endotelu se projevuje narušením rovnováhy funkcí, které endotel zajišťuje. Předchází vzniku organických změn, charakteristických pro choroby kardiovaskulárního systému. Začíná převahou vazospastických, prokoagulačních a aterogenních pochodů. Klesá produkce protektivních vazodilatačních, antiaterogenních a antitrombotických molekul a rovnováha se postupně vychyluje na stranu vazokonstrikčních, aterogenních a protrombogenních mechanismů.
Hlavní známkou dysfunkce endotelu je pokles koncentrace NO z důvodu jeho porušené syntézy anebo jeho zvýšené spotřeby. Při farmakologické inhibici NOS2 bylo experimentálně pozorováno hromadění tukových kapének ve stěnách interlobulárních arteriol v ledvinách, i když nebyla přítomna hyperlipoproteinémie. Aferentní arterioly zůstaly ušetřeny. Endotelová dysfunkce tudíž sama může urychlit, nebo i způsobit, aterosklerotické změny, přinejmenším středních arteriol.
Při dysfunkci endotelu lze pozorovat snížení plazmatických koncentrací NO i koncentrací jeho konečných produktů – dusitanů a dusičnanů. Ochranný účinek NO je potlačen hromadícími se volnými kyslíkovými radikály, zejména superoxidovým anionem. Při tom se zvyšují koncentrace produktů reakcí NO s kyslíkovými radikály, hlavně peroxonitritů. Syntéza NO nestačí při vysoké tvorbě kyslíkových radikálů nahradit jeho odstraňování. Je zajímavé, že k nadměrné tvorbě kyslíkových radikálů dochází při nedostatku výše vzpomenutého tetrahydrobiopterinu. K mocným zdrojům kyslíkových radikálů dále patří xantinoxidáza, cyklooxygenázový systém metabolismu kyseliny arachidonové anebo membránové oxidázy zpracovávající NAD(P)H a stimulované ve stěnách cév angiotenzinem II. Xantinoxidáza stěn cév se pravděpodobně uplatňuje hlavně v aterosklerotických ložiscích. Oxidázy závislé na NAD(P)H sestávají nejméně z pěti podjednotek. Jejich součástí je cytochrom b558.
Kromě kyslíkových radikálů je významným lapačem NO také glukóza. Může přispívat k deficitu NO v řadě závažných klinických stavů (např. při diabetes mellitus).
NO se konečně také může nepřiměřeně vázat na -SH skupiny volného hemoglobinu anebo nízkomolekulárních sloučenin, jako je např. glutathion.
Acetylcholin, který normálně stimuluje tvorbu NO, a tedy vazodilataci, při porušeném endotelu působí přímo na hladké svalové buňky cévní stěny a paradoxně vyvolává vazospasmy. Navíc při endotelové dysfunkci narůstá aktivita angiotenzinu II, endotelinu a tromboxanů. Jakmile dysfunkce přejde do chronického stadia, poškození orgánů progreduje autonomně.
Aktivovaný endotel produkuje řadu dalších aterogenních a protrombogenních faktorů. Příklady jsou cévní adhezní molekuly (VCAM, ICAM, selektiny), von Willebrandův faktor (vWF), tkáňový faktor (TF), monocytový chemotaktický protein-1 (MCP-1), růstový faktor pocházející z destiček (PDGF), růstový faktor pocházející z fibroblastů (FGF), metaloproteinázy (MMP) aj. Mění se propustnost endotelové bariéry. Makromolekuly a velké částice, jako jsou lipoproteiny, ve zvýšené míře přecházejí do subendoteliálního prostoru. Dochází k poruše nesmáčivosti. Adhezní molekuly se aktivně účastní trombogeneze a diapedezy bílých krvinek do subendoteliálního prostoru. MCP-1 stimuluje infiltraci arteriálních stěn monocyty, z nichž pocházejí pěnité buňky. PDGF a FGF podporují proliferaci a patologickou migraci buněk hladkého svalstva z médie do intimy. MMP a jejich tkáňové inhibitory se účastní přestavby extracelulární matrix. Na endotelu ulpívají bílé krvinky a trombocyty. Přestupují do nitra cévní stěny anebo vytvářejí tromby. Vázne krevní průtok a dále narůstá permeabilita cévních stěn.
Obr. 1. Prostup leukocytů endotelovou bariérou (kontakt, rolování, adheze, diapedeza) a změny permeability endotelové bariéry pro vodu, ionty a proteiny. Schéma je možno zhlédnout i v animované podobě.
Obr. 2. Hlavní faktory aktivace endotelu (modře) a hlavní projevy endotelové dysfunkce (červeně) v lumen a ve stěně cévy.
Důležitým rysem endotelové dysfunkce je vratnost. Pokud faktory, které ji vyvolaly, přestanou působit, může se normální činnost endotelu obnovit. Pokud se funkce endotelu neobnoví, dojde k poškození cévní stěny, které se zpravidla napravuje až zánětem. Proto je prakticky významné naučit se rozumět metabolismu zdravých endotelových buněk a tomu, jak jejich poruchy zavčas léčit. Lze tím předejít pozdějším strukturním, nevratným patologickým změnám.
Rizikové faktory endotelové dysfunkce
Mezi populačně nejvýznamnější faktory, onemocnění a stavy poškozující endotel, a tím vyvolávající endotelovou dysfunkci patří:
- Kouření;
- Hypoxie, reperfúze, oxidační stres;
- Obezita, dys- anebo hyperlipidémie;
- Diabetes, hyperglykémie;
- Zánět, infekce, cytokiny;
- Hypertenze;
- Abnormální hemodynamické síly:
- Nepravidelné anebo nerovnoměrné turbulentní proudění, zpomalení proudu krve anebo její stagnace, nízké smykové tření, recirkulující krev a rekurentní anebo retrográdní proudění významně podporují vznik aterosklerotických lézí a trombů, a to v arteriích, v žilách i na chlopních.
- Znečištění životního prostředí mikro- a nanočásticemi (částice menší než 10 μm).
- Vzestup znečištění okolního vzduchu jemnými částicemi prokazatelně zvyšuje riziko kardiovaskulárních, kožních, alergických a jiných onemocnění. Jsou definovány přípustné normy. Řada zemí intenzivně rozvíjí strategie s cílem účinně omezit působení mikro- a nanočástic na zdraví.
Klinický význam endotelové dysfunkce
Dysfunkce endotelu je společnou úvodní poruchou anebo významnou součástí četných stavů a nemocí, ať už chronických nebo akutních až perakutních. Nejvýznamnější zřejmě jsou:
- Ateroskleróza;
- Ischemická choroba srdeční a onemocnění periferních artérií;
- Flebotrombóza a trombembolická nemoc, trombotické mikroangiopatie, DIC;
- SIRS, MODS;
- Preeklampsie;
- Neointimální hyperplázie způsobující cévní pooperační komplikace, jako jsou restenózy (bypass, in-stent), selhání venózních štěpů, transplantační vaskulopatie apod.;
- Významnou úlohu přitom hraje endotelová dysfunkce navozená neuspořádaným prouděním v místech spojení, zúžení a rozšíření rekonstruovaných cév;
- Srdeční a cévní chlopňové vady aj.
Funkční vyšetření endotelu a endotelové dysfunkce
Nejčastější používaná laboratorní vyšetření endotelu jsou uvedena v tabulkách 1 a 2. Význam těchto vyšetření spočívá v tom, že umožňují posoudit nejen stupeň endotelové dysfunkce, ale také vliv terapeutických zásahů. Zanedbatelné není ani to, že dovolují nahlédnout do mechanismů, kterými se změny endotelu uskutečňují.
Tabulka 1. Vyšetření endotelu – Biochemické markery
| Adhezní molekuly |
|
| Ukazatelé zánětu |
|
| Ukazatelé koagulace |
|
| Ukazatelé metabolismu NO |
|
| Ukazatelé metabolismu eikosanoidů |
| Růstové faktory |
|
| Další významné biochemické markery |
|
Tabulka 2. Vyšetření stavu endotelu – Přístrojové metody
| Přístrojové metody |
| Měření pulsové vlny (měření poddajnosti cévní stěny) |
| Laserové dopplerovské měření |
| Dvourozměrné dopplerovské zobrazení |
|
| Kapilaroskopie |
|
| Pletysmografie – dilatace brachiální arterie zprostředkovaná změnou krevního proudu |
| Sfyngomanometrie |
| Elektroforetická aplikace vazoaktivních substancí |
Zpracoval: Jaroslav Veselý, Ústav pastologické fyziologie LF UP v Olomouci