Charakteristika
Komplexní (civilizační) nemoci zahrnují především nemoci, jejichž incidence a prevalence se výrazně zvyšuje od počátku 60. let minulého století. Dosáhly epidemiologického rozšíření, přestože nejde o infekční nákazy. Jejich původ především je v poruchách metabolismu.
Individuální přístup vs. epidemiologický přístup k civilizačním nemocem
Jsou dva základní přístupy ke komplexním nemocem, ze kterých vyplývají dvě odlišné strategie jejich poznání, léčby a zejména prevence – individuální přístup a epidemiologický přístup.
Individuální přístup k civilizačním nemocem
Individuální (klinický) přístup se soustřeďuje na vysoce rizikového jedince. Zejména analyzuje:
- Jaké faktory (genetické, endogenní, exogenní) určují výskyt nemocí u daného jedince;
- Jak a v jakém poměru jsou tyto faktory u daného jedince přítomny a zastoupeny;
- Proč tyto faktory působí u daného jedince jinak než u jiných, kteří neonemocněli.
Omezení individuálního klinického přístupu
Strategie zaměřená na vyhledávání a léčení osob s vysokým rizikem onemocnění stěží může ovlivnit více než 10 – 15 % všech případů.
Příklad: Při všech vynaložených prostředcích v současné době pouze 20 – 25 % všech nemocných léčených pro hypertenzi dosahuje požadovaných hodnot tlaku.
Epidemiologcký přístup k civilizačním nemocem
Epidemiologie se zaměřuje:
- Na odhalení příčin nemocí v populaci;
- Na porozumění šíření nemocí v populaci.
Epidemiologie zkoumá:
- Co je příčinou nemoci;
- Jaké interakce mezi prostředím a genotypem určují vznik a vývoj nemoci;
- Jak se nemoc šíří v populaci.
Východiskem epidemiologické strategie k civilizačním nemocem je předpoklad, že dnešní populační nemoci se objevily jako výsledek konfliktu mezi velice konzervativním, velmi pomalu se měnícím lidským genotypem a poměrně rychle se měnícími vlivy prostředí, přetvářeným, nebo lépe vytvářeným lidskou činností. Tento konflikt vytváří četné a mocné rizikové faktory. Rizikové faktory působí prostřednictvím osvojených (tzn. naučených) návyků, zvyků a vzorců chování lidí. Zvyky lidí však často nejsou s to dostatečně rychle se přizpůsobit novým hrozbám (a to ani takovým, jaké představuje šíření nových infekčních nemocí, např. epidemie HIV).
Epidemiologický (populační) přístup se soustřeďuje na rizikovou populaci. Analyzuje:
- Jaké rizikové faktory (genetické, endogenní, exogenní) určují rozšíření nemocí v populaci;
- Jaké je zastoupení těchto faktorů;
- Proč je postižena určitá populace ve větší míře než jiné anebo proč je určitá populace nově postižena.
Rizikové faktory
Rizikové faktory jsou takové faktory, které, pokud jsou přítomny, významně zvyšují pravděpodobnost vzniku onemocnění u osob, na něž působí (v klasické epidemiologii šlo o infekční agens). Epidemiologie dokáže rizikové faktory lze kvantifikovat. Může konstruovat jejich distribuční křivky v populaci, které charakterizují jejich přítomnost, intenzitu a cesty působení.
Pokud jde o působení rizkových faktorů civilizačních nemocí, je namístě mít na paměti, že vlohy individuálních genotypů, které jsou konfrontovány s masově působícími rizikovými faktory, je v prostředí silných sociálních, ekonomických a kulturních vazeb silně omezen. Právě tyto vazby ve velké míře určují chování jedince a zároveň limitují možnosti jedince vyhnout se rizikovým faktorům. Přirozená variabilita genotypů a exprese různých variant a kombinací proteinů potom jen vysvětluje, proč někteří jedinci jsou ke vzniku poruch a nemocí náchylnější než jiní.
Masové rizikové faktory
Zřejmě nejvýznamnějším rizikovým faktorem je složení stravy. Potravu přijímáme trvale, takže dlouhodobě určuje individuální expresi jedinečných kombinací genů a jedinečných proteinových variant (proteomů)ve tkáních jednotlivců v populaci. Potrava je hlavní rizikový faktor našeho životního prostředí (životního stylu). Ovlivňuje zdraví lidí z 20 – 70 % (v našich zemích 40 – 60 %). Druhým populačně nejúčinnějším rizikovým faktorem v populaci je kouření (25 – 40% podíl na zdravotním stavu).
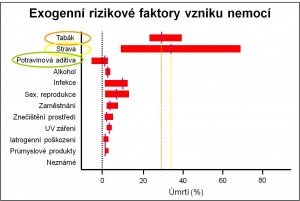
Obr. 1. Hlavní exogenní rizikové faktory vzniku masových chorob na příkladu vzniku nádorových onemocnění. Venitt S. (1966) Environ Health Perspect 104(Suppl 3):633-637.
Nutriční genomika a nutriční proteomika (nutrigenomika a nutriproteomika)
Nutrigenomika zkoumá, jak složky potravy ovlivňují zdraví a vznik a vývoj nemocí. Usiluje o to poznat, jak složení a změny stravy ovlivňují expresi genů a metabolické procesy.
Lidský genom obsahuje asi 23 000 strukturních genů, které kódují proteiny. Na úrovni sekvencí genů jsou lidé z více než 99,9 % identičtí. Zbývající 0,1 % variací (řádově miliony párů bazí) odpovídá za všechny fenotypové rozdíly (výška, barva kůže, očí, atd.), včetně náchylnosti nebo odolnosti k různým onemocněním.
Počet proteinových variant v buňkách lidského těla, syntetizovaných na strukturních genech (proteom), však je mnohem vyšší, asi 200 000 – 300 000. Díky posttranskripčním úpravám (alternativnímu sestřihu) se totiž na každém strukturním genu podle okolností průměrně syntetizuje přinejmenším 8 různých variant proteinů. Tyto varinaty jsou dále modifikovány posttranslačními procesy. Individuální proteomy lidských jedinců se proto v závislosti na vnějších regulačních faktorech navzájem velmi liší i mezi jednovaječnými dvojčaty. Kombinace exprimovaných proteinových variant v tělech různých jednotlivců jsou jedinečné nejen v závislosti na jejich genetické výbavě, ale i stravě.
Regulace genů nutrienty
Všechny hlavní chemické složky obsažené v naší stravě regulují expresi genů, jednotlivých variant proteinů a buněčný metabolismus. Působí přímo anebo nepřímo, prostřednictvím svých metabolitů, jako:
- Regulátory nitrobuněčných signálních kaskád kontrolujících expresi genů, postranskripční úpravy, posttranslační úpravy a buněčný metabolismus;
- Regulátory transkripčních faktorů obstarávajících expresi genů;
- Regulátory faktorů kontrolujících alternativní sestřih;
- Regulátory postranslačních modifikací proteinů.
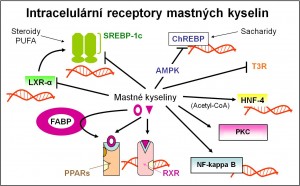
Obr. 2. Intracelulární receptory mastných kyselin a jejich metabolitů. Podle Duplus E, Forest C (2002) Biochem Pharmacol 64 893-901.
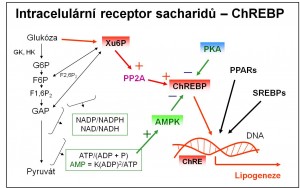
Obr. 3. Intracelulární signalizace sacharidy – receptor ChREBP. Podle Veech RL. (2003) PNAS 100, 5578-5580, a Dentin R, Girard J, Postic C (2005) Biochimie 87, 81-86.
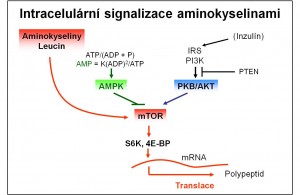
Obr. 4. Intracelulární signalizace aminokyselinami – úloha mTOR. Podle Soliman GA (2005) Curr Opin Lipidol 16, 317–323.
Nutrigenomika a nutriproteomika hledají cesty pro optimální dietní prevenci založenou na poznání nutričních potřeb, stavu výživy a genomu a proteomu jedince (individualizovaná výživa) anebo skupin jedinců s podobnými genomy a proteomy. Nejúčinnějším východiskem se zdá co nejlepší přizpůsobení našeho životního stylu, stravy, prostředí a okolních možnostem, které zakládá náš genotyp (popř. genofond).
Farmakologická genomika a farmakologická proteomika (farmakogenomika a farmakoproteomika)
Farmakogenomika a farmakoproteomika obdobně hledají cesty pro optimální terapeutické intervence založené na poznání interakcí mezi zvlášními chemickými (farmakologickými) látkami s genomem anebo proteomem. Zaměřuje se jen na zvláštní skupinu chemických látek v našem okolí. Její cíle jsou obdobné.
Buňky ve tkáních musí mít zajištěny energetické a metabolické funkce na své bazální úrovni, než začnou odpovídat na vnější meziorgánové anebo centrální (hormonální, nervové) stimuly. Je vhodné se zamyslet nad tím, jak lokální regulace metabolismu buněk ve tkáních nutrienty, coby jejich základní regulační článek, nastavuje limity našim farmakologickým zásahům.
Zpracoval: Jaroslav Veselý, Ústav patologické fyziologie LF UP