Charakteristika onemocnění
Trombofilie je přijaté označení pro zvýšenou tendenci k tvorbě cévních sraženin.
Trombóza je proces tvorby trombů; termín ovšem zároveň označuje i přítomnost trombů v cévách.
Trombembolie je trombóza spojená s uvolněním trombu do krevního proudu.
Klasifikace podle místa výskytu
Tromby mohou vznikat kdekoliv v oběhu – v srdci, v arteriích i vénách.
Srdeční tromby často vznikají v síních postižených fibrilací. Predilekčním místem je ouško levé síně. Tvorba trombů může provázet infarkt myokardu, kdy se tromby přednostně tvoří v místě akutního komorového aneurysmatu anebo, později, ve výdutích srdečních komor vzniklých remodelací srdce.
Arteriální tromby nejčastěji vznikají na aterosklerotickém podkladě. Mohou způsobit okluzivní onemocnění kterékoliv tepny. Vrozené trombogenní faktory mají v genezi arteriální trombózy daleko menší vliv než při vzniku žilní trombózy. Klinická pozornost se soustřeďuje zejména na následující tepny:
- Artérie koronárního řečiště;
- Artérie mozkové cirkulace;
- Renální přívodní tepny;
- Tepny končetin atd.
Okluzivní onemocnění tepen s výjimkou koronárního řečiště se zahrnují pod označení periferní arteriální onemocnění. Někdy se ze skupiny periferních arteriálních onemocnění ještě navíc vyjímají onemocnění mozkových tepen.V případě postižení dolních končetin se hovoří o ischemické chorobě dolních končetin, v případě splanchnických arterií o abdominální angínu, střevní apraxii apod.
Žilní tromby jsou především reprezentovány hlubokou žilní trombózou neboli flebotrombózou, zejména flebotrombózou dolních končetin. Onemocnění povrchových žil spojené se zánětem se naproti tomu označuje jako tromboflebitida.
Etiopatogeneze onemocnění
Trombofilie je multifaktoriální porucha. Vzniká kombinací exogenních a endogenních příčin. Rizikové faktory mohou být vrozené anebo získané. Jsou rozvedeny jednak v této kapitole, jednak v kapitolách Ateroskleróza, Onemocnění periferních arterií, Žilní trombóza, Plicní embolie (Syndrom plicní hypertenze) a Ischemická choroba srdeční. Jejich výčet však nepostihuje celý problém sklonu k nadměrné hemokoagulaci. Existují totiž pacienti a rodiny s recidivujícími těžkými trombózami bez známého defektu krevního srážení a naopak je řada osob, u nichž byla zaznamenána porucha, která se nikdy klinicky neprojevila.
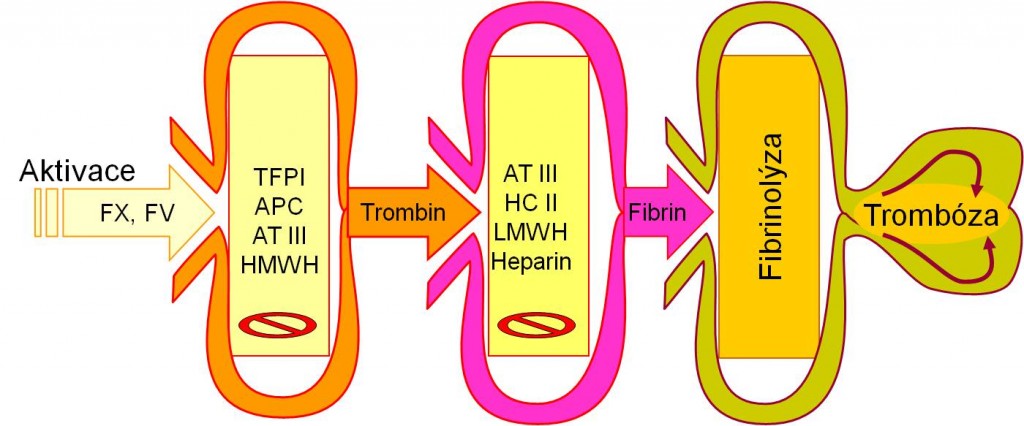
Vrozené trombogenní faktory hrají daleko větší úlohu v genezi žilní než arteriální trombózy. Normální cévní endotel je vysoce antitrombogenní. Heparansulfát, produkovaný intaktními endotelovými buňkami, slouží jako základna pro ukotvení přirozeného inhibitoru koagulace antitrombinu. Inhibiční působení antitrombinu významně stimuluje heparin, strukturou příbuzný heparansulfátu. Na povrchu endotelových buněk se nachází trombomodulin, který má vysokou afinitu k trombinu. Naprosto největší hustota trombomodulinu je v kapilárách. Trombin přestává po vazbě na trombomodulin působit v koagulační kaskádě a štěpit fibrinogen, naopak získává schopnost aktivovat přirozený inhibitor koagulace protein C. Protein C je vystaven působení trombinu po své vazbě na specifický povrchový endotelový protein EPCR (endothelial cell protein C receptor). Protein C aktivovaný trombinem (APC, activated protein C) ve spolupráci se svým kofaktorem proteinem S potom blokuje koagulační faktory V a VIII. Kofaktor proteinu S je ve své funkci významně stimulován faktorem V, takže faktor V podobně jako trombin působí současně jako koagulant i antikoagulant. K interakci mezi zúčastněnými proteiny je zapotřebí negativně nabitých fosfolipidových povrchů. Komplex APC je pomalu inaktivován α1-antitrypsinem anebo inhibitorem proteinu C (PCI). Poločas působení APC je asi 20 minut. Stojí za zmínku, že endotelové buňky dále syntetizují jak tkáňový aktivátor plazminogenu (tPA), tak jeho inhibitor (PAI-1).
Obr. 1. Hlavní protitrombotické bariéry v kaskádě hemokoagulace a fibrinolýzy. Schéma je možno zhlédnout i v animované podobě.
Získané trombofilie
Těhotenství, perorální antikoncepce a hormonální substituční léčba
U žen mladších 40 let je asi polovina všech případů hluboké žilní trombózy spojena s těhotenstvím. Zejména rizikový je poslední trimestr a šestinedělí. K žilní stáze způsobené útlakem zvětšenou dělohou přispívají v těhotensví fyziologicky zvýšené koagulační faktory VII, X, II a VIII, snížený protein S a snížená fibrinolýza.
Významným rizikovým faktorem u žen je také perorální antikoncepce a hormonální substituční léčba:
- Perorální antikoncepce může odpovídat až za 25 % případů flebotrombózy bez jiné zjevné příčiny. Podílí se na ní deficit proteinu S.
- Zvláště zde toto riziko dále stoupá ve spojení s kouřením cigaret.
- Riziko trombembolických komplikací se v těchto případech dále mimořádně zvyšuje, jestliže žena navíc trpí některou z vrozených predispozic ke vrozené trombofilii.
Přítomnost protilátek a obecně autoimunitní nemoci
Představitelem trombofilií vyvolaných protilátkami je antifosfolipidový syndrom. Antifosfolipidový syndrom se vyskytuje především u mladých žen ve fertilním věku a projevuje se:
- Opakovanými potraty;
- Opakovanou venózní, arteriální anebo mikrovaskulární trombózou;
- Trombopenií;
- Políčky viditelných rozšířených sítí malých kožních cév (cutis marmorata, livedo reticularis);
- Zpravidla pozitivní rodinnou anamnézou.
Zjišťují se zejména:
- Protilátky proti destičkovému glykoproteinu GP Iβ2 (anti-β2-GP I).
- Protilátky proti kardiolipinu.
Protilátky napadají endotel a trombocyty a aktivují komplement. Působí pro-agregačně, pro-koagulačně a pro-zánětlivě. Antifosfolipidové protilátky se vyskytují asi u 1 – 5 % jinak zdravých osob. Asi v 50 % případů se příčina přítomnosti protilátek nezjistí (primární antifosfolipidový syndrom). Nejčastější forma sekundárního antifosfolipidového syndromu je spojena se systémovým lupus erytematosus (20 – 35 % všech případů).
Přítomnost maligního nádorového onemocnění
Je důležité mít na paměti, že asi u 10 % pacientů, u kterých se nepodaří hned diagnostikovat příčinu ataky hluboké žilní trombózy (primární neboli „spontánní“ trombóza), se v průběhu dalších 6 měsíců diagnostikuje zhoubné nádorové onemocnění. Zejména může jít o nádory pankreatu, žaludku a prostaty.
Z myeloproliferativních onemocnění jsou s výskytem trombóz významně spojeny polycytemia vera a esenciální trombocytémie. Mohou se vyskytovat nejen venózní, ale také arteriální anebo mikrocirkulační trombózy. Venotrombóza při těchto onemocněních často vzniká v nezvyklých místech, např. ve splanchnické oblasti.
Nefrotický syndrom a jaterní cirhóza
Oba tyto stavy provází zvýšené riziko arteriální i venózní trombózy. Podílí se na ní nedostatek proteinu C, proteinu S i antitrombinu III.
Znečištění životního prostředí mikro- a nanočásticemi
Vzestup znečištění okolního vzduchu jemnými částicemi o průměru ≤ 2,5 μm už o 10 μg/m3 zvyšuje riziko kardiovaskulárních onemocnění na podkladě trombózy. Při krátkodobé expozici bylo naměřeno zvýšení rizika o asi 5 %, při dlouhodobé expozici (po 6 letech) se riziko kardiovaskulárních onemocnění zvýšilo o 24 % a riziko úmrtí po kardiovaskulárních příhodách o 76 %. Má se za to, že znečištění vyvolává endotelovou dysfunkci; například potlačuje produkci plazminového aktivátoru tPA v endotelu.
Poruchy trombocytů
Lze upozornit alespoň na jednu z nich:
- Trombocytopenie indukovaná heparinem. Tato iatrogenní porucha se však také často naopak manifestuje krvácením.
Jiné získané příčiny trombofilie
Z dalších získaných příčin je namístě zmínit:
- Získaný nedostatek proteinu C (jaterní cirhóza, DIC, avitaminóza K);
- Získaný nedostatek proteinu S (jaterní cirhóza, gravidita, terapie estrogeny);
- Získaný nedostatek AT (jaterní cirhóza, DIC, nefrotický sy, céliakie);
- Léčba neuroleptiky (flufenazin, butyrofenon).
Konečně kromě výše uvedených situací existují další podpůrné faktory vzniku tromboembolií. Jde zejména o vyšší věk pacienta, výskyt trombóz v předchorobí, trombocytemii nebo polycytemii, hyperviskozitu krve při dehydrataci, obezitu, infekce a obecně další těžší onemocnění. Některé situace bývají spojeny se zřetelně zvýšeným rizikem vzniku trombóz. Tak např. u středně závažných operačních výkonů se operační riziko trombóz pohybuje okolo 40 %, těžkých operací (koleno, kyčel, polytraumata) vzrůstá až k 80 %. Profylaktickým podáním heparinu lze zabránit výše uvedené komplikaci až v 70 %.
Paroxysmální noční hemoglobinurie
- Onemocnění způsobuje získaná mutace dřeňové kmenové buňky v genu odpovídajícím za výbavu povrchových membrán krevních elementů glykosylfosfatidylinositolem. Tato složka normálně slouží k ukotvení molekul, které inhibují komplement. Mutací uvedeného genu vzniká klon buněk, které tuto schopnost nemají. Erytrocyty pozbývají povrchové znaky CD55 a CD59 a jsou mimořádně citlivé k působení komplementu.
- Onemocnění se projevuje hemolýzou, trombózou a aplázií kostní dřeně. Anémie má rysy jednak hemolytické a jednak aplastické poruchy. K hemolýze často dochází při mírném okyselení při spánku (noční nebo ranní hemoglobinurie, moč barvy Coca-coly). Trombóza často postihuje žíly v neobvyklých lokalizacích, např. splanchnické anebo mozkové vény.
Vrozené trombofilie
Vrozené trombofilie odpovídají asi za polovinu všech případů žilních trombóz (flebotrombóz). Trombofilní stav lze prokázat u více než 75 % jedinců s trombózou hlubokých žil, z čehož ve 30 – 50% jde o vrozený defekt. U arteriálních a srdečních trombóz se přednostně uplatňují jiné příčiny.
- Muži mají vyšší riziko flebotrombózy než ženy.
- Nositelé krevní skupiny A, B, nebo AB mají asi 2x vyšší riziko flebotrombózy než nositelé skupny O.
- Může to souviset s nízkou koncentrací von Willebrandova faktoru u skupiny O. Je to v souladu s poznatkem, že deficit von Willebrandova faktoru způsobuje krvácivost (von Willebrandova choroba).
Genetické poruchy funkce trombocytů
- Zvýšené riziko arteriální trombózy (kardiálních tepen) je spojeno s některými genetickými variantami destičkových glykoproteinů GP Ibα, IIIa, 6 a některých dalších.
- Je důležité mít na paměti, že některé subpopulace trombocytů jsou rezistentní proti běžně používaným protidestičkovým léčivům, jako jsou kyselina salicylová a thienopyridiny. Prevence těmito medikamenty potom nemusí splnit očekávání. V takových případech je namístě přihlédnout k výsledkům destičkových funkčních testů.
- Trombotická trombocytopenická purpura je způsobena abnormální plazmatickou metaloproteinázou, která je odpovědá za odbourávání agregátů von Willebrandova faktoru. Von Willebrandův faktor je vazebný protein, který usnadňuje agregaci trombocytů a váže řadu koagulačních faktorů. Do oběhu se uvolňuje z endotelu, trombocytů a makrofágů. Také chrání faktor VIII před degradací. Porucha odbourávání agregátů von Willebrandova faktoru proto zvyšuje koncentraci faktoru VIII, a tím i riziko trombózy.
Mutace pro-koagulačních faktorů
Ve srovnání s mutacemi anti-koagulačních faktorů mají větší penetranci a mohou se manifestovat v mladším věku. Všechny uvedené příčiny jsou autosomálně dominantně dědičné.
- Nejčastější vrozenou trombofilií je trobofilie způsobená tzv. Leidenskou mutací koagulačního faktoru V. Je přítomná asi u 30 % pacientů s trombózou. Faktor V je kofaktorem faktoru X, s nímž v přítomnosti iontů Ca2+ vytváří protrombinázu.
- Mutovaný faktor V je odolný proti inhibici přirozeným koagulačním inhibitorem proteinem C.
- Heterozygotní mutace faktoru V typu Leiden asi 5krát zvyšuje riziko venózní trombózy a plicní embolie; homozygotní až 50krát, podle některých zdrojů až 80krát.
- Venózní trombózy z mutace faktoru V naštěstí přicházejí v pozdějším věku. V mladém věku naopak představuje určitou výhodu v podobě sníženého rizika výskytu těžkého porodního krvácení.
- Leidenská mutace není rizikovým faktorem arteriální trombózy.
- Leidenská mutace se v historii lidí objevila poměrně pozdě, asi před 21 000 lety, tedy dlouho po exodu z Afriky a rozdělení na rasy. Prakticky postihuje pouze ty rasy, které se původně vyvíjely na Blízkém východě a v Evropě. Podobné rysy má i mutace postihující protrombin.
- Mutace genu protrombinu způsobuje druhou nejčastější vrozenou trombofilii. Na jejím základě dochází ke zvýšení koncentrace protrombinu v plazmě. Trombotické příhody s ní spojené se mohou manifetovat už v mladším věku. Podobně jako mutace faktoru V se i mutace protrombinu objevila v lidské historii až asi před 24 000 lety, takže se ponejvíce omezuje na Evropu.
- Zvýšené riziko arteriální trombózy bylo pozorováno také při zvýšených koncentracích fibrinogenu (dysfibrinogenémie).
Mutace anti-koagulačních faktorů
Trombózy podmíněné mutacemi antikoagulačních faktorů se manifestují v pozdějším věku a jen zřídka mají smrtelný průběh. Všechny uvedené příčiny jsou autozomálně dominantně dědičné.
Tyto poruchy zahrnují:
- Deficit antitrombinu.
- Přirozený inhitor koagulace antitrombin se váže k heparansulfátu v povrchové membráně endotelových buněk, který stimuluje jeho aktivitu. Heparin působí jako jeho kofaktor. Na povrchu endotelií je pomocí trombomodulinu rovněž ukotven trombin, takže antitrombin na něj může efektivně působit. Antitrombin má širokou inhibiční specifičnost a kromě trombinu může inhibovat všechny ostatní koagulační faktory.
- Nositelé deficitu antitrombinu jsou heterozygoti. Homozygotní forma není slučitelná se životem. Deficit antitrombinu byl historicky první popsahou formou dědičné trombofilie. Riziko trombofilie zvyšuje asi 10krát. Odpovídá asi za 1 – 2 % všech případů trombózy.
- Deficit proteinu C. Přirozený inhibitor koagulace protein C spolu se svým kofaktorem proteinem S kontroluje aktivitu dvou kofaktorů koagulační kaskády – faktoru VIII a faktoru V.
- Deficit proteinu C spočívá buď v alteraci funkce, nebo množství a je spojen s méně než 5 % všech případů trombózy. Homozygotní defekt nicméně vede k rozsáhlé trombotizaci mikrocirkulace, která se projeví jako těžká purpura fulminans novorozenců.
- Deficit proteinu S. Podobně jako u proteinu C může být deficit proteinu S způsoben sníženou aktivitou, nebo poklesem jeho volné frakce v plazmě.
- Protein S se s vysokou afinitou váže na složku komplementu C4BPβ+. Po nasycení C4BP+ normálně bývá o něco více než 1/3 proteinu S v plazmě ve volné formě. Při poklesu koncentrace proteinu S pak utrpí hlavně jeho volná frakce.
- Ojediněle byla popsána mutace EPCR.
Hyperhomocysteinémie
Nejčastější příčinou vrozené hyperhomocyteinémie je mutace genu pro metylentetrahydrofolátreduktázu. Nálezy hyperhomocysteinémie korelují se zvýšeným výskytem arteriální trombózy. Předpokládá se, že homocystein ve zvýšených koncentracích negativně ovlivňuje funkci endotelu a napomáhá aktivaci destiček. Přímé kauzální vztahy však dosud nejsou známé, takže dosud není jasné, zda nejde jen o souběh dvou nezávislých fenoménů.
Poznámka
Paroxysmální noční hemoglobinurie není vrozenou poruchou, ale vzniká získanou mutací kmenové buňky (viz výše).
Následující tabulka shrnuje vybrané genetické faktory trombofilie.
| Vybrané genetické faktory trombofilie | |
| Proteiny koagulační kaskády | Fenotyp |
| Faktor V (Leydenská mutace G1891A) | Rezistence proti APC |
| Protrombin (Mutace G20210A) | Zvýšená prokoagulační aktivita |
| Fibrinogen (Mutace β-řetězce -455G/A, 854 G/A a Bc/1, mutace α-řetězce Thr312Ala) | Zvýšená prokoagulační aktivita |
| Přirozené inhibitory koagulace | Fenotyp |
| Antitrombin | Deficit antitrombinu |
| Protein C | Deficit proteinu C |
| Protein S | Deficit proteinu SDeficit volné frakce proteinu S |
| Fibrinolytický systém | Fenotyp |
| TAFI (Mutace 1542C/G, Ala147Thr) | Snížená fibrinolytická aktivita |
| PAI (Mutace -6754G/5G) | Snížená fibrinolytická aktivita |
| Receptory trombocytů | Fenotyp |
| GP IIIa (Mutace Leu33Pro) | Aktivace a agregace trombocytů |
| GP1bα (Mutace -5T/C) | Aktivace a agregace trombocytů |
| GP 6 (Mutace13254T/C) | Aktivace a agregace trombocytů |
| Metabolické cesty | Fenotyp |
| MTHFR (metylentetrahydrofolátreduktáza) ( Mutace 677C/T) | Hyperhomocysteinémie |
| Mužské pohlaví | Zvýšená prokoagulační aktivita |
| Nositelé krevních skupin A, B, AB | Zvýšená prokoagulační aktivita |
Následující tabulka ukazuje potenciaci rizika trombózy zevními faktory u vybraných genetických poruch.
| Vybrané zvýšeně rizikové trombofilické stavy | |
| Proteiny koagulační kaskády | Potenciace rizika trombózy |
| Faktor V (Leydenská mutace G1891A) | Pooperační období |
| Protrombin (Mutace G20210A) | Perorální antikoncepce |
| Fibrinogen (Mutace β-řetězce -455G/A, 854 G/A a Bc/1; mutace α-řetězce Thr312Ala) | Antifosfolipidový syndrom |
| Přirozené inhibitory koagulace | Potenciace rizika trombózy |
| Antitrombin | Těhotenství |
| Protein C | Znehybnění |
| Protein S | Trauma |
| Fibrinolytický systém | Potenciace rizika trombózy |
| TAFI (Mutace 1542C/G, Ala147Thr) | Hormonální substituční léčba |
| PAI (Mutace -6754G/5G) | Hormonální substituční léčba |
| Metabolické cesty | Potenciace rizika trombózy |
| MTHFR (metylentetrahydrofolátreduktáza) (Mutace 677C/T) | Nádorová onemocnění |
Komplikace trombózy
Tři hlavní obecná nebezpečí trombóz jsou:
- Omezení krevního průtoku postiženou cévou;
- Vznik embolie;
- Posttrombotický syndrom.
1. Omezení krevního průtoku
Může způsobit ischémii a nekrózu anebo gangrénu a ohrozit pacienta na životě. Trombózy postihující koronární řešitě a způsobující ischémii myokardu jsou v naší populaci hlavní příčinou úmrtí. Trombózy postihující periferní arterie jsou často provázeny arteriálními spasmy, které dále omezují krevní průtok. Trombózy postihující periferní žíly jsou nejčastějším zdrojem plicních embolií.
2. Trombembolická nemoc
Trombembolickou nemoc charakterizuje uvolnění trombu a jeho vmetení do části řečiště ležící po proudu (embolie; embolos = vmetek, doslova beranidlo). Stejně jako účinek trombů spočívá potenciální fatální účinek embolie v kritickém omezení krevního průtoku postiženým řečištěm. V plicích vede k akutní plicní embolii.
- Tromby ze srdce mohou být vmeteny do mozku, do ledvin, do koronárních tepen, končetinových tepen anebo do kterékoliv jiné hlavní větve odvětvující se z aorty (centrální embolie).
- Tromby z arterií jsou vmítány do distálních úseků arterií (arterio-arteriální embolie). Příkladem jsou emboly z bifurkace karotidy do mozkové cirkulace.
- Tromby ze žil jsou vmítány do srdce a do plicních arterií (periferní embolie, žilně-arteriální embolie); způsobují plicní embolii.
- Portální embolie vychází z portálního řečiště a směřuje do jater.
- Retrográdní embolie (žilně-žilní embolie) může nastat při Valsalvově manévru (např. při kašli), kdy se embolus z vena cava pohybuje retrográdně, např. do jaterních žil.
- Paradoxní embolie může nastat při perzistujícím foramen ovale a současně zvýšeném tlaku v pravé síni. Embolus se potom pohybuje z žil přes srdce do arteriální části řečiště. Podobná (a ovšem podobně raritní) je i embolie z aorty do plicnice při perzistujícím ductus arteriosus.
- Zvláštní případ, kdy se (původně) žilní prostředí napojuje přímo na arteriální úsek oběhu, vzniká při použití autologního štěpu vena saphena magna k rekonstrukci arteriálního řečiště (např. přemostění úseku koronární arterie). Žilní trombóza v tomto případě může přímo postihnout příslušnou arterii.
3. Posttrombotický syndrom
Posttrombotický syndrom vzniká následkem insuficience žilních chlopní anebo i přetrvávající částečné obstrukce. Může vést k invaliditě.
Diagnóza trombofilie
Které nemocné tedy vyšetřujeme na přítomnost trombofilního stavu? Jde o mladší dospělé pacienty (do 45 let) s rodinnou anamnézou a opakovanými trombózami, dále při chybějící vyvolávající příčině trombózy, nebo při její neobvyklé lokalizaci (portální, axilární, oční event. mozkové).
Kromě běžných testů koagulace vyšetřujeme APC rezistenci a při jeho abnormálním výsledku f. V Leiden, aktivitu proteinu C, S, antitrombinu a f. VIII, antifosfolipoidový syndrom a konečně i protrombinovou mutaci. Vyšetření provádíme nejdříve 3 měsíce po odeznění trombózy, nikoliv však v těhotenství a při hormonální terapii. U warfarinizovaných nemocných lze vyšetřovat za 2 týdny po přerušení léčby. Při zjištění trombofilního stavu je nezbytné také testovat rodinné příslušníky. Indikace vyšetření však někdy bývají sporné.
Terapie trombofilie
Z terapeutického hlediska nemá přítomnost trombofilního stavu vliv na zásady léčby akutních trombóz. Jinak má ale obecně u trombofilií význam hlavně dlouhodobá profylaxe trombóz pomocí antikoagulancií; je zde však vždy nutno zvážit i riziko krvácivých komplikací (zvláště u starších osob a při abuzu alkoholu). Delší profylaxe má význam hlavně tam, kde prvá trombóza byla život ohrožující, nebo vznikla bez zjistitelné příčiny, a také u těžkých vrozených defektů. U získaných trombofilních stavů pak je nutno důsledně léčit základní chorobu.
Zpracovali: Prof. MUDr. Ivo Krč, CSc., II. interní klinika LF UP a FN v Olomouci; MUDr. Roman Hájek, PhD., Kardiochirurgická klinika LF UP a FN v Olomouci; a Jaroslav Veselý, Ústav patologické fyziologie LF UP
Použitá literatura a literatura k dalšímu studiu:
- Krčová V.: Trombofilní stavy, s. 123-131.
- In: K. Indrák a kol.: Hematologie, Ed. Triton Praha, 2006.
- Herold G. u. Kol.: Innere Medizin – haemorrhagische Diathesen, Ed. Privatverlag, Koeln a. Rh., 2010.
- Lee G. R. et al.: Wintrobe´s clinical hematology, Ed. 11, Williams andWilkins, Baltimore, 200