Charakteristika
Krevní oběh je po hemodynamické stránce popsán třemi základními veličinami:
- Krevním tlakem;
- Krevním tokem (průtokem);
- Odporem kladeným proudící krvi.
Veličiny jsou spolu svázány základní hemodynamickou rovnicí. Rovnice je obdobou Ohmova zákona - tok J je roven tlakovému rozdílu P mezi výchozím a cílovým místem (v elektronauce napětí, U) dělenému odporem (rezistencí) R:
J = ΔP/R ~ I = U/R (Ohmův zákon).
Krevní tlak
Krevní tlak, přesněji tlakový spád, je hybnou silou toku krve. Uvádí krev do pohybu a umožňuje jí překonat odpor, který jí kladou duté prostory oběhu.
Tlak P se definuje jako síla F působící na plochu S:
P = F/S (N/m2 = Pa; 1 mm Hg = 0,133 kPa)
V krevním řečišti je tlak poměrem síly, kterou krev působí na stěny cév a srdce, k ploše těchto stěn. Vyjadřuje vztah mezi náplní cirkulace a její kapacitou. Podobně je tomu v míči nebo v pneumatice.
Plnicí tlaky v cirkulaci
Tlak, který se ustaví, jestliže srdce přestane pracovat a všechny hydrostatické tlakové gradienty v oběhové soustavě se vyrovnají, je tzv. střední cirkulační plnicí tlak (statický tlak krve).
Střednímu cirkulačnímu plnicímu tlaku je blízký střední systémový plnicí tlak. Je to tlak, který naměříme po vyrovnání všech tlakových gradientů v cévách systémového (velkého, periferního) oběhu, když se vyřadí jeho spojení se srdcem a s malým oběhem. V experimentu se toho dosahuje naložením svorek na odstup aorty ze srdce a na ústí dutých žil do srdce. Hydrostatické plnicí tlaky charakterizují tzv. efektivní objem krve.
Střední systémový plnicí tlak informuje o náplni velkého oběhu. Jeho fyziologická hodnota není nulová – je asi 7 mm Hg. Z toho je vidět, že náš oběh je krví natlakován, což znovu ukazuje na paralelu mezi krevním oběhem a nafouknutým míčem nebo nahuštěnou pneumatikou. Pumpou, která odpovídá za natlakování oběhu v našem těle, jsou ledviny.
Existuje těsná vazba mezi objemem krve a celkovým objemem všech extracelulárních tekutin v těle. Pokud je zachována celistvost cirkulace a fyziologická koncentrace proteinů v plazmě, objem krve se mění paralelně s velikostí extracelulárního prostoru tekutin.
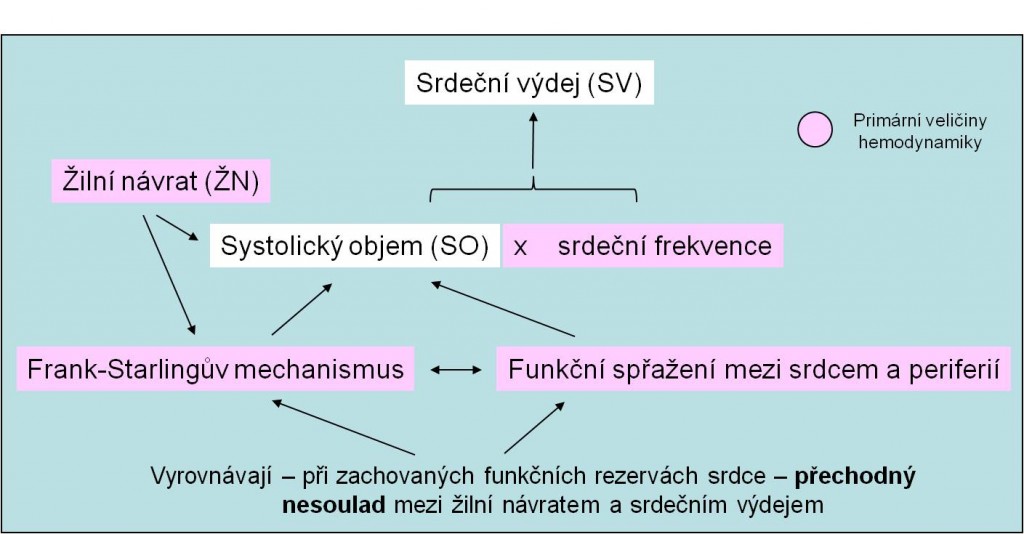
Význam natlakování cévního řečiště je zřejmý, pokud si uvědomíme, že vzduch z míče anebo z pneumatiky proudí po otevření ventilu tím prudčeji, čím větší je tlak uvnitř. Podobně hodnoty středního systémového plnicího tlaku určují, jak vydatně se bude po otevření chlopní plnit pravá srdeční síň krví z dutých žil. Objem krve, který se k srdci vrátí za jednotku času, se označuje jako žilní návrat. Střední systémový plnicí tlak tedy určuje žilní návrat. Čím vyšší je střední cirkulační plnicí tlak, tím větší je žilní návrat; při jeho poklesu se žilní návrat zmenšuje.
Srdce nemůže než přečerpat pouze to množství krve, které se do něho vrátí. Žilní návrat nastavuje tomuto množství limit. Srdce, posuzováno v delší periodě, nemůže přečerpat více krve, než do něho přiteče.
Objem krve, který srdce vypudí za jednotku času, se označuje jako srdeční výdej. Zpětný tok krve k srdci, který určuje plnění srdečních komor, tak je klíčovou determinantou srdečního výdeje. Srdeční výdej je v ustáleném stavu (tj. v dlouhodobém měřítku) roven žilnímu návratu. Prostřednictvím žilního návratu je dlouhodobě určen středním systémovým (cirkulačním) plnicím tlakem, nikoliv srdcem samotným. Srdce je pouze vybaveno mechanismy, kterými v rámci svých rezerv zajišťuje, že se krev v jeho dutinách nehromadí. Postavení srdce je v tomto smyslu servisní, podřízené potřebám periferie. Pokud srdce za patologických okolností nemůže přečerpat všechnu krev a vydává menší objemy krve než ty, které přijímá, čelí pacient, a s ním lékař, nedostatečnosti funkčních rezerv a srdeční nedostatečnosti nebo selhání.
Ke změnám středního cirkulačního plnicího tlaku může dojít dvěma způsoby:
- Změnami kapacity cévního řečiště;
- Změnami plnění – objemu náplně.
Jestliže se při nezměněném objemu náplně cév zmenší kapacita oběhového systému vazokonstrikcí (venokonstrikcí), střední cirkulační anebo systémový plnicí tlak vzrostou. Následně se zvýší žilní návrat, a tedy i srdeční výdej. Venokonstrikce v tomto ohledu působí na krevní oběh stejně jako stlačení na tlak v míči nebo v pneumatice, a pokud to srdeční rezervy dovolí, je jejím následkem zvětšený srdeční výdej.
Plnicí tlak se zvýší zvýší také tehdy, když se při nezměněné kapacitě cév zvětší objem náplně. Toho lze dosáhnout infúzí, perorálním příjmem tekutin anebo zvýšenou retencí tekutin v ledvinách zprostředkovanou např. hypersekrecí antinatriuretických hormonů, jako jsou angiotenzin II anebo aldosteron. Ve výše opakovaně citované paralele jde o dohuštění míče nebo pneumatiky.
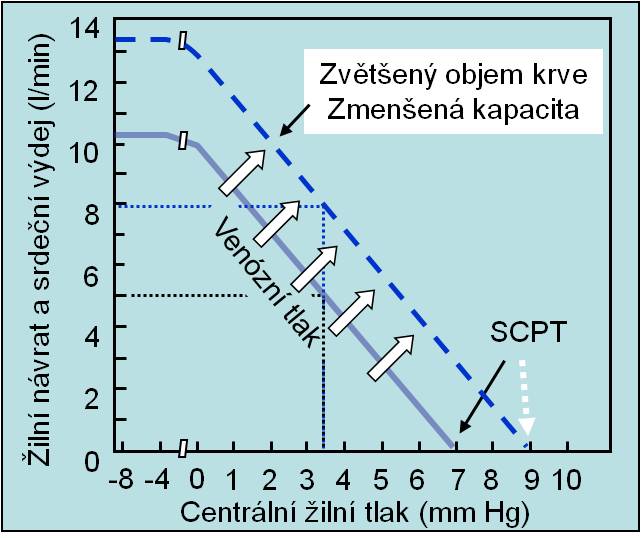
Vliv změn středního systémového plnicího tlaku (SCPT) na velikost žilního návratu ukazuje níže uvedený graf.
Obr. 1. Nárůst žilního návratu při zvýšení středního cirkulačního plnicího tlaku dosaženého zvětšením objemu krve anebo zmenšením kapacity cirkulace. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.) Schéma je možno zhlédnout i v animované podobě.
Velkoobjemový systémový žilní oddíl je hlavním kapacitním článkem krevního řečiště. Asi 2/3 veškeré krve se konstantně nacházejí v žilní části velkého oběhu (tabulka 1). Žíly tak obsahují asi 4 – 5x větší objem krve než tepny. Poddajnost (přírůstek objemu na jednotku přírůstku tlaku) žil systémového oběhu je asi 24x větší než poddajnost systémových artérií. Vzhledem k velké kapacitě žilního systému vedou už malé změny napětí žilních stěn k významným změnám středního plnicího tlaku. Venokonstrikční anebo venodilatační změny tak mají jen malý vliv na tlak v žilách a na odpor kladený proudu krve v nich, ale mohou způsobit velké přesuny krve do nekapacitních částí krevního řečiště. Takové přesuny nevyhnutelně vyvolají znatelné změny tlaku v nízkokapacitních (vysokotlakých, odporových) částech oběhové soustavy.
Součástí kapacitní části cirkulace je i celé pravé srdce a plicní oběh. Díky tomu se mnohem lépe vyrovnávají s velkými objemy tekutin než levé srdce, kde – stejně jako v ostatních nízkokapacitních částech oběhu - tlaky rychle narůstají už s malými přírůstky objemu. Pokud dojde k objemovém přetížení cirkulace, které kapcitní oddíl už nestačí pojmout, obvykle selhává jako první levá komora, a ne pravá.
Kontrakce žil může pokrýt ztrátu až 1/5 – 1/4 celkového objemu krve. Po silné sympatické stimulaci se tímto mechanismem může zvýšit střední plnicí tlak 2-4x. Podobný efekt může způsobit komprese vén svalstvem při svalové práci.
Průtok krve
Průtok krve Q se definuje součinem průřezu (průsvitu) S cévy nebo dutiny a lineární rychlosti toku tímto průřezem:
Q = S x v (m3/s)
V místech s různými průřezy (např. Sa a Sb) platí rovnice kontinuity:
Q = Sa x va = Sb x vb
Rovnice vyjadřuje, že pokud průtok zůstává stálý, je jeho lineární rychlost nepřímo úměrná na průřezu cévního řečiště.
Krev vypuzená ze srdce protéká oddíly cirkulace uspořádanými v sérii za sebou. Jsou to:
- Oddíl arteriální (nízkokapacitní, vysokotlaký a vysokoodporový);
- Oddíl mikrocirkulace;
- Oddíl žilní (vysokokapacitní, nízkotlaký a nízkoodporový).
Původ tlakového gradientu
Dokud srdce nefunguje, tlak je v celém oběhovém systému stejný. Jakmile srdce začne pumpovat, přesune se část krve z oběhového oddílu před srdcem (z žil) do oddílu za srdcem (do arterií). Než krev stačí periferní mikrocirkulací, kde se setkává s odporem, odtéci z artérií zpátky do žil, přichází ze srdce nová dávka krve. Vytváří se tlakový spád. Tlakový rozdíl mezi žilním a arteriálním oddílem zvýrazňuje jejich rozdílná poddajnost. Aby se ovšem tlakový gradient ustálil na potřebné výši, musí srdce dosáhnout dostatečného obratu. Podmínkou pro to je jeho dostatečné plnění, tedy dostatečný plnicí tlak v cirkulaci. Tlakový spád se spotřebuje na překonávání odporu („pokles napětí na odporu“, známý z nauky o elektřině).
| Oddíl cirkulace | % | ml |
| Plicní oběh | 9 % | 450 |
| Srdce | 7 % | 350 |
| Tepny periferního oběhu | 13 % | 650 |
| Tepénky a kapiláry periferního oběhu | 7 % | 350 |
| Žilky, žíly a žilní splavy periferního oběhu | 64 % | 3200 |
Tabulka 1. Rozdělení krve v cirkulaci. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.)
Podíl 64 % krve v žilní části periferního oběhu představuje asi 3 200 ml krve. Znamená to, že objem krve v kapacitní části je téměř desetinásobkem objemu krve v srdci, pětinásobkem objemu krve v arteriích a více než trojnásobkem objemu krve v celém arteriálním a kapilárním stromu větvícím se z aorty.
Souhrnný průtok krve kterýmkoliv z oddílů cirkulace (arteriálním, žilním, mikrocirkulací) je v ustáleném stavu totožný s množstvím krve, které se vypudí ze srdeční komory, tedy se srdečním výdejem. Srdeční výdej je za fyziologických okolností kolem 5 l/min. Tento objem se žilami vrací k srdci. Je zřejmé, že obě veličiny, srdeční výdej a žilní návrat, si v ustáleném stavu musí být navzájem rovny.
V reálných situacích tomu tak ovšem není. Za prvé, objem krve směřující z žil k srdci může být minutu po minutě, nebo dokonce i mezi dvěma srdečními stahy, výrazně odlišný od objemu, který srdce do systému dodalo během předchozí periody. Žilní návrat může být ohrožen při krvácení, pocení, tvorbě moči, sekreci tekutin do střeva, přesunech do intersticia, zvětšení kapacity cirkulace atd. Může se naopak zvětšit vstřebáváním ze střeva, přesunem z intersticia, infúzemi, zmenšením kapacity cirkulace atd. Proto je mimořádně důležité, že kapacitní část řečiště, která může měnit svůj objem, a tím regulovat žilní návrat, je zařazena před srdcem. Přizpůsobení velikosti žilního návratu čerpací kapacitě srdce je primární funkcí kapacitního oddílu krevního oběhu. Tato skutečnost se v učebnicích popisuje nedostatečně.
Za druhé, ani množství krve vypuzené ze srdce během systoly se nemusí vždy rovnat objemu krve, které srdce přijalo během předchozí diastoly. Variabilita systolického volumu ale má mnohem užší meze než potenciální variabilita žilního návratu. Vyrovnání a návratu k ustálenému stavu v srdci napomáhají Frank-Starlingův mechanismus, změny ejekční frakce a změny srdeční frekvence.
Arteriální oddíl
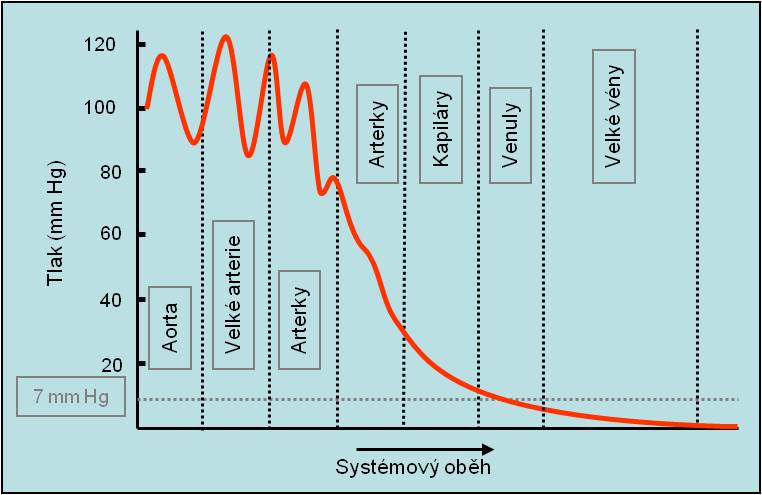
Arteriální tlak je tlak v arteriálním řečišti. Rutinně se zjišťuje systémový arteriální tlak na paži v úrovni pravé srdeční síně, ale podle okolností jej lze měřit v kterékoliv artérii. Tlak v pravé síni je za fyziologických podmínek roven tlaku atmosférickému. Tato hladina byla pro fyziologické a klinické účely dohodou stanovena jako nulová.
Rozeznáváme systolický, diastolický a střední arteriální tlak. Střední arteriální tlak - za předpokladu stálého periferního odporu - určuje průtok krve z arteriální do venózní části řečiště. Je tedy kritickou determinantou zásobení tkání. Normálně periferií systémového oběhu proteče asi polovina systolického objemu krve v průběhu systoly a druhá polovina v průběhu diastoly. Pokud se snižuje srdeční výdej (poklesem žilního návratu, srdeční frekvence anebo výkonnosti myokardu) anebo klesá periferní odpor, periferií mezi dvěma srdečními stahy odtéká do žil příliš velká frakce systolického volumu, plnění arteriálního stromu ubývá, a arteriální tlak se snižuje.
Úroveň tlaku v arteriích se dlouhodobě udržuje s potřebnou rezervou. Jde o rezervu stejné povahy, s jakou je např. v městské vodovodní síti nastaven tlak vody, aby byl jednotlivým odběratelům zabezpečen její nezávislý odběr i při její spotřebě na více místech.
Naproti tomu dlouhodobý mechanismus pracuje na zcela jiném principu. Reaguje na změnu tlaku tak, že upravuje objem krve, a tím střední cirkulační plnicí tlak. V dlouhodobé perspektivě se objem krve v těle vždy přizpůsobuje kapacitě cirkulace a požadavkům vyrovnané bilance tekutin, ne naopak. Umožňuje to funkce ledvin. Lze rozeznávat tři hlavní typy odpovědí:
- Za prvé, pokud ke změně tlaku dochází z důvodu poruchy krevního objemu, např. krvácením, nebo převodněním, obnovuje se objem v jeho původní výši.
- Za druhé, pokud došlo ke změnám kapacity cirkulace, přizpůsobuje se objem krve novým poměrům. Jako názorný příklad přizpůsobení objemu změnám kapacity cirkulace lze uvést zachování stálé hladiny systémového arteriálního tlaku při výskytu rozsáhlých varixů dolních končetin, které mohou trvale pojímat stovky mililitrů krve. Celkový objem tekutiny v oběhu je zvětšen o toto množství, ale krevní tlak neroste. Při polyglobulii roste hematokrit, ale relativně klesá objem plazmy. Při anémii se naopak udržuje krevní volum na prakticky normální hodnotě díky relativně zvětšenému objemu plazmy. V kontrastu k tomu po ztrátě končetiny nebo orgánu, kdy dochází ke zmenšení kapacity řečiště, klesá krevní objem bez změny tlaku.
- Konečně pokud je za změnu systémového arteriálního krevního tlaku odpovědný nárůst periferního odporu, např. ztráta končetiny anebo orgánu, nebo otevření arterio-venózní píštěle, opět se přizpůsobuje objem krve novým poměrům tak, aby byl systémový arteriální tlak zachován v původní výši.
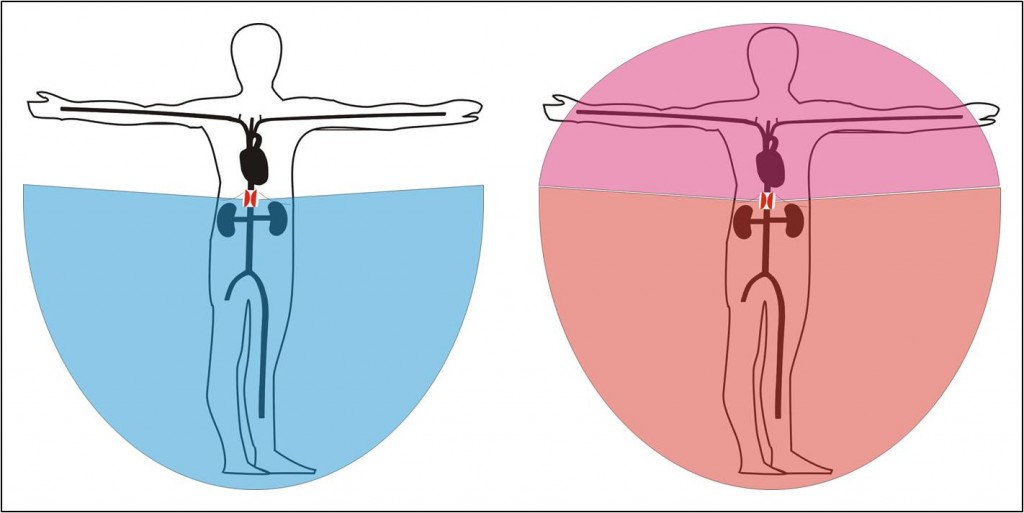
Přes rozšířené odlišné pojetí, dosud prezentované v učebnicích, platí, že dlouhodobá hladina systémového arteriálního krevního tlaku není určena samotným oběhovým systémem. Je oběhu diktována zvnějšku, jiným tělním systémem - systémem, který zabezpečuje trvalou vyrovnanou bilanci iontů a vody. Dlouhodobý střední arteriální krevní tlak není veličina, kterou by si oběhový systém mohl dlouhodobě volit sám. Naopak, je oběhu vnucen ledvinovým přepadem, který zajišťuje odvod nadbytečných tekutin mimo tělo. V tomto smyslu je dlohodobý arteriální tlak primární veličinou oběhu, nezávislou na ostatních hemodynamických veličinách. Z fyziologického hlediska tedy základní hemodynamickou rovnici není zcela správné psát ve formě P = J x R, kde P vystupuje, jako by byl závisle proměnnou.
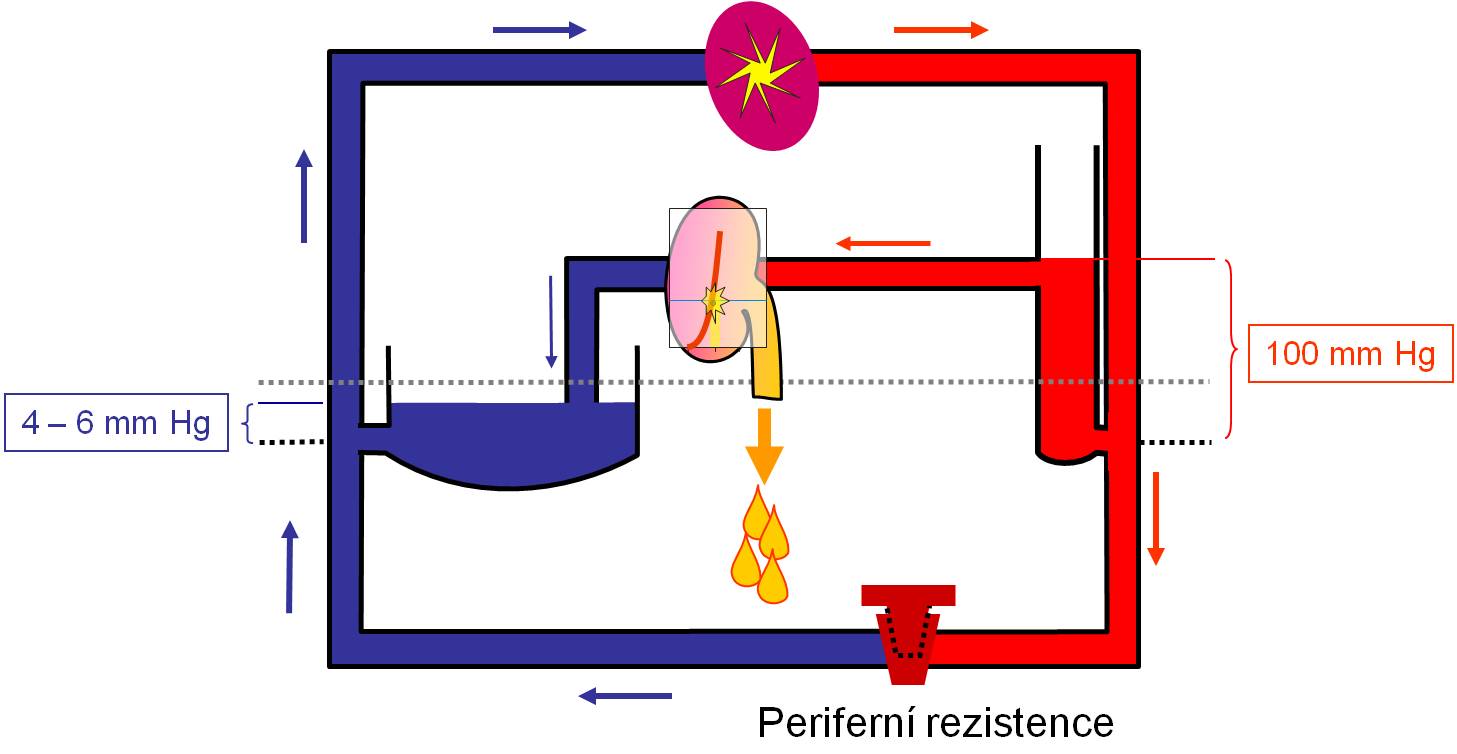
Obr. 2. Zařazení ledvinového přepadu v systémovém oběhu. Toto jednoduché dvoukompartmentové schéma cirkulace je možnmo zhlédnout i v animované podobě.
Ledvinový přepad kontroluje arteriální tlak změnami objemu tekutiny v cirkulaci. Je zařazen ve vysokotlakém oddílu systémového oběhu. Pracuje na principu ledvinové tlakové diurézy. Tlaková diuréza spočívá v tom, že ledviny mění objem vylučované tekutiny (diurézu a natriurézu) podle výše středního systémového arteriálního tlaku, nebo přesněji, perfúzního tlaku v ledvinách. Tento jev graficky vyjadřuje křivka tlakové diurézy neboli ledvinová funkční křivka.
- Pokud se systémový arteriální tlak zvyšuje, diuréza roste a objem intravazální tekutiny a tělesných tekutin se zmenšuje.
- Pokud systémový arteriální tlak klesá, diuréza se zmenšuje, ledviny šetří tekutiny a vrací je zpátky do krevního oběhu.
Obr. 3. Křivka tlakové diurézy/natriurézy neboli funkční křivka ledvin. Čárkovaně je vyznačena křivka tlakové diurézy provázející zvýšenou resorpci (sníženou exkreci) sodných iontů a vody v tubulech např. při hypovolémii. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.) Toto schéma je možno zhlédnout i v animované podobě.
Fyziologicky fungující ledvinový přepadový systém (tlaková diuréza), zařazený ve vysokotlakém oddílu cirkulace, zbavuje tělo nadbytečné intravazální tekutiny, kterou orgánová a tkáňová mikrocirkulace nepropustila do vén a která navyšuje náplň v systémovém arteriálním stromu. Nadbytečná tekutina odchází do moči. Výdejem moči mimo tělo se upravuje tlak v arteriích a zároveň i žilní návrat, a srdeční výdej. Protože objem krve koreluje s objemem tělních tekutin, reguluje se tím zároveň i množství tekutin v těle. Při nízkém tlaku anebo nedostatku tekutin systém pracuje opačně.
Na rozdíl od výše zmíněných pohotovostních systémů regulace arteriálního tlaku upravuje ledvinový přepadový systém tlakové diurézy dlouhodobou bilanci tekutin. Tím upravuje náplň cirkulace, ne její kapacitu. Přizpůsobuje náplň kapacitě tak, aby ve výsledku přitékala krev do ledvin pod tlakem, který ledviny vyžadují pro plnění svých dlouhodobých funkcí. Ledviny jsou jediným orgánem v těle, který disponuje takovými nástroji, že může své požadavky na potřebné krevní zásobení vnutit celé cirkulaci. Pokud kapacitní oddíl cirkulace hlavně slouží bezprostředním a akutním úpravám žilního návratu, slouží vysokotlaký oddíl dlouhodobé kontrole cévní náplně. Nástrojem této kontroly je dlouhodobá regulace středního arteriálního krevního tlaku, kterou ledviny neoddělitelně spojují s regulaci objemu tělesných tekutin. Funkce vysokotlakého oddílu tím přesahují užší poslání oběhového systému.
Systém tlakové diurézy je jediný známý systém dlouhodobé regulace stálého středního systémového arteriálního krevního tlaku. Poruchy přepadového systému jako jediné vedou k chronickým poruchám jedné ze dvou hlavních primárních veličin cirkulace – systémového arteriálního tlaku, tzn. k chronické systémové arteriální hypertenzi, nebo hypotenzi.
Přepadový systém, který odvádí přebytečnou tekutinu mimo tělo, není přítomen ani v plicní, ani v portálním řečišti (výsledkem přepadu tekutin je v uvedených případech plicní edém, popř. ascites). Proto jsou mechanismy chronických poruch tlaku v těchto oddílech odlišné od chronických poruch tlaku v systémových artériích.
Žilní oddíl
Žilní tlak je tlakový rozdíl mezi začátkem žilního oddílu a pravou síní. Tlak v malých žilkách na začátku nízkokapacitního oddílu je menší než tlak na konci kapilár (< 10 mm Hg). Tlak na konci žilního oddílu, tj. tlak v pravé síni, tzv. centrální žilní tlak, je podle dohody definován jako 0 mm Hg (roven atmosférickému tlaku v okolí těla). Žilní tlak se promítá do plnění srdce za diastoly – je bezprostředním plnicím tlakem srdce.
Dolní limit centrálního žilního tlkau je – 3 až – 5 mm Hg (negativní hrudní tlak v okolí srdce). Dosahuje se při usilovné práci srdce. Velké žíly v hrudníku při nižším tlaku kolabují. Při zvyšování centrálního žilního tlaku nad 0 mmHg tlak v malých žilkách v periferii neroste, dokud centrální žilní tlak nedosáhnou hodnot kolem + 4 až + 6 mm Hg. Při této úrovni tlaku už krev vyplňuje všechny kolabované úseky v průběhu velkých vén. Horní limit centrálního žilního tlaku je 20 - 30 mm Hg. Dosahuje se při srdečním selhání anebo při masivním přívodu tekutin do těla (infúze).
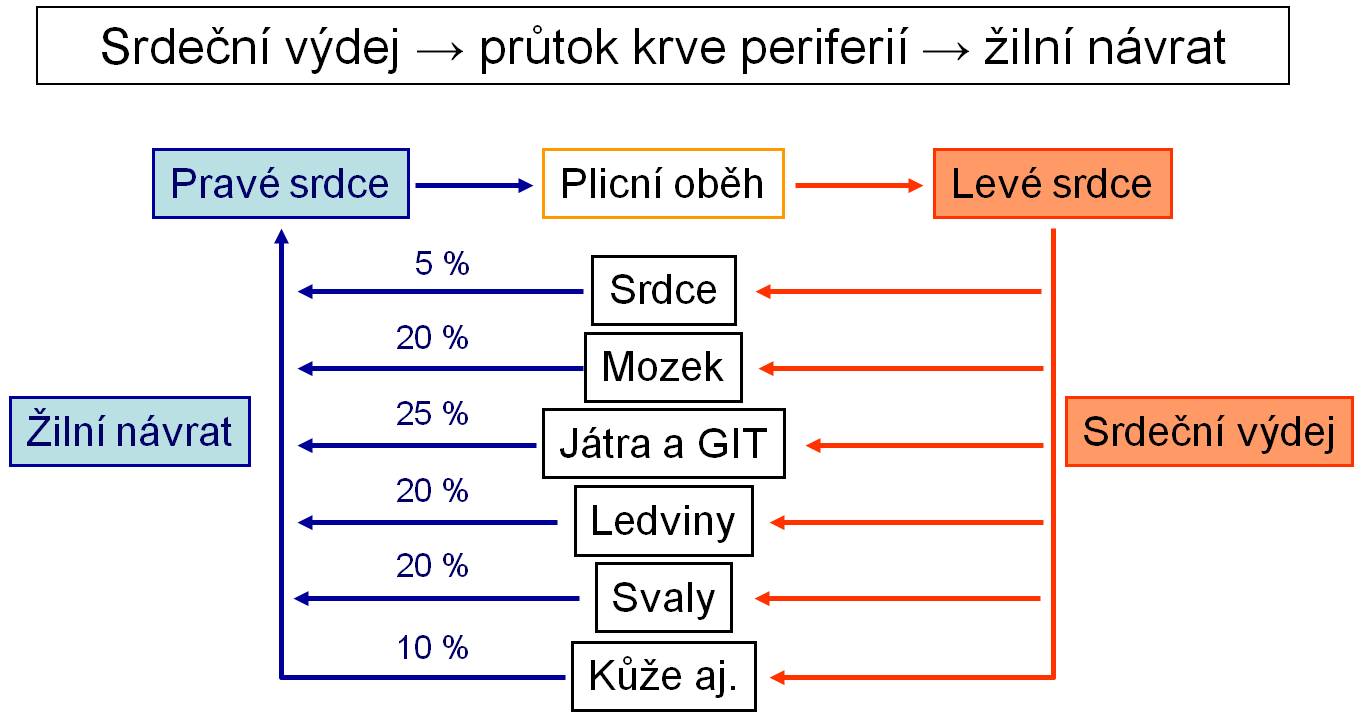
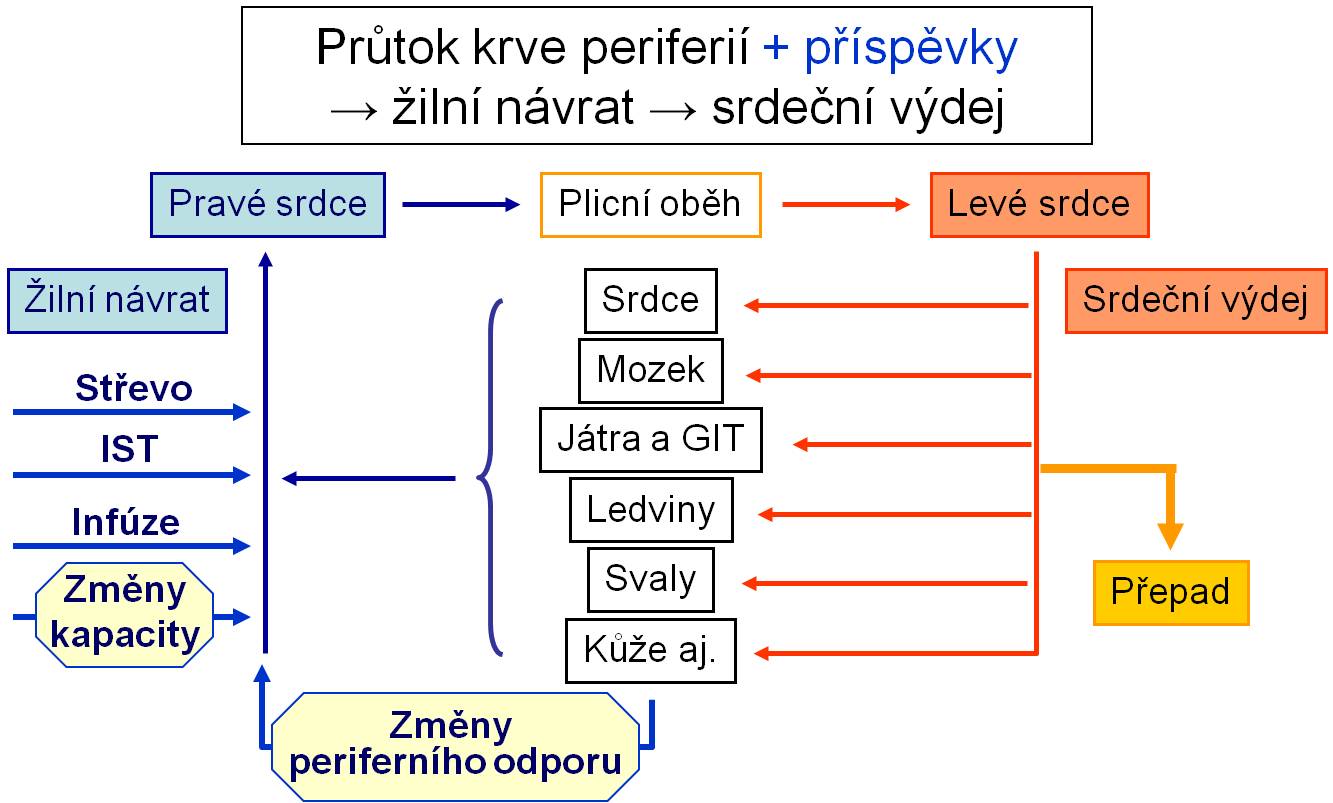
Hlavní funkcí žilního, tj. kapacitního oddílu systémové cirkulace je přizpůsobení žilního návratu, který se udržuje v mezích slučitelných s pracovními rezervami srdce. O žilním návratu, tj. o tom, kolik krve proteče periferií z arterií zpátky do vén, rozhoduje náplň řečiště a – při ustálené náplni řečiště - průsvit cév v periferních orgánech. Příspěvky jednotlivých orgánů k žilnímu návratu z periferie směrem do dutých žil se postupně sčítají (viz níže obr. 7 a 8).
Mikrocirkulace
S tím, jak se tepny větví na menší a menší cévy, přechází oběhový systém do nižších oddílů, až nakonec ústí do mikrocirkulace. Anatomicky patří k mikrocirkulaci veškeré mikrocévy (cévy s průměrem menším než 150 μm). V mikrocirkulaci se na úrovni kapilár odehrávají základní děje zabezpečující výživu tkání. Vstup krve do mikrocirkulace zprostředkují malé svalnaté tepénky o průměru mezi 150 – 500 μm – tzv. odporové arterioly. Ty se větví na menší tepénky o průměru 80 – 120 μm (mikrotepénky 1. řádu) a ty se pak postupně dělí ještě dál, 4 – 5x za sebou, až vzniknou terminální arterioly s průměrem asi 10 μm (mikrotepénky 4. nebo 5. řádu). V místech větvení jsou přítomny svalové svěrače. Každá z terminálních arteriol pak zásobuje kolem 10 kapilár o průměru mezi 3 – 7 μm.
Žilní část mikrocirkulace je vystavěna přibližně zrcadlově, jen průřezy žilek jsou asi o 1/5 větší než jsou průřezy odpovídajících tepének.
Důsledky plynoucí pro mikrocirkulaci z rovnice kontinuity, uvedené výše, lze prakticky zužitkovat. Rovnice například dovoluje přibližně určit celkovou plochu průřezů všech periferních kapilár. Protože lineární rychlost toku krve v aortě, která má průsvit 3 – 4 cm2, je asi 0,2 – 0,3 m/s, a v kapilárách je kolem 0,3 mm/s, lze vypočítat, že celkový průřez kapilár je ve srovnání s aortou asi tisícinásobný. V klidu ovšem prochází krev jen asi 1/3 – 1/4 všech kapilár. Proto je za fyziologických podmínek pohotovostní plocha průřezů celého kapilárního řečiště ještě asi 3 – 4x větší – tj. celkem asi 1 m2. Lze dále uvést, že typická délka kapiláry je 0,3 – 1,0 mm, a že krev tedy setrvává v kapiláře po dobu 1 – 3 s. To poskytuje několikanásobnou rezervu pro uskutečnění výměny všech potřebných živin.
Periferní odpor
Hemodynamický odpor R je podobně jako odpor kladený elektrickému toku ve vodičích přímo úměrný délce l a nepřímo úměrný poloměru r cévy. Na rozdíl od ohmického odporu, který klesá s druhou mocninou poloměru vodiče, však je hemodynamický odpor nepřímo úměrný čtvrté mocnině poloměru cévy:
R = 8ηl/πr4 (N x s/m5 = Pa x s/m3).
Symbol η v rovnici je viskozita (pro mnemotechnické účely je vhodné si uvědomit, že viskozita je charakteristikou materiálu – zde krve – podobně, jako v nauce o elektřině je charakteristikou materiálu specifický odpor vodiče). Stejně jako ohmický odpor nelze ani hemodynamický odpor měřit přímo. Lze jej vypočítat z údajů o krevním průtoku a tlaku. Celkový periferní odpor je součtem odporů všech jednotlivých článků velkého oběhu.
Periferní rezistence způsobuje, že krev pumpovaná ze srdce se zadržuje v arteriální části oběhu a neodtéká naráz do žil. Spolupůsobí při tom elastické vlastnosti velkých arterií (pružník). Díky tomu se po celou dobu srdečního cyklu udržuje strmý tlakový gradient mezi arteriemi a vénami (arteriální tlak). Výsledkem je nepřerušovaný, plynulý tok krve mikrocirkulací přes to, že ve velkých arteriích se na začátku diastoly krevní proud zastavuje, nebo dokonce obrací.
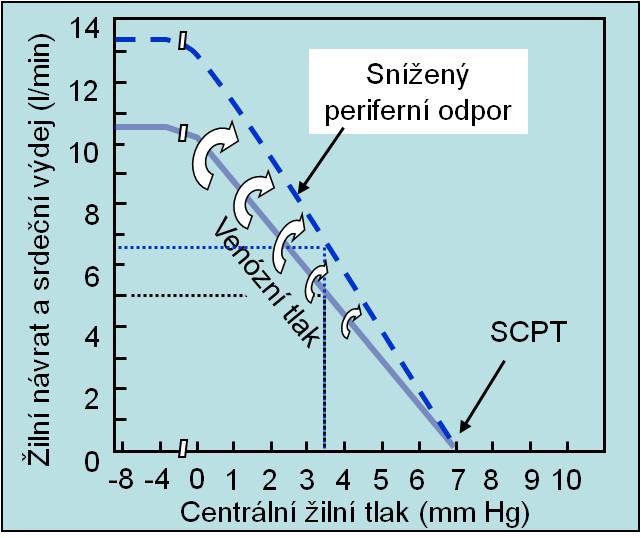
Při poklesu periferního odporu se snižuje arteriální tlak. Zároveň, jak ukazuje následující graf, se zvyšuje žilní návrat.
Obr. 4. Zvýšení žilního návratu při poklesu periferní rezistence. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.) Toto schéma je možno zhlédnout i v animované podobě.
Za regulaci hemodynamického odporu jsou ponejvíce odpovědné změny poloměru (průsvitu) cév. Musíme odlišovat krátkodobou a dlouhodobou regulaci cévního odporu. Při krátkodobé regulaci jsou tyto změny umožněny stahy hladkého svalstva cév. Změna poloměru 1,2x znamená asi dvojnásobnou, ale změna 1,8x už desetinásobnou změnu odporu. Při dlouhodobé regulaci se nadto setkáváme s obtížně vratnou, koncentrickou přestavbou, provázenou hypertrofií cévní stěny. Dalším nástrojem dlouhodobé regulace je změna hustoty cév – vytváření, nebo zánik kolaterál a s nimi související zvětšení, nebo zmenšení celkového průřezu sítě mikrocév. V obojí regulaci hraje ústřední úlohu endotel, popř. endotelová dysfunkce.
Rozhodujícími odporovými články oběhu jsou tepénky a odporové arterioly s kapilárami. Anatomicky jde o velmi krátký úsek cirkulace, který má délku pouhých několik milimetrů. Přesto tato část oběhu odpovídá za přinejmenším padesát a více procent celkového periferního odporu. Podíl tepének a mikrotepének na odporu řečiště je ale v různých tkáních různý.
Obr. 5. Odporové články v krevním oběhu. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.) Toto schéma je možno zhlédnout i v animované podobě.
Odporové arterioly. O tom, jak velký proud krve bude vpuštěn do mikrocirkulace, rozhodují v každém orgánu hlavně odporové arterioly. Odporové arterioly jsou hemodynamické ventily ovládané hladkým svalstvem, jež je hojně zásobeno sympatickými vegetativními vlákny. Proud krve směřující do tkání je tudíž pod významnou centrální kontrolou sympatiku. Působení sympatiku však má limity. V dlouhodobém horizontu ho převyšují lokální tkáňové vlivy.
Stah odporových arteriol má účinek analogický zvýšení přepadu vodního stavidla. Dočasně zadrží přitékající tekutinu, a pokud se náležitě nezvedne hydrostatický tlak (hladina před stavidlem), protéká tekutiny méně. Po zvýšení tlaku ovšem může tekutina znovu začít proudit přepadem stejně rychle jako před vazokonstrikcí. V nauce o elektřině jsou paralelami odporových cév reostaty.
V úseku odporových arteriol už také působí místní regulátory krevního průtoku. Místní regulátory se mohou uvolňovat nejen z nervových vláken, ale také z endotelií, hladkých svalových buněk apod. Arteriolární odporový kontrolní článek ale není konečný, a není ani základní.
Prekapilární svěrače. Základní fyziologický, dlouhodobý regulační odporový článek je na nejnižších úrovních organizace oběhové soustavy, na úrovni metaarteriol, prekapilárních svěračů a venul. Zde je napětí cévního svalstva z největší části podřízeno přímému vlivu tkáňových faktorů. Změny průtoku v tomto úseku především upravují místně působící mediátory – jejich nadbytek, nebo nedostatek. Zatímco nervové vlivy jsou hlavně vazokonstrikční, místní tkáňové produkty zde působí převážně vazodilatačně. Navíc svými dlouhodobými účinky zatlačují nervové vlivy do pozadí. Místní produkty se hromadí, nebo ubývají v závislosti na intenzitě tkáňového metabolismu. Jejich účinnost je závislá na expresi receptorů v příslušných tkáních.
Kapiláry. Pokud jde o kapiláry, nemají svalovou vrstvu. Jejich rezistence však může být ovlivněna stavem endotelií. Zbobtnání endotelových buněk zmenšuje průsvit kapilár a naopak. I tyto změny jsou z největší části pod lokální tkáňovou kontrolou.
Pericyty. K endotelové vrstvě kapilár přiléhají zvnějšku pericyty. Obsahují stažlivé proteiny. Svou kontrakcí přispívají k regulaci průtoku krve kapilárami. Je pravděpodobné, že se podílejí i na udržování selektivní permeability kapilárních úseků. V některých oblastech mají fagocytární vlastnosti. Schopnostmi fagocytovat jsou například vybaveny mesangiální buňky glomerulů ledvin.
Fenotyp pericytů kapilár se plynule mění ve fenotyp svalových buněk zevně obemykajících terminální arterioly, venuly a větší cévy. Pericyty mohou diferencovat ve svalové buňky, adipocyty, nebo osteoblasty.
Podíl vén na celkové periferní rezistenci není větší než 10 %, a to ani při silném sympatickém venokonstrikčním působení. Odpor žil – zejména velkých žil – bývá způsoben hlavně jejich stlačením okolními tkáněmi a je oproti odporu v tepenném oddílu zanedbatelný. To koresponduje s funkcí žilního systému jako kapacitní části oběhové soustavy. Změny napětí žilních stěn mají mimořádný vliv na plnicí cirkulační tlaky. Jedinou alternativní cestou významného ovlivnění plnicích tlaků venokonstrikcí jsou změny objemu intravazální tekutiny. Oběh efektivně využívá oba tyto mechanismy.
Lokální odpory v jednotlivých orgánech
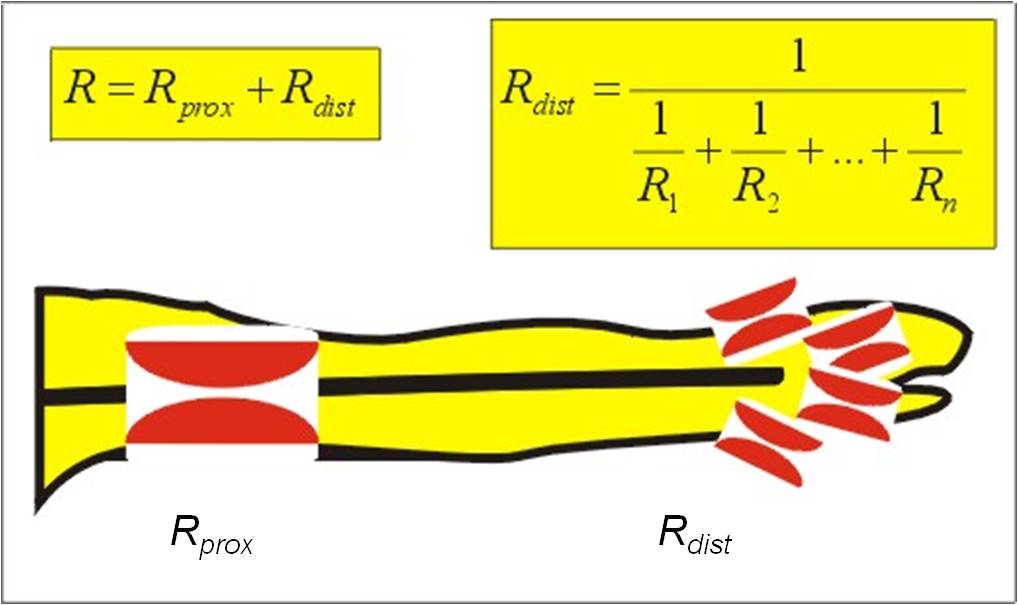
Souhrnný periferní odpor R kladený krevnímu toku je součtem dílčích odporů všech jednotlivých článků velkého oběhu. Je popsán příslušnými rovnicemi. Rovnice se liší podle toho, zda jde o sériové, nebo paralelní odpory. Jsou uvedeny v obrázku 6. Celkový odpor sériově (za sebou) uspořádaných odporů je roven jejich součtu. Celkový odpor paralelně uspořádaných odporů (vedle sebe) je roven převrácené hodnotě součtu jejich převrácených hodnot.
Obr. 6. Sériové a paralelní odpory v oběhu.
Hemodynamický odpor určitého orgánu omezuje množství krve, které orgánem projde. Určuje, jak velký podíl ze srdečního výdeje orgán využije pro svoje potřeby. Tím zároveň vymezuje, jak velký bude příspěvek tohoto orgánu k žilnímu návratu. Krev prochází orgány do žil a vrací se k srdci pouze v takovém množství, jaké vyžadovaly potřeby tkání. Pokud srdeční výdej poskytuje více krve, než orgámy potřebují, krev zůstává v arteriálním řečišti (zvyšuje tlak) pro potřeby jiných orgánů, nebo je odstraněna tlakovou diurézou. Příspěvky jednotlivých orgánů k žilnímu návratu z periferie do dutých žil se směrem k srdci postupně sčítají.
Obr. 7. Příspěvky orgánů k žilnímu návratu. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.) Toto schéma je možno zhlédnout i v animované podobě.
Obr. 8. Příspěvky vnitřních orgánů, exogenních vstupů a exogenních výstupů k žilnímu návratu. Také toto schéma je možno zhlédnotu v animované podobě.
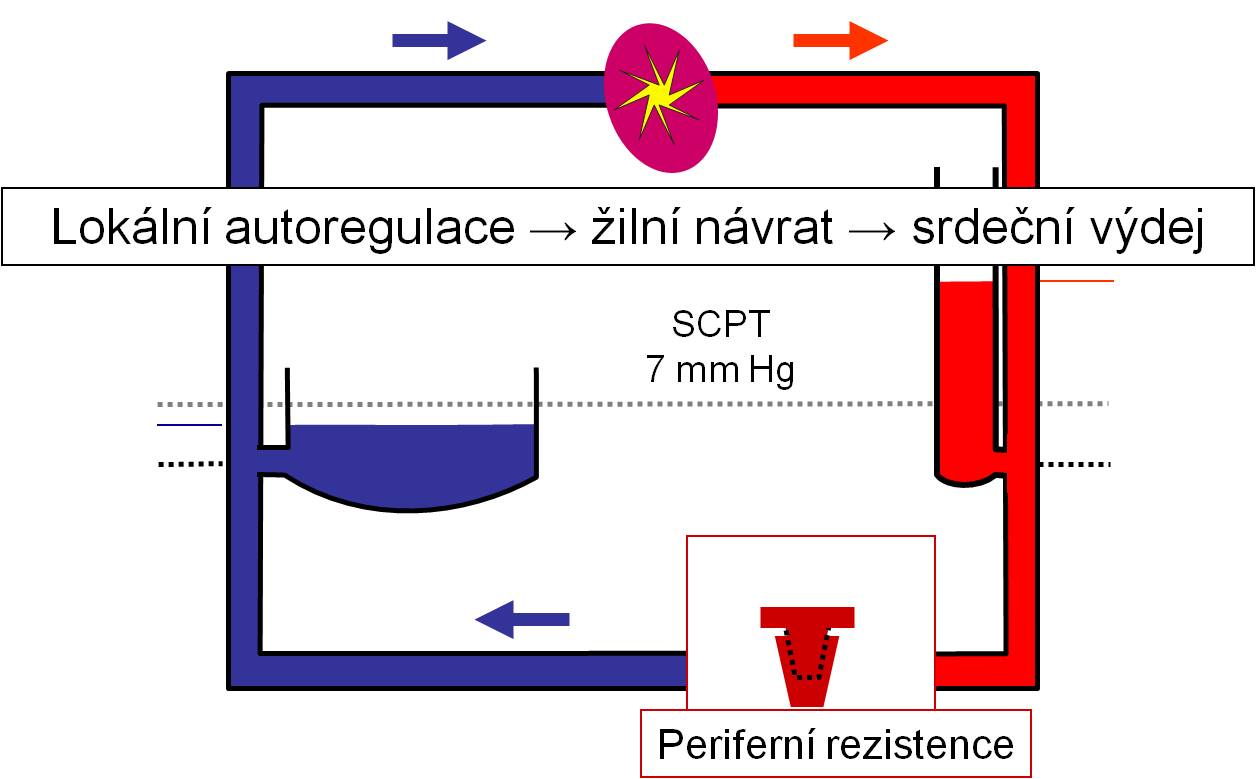
Periferní tkáně si řídí průsvit cév, a tím periferní odpor samy, lokálními autoregulačními mechanismy. Žilní návrat je tedy dlouhodobě určen autoregulačními mechanismy ve tkáních. Podobně jako systémový arteriální tlak není ani periferní odpor v systémovém oběhu pod suverénní kontrolou cirkulace. Průsvit cév a hustota cévní sítě nezávisí v dlouhodobé perspektivě na jiných hemodynamických veličinách, nýbrž na metabolických požadavcích tkání. Periferní odpor dlouhodobě bezprostředně určují metabolické – tedy mimohemodynamické – faktory. Jeho velikost je proto oběhu dlouhodobě vnucena zvnějšku. Z toho důvodu je celkový periferní odpor druhou primární, tj. nezávislou hemodynamickou veličinou.
Ze tří veličin hemodynamiky J = P/R je jedinou skutečně závisle proměnnou průtok krve (srdeční výdej).
Obr. 9. Lokální autoregulace ve tkáních při stálém středním arteriálním tlaku dlouhodobě určuje srdeční výdej. Srovnej s obr. 2.
Je zapotřebí rozlišovat krátkodobé a dlouhodobé procesy autoregulace tkáňového průtoku. V obojích má kritickou iniciační úlohu endotel. Krátkodobá regulace spočívá ve změnách průsvitu cév zprostředkovaných snížením nebo zvýšením napětí hladkého svalstva. Dochází k nim v intervalech sekund a minut. Jako příklady je možno připomenout aktivní hyperémii (ve funkčním orgánu, svalu, žláze, povrchovém okrsku končetiny ponořené do teplé vody) anebo reaktivní hyperémii (v končetině po uvolnění manžety). Segmentové reakce svědčí o tom, že místní změny se navíc mohou reflexně přenášet do vzdálenějších oblastí těla.
Dlouhodobá regulace zahrnuje složitější pochody. Jednu skupinu představují změny cévního průsvitu způsobené koncentrickou přestavbou (zbytněním) svalových a vazivových vrstev stěn. Podle Laplaceova zákona je tangenciální pnutí v cévní stěně přímo úměrné krevnímu tlaku a poloměru cévy a nepřímo úměrné její tloušťce. Proto když se zvýší tlak nebo se céva rozšíří (např. výdutí), a pnutí abnormálně vzroste, svalstvo i mezibuněčná hmota hypertrofují. Stěna zesílí, dokud se až se pnutí nenormalizuje. Jinou skupinou dlohodobých procesů jsou změny hustoty cévního stromu, mikrocirkulace a kapilární sítě ve tkáních.
Lokální procesy, spouštěné endotelem, mají velký význam i pro chirurgické zásahy do oběhové soustavy. Rozhodují o úspěchu takových operací, jako jsou implantace by-passů, angioplastiky, uzavírání arteriovenózních píštělí apod.
Periferní odpor úzce souvisí s anatomií cirkulace. Anatomie cirkulace se neustále mění. Po narození pokračuje vývoj cév v sítnici a v srdci, později také v reprodukčních orgánech. Nicméně krevní cévy si i v dospělosti uchovávají schopnost reagovat změnami struktury na mechanickou zátěž nebo na metabolické potřeby. Cirkulace se přestavbou obvykle adaptuje na dlouhodobé změny hemodynamických podmínek. Přestavba může provázet nejen fyziologické, ale i patologické procesy a vyústit do klinických poruch. Rychlost, rozsah a intenzita fyziologických strukturních změn klesají s věkem.
Proliferační signály. Proliferační signály remodelace a růstu cév patrně integruje endotel. K nejúčinnějším cévním růstovým faktorům patří vaskulární endotelový růstový faktor (VEGF, varianty A až D), placentární růstový faktor (PIGF) příbuzný VEGF a fibroblastový růstový faktor (FGF). Významné postavení má rodina signálních proteinů transformačního růstového faktoru TGFβ. I když VEGF produkují mnohé typy buněk, ale zpravidla ne endotel (významným zdrojem jsou např. aktivované trombocyty), jeho účinek se relativně úzce omezuje na endotelové buňky. FGF naproti tomu výrazně stimuluje růst i mnohých jiných druhů buněk včetně hladkých svalových buněk cévních stěn.
Ústředním proliferačním cévním faktorem je VEGF-A. Na rozdíl od exprese ostatních členů rodiny VEGF indukuje jeho expresi hypoxie. Prostředníky jsou hypoxií-indukovatelné transkripční faktory HIF-1α a HIF-2α. Faktory anebo jejich mRNA jsou při dostatku kyslíku degradovány, hypoxie je naopak stabilizuje. Důležitou úlohu při stabilizaci HIF má produkt genu, jehož mutace způsobuje von Hippelovu-Lindauovu chorobu. Účinky VEGF zprostředkovávají receptory VEGFR1 až -R3, jakož i membránové proteiny neuropilin-1 a neuropilin-2. Jednotlivé VEGF navozují vazodilataci (částečně přes NO), stimulují migraci buněk, zvyšují permeabilitu, inhibují apoptózu apod. VEFG-C se spolu s receptorem VEFG-R3 uplatňuje hlavně při proliferaci lymfatických cév.
Angiogenze a vaskulogeneze. Při chronické (absolutní anebo relativní) hypoxémii dochází nejen k vazodilataci, ale i k bujení kolaterál a zvětšení počtu a velikosti cév. Podobné procesy jsou nezbytné např. pro regeneraci tkání a hojení ran. Signálem k růstu cév je vychýlení rovnováhy mezi angiogenními a angiostatickými faktory na stranu prvně jmenovaných.
Rozlišuje se mezi angiogenezí a vaskulogenezí. Angiogeneze začíná aktivací endotelových buněk, rozvolněním jejich mezibuněčných spojů, vysláním dlouhých výběžků a následnou migrací a proliferací endotelových buněk z už přítomných cév, zejména venul, do intersticia . Výhonky endotelových buněk obvykle pronikají bazální membránou a intersticiem směrem k angiogennímu stimulu. V dalších fázích se výhonky spojují se svými protějšky z protilehlých cév a postupně se z nich konstituují cévy.
Vaskulogeneze naproti tomu vychází z pluripotentních mesenchymových buněk – angioblastů – přítomných v cirkulaci. Edoteliální prekurzorové buňky se do cirkulace dostávají z kostní dřeně. Jsou mobilizovány ischémií. Kapiláry se při tomto pochodu tvoří de novo. Vyzrávají a mohou se dále vyvíjet ve větší cévy. Mohou tak vzniknout celé nové úseky mikrocirkulace.
Redukce cévní sítě. Naopak, jsou známy stavy, které vedou ke ztluštění stěn cév a zúžení jejich průsvitu, nebo dokonce k lokální redukci počtu cév a prořídnutí arteriolární a kapilární sítě. Oblasti se zachovanou hustotou cévních struktur jsou potom po přerozdělení krve vystaveny nadměrnému krevnímu průtoku, kterému se brání zmenšením krevního objemu (normalizací tlaku) anebo sekundární vazokonstrikcí. Dlouhodobá přestavba, byť začala v omezené oblasti, se tak nakonec může dotknout velkých úseků cirkulace.
Při hypertenzi dochází ke snížení hustoty sítě mikrocév. Změna probíhá ve dvou fázích. První fáze je funkční a vratná, neprovázená anatomickými změnami. Mikrocévy jsou přítomny, ale většinou zůstávají uzavřeny a nejsou perfundovány. Za toto uzavření cév není odpovědný sympatikus – denervace nevede k naplnění cév. Druhá fáze je anatomická. Během ní může snížení hustoty arteriol dosáhnout až 25-40 % oproti výchozímu stavu.
Na buněčné úrovni jde při přestavbě cirkulace o mimořádně složité změny. Zahrnují nejméně čtyři typy procesů. Lze rozeznat zánik (zpravidla apoptózu) buněk, růst, dělení a diferenciaci buněk, buněčnou migraci a dále přeměnu (odbourávání a znovuvytváření) extracelulární matrix.
Klinické příklady uplatnění dlouhodobé lokální tkáňové regulace
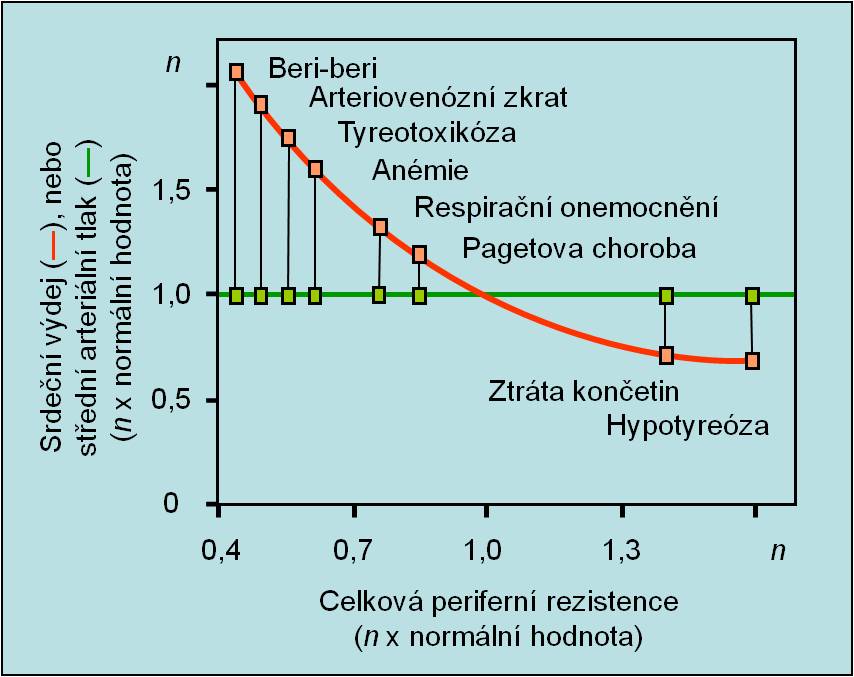
Jako doklady účinnosti lokálních tkáňových regulačních okruhů slouží případy chronických změn periferního odporu u některých dobře známých klinických stavů (obr. 10). Jde zejména o hypoxii (chronické otravy, anémie, plicní onemocnění), tyreotoxikózu a deficity vitaminů (beri-beri). Provází je trvalá vazodilatace ve tkáních, která sleduje zajištění tkáňových metabolických potřeb. Zároveň je zvýšen žilní návrat a srdeční výdej. Periferní odpor je 1,3-1,6x snížen oproti zdravým jedincům. Současně se 1,3 – 1,6x zvětšuje krevní průtok tkáněmi. Stojí za zmínku, že přes tyto zjevné známky hyperkinetické cirkulace nebývá přítomna hypertenze. Podobně je tomu také při arteriovenózních píštělích, Pagetově chorobě, horečce nebo při normálním průběhu těhotenství. Lze sem přiřadit i jaterní selhání a hepatorenální syndrom, u nichž se mechanismus hyperkinetické cirkulace, provázené ovšem hypotenzí, nedaří jednoznačně objasnit.
Obr. 10. Výrazné změny periferního odporu neprovázené změnami arteriálního tlaku u známých klinických stavů. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.) Schéma je možno zhlédnout v animované podobě.
Snad ještě přesvědčivěji vypovídá o výkonnosti lokální tkáňové autoregulace oběhová přestavba, která provází zúžení břišní aorty nad odstupem renálních arterií. Při tomto postižení je tlak na dolní polovině těla v normálních mezích, zatímco tlak v cévách horní poloviny těla je až 1,6x vyšší. Dalo by se proto očekávat, že v souladu s rovnicí Q = ΔP/R bude v horní polovině těla proudit krev cirkulací 1,6x rychleji. Průtok krve tkáněmi je však na obou polovinách těla prakticky stejný. Rozdíl tlaků je vyvážen rozdílnými hodnotami periferního cévního odporu. Na horní polovině těla je cévní odpor vyšší. Sekundárně se zde vyvinula vysoká periferní rezistence jako nástroj redukce krevního průtoku při vysokém arteriálním tlaku. Tuto redukci si vynutily samotné tkáně v souladu s jejich metabolickými potřebami. Žilní návrat a srdeční výdej potom bývají při tomto postižení aorty prakticky normální.
Obr. 11. Reakce ledvin na snížení přívodu krve po zúžení břišní aorty nad odstupem renálních arterií. Vlevo: Ischemická oblast těla před rozvinutím ledvinové odpovědi; Vpravo: Stav po úpravě vynucené ledvinovou odpovědí – ledviny a dolní polovina těla zásobeny při středním arteriálním tlaku 100 mm Hg, hormí oblast těla vykupuje tuto úpravu zásobení ledvin hypertenzí.
Zatímco v různých oblastech organismu může být tok krve podle situace velmi proměnlivý (svaly, kůže, střevo), v některých orgánech kolísá krevní průtok pouze v nejužších mezích. Je vhodné mít na paměti zejména zvláštnosti krevního zásobení ledvin a mozku. Oba uvedené orgány mají konstantní vysoké nároky na přívod krve, který se proto specifickými autoregulačními mechanismy udržuje na vysoké a téměř stálé úrovni.
Srdeční výdej
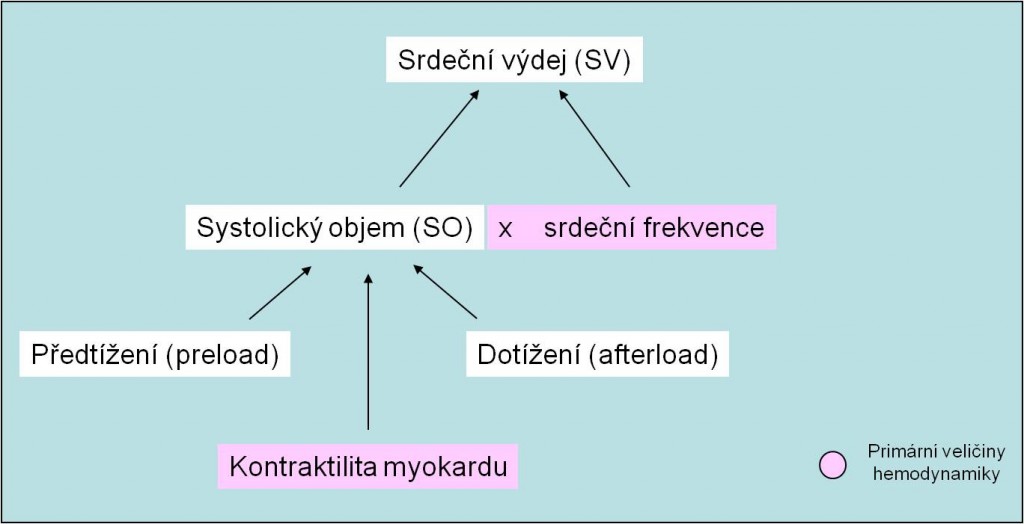
Srdeční výdej SV (také minutový srdeční objem) je součinem systolického objemu SO a srdeční frekvence F vyjádřené za minutu: SV (ml/min) = SO x F (obr. 12).
Obr. 12. Determinanty srdečního výdeje.
V levé komoře na konci diastoly normálně je asi 120 ml krve (end-diastolický volum). Toto množství se při systole zmenší asi na 50 ml (end-systolický volum). Asi 70 ml krve se při systole vypudí do aorty (systolický objem). Normální ejekční frakce komory je 70/120 = 0,7. Normální srdeční výdej je asi 5000 ml/min. Srdce může jednorázově zvětšit systolický objem tím, že na úkor end-systolického komorového volumu zvýší ejekční frakci. End-systolický objem pak může poklesnout až na 10-20 ml. Aby však i při následujících stazích mohl systolický objem zůstat zvýšený, musí se srdce znovu adekvátně naplnit, tj. musí při diastole přijmout odpovídající větší množství krve. Zdravé srdce může pojmout 150-180 ml end-diastolického volumu. Systolický objem se tak v případě potřeby může přibližně zdvojnásobit. Spolu s frekvencí, která se může efektivně zvýšit téměř třikrát, může srdce v rámci svých fyziologických rezerv zajistit až šestinásobný nárůst srdečního výdeje.
Srdeční výdej je při zachovaných funkčních rezervách srdce přímo určen jinou hemodynamickou veličinou – žilním návratem. Srdeční výdej SV, a s ním i krevní tok J, proto nejsou primární, nezávislé, nýbrž sekundární, závisle proměnné hemodynamické veličiny. Srdeční výdej určují (obr. 12):
- Náplň srdce za diastoly a předtížení (preload) srdečního svalu;
- Odpor, s kterým se setkává krev vypuzovaná při systole komor do aorty a dotížení (afterload) srdečního svalu;
- Síla a rychlost stahu myokardu;
- Srdeční frekvence.
Předtížení
Předtížení (preload) je zatížení, které stěna komory vyrovnává svým napětím na konci diastoly. Velikost je především dána end-diastolickou náplní komor, tedy:
- Žilním návratem (periferní determinanta) (obr. 13);
- Rychlostí relaxace a stupněm roztažení komor (srdeční determinanta);
- Kontrakcí síní.
Obr. 13. Žilní návrat v postavení determinanty srdečního výdeje.
Žilní návrat je při stálém periferním odporu primárně determinován středním systémovým plnicím tlakem, tj. především:
- Objemem krve v cirkulaci (obr. 1);
- Napětím velkých kapacitních žil (obr. 1).
Žilní návrat je rovněž závislý na periferním odporu:
- Při poklesu periferního odporu se zvyšuje (obr. 4);
- Při růstu periferního odporu se snižuje (obr. 4).
Rychlost a stupeň relaxace komory za diastoly determinují následující procesy:
- Komora musí na přítok krve odpovídat dostatečně rychlou relaxací. Tuto schopnost označujeme termínem lusitropie. Relaxaci významně spoluurčuje rychlost odstranění (sekvestrace) Ca2+ iontů ze sarkoplazmy po kontrakci. Odstranění Ca2+ vyžaduje ATP. Proto výrazně trpí při hypoxii a toxických vlivech.
- Relaxaci a plnění také zhoršují:
- Hypertrofie komory;
- Infiltrace komory (amyloidóza, hemochromatóza);
- Překážky:
- Uvnitř srdce (vady atrio-ventrikulárních chlopní);
- Vně srdce (tamponáda, změny perikardu).
Porucha relaxace komory při diastole se nazývá diastolická dysfunkce.
Význam kontrakce síní zejména narůstá při koncentrické hypertrofii komor. Příspěvek síňové kontrakce chybí anebo je hrubě narušen při síňové fibrilaci, poruchách kontraktility síní, zkrácení, nebo prodloužení intervalu P-R a při atrioventrikulární disociaci.
Dotížení
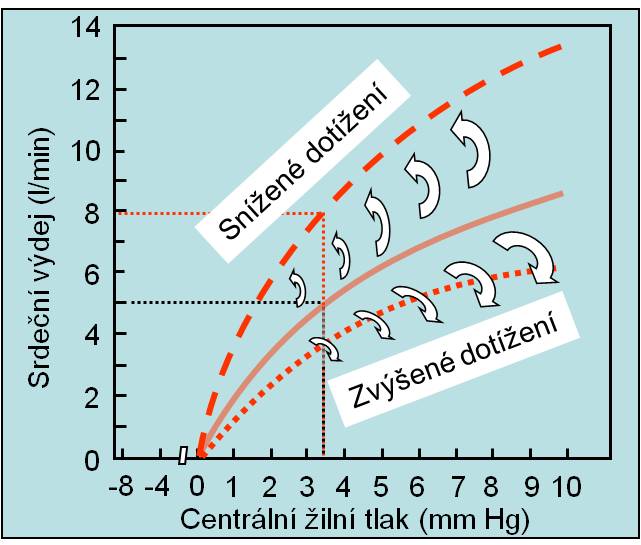
Dotížení (afterload) je zatížení, který komora překonává svým napětím po začátku systoly, aby efektivně vypudila krev do arteriálního stromu. Velikost dotížení určují:
- Síla a rychlost kontrakce komor (srdeční determinanta);
- Odpor, který krvi kladou srdeční ústí, velké arterie a jejich náplň (periferní determinanta).
Obr. 14. Změny srdečního výdeje při změnách dotížení. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.) Schéma je možno zhlédnout v animované podobě.
Pro klinické účely má význam zejména analýza dotížení levé komory. Srdeční složka dotížení, tedy napětí svalu a tlak vyvinutý v komoře jsou:
- Přímo úměrné objemu (náplni) srdeční dutiny;
- Nepřímo úměrné tloušťce stěny dutiny (Laplaceův zákon):
- Hypertrofie zmenšuje napětí, a dotížení; srdeční výdej roste;
- Dilatace zvětšuje napětí, a dotížení; srdeční výdej klesá.
Závislost je zvláště nápadná u trénovaného anebo u patologicky změněného srdce. Trénované srdce se může lépe vyrovnat s vyšším předtížením i dotížením. Koncentricky hypertrofovaný myokard se hlavně objevuje u patologických stavů spojených s vysokým dotížením, dilatace vzniká při neschopnosti srdce dostát nárokům kladeným vysokým plněním.
Periferní složka dotížení levé komory je dána naplněním aorty a velkých arterií. Uplatňuje se tlakem krve nad aortálními chlopněni. Závisí na následujících faktorech:
- Na rychlosti plnění arterií z komory;
- Na relaxaci stěn plněných arterií;
- Na rychlosti vyprazdňování plněných arterií;
- Odtok krve z arterií je hlavně určen periferním odporem. Akutní zmenšení periferního odporu se bezprostředně projeví nižším dotížením (snížený diastolický a střední tlak v aortě) a následně vyšším předtížením (větším žilním návratem; část krve ovšem zadrží kapacitní oddíl řečiště).
Periferní dotížení se snižuje za situací, které usnadňují ejekci krve z komor. Zvyšuje se při ztížené ejekci krve. Dotížení se proto zejména mění:
- Změnami aortálních chlopní;
- Výškou krevního tlaku v aortě a v arteriích;
- Změnami poddajnosti velkých arterií;
- Konstrikcí, nebo dilatací arteriol;
- Arteriovenózními zkraty.
Limitem navyšování dotížení je situace, kdy srdce ani při krajním napětí vláken nedokáže otevřít aortální chlopně.
Síla a rychlost stahu myokardu. Sílu a rychlost zkrácení příčně pruhovaného svalového vlákna určují dva faktory:
- Kontraktilita (inotropie; hovoříme o síle stahu svalového vlákna o určité délce):
- Je dána metabolickým a energetickým stavem svalových vláken;
- Určuje úroveň, na které pracuje Frank-Starlingův mechanismus.
- Počáteční délka svalových vláken (hovoříme o síle stahu svalového vlákna při jeho protažení) – působí i při nezměněné kontraktilitě:
- Je dána diastolickou náplní srdce;
- Působí Frank-Starlingovým mechanismem.
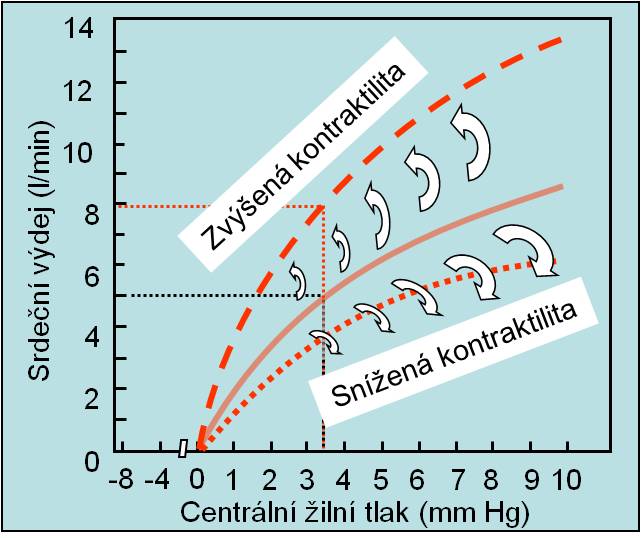
Kontraktilita (síla stahu vlákna o určité délce)
V sarkoplasmě není při svalovém stahu dostatek Ca2+, aby se nasytila všechna vazebná místa na troponinu C pro tyto ionty. Procesy, které zvyšují koncentraci Ca2+ v cytosolu svalového vlákna, zvyšují sílu kontrakce svalu bez ohledu na jeho výchozí délku. To je podstatou ovlivnění kontraktility. Ví se, že fenomén je složitější, protože změny koncentrace Ca2+ ho úplně nevysvětlují. Dolní limit poklesu kontraktility je dán komorovým tlakem potřebným pro otevření aortálních chlopní.
Křivka srdečního výdeje (kardiální funkční křivka) se při zvýšení kontraktility odklání doleva a nahoru. Výsledkem je zvýšený srdeční výdej při redukovaném žilním tlaku. Snížení kontraktility působí opačně (obr. 13).
Obr. 13. Změny srdečního výdeje při změnách kontraktility. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.). Schéma je možno zhlédnout v animované podobě.
Kontraktilitu ovlivňují:
- Metabolické vlivy (hypoxie, hyperkapnie, acidóza; stav koronárních cév);
- Nervové a hormonální vlivy (symaptikus, parasymaptikus, cirkulující hormony);
- Ztráta svalové hmoty myokardu;
- Frekvenční efekt;
- Farmaka (kardiotonika, kardiodepresiva).
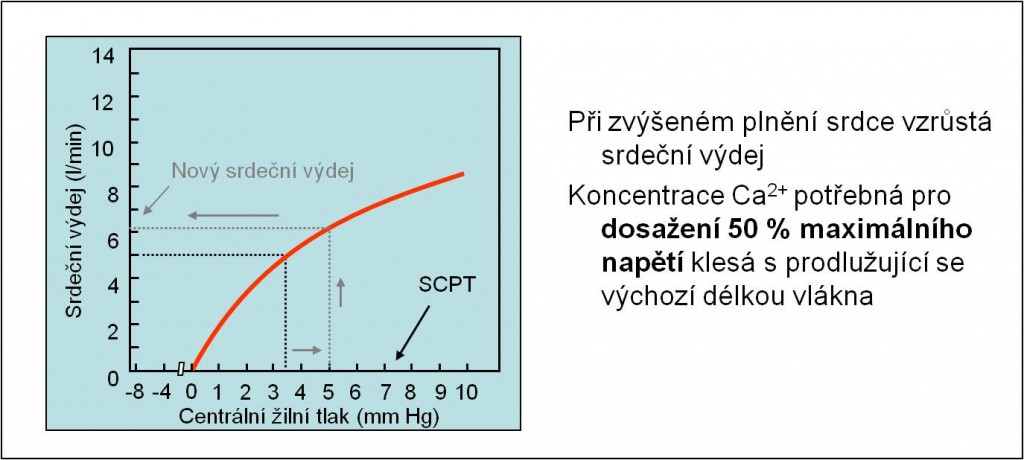
Frank-Starlingův mechanismus (síla stahu svalového vlákna při jeho protažení)
S prodlužující se výchozí délkou svalového vlákna do určité meze klesá koncentrace Ca2+, které je zapotřebí pro dosažení 50 % maximálního napětí vlákna. Proto je tlak vyvinutý komorou při systole tím vyšší, čím více jsou protažena svalová vlákna svalu (při nezměněné kontraktilitě). Systolický volum proto je tím větší, čím větší je diastolická náplň srdce (obr. 14). Při náhlé změně žilního návratu se během několika stahů ustálí nová hemodynamická rovnováha. Frank-Starlingův mechanismus tak zajišťuje, že srdce vypumpuje – při nezměněné kontraktilitě – stejné množství tekutiny, jaké do něho přiteče.
Obr. 14. Ilustrace Frank-Starlingova zákona. Schéma je možno zhlédnout v animované podobě.
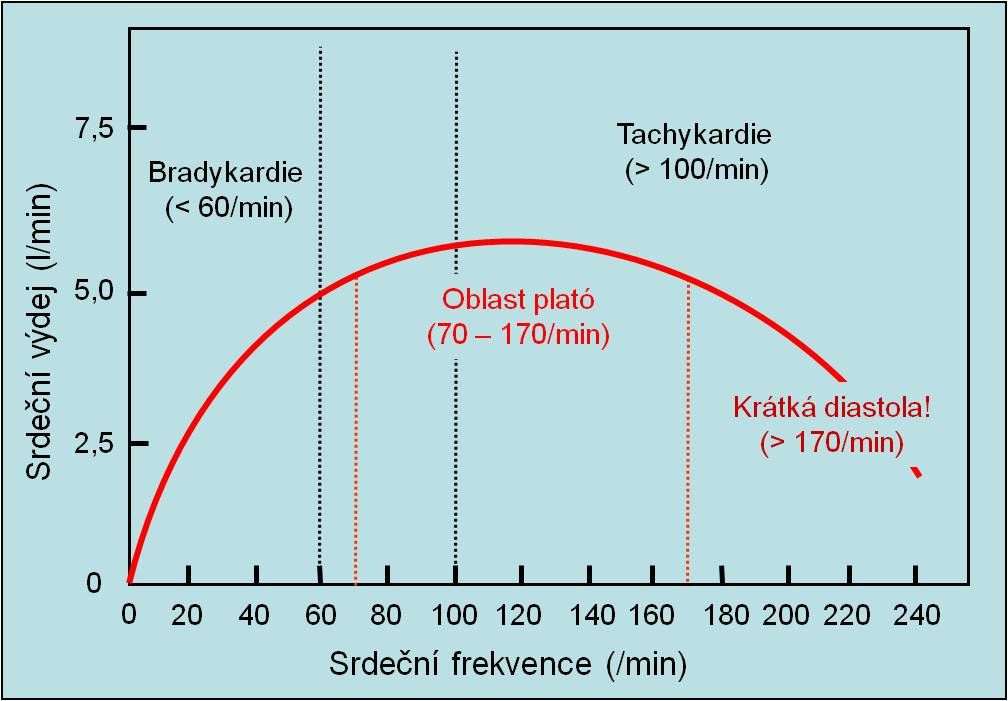
Srdeční frekvence
S růstem srdeční frekvence dosahuje srdeční výdej plató. Růst frekvence nad oblast plató má negativní dopad. Je to patrné z uvedeného grafu. Růst frekvence jde na úkor většího zkracování diastoly než systoly. Komory se pak v průběhu krátké diastoly nestačí naplnit.
Obr. 15. Změny srdečního výdeje se změnami centrálního žilního tlaku. (Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.)
Zpracoval: Jaroslav Veselý, Ústav patologické fyziologie LF UP
Při tvorbě této stránky byl se svolením autora a vydavatele částečně využit text monografie „Tlaková diuréza a arteriální hypertenze“ (Autor: J. Veselý. Vydavatelství EPAVA, Olomouc. 2002). V případě zájmu o původní širší text prosím kontaktujte vydatelství EPAVA, Olomouc (E-mail: ec@epava.cz).