Charakteristika
Nukleární kardiologie se zabývá radionuklidovým vyšetřováním kardiovaskulárního systému. Její metody nám neinvazivním způsobem poskytují unikátní funkční informace, které jsou komplementární k informacím morfologickým získaným invazivními vyšetřeními, tj. zejména pomocí koronarografie. V klinické kardiologii jsou používány tyto metody:
- Zobrazování myokardiální perfúze a funkce jednofotonovou emisní tomografií (SPECT) je používáno u pacientů se suspektní nebo známou ischemickou chorobou srdeční, obvykle ve spojení se zátěžovým testem. Po aplikaci perfúzních radiofarmak (201Tl nebo 99mTc-sestamibi resp. tetrofosmin) jsou data standardně snímána pomocí EKG synchronizace (gated SPECT), což umožňuje hodnotit perfúzi i funkci levé komory.
- Radionuklidová ventrikulografie – pomocí 99mTc-značených erytrocytů jsou zobrazeny srdeční dutiny a získány informace o regionální a globální funkci srdečních komor a regionální kinetice jejich stěny.
- Radionuklidová angiokardiografie – během prvního průtoku radionuklidu můžeme hodnotit sekvenci plnění srdečních dutin, detekovat a kvantifikovat levo-pravý srdeční zkrat.
- Pozitronová emisní tomografie (PET) - metoda je v kardiologii používaná zejména k detekci viabilního myokardu, kdy pomocí 18F značené fluorodeoxyglukózy (FDG) lze zobrazit metabolismus glukózy. V experimentálních studiích je využívána také ke kvantitativnímu posouzení perfúze myokardu.
- Vyšetření adrenergní inervace - umožňuje pomocí 123I značeného metaiodobenzylguanidinu (MIBG) diagnostikovat pacienty s poruchou adrenergní inervace, kteří jsou ohroženi srdečním selháním a maligní arytmií.
Zobrazování perfúze a funkce levé srdeční komory pomocí SPECT
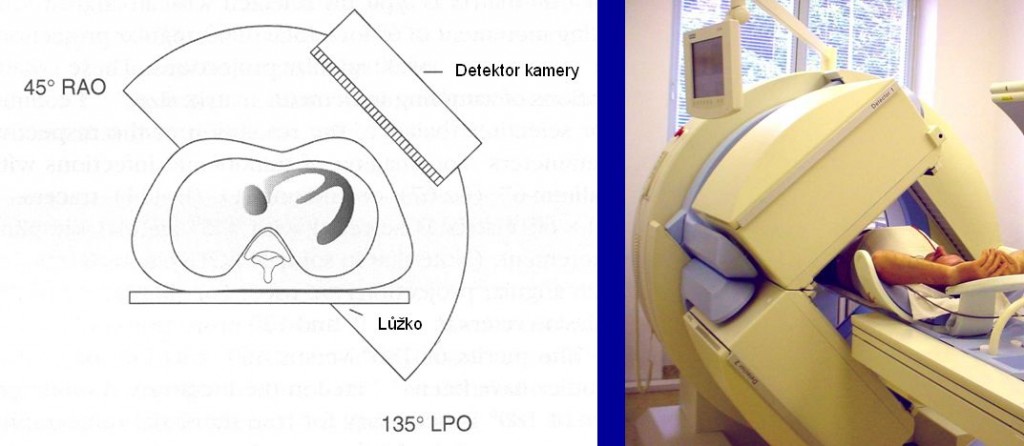
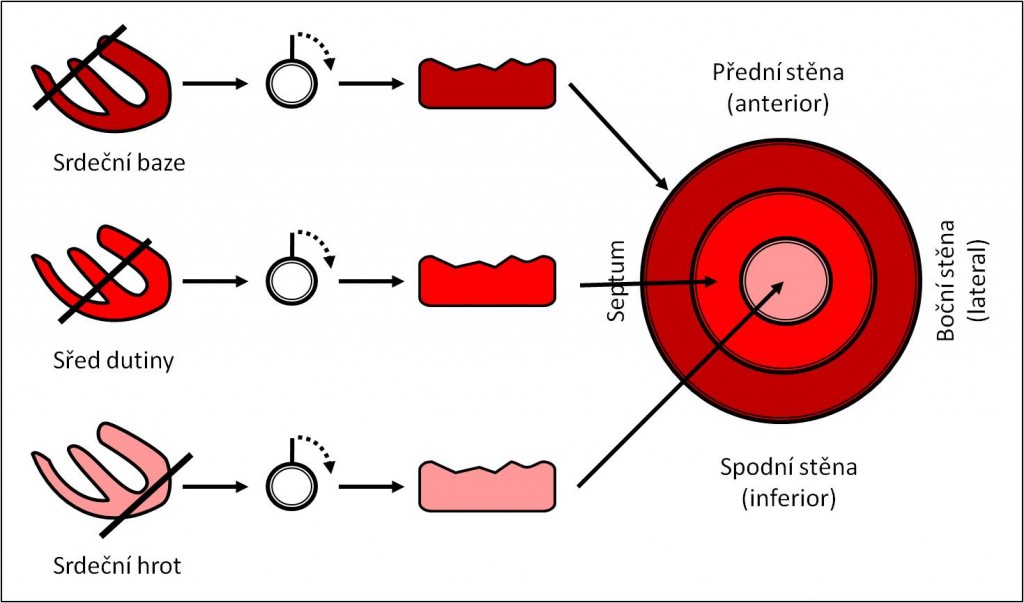
SPECT myokardu je v nukleární kardiologii jednoznačně nejdůležitější a nejvíce používanou metodou. Princip SPECT myokardu je na obrázku 1 – detektor scintilační kamery se otáčí v postupných krocích kolem pacienta a při úhlu rotace 180° obvykle získáme 60 – 64 projekcí z pravé přední do levé zadní šikmé projekce. Po počítačové rekonstrukci těchto dat pak vidíme tomografické řezy levé komory srdeční (obrázek 2).
Obr. 1 Snímání dat při SPECT myokardu probíhá v úhlu 180° z pravé přední šikmé projekce (RAO) do levé zadní šikmé projekce (LPO). Při gated SPECT je srdeční revoluce dále rozdělena na 8 – 16 obrázků od end diastoly přes end-systolu po end-diastolu dalšího cyklu.
Obr. 2 Standardní orientace pro SPECT zobrazování myokardu. Homogenní distribuce perfúze v pozátěžovém zobrazení svědčí pro dostatečnou rezervu koronárního průtoku a dobrou prognózu (riziko závažné kardiální příhody menší než 1 % ročně).
Standardem je nyní technika gated SPECT, kdy díky nahrávání dat synchronizovanému se záznamem EKG lze posoudit nejen perfúzi, ale i funkci levé komory během jednoho vyšetření. Můžeme tak vidět tomografické obrazy perfúze v jednotlivých fázích srdeční revoluce a sledovat systolické ztlušťování a hybnost stěn levé komory (obrázek 3).
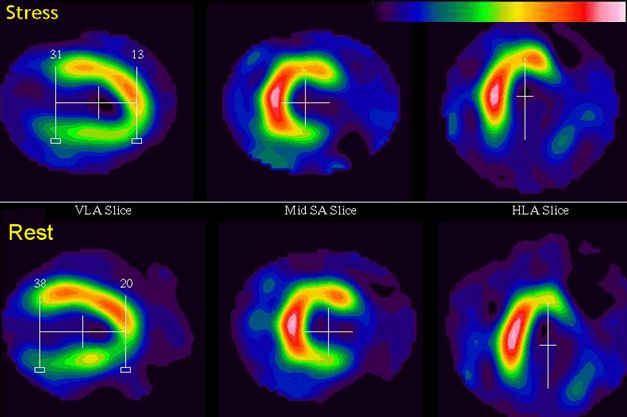
Obr. 3 Obrazy myokardiální perfúze v horizontální dlouhé ose (HLA) získané metodou gated SPECT. Kromě sumačního („ungated“) obrazu lze sledovat i obrazy v jednotlivých fázích srdeční revoluce (od end-diastoly přes end-systolu do end-diastoly dalšího cyklu).
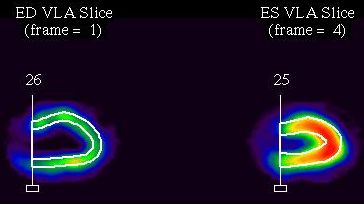
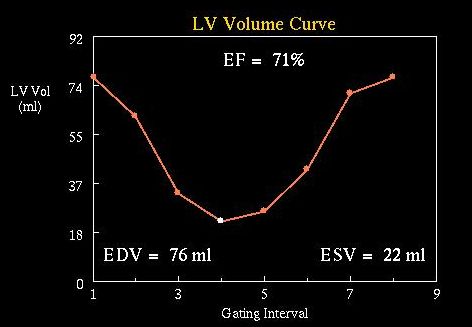
Software vymezí kontury epikardu a endokardu (Animace 1, obrázek 4). Endokardiální kontura je nezbytná pro kvantifikaci volumů levé komory v end-diastole (EDV) a end-systole (ESV) a určení ejekční frakce (EF) (obrázek 5). EF je automaticky kalkulována ze vztahu:
EF = (EDV – ESV)/EDV . 100 (%)
Obr. 4 Na tomografických řezech ve vertikální dlouhé ose (VLA) je pomocí automatického softwaru vykreslena endokardiální kontura v end-diastole (ED) a end-systole (ES).
Obr. 5 Normální volumová křivka levé komory a kvantitativní parametry – ejekční frakce (EF) a objemy levé komory v end-diastole a end-systole (EDV, ESV).
Posouzení hybnosti stěn umožňuje gated SPECT 3D zobrazení. Jak ukazuje Animace 2, můžeme v několika perspektivách sledovat normální kinetiku stěn levé komory po zátěži (horní řádek) i v klidu (dolní řádek). Animace 3 pak ukazuje přechodné pozátěžové omráčení levé komory u 71letého muže: zatímco v klidu (dolní řádek) je kinetika normální, po zátěži (horní řádek) je patrná hypokinéza přední a bočné stěny. Mřížka znázorňuje endokardiální povrch zafixovaný v end-diastole, barevně je kódován systolický pohyb endokardu v mm (viz též obrázky 14B, 15B , 17B a Animace 4).
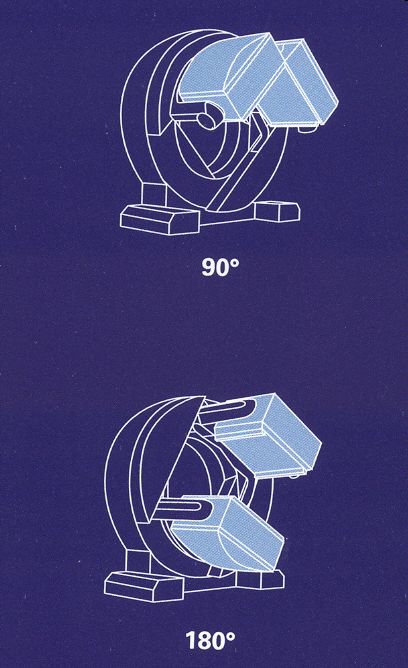
V posledních deseti letech byly původně jednodetektorové SPECT kamery postupně nahrazovány dvoudetektorovými kamerami s variabilním uspořádáním detektorů. Standardem jsou dnes kolimátory s vysokým rozlišením a paralelními otvory umožňujícími registrovat jen kolmo letící fotony (obrázek 6 vpravo). Nejnověji lze speciálními kolimátory registrovat i šikmo letící fotony (obrázek 6 vpravo), a tak lze za stejnou dobu nastřádat čtyřnásobnou hustotu impulsů.
Obr. 6 Dvoudetektorové variabilní kamery pro kardiologii umožňují zvolit sklon detektorů v úhlu 90° (tj. tzv. L-mode). Lze tak zkrátit dobu akvizice nebo získat dvojnásobnou naměřenou hustotu impulzů. Vlevo standardní kolimátor s paralelními otvory, vpravo konstrukčně nové typ s konvergentním kolimátorem umožňujícím další podstatné zkrácení akviziční doby resp. snížení aplikované aktivity radiofarmaka.
Zátěžové testy
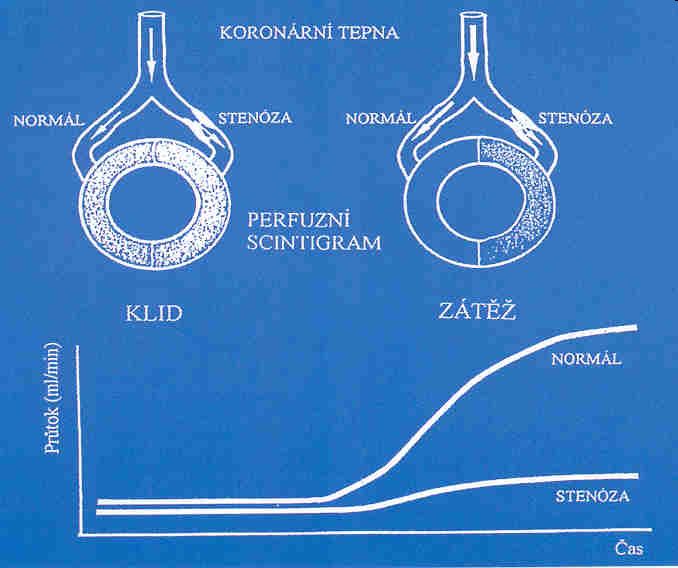
Vyšetření je nejčastěji používáno u pacientů s předpokládanou nebo prokázanou ischemickou chorobou srdeční (ICHS), obvykle ve spojení se zátěžovým testem. Zátěžové testy při vyšetření perfúze myokardu mají za úkol navození heterogenity perfúze myokardu anebo ischémii pomocí fyzické nebo farmakologické zátěže (obrázek 7).
Obr. 7 Schematické znázornění principu klidové a zátěžové perfúzní scintigrafie myokardu. Na klidovém scintigramu je distribuce radioaktivity v myokardu homogenní i přes přítomnost významné stenózy koronární arterie (horní křivka). Po zátěži dochází k heterogenitě myokardiálního krevního průtoku a v povodí zásobovaném stenotickou koronární arterií je koncentrace radioaktivity relativně nižší (dolní křivka).
Fyzická zátěž
Fyzická dynamická zátěž (bicykl nebo pohyblivý pás) je fyziologickým podnětem ke zvýšení koronárního průtoku. Při fyzické zátěži dochází k nepřímé vazodilataci vlivem nárůstu kyslíkové spotřeby myokardu (krevní průtok koronárním řečištěm se zvýší asi 2x). Provádění je obdobné jako u zátěžového EKG včetně monitorování a hodnocení EKG.
Někteří pacienti vůbec nejsou schopni fyzickou zátěž podstoupit anebo je dosažená zátěž velmi nízká. Nedostatečná úroveň zátěže je nejčastější příčinou falešně negativních nálezů. Proto je u těchto pacientů doporučována farmakologická zátěž. Mezi nejčastější příčiny nedostatečné úrovně zátěže patří:
- Ortopedické problémy;
- Bolesti páteře;
- Ischemická choroba dolních končetin (klaudikace);
- Diabetická neuropatie;
- Nelze vysadit betablokátory;
- Věk (starší pacienti);
- Neochota spolupracovat.
Farmakologická zátěž
Používají se látky s přímým vazodilatačním účinkem (dipyridamol nebo adenosin) nebo adrenergní látky s inotropním a chronotropním účinkem (dobutamin).
Dipyridamol je nejčastější variantou farmakologické zátěže. Jedná se o pyrimidinovou bázi, která zabraňuje zpětnému vychytávání adenosinu (inhibitor adenosinové deaminázy), což vede k akumulaci endogenního adenosinu a vazodilataci. Průtok koronárním řečištěm se zvýší asi čtyřikrát. Pacienti nesmí nejméně 12 hod. před vyšetřením užít látky obsahující kofein a ostatní methylxantinové deriváty, které by blokovaly adenosinový receptor. Obdobně jako u ergometrie je nutné monitorovat EKG a krevní tlak. Dipyridamol je aplikován v nitrožilní infuzi trvající 4 min. (0,56 mg/kg hmotnosti). Současná fyzická zátěž je možná (ergometrie nebo “handgrip“) a obvykle je pacienty dobře tolerována, nevede však k další dilataci koronárního řečiště. Důvodem kombinace dipyridamolu s fyzickou zátěží je pokles frekvence nežádoucích účinků, lepší kvalita obrazů při redukci tkáňového pozadí (redistribuce radioaktivity do pracujících svalů) a možnost provedení zátěže i u pacienta s nízkým výchozím krevním tlakem.
V případě obtíží při anebo po dipyridamolovém testu můžeme jeho účinek zablokovat podáním 100-300 mg aminophyllinu i.v. (dávku aminophyllinu je výhodnější podat frakcionovaně pro jeho kratší plazmatický poločas ve srovnání s dipyridamolem). Incidence závažných kardiálních příhod je relativně nízká (asi 0,03 %), hypotenze po dipyridamolu se však objevuje poměrně často (5 %) a u pacientů se závažným postižením koronárního řečiště může progredovat do kardiogenního šoku. Proto je potřeba věnovat provedení testu vždy maximální pozornost..
Klinické využití SPECT myokardu
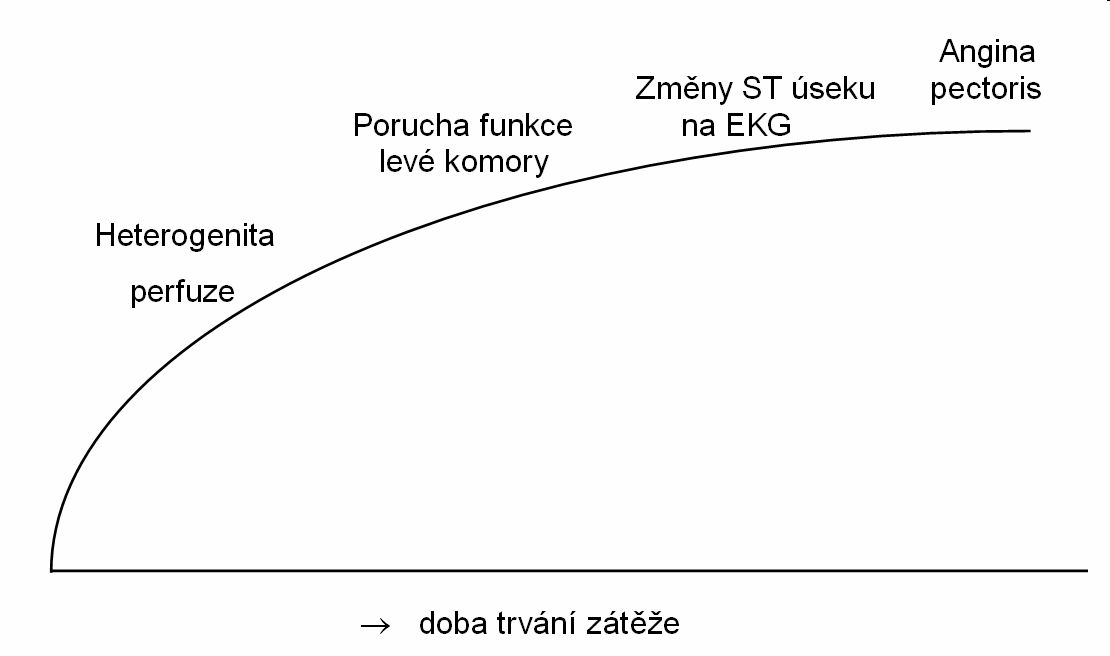
Zátěžové gated SPECT vyšetření myokardu dnes hraje důležitou roli v diagnostice ischemické choroby srdeční (ICHS). Využívá se při posuzování prognózy u pacientů s velmi pravděpodobnou nebo již koronarograficky prokázanou ICHS, při detekci ischémie u pacientů po koronární revaskularizaci a při zjišťování viabilního myokardu. Jelikož porucha perfúze nastupuje v ischemické kaskádě nejdříve, je scintigrafie myokardiální perfúze citlivější než ostatní neinvazivní metody (obrázek 8).
Obr. 8 Vztah mezi intenzitou zátěže a výskytem abnormalit myokardiálního krevního průtoku nebo kontraktility stěny myokardu. Perfúzní defekt lze na scintigramu myokardu detekovat v průběhu zátěže mnohem dříve než deprese ST úseku na EKG nebo anginózní bolest.
Pomocí gated SPECT však lze u některých pacientů zobrazit i pozátěžové zhoršení regionální kinetiky a globální funkce levé komory. Tyto známky pozátěžového omráčení pak mají prognostický význam. Tak lze identifikovat např. nemocné se závažným postižením koronárního řečiště, často s nemocí více tepen. U některých pacientů s těžkou dysfunkcí levé komory může být v popředí otázka viability myokardu a lze provést i samostatné klidové vyšetření. Samostatná klidová studie může sloužit i k posouzení funkce levé komory jakožto alternativa k echokardiografii nebo ventrikulografii. Přehled indikací SPECT zobrazování myokardu je uveden v tabulce 1.
Tabulka 1. Indikace SPECT zobrazování myokardu
| Detekce, lokalizace, rozsah a závažnost myokardiální ischémie |
| Stratifikace rizika, posouzení závažnosti stenózy zjištěné při koronarografii |
| Vyšetření po koronární revaskularizaci (angioplastika nebo bypass) |
| Zjištění viability myokardu u pacientů s dysfunkcí levé komory při plánování revaskularizace |
| Kvantifikace funkce levé komory (alternativa k echokardiografii nebo ventrikulografii) |
Diagnostika ICHS
Podle Bayesova teorému je optimální indikovat neinvazivní vyšetření pro detekci ICHS u pacientů se střední předtestovou pravděpodobností ICHS. Významnou skupinou vyšetřovaných jsou pacienti s neurčitým diagnostickým závěrem po zátěžové elektrokardiografii (neinterpretovatelná EKG křivka, nižší tolerance zátěže apod.). Obtížnější rozhodování je u žen a u diabetických pacientů s ICHS.
Při hodnocení obrazů je posuzována regionální distribuce myokardiální perfúze pomocí barevné škály, kdy každý pixel v digitálním obraze je zobrazen barvou odpovídající počtu naměřených impulzů. Scintigrafické nálezy při zátěžovém zobrazování myokardiální perfúze jsou v zásadě trojího druhu:
- Normální perfúze (obrázek 2)
- Reverzibilní defekt (svědčí pro ischémii, obrázek 9)
- Fixní defekt (obvykle svědčí pro jizvu po infaktu myokardu, obrázek 10).
Obr. 9 Zátěží navozený reverzibilní defekt perfúze u 57letého muže svědčí pro ischémii v oblasti hrotu, septa a spodní stěny.
Obr. 10 Fixní defekt perfúze s nízkou akumulací radiofarmak u 54letého pacienta svědčí pro jizvu po infarktu myokardu v oblasti bočné stěny.
Stratifikace rizika, posuzování závažnosti stenóz zjištěných při koronarografii
Pacienti s normální perfúzí po adekvátní zátěži mají velmi nízkou frekvenci kardiálních příhod nezávisle na přítomnosti koronarograficky prokázané ICHS. Dobrá prognóza se pojí i s nevelkým fixním nebo reverzibilním defektem při celkově dobré pozátěžové funkci levé komory. Hlavní výhodou SPECT v této indikaci se proto jeví možnost automatického kvantitativního posouzení rozsahu a závažnosti regionálních perfuzních abnormalit.
Na počítačem vytvořených polárních mapách (obrázek 11) kvantifikujeme rozsah perfúzního defektu pomocí tzv. „defect blackout map“. Při této analýze je perfúzní defekt definován jako zhoršení perfúze o více než 2,5 hodnoty standardní odchylky (SD) ve srovnání s normálovou databází. Obrazové body s touto vlastností pak jsou graficky vyjádřeny černě a rozsah defektu se udává v % z celé levé komory a z jednotlivých koronárních povodí (obrázek 12).
Obr. 11 Schéma konstrukce polárních map.
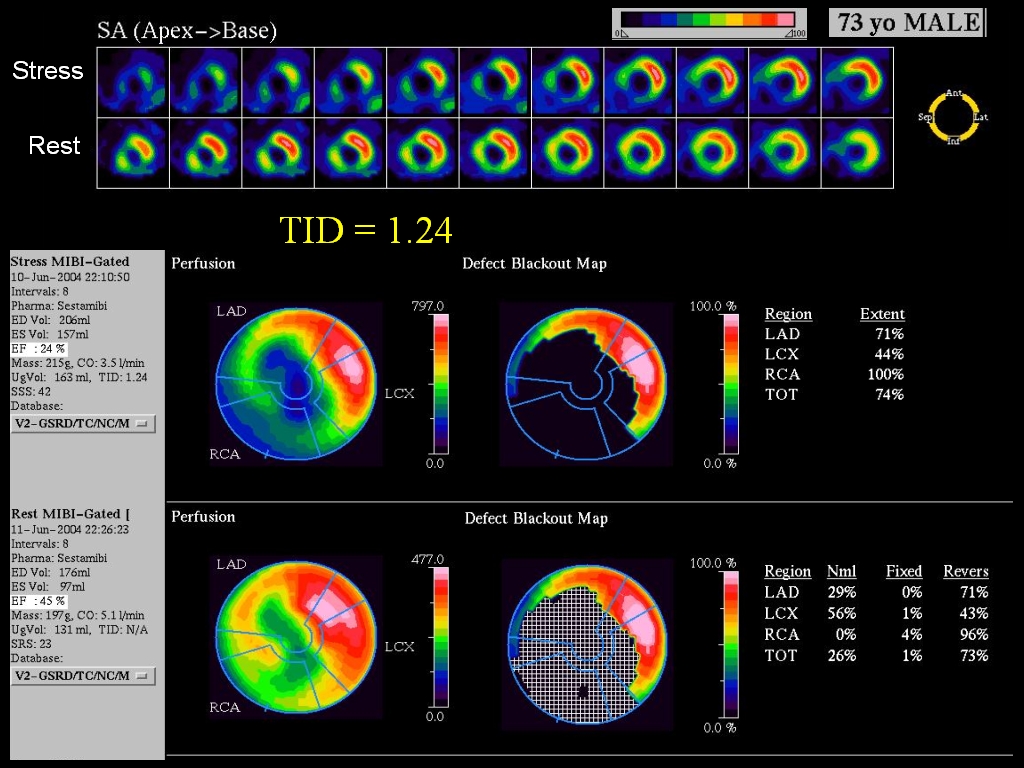
Obr. 12 Ukázka možností kvantifikace pozátěžové perfúzní abnormality u 73letého muže. Pomocí tzv. „defect blackout map“ je znázorněn rozsah defektu (74 % levé komory), který zasahuje do povodí všech tří koronárních tepen (LAD = left anterior descending artery, LCX = left circumflex artery, RCA = right coronary artery). Pomocí hodnoty standardní odchylky (SD) od normy je kalkulováno sumační zátěžové skóre (SSS), které vyjadřuje závažnost perfúzní abnormality v jednotlivých segmentech levé komory (SSS 42 svědčí pro velmi těžkou poruchu perfúze po zátěži).
Pokud chceme kvantifikovat současně rozsah i závažnost defektu (tj. jeho hloubku), použijeme systém segmentálních skóre. Perfúze v jednotlivých segmentech je podle velikosti SD ve srovnání s normálovou databází charakterizována pětistupňovou škálou, kdy hodnota 0 = normální perfúze a hodnota 4 = absence vychytávání radiofarmaka (obrázek 12). Každý ze segmentů levé komory je tedy takto ohodnocen a body se sčítají – stanovuje se tzv. sumační zátěžové skóre (SSS; summed stress score) , sumační klidové skóre (SRS; summed rest score) a sumační rozdílové skóre (SDS; summed difference score). Se stoupajícími hodnotami sumačního skóre pak byla prokázána i narůstající mortalita pacientů. Zatímco pacienti s mírným perfúzním defektem (SSS v rozmezí 4 – 8) mají mortalitu pod 1 % ročně a lze u nich upřednostnit konzervativní řešení, koronární intervence je naléhavá u pacientů s SSS > 8. Závažnost perfúzní abnormality hodnotíme vždy komplexně, svoji roli hraje i počet postižených koronárních tepen (tabulka 2). V současných doporučeních pro revaskularizaci je doporučována konzervativní strategie např. u pacientů se stabilní anginou pectoris, bez postižení proximálního úseku ramus interventricularis anterior, a pokud zátěžový test současně neprokáže větší než 10% ischémii myokardu. Pokud je však zobrazena ischémie většího rozsahu než 10 % levé komory (v 17segmentovém modelu to odpovídá SDS ≥ 7 ), je doporučována revaskularizace.
Tabulka 2. Klasifikace rozsahu a závažnosti perfúzní abnormality.
| Parametr | Perfúzní abnormalita | ||
| Malá | Střední | Rozsáhlá | |
| Postižená koronární povodí | < 1/2 | 1 | 2 až 3 |
| Sumační zátěžové skóre (SSS) | 4 – 8 | 9 – 13 | > 13 |
| Rozsah postižení (% z LK) | < 10% | 10 – 20% | > 20% |
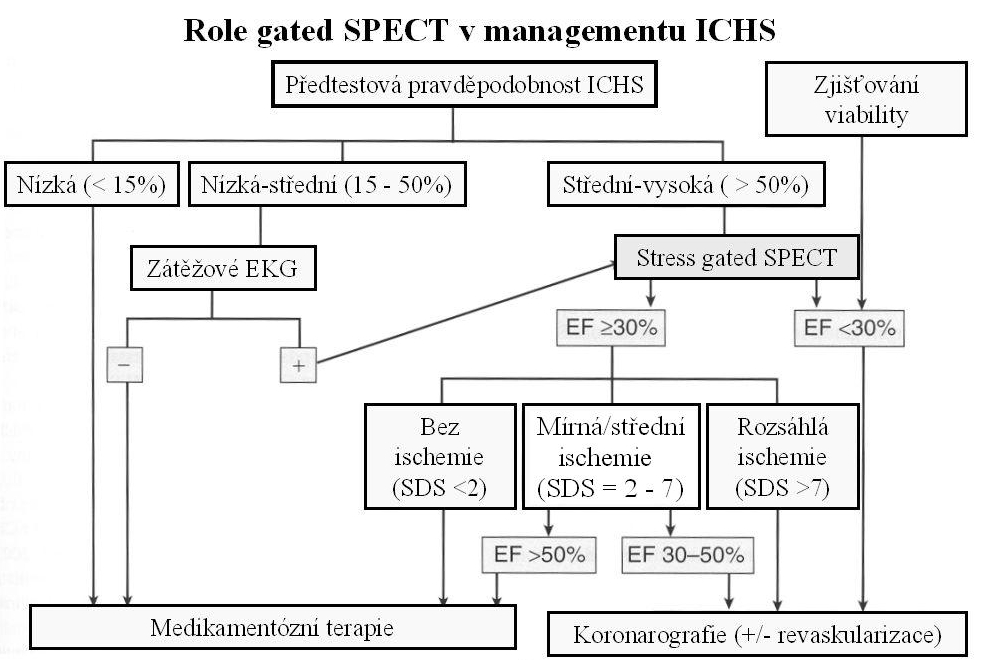
Nezávisle na perfúzních datech je horší prognóza i u pacientů, u kterých vyšetření ukáže pozátěžové omráčení levé komory (tranzientní ischemickou dilataci, pozátěžové zhoršení EF nebo regionální kinetiky apod.). Zatímco SSS informuje pouze o rozsahu a závažnosti perfúzní abnormality po zátěži (nezávisle na reverzibilitě defektu), ukazatelem rozsahu samotné ischémie je pozátěžové zhoršení perfúze, tj. SDS. A právě SDS se uplatňuje v algoritmech, které do managementu u pacientů s ICHS inkorporují perfúzní i funkční data zjištěná pomocí gated SPECT (obrázek 13).
Obr. 13 Využití perfúzních i funkčních dat zjištěných pomocí gated SPECT při rozhodování o dalším postupu u pacientů se suspektní ICHS.
Ukázka vysoce rizikového pacienta s rozsáhlou poruchou perfúze a současně i pozátěžovým omráčením levé komory je na obrázku 14 A-B.
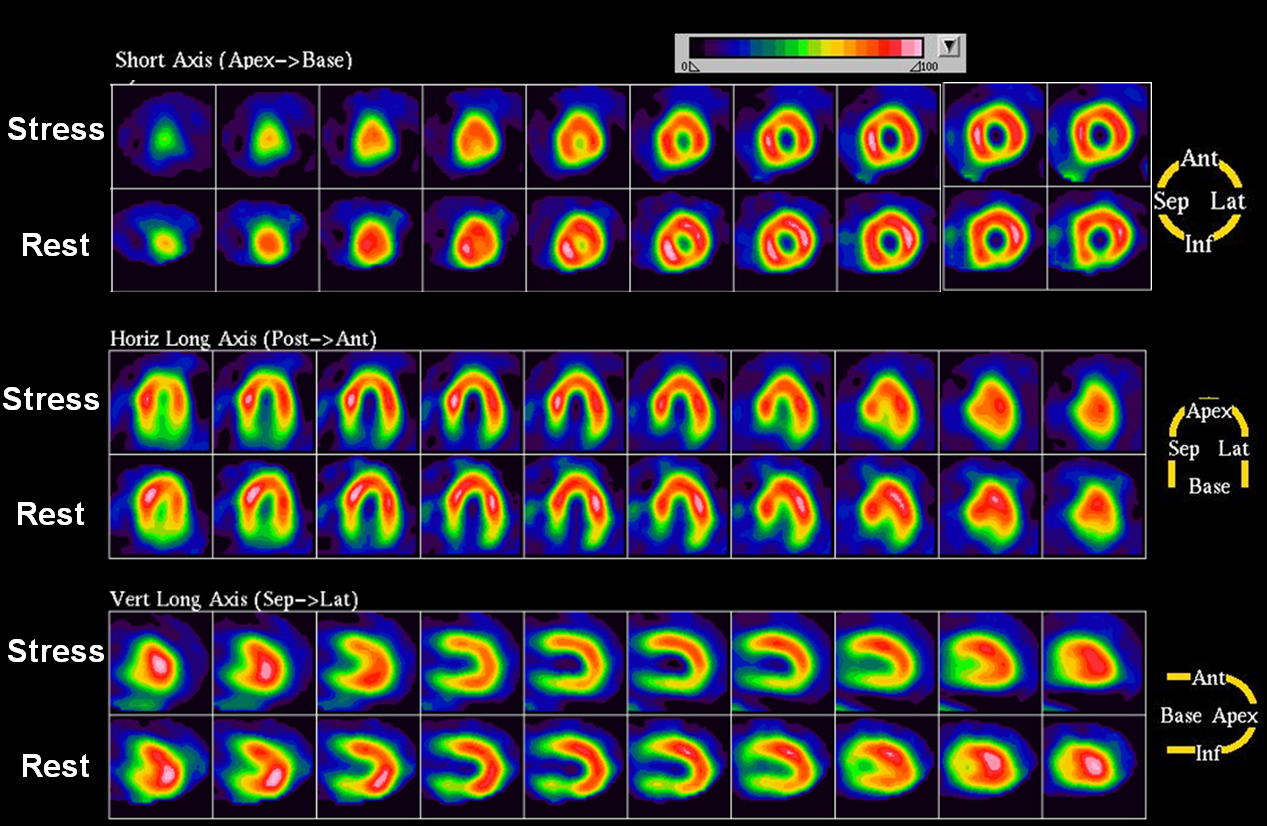
Obr. 14A Kompletní vyšetření 73letého muže, jehož pozátěžová data byla prezentována na obr. 12. Po zátěži dipyridamolem byla patrná těžká porucha perfúze anteroseptálně, apikálně a v oblasti spodní stěny (inferiorně), která se v klidu částečně upravuje. Rovněž je zřejmá pozátěžová tranzientní ischemická dilatace (TID) levé komory srdeční (TID poměr je zvýšený na 1,24). Kvantifikace svědčí pro závažnou ischémii postihující více koronárních povodí.
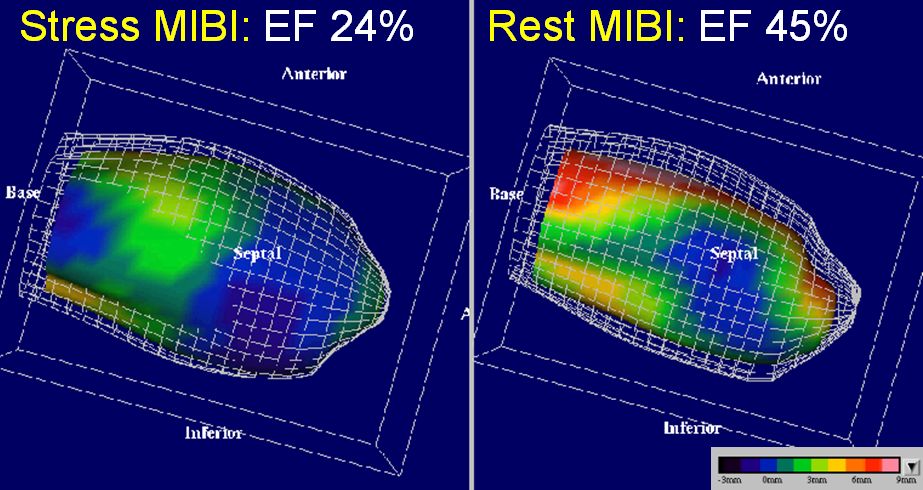
Obr. 14B Gated SPECT 3D zobrazení. Mřížka znázorňuje endokardiální povrch zafixovaný v end-diastole, barevně je kódován systolický pohyb endokardu v mm. Video systolického pohybu endokardu můžeme rovněž sledovat pomocí Animace 4. Je zobrazeno pozátěžové zhoršení kinetiky anteroseptálně a apikálně (omráčení levé komory). Pozátěžová EF byla snížena na 24 %, zatímco klidová EF byla 45 %. Koronarograficky byla prokázána nemoc tří tepen a bylo indikováno chirurgické řešení.
Jistou relativní nevýhodou perfúzního SPECT vyšetření je, že posuzuje pouze relativní perfúzi. Pouze polovina pacientů s nemocí více tepen má zobrazen defekt, který postihuje více koronárních povodí (u zbývajících pacientů je patrný perfúzní defekt odpovídající nejvíce postiženému řečišti). U asi 4 % pacientů s vybalancovanou stenózou tří tepen se dokonce perfúze může jevit jako homogenní. Naštěstí většinu z těchto vysoce rizikových pacientů jsme schopni správně identifikovat pomocí funkčních změn zjištěných technikou gated SPECT.
Další novou možností rizikové stratifikace jsou informace zjištěné pomocí CT, a to jak z hybridních SPECT/CT kamer, tak i ze dvou samostatně stojící přístrojů. Obtížné diferenciaci mezi ischemickou a neischemickou kardiomyopatií, např. u diabetických pacientů apod., může napomoci informace o koronárním kalciu. Ke koronarografii by tak např. měl být odesílán i pacient se střední předtestovou pravděpodobností, který má na zátěžovém gated SPECT vyšetření normální nález anebo pouze mírnou ischémii, ale jeho koronární kalciové skóre je významně zvýšené (> 1000). Na obrázku 15 A-C je ukázka využití tohoto postupu u diabetického pacienta s narůstající dušností. U asymptomatických pacientů pak lze pomocí kalciového skóre identifikovat jedince s časnou preklinickou aterosklerózu.
Obr. 15A 54letý diabetický pacient byl odeslán na zátěžový SPECT myokardu pro narůstající dušnost. Na tomografických řezech je vizuálně patrná jen lehká zátěží navozená porucha perfúze apikálně a inferoapikálně, nález však nebyl kvantitativně významný (sumační zátěžové i rozdílové skóre = 1).
Obr. 15B Pomocí gated SPECT je zobrazeno pozátěžové omráčení levé komory se zhoršením kinetiky v oblasti spodní stěny (inferiorně) a poklesem pozátěžová EF na 53 %, zatímco klidová EF byla 59 %.
Obr. 15C Pomocí CT jsou zobrazeny výrazné kalcifikace difúzně postihující koronární řečiště. Celkové kalciového skóre je extrémně zvýšeno na 4735. Na koronarografii bylo zjištěno postižení tří tepen a byla provedena chirurgická revaskularizace. LM – left main (kmen levé věnčité tepny), LAD – left anterior descending (ramus interventricularis anterior), LCX – left circumflex artery (ramus circumflexus), RCA – right coronary artery (arteria coronaria dextra).
Vyšetření po koronární revaskularizaci
Obzvlášť cenné je SPECT vyšetření u pacientů po revaskularizaci, tj. při podezření na restenózu po perkutánní koronární intervenci (PCI) nebo na okluzi štěpů u pacientů po by-passové operaci koronárních tepen (CABG). Může však rovněž docházet k progresi aterosklerózy v povodí, kde dosud nebyla provedena intervence. Indikováni jsou zejména pacienti s rekurencí symptomů nebo s pozitivním či nediagnostickým zátěžovým EKG. Klinický prospěch z neinvazivního zobrazovacího vyšetření mohou mít rovněž asymptomatičtí diabetičtí pacienti, stejně jako pacienti více než 5 let po CABG (zvláště mají-li venózní štěpy) a pacienti po prodělaném infarktu myokardu (zátěžová elektrokardiografie je často obtížně interpretovatelná pro klidové abnormality na EKG). Zátěžové zobrazení myokardiální perfúze je rovněž přínosné u pacientů s nekompletní revaskularizací, kdy intervence bývá často provedena pouze na nejvýznamnějších stenózách a ostatní stenózy ponechány bez dilatace. U porevaskularizačních studií je obvykle nutné zjistit, zda má pacient zátěží navozenou ischémii, ve kterém povodí je ischémie zobrazena a jaká je její závažnost, a u dysfunkčních segmentů je zapotřebí posoudit i jejich viabilitu (obrázek 16 A-B).
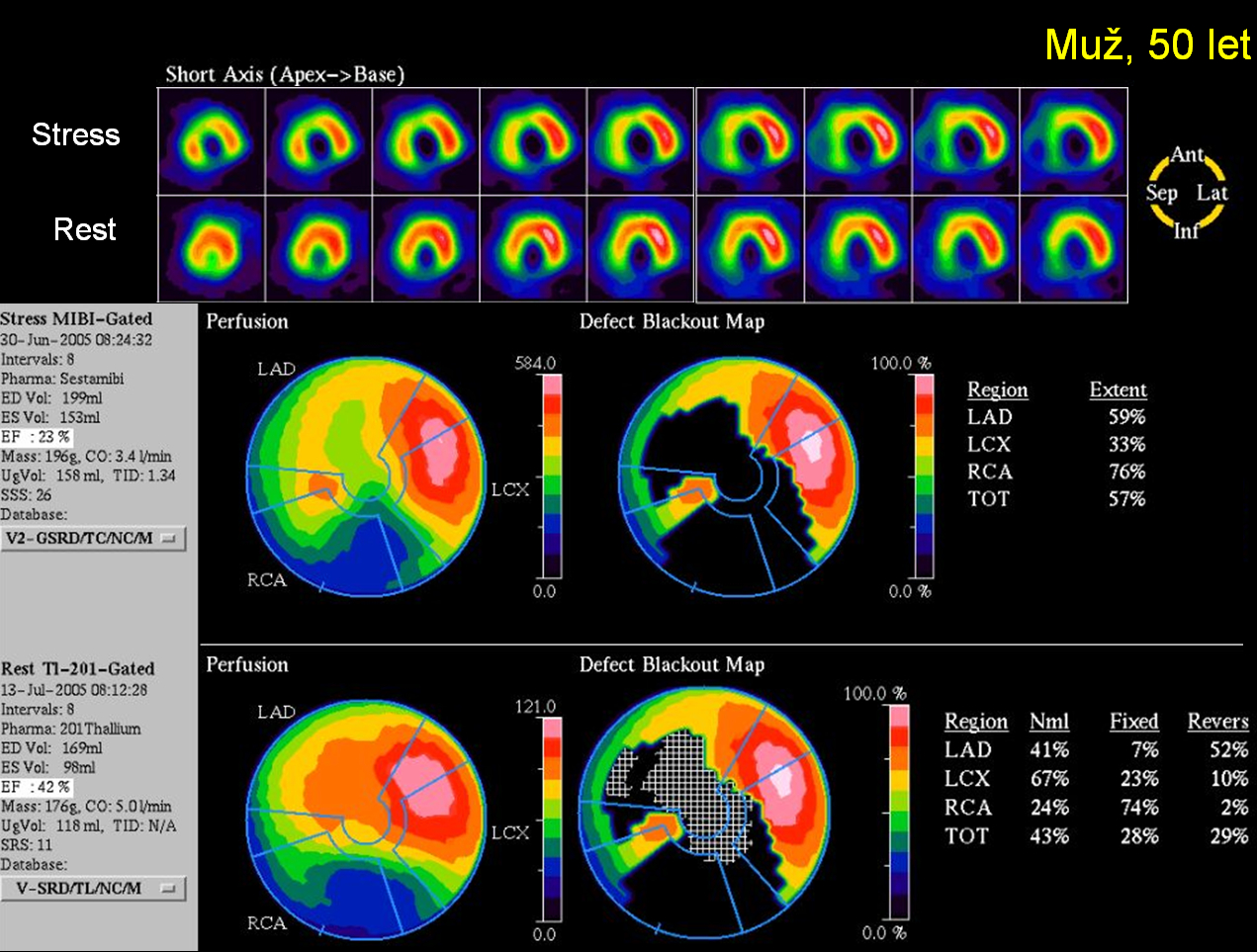
Obr. 16A 50letý muž s ICHS, po diafragmatickém infarktu myokardu řešeném přímou angioplastikou (PCI; perkutánní koronární intervence) na pravé koronární tepně (ACD). V povodí ramus interventricularis anterior (RIA) proximálně zůstala nezdilatovaná 70% stenóza. Pomocí kontrastní ventrikulografie při koronarografii byla zjištěna těžká hypokinéza posterobazálně a diafragmaticky, hodnota EF byla 46 %. Po přechodném období, kdy byl pacient bez obtíží, se u něho znovu objevil syndrom anginy pectoris, EKG bylo bez vývoje. Pacient byl odeslán na zátěžové SPECT vyšetření s dotazem, zda se jedná o restenózu po PCI na ACD nebo o projev ischémie v povodí RIA, a zda je myokard v obou povodích viabilní. Vyšetření ukázalo kombinaci reverzibilní poruchy perfúze anteroseptálně a apikálně (ischémie dominantně v povodí RIA provázená pozátěžovým omráčením levé komory) a fixní defekt v oblasti spodní stěny (inferiorně) (jizva po infarktu myokardu postihující 3/4 povodí ACD). Pacient byl odeslán k rekoronarografii, která vyloučila in-stent restenózu na ACD, a měl provedenu PCI na RIA.
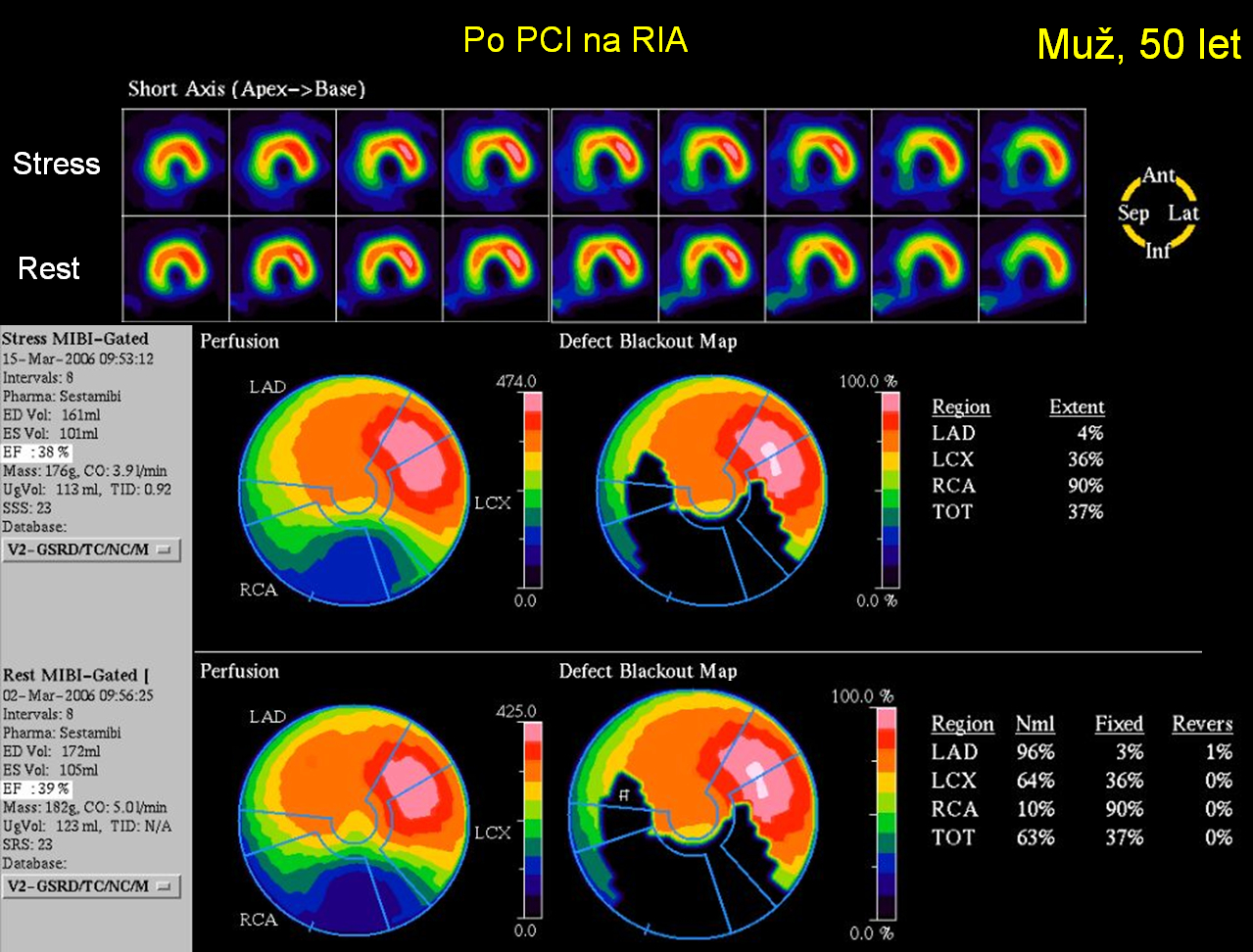
Obr 16B Tentýž pacient byl odeslán na opakovaný zátěžový test 9 měsíců po PCI provedenou na RIA pro atypickou anginu pectoris a dušnost při námaze. Byl zobrazen pouze fixní defekt v oblasti spodní stěny (inferiorně) s vychytáváním radiofarmaka < 50 % maxima odpovídající jizvě po infarktu myokardu. Jelikož nebyla prokázána zátěží navozená ischémie, další intervence již nebyla nutná.
Viabilita myokardu
Zjištění viability myokardu má klinický význam u pacientů s dysfunkcí levé komory a nízkou EF levé komory (EF pod 40 %). Signifikantně horší prognózu mají nemocní s dysfunkčním viabilním myokardem, nejsou-li revaskularizováni, než ti, kteří se podrobili revaskularizaci, nebo než nemocní s dysfunkčním neviabilním myokardem. Intervenční kardiology zpravidla zajímá nejen viabilita, ale také rozsah a závažnost ischémie v jednotlivých koronárních povodích. Proto nejcennějším testem se jeví zátěžové SPECT vyšetření, které poskytne odpověď na obě otázky. Pokud je klinický dotaz pouze na viabilitu, nebo pacient není schopen zátěže, lze provést jen klidové SPECT vyšetření. Dysfunkční segmenty s fixním defektem vychytávajícím méně než 50 % maximální aktivity perfúzního radiofarmaka odpovídají jizvě po infarktu myokardu (obrázky 10 a 17 A-C). Pokud v dysfunkčním segmentu zobrazíme zhoršenou perfúzi, ale vychytávání radiofarmaka je ještě nad hranicí 50 % maxima, hovoříme o hibernujícím myokardu (obrázek 18). Nález normální perfúze v dysfunkčním segmentu svědčí pro omráčený myokard.
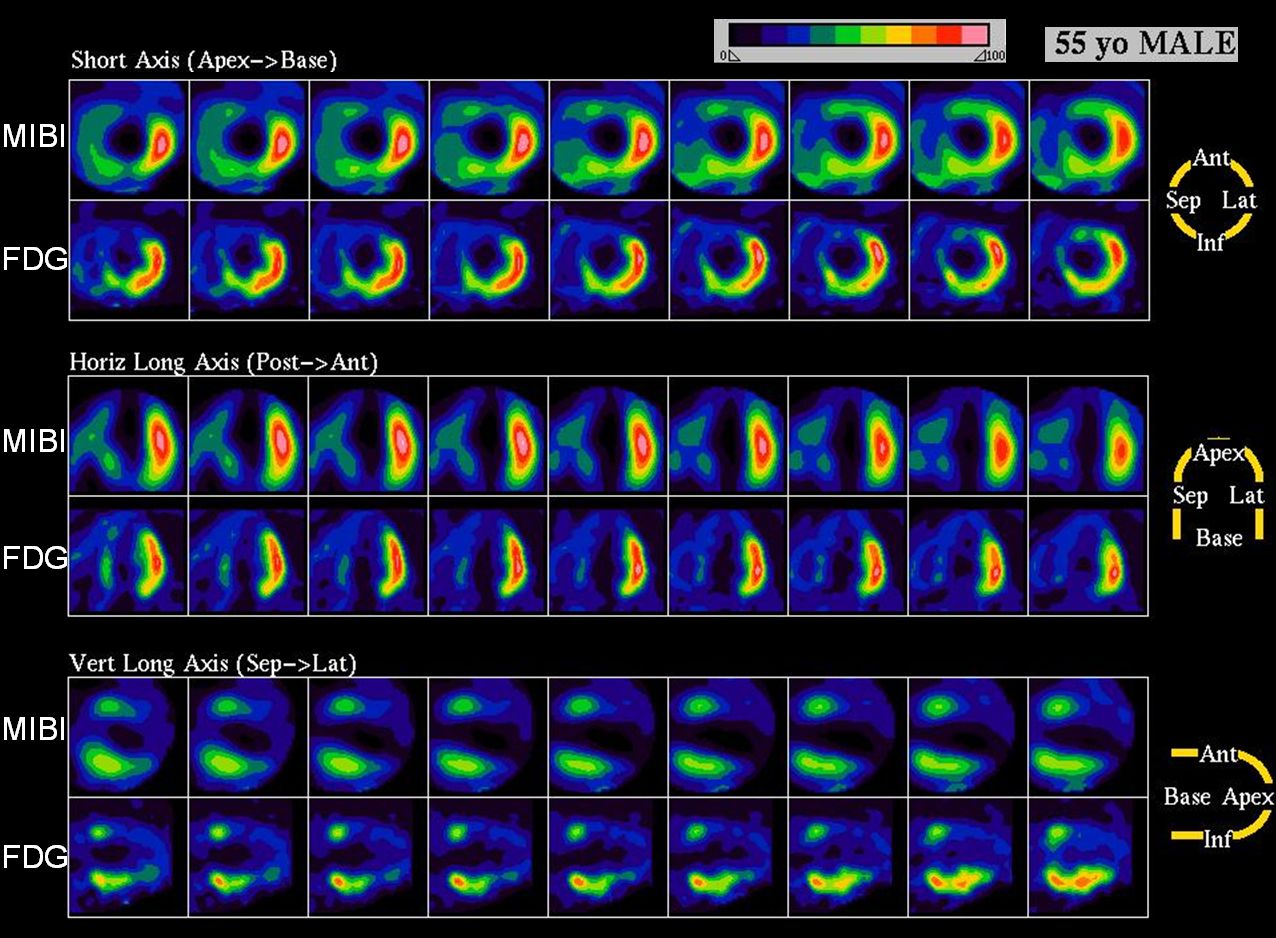
Obr. 17A 55letý muž s akutním anteroextenzivním infarktem myokardu léčeném direktivní perkutánní koronární intervencí (PCI) na ramus interventricularis anterior. Na tomografických řezech levé komory po aplikaci Tc-99-MIBI SPECT a F-18-FDG je v horizontální dlouhé ose zobrazen „perfúzně metabolický match“ svědčící pro jizvu anteriorně, anteroseptálně a apikálně.
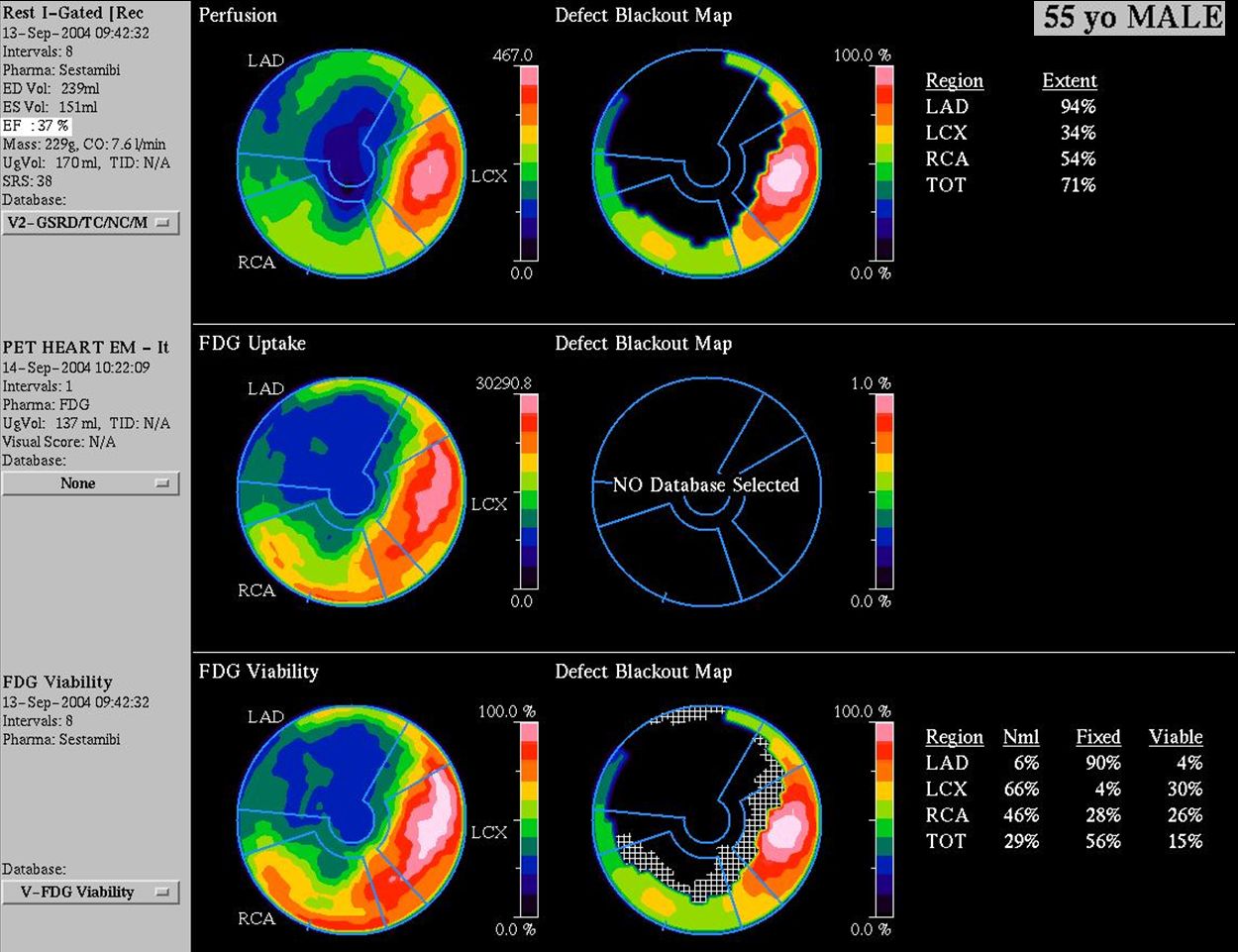
Obr. 17B Kvantifikace na polárních mapách u téhož pacienta svědčí pro rozsáhlý neviabilní myokard postihující 56 % levé komory a 90 % povodí ramus interventricularis anterior (LAD).
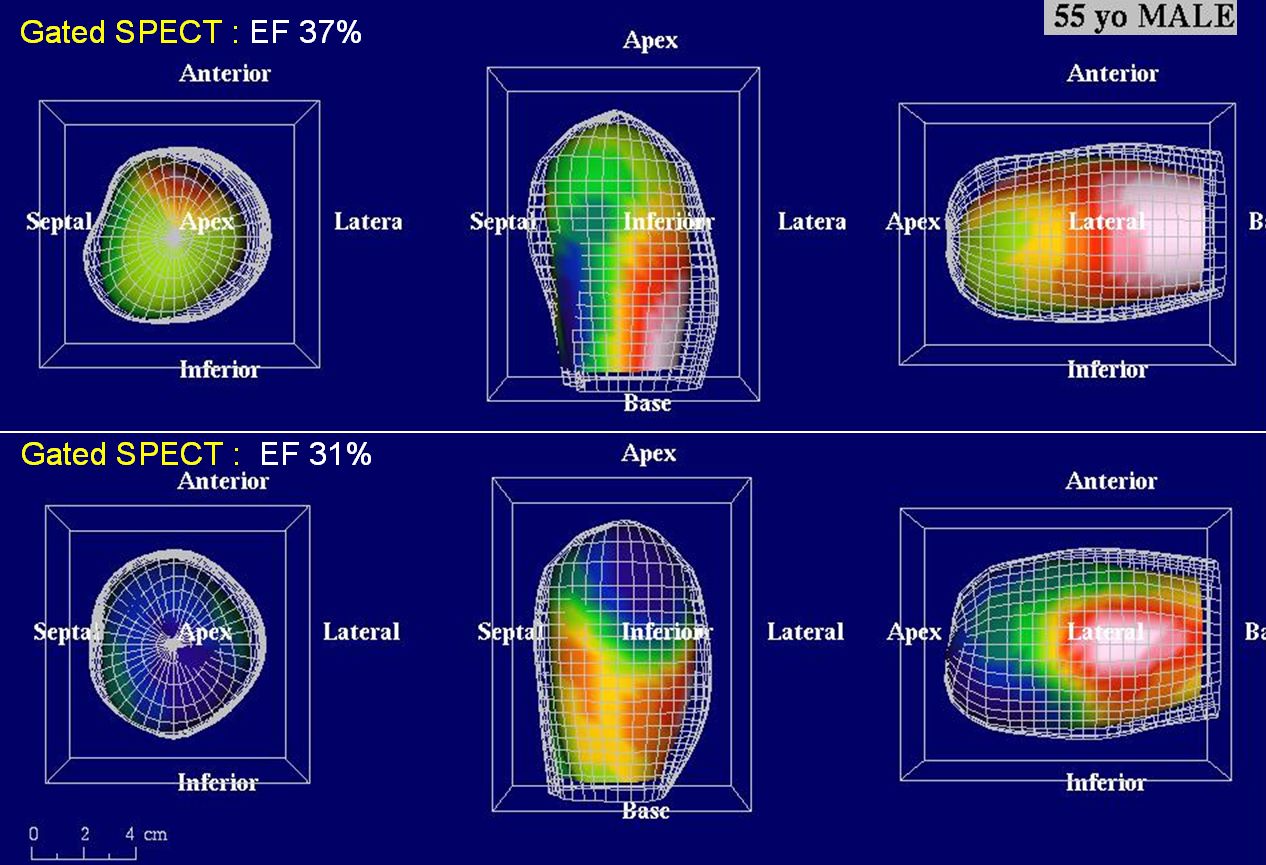
Obr. 17C Na gated SPECT bezprostředně po infarktu (horní řádek) je patrná hypokinéza přední stěny, septa a hrotu. Objemy levé komory byly výrazně zvýšené (EDV 239 ml, ESV 151 ml) a EF snížena na 37 %. Při kontrole za 3 měsíce po PCI (dolní řádek) je patrné, že regionální kinetika se nezlepšuje, naopak dochází k poinfarktové remodelaci s nárůstem objemů (EDV 299 ml, ESV 205 ml) a dalšímu snížení EF na EF 31%.
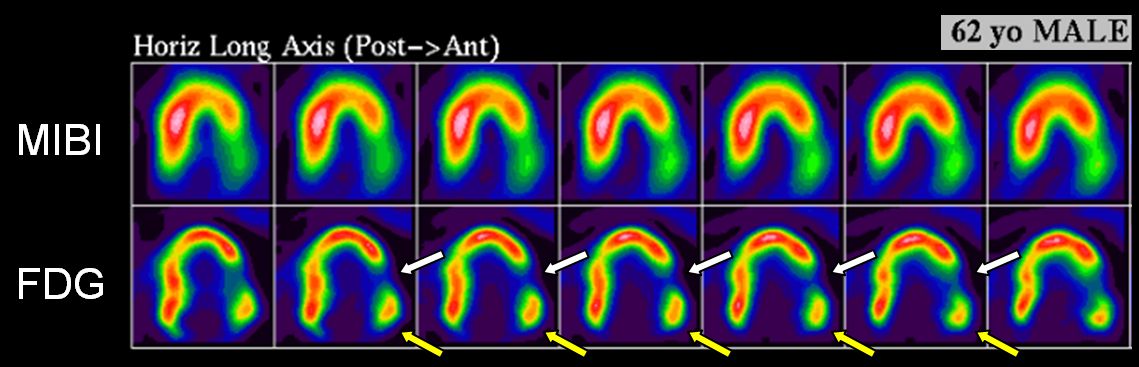
Obr. 18 62letý muž s průkazem hibernujícího myokardu v bazální partii bočné stěny (perfúzně-metabolický „mismatch“ – žluté šipky) a jen nevelkou oblastí neviabilního myokardu ve střední třetině bočné stěny (perfúzně-metabolický „match“ – bílé šipky).
Zpracoval: Milan Kamínek, Klinika nukleární medicíny LF UP a FN v Olomouci
Literatura k dalšímu studiu:
- Hesse B, Tägil K, Cuocolo A, et al. EANM/ESC procedural guidelines for myocardial perfusion imaging in nuclear cardiology. Eur J Nucl Med Mol Imaging 2005;32:855-97.
- Germano G, Berman DS. Regional and Global Ventricular Function and Volumes from Single-Photon Emission Computed Tomography Perfusion Imaging. In: Zaret BL, Beller GA. Clinical Nuclear Cardiology. Third Edition. Philadelphia, Elsevier Mosby, 2005, 189-212.
- Kamínek M, Lang O, Henzlova M. Activity of nuclear cardiology in the Czech Republic in 2000 – 2005. Eur J Nucl Med Mol Imaging 2007;34:959-960.
- Underwood SR, Wiener S. Myocardial perfusion scintigraphy in Europe 2005: A survey of the European Council on Nuclear Cardiology. Eur J Nucl Med Mol Imaging 2009;36(2):260-268.
- Mysliveček M, Kamínek M. Doporučení k provádění zátěžových testů v nukleární kardiologii. Cor Vasa 2000;42(3): K54-56.
- Lang O, Kamínek M, Trojanová H. Nukleární kardiologie. Galén, Praha, 2008.
- Flotats A, Knuuti J, Gutberlet M, et al. Hybrid cardiac imaging: SPECT/CT and PET/CT. A point position statement by the European Association of Nuclear Medicine (EANM), the European Society of Cardiac Radiology (ESCR) and the European Council of Nuclear Cardiology (ECNC). Eur J Nucl Med Mol Imaging 2011;38:201–212.
- Klocke FJ, Baird MG, Lorell BH, , et al. ACC/AHA/ASNC guidelines for the clinical use of cardiac radionuclide imaging—executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASNC Committee to Revise the 1995 Guidelines for the Clinical Use of Cardiac Radionuclide Imaging). J Am Coll Cardiol 2003;42:1318–33.
- Hachamovitch R, Rozanski A, Shaw LJ, et al. Impact of ischaemia and scar on the therapeutic benefit derived from myocardial revascularization vs. medical therapy among patients undergoing stress-rest myocardial perfusion scintigraphy. Eur Heart J 2011;32:1012–1024.
- Metelková I, Kamínek M, Sovová E, et al. Stratifikace rizika pomocí zátěžového SPECT zobrazení myokardu v kombinaci se stanovením koronárního kalciového skóre u rizikových pacientů s diabetem a/nebo ledvinným selháním. Vnitř Lék 2010;56(11):1122-29.
- Budíková M, Kamínek M, Sovová E, Kaletová M, Metelková I, Henzlová L, Buriánková E, Formánek R. Prognostický význam koronárního kalciového skóre a zátěžového zobrazení myokardu pomocí jednofotonové emisní tomografie u asymptomatických rizikových pacientů. Cor Vasa (v tisku).
- Hendel RC, Abbott BG, Bateman TM, et al. The role of radionuclide myocardial perfusion imaging for asymptomatic individuals. J Nucl Cardiol 2011;18(1):3-15.
- Wijns W, Kolh P, Danchin N, et al. Guidelines on myocardial revascularization. Eur Heart J 2010;31(20):2501-55.