Funkční anatomie jater
Jaterní lalůčky
Trámce hepatocytů jsou organizovány kolem centrální vény do šestibokých lalůčků. V každém ze šesti periferních rohů je mezi lalůčky uložena triáda struktur obsahující větve vena portae, arteria hepatica a biliární kanálky. Arteriální krev a portální krev tak vstupují do lalůčků z periferie a společně se vylévají do jaterních sinusů. Žluč naproti tomu postupuje od středu do periferie lalůčků.
Hepatocyty tvoří asi 2/3 jaterní hmoty. Mají krevní pól (bazolaterální membrána lemovaná mikroklky) a biliární pól (apikální membrána lemující žlučové kanálky). Další buněčné struktury v játrech jsou:
- Kupferovy buňky – jde o největší nahromadění fixních makrofágů v těle;
- Hvězdicové buňky (Itovy buňky) – po své aktivaci produkují matrix a vazivo;
- Endotelové buňky a buňky cévních stěn;
- Buňky žlučových kanálků a žlučových cest.
Zóny lalůčků
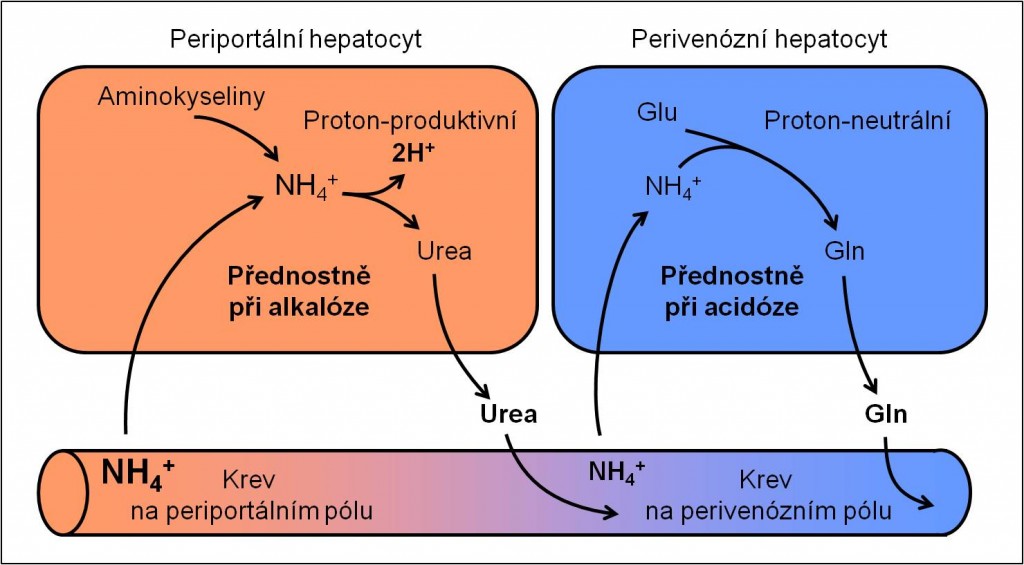
Směr proudění krve od periferie do centra lalůčků určuje, že periferní zóna každého lalůčku (zóna 1) je nejlépe zásobena kyslíkem a živinami. Kyslíku a živin ubývá ve střední zóně (zóna 2), a jsou nejnižší v centrální zóně při centrální véně (zóna 3).
Vzhledem ke svému diferencovanému zásobení se hepatocyty zóny 1 a zóny 3 významně liší jak svým enzymovým vybavením, tak fyziologickými funkcemi, které plní. Buňky v zóně 1 jsou specializovány na energeticky náročné procesy – např. glukoneogenezu, syntézu močoviny, oxidativní detoxikační procesy apod. Buňky zóny 3 přednostně obstarávají např. glykolýzu, lipogenezu, syntézu glutaminu, konjugační detoxikační reakce apod., které vyžadují daleko méně kyslíku.
Obr. 1. Rozdílné metabolické procesy v perifernbí zóně 1 (periportální hepatocyt) a centrální zóně 3 (perivenózní hepatocyt) jaterního lalůčku ilustrované syntézami močoviny a glutaminu.
Ze zonálního uspořádání také vyplývá, že buňky v zóně 3 jsou nejzranitelnější. V kritických stavech mohou být snadno poškozeny hypoxií (centrolobulární nekróza se může objevit jako korelát postižení jater při multiorgánovém selhání) anebo toxickými produkty buněk zóny 1 (produkty detoxikace škodlivin).
Regenerace jater
Jaterní buňky ochotně proliferují v případě poškození orgánu nekrózou nebo chirurgickou resekcí a jsou schopny nahradit ztracenou tkáň. Proliferaci hepatocytů však může provázet nepřiměřená proliferace vaziva. Výsledkem je náhrada masou jaterních buněk bez zachované funkční architektury, která tvoří základ jaterní fibrózy a později cirhózy.
Krevní zásobení jater
Arteriální tepna obstarává 20 % zásobení jater a přináší kyslík. Portální krev přivádí vstřebané živiny a obstarává 80 % zásobení jater.
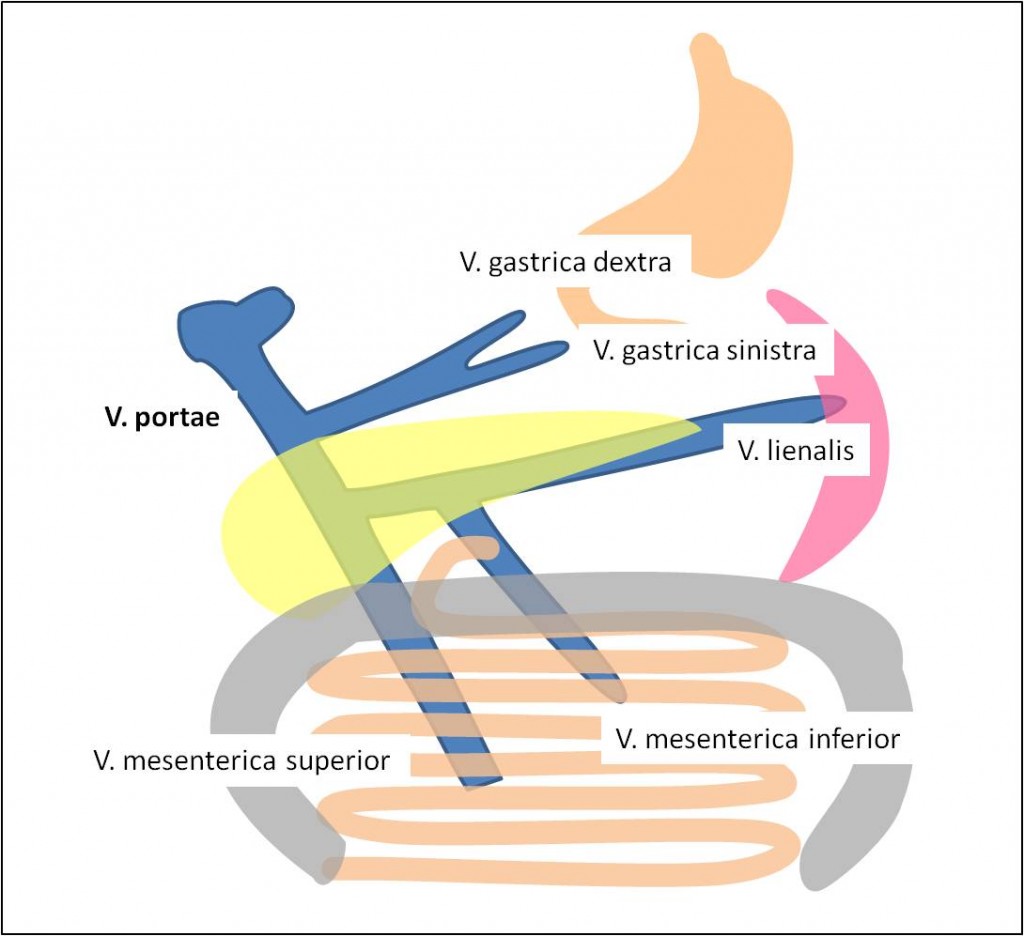
Obr. 2. Venózní zdroje v. portae.
Krev ve vena portae je venózní a má nízký hydrostatický tlak (asi 10 mm Hg). I přes nízký tlakový gradient volně prochází jaterními sinusy, protože se v nich setkává jen s nízkým odporem. Nízký odpor jaterních sinusů vyplývá ze strukturních zvláštností:
- Endotel jaterních kapilár je fenestrovaný – mezi jednotlivými endotelovými buňkami jsou volná okénka;
- Jaterní kapiláry mají atypickou, vysoce propustnou bazální membránu.
Oba tyto rysy jsou naprosto zásadní pro funkce jaterních buněk. Jaterní buňky nejen produkují velké proteinové částice do krevního oběhu, ale také přijímají částice z krve. Proteinové částice volně procházejí prostorami mezi endotelovými buňkami. Tekutina, která omývá jaterní buňky, má prakticky stejné složení jako krevní plazma. S plazmou jsou unášeny také mikroorganismy, ale ne krevní elementy. Leukocyty mohou bariéru překonat diapedézou. Střevní mikroorganismy přicházející portální krví jsou v sinusech efektivně odstraňovány Kupferovými buňkami, které tak plní důležité obranné funkce. Osoby postižené cirhózou anebo selháním jater jsou mimořádně náchylné k rozvoji sepse.
Klasifikace jaterních poruch
Jaterní poruchy a nemoci lze lépe chápat, pokud se odděleně zvažují:
- Postižení hepatocytů (toxické vlivy, infekční vlivy, zánět, hypoxie atd.), které může způsobit částečný nebo úplný výpadek vnitřních biochemických funkcí hepatocytů anebo sekrečních funkcí hepatocytů;
- Postižení žlučových cest, které se manifestuje cholestatickými poruchami;
- Postižení krevních cest, které se manifestuje portální hypertenzí a porto-kaválními venózními zkraty.
Všechna tři tato hlediska se velmi často navzájem kombinují.
Postižení hepatocytů
Intermediární metabolismus a metabolismus energie
Při postižení hepatocytů se na prvním místě věnuje pozornost jejich funkcím v intermediárním a energetickém metabolismu.
Metabolismus sacharidů
Játra dospělé osoby obsahují kolem 75 g glykogenu, tj. asi 1/3 veškerého glykogenu v těle. Zásoby glykogenu jsou určovány pravidelným denním příjmem potřebného množství sacharidů.
Játra jsou odpovědná za udržování stálé koncentrace krevní glukózy ve fyziologických mezích (3,5 – 5,6 mmol/l). Stálá koncentrace krevní glukózy se udržuje změnami produkce glukózy játry. Za hyperglykémii při diabetu je odpovědná vysoká glukoneogeneze a sekrece glukózy z jater.
Poškození jater může být provázeno hypoglykémií i hyperglykémií. Na jedné straně vázne odstraňování glukózy z krevního oběhu, a proto po jídle může dlouho přetrvávat hyperglykémie. Na druhé straně při hladovění a při zvýšené poptávce po glukóze při námaze játra nejsou schopna dodat potřebné množství do oběhu, takže může vzniknout těžká hypoglykémie.
Metabolismus lipidů a mastných kyselin
Lipidy neustále cirkulují mezi střevem, játry, tukovou tkání a ostatními periferními tkáněmi. Játra mají v metabolismu lipidů klíčovou úlohu. Přijímají mastné kyseliny a lipoproteiny, degradují anebo syntetizují lipidy a syntetizují a vydávají do oběhu lipoproteinové částice. Zatímco triacylglyceridy, fosfolipidy a cholesterol se v krevním oběhu transportují ve formě lipoproteinů, volné neesterifikované mastné kyseliny (MK) se transportují hlavně vázány na albumin. Normální poměr je 3 mol MK/1 mol albuminu, ale může být vyšší. Koncentrace volných mastných kyselin v plazmě je v klidu 0,5 – 1 mmol/l. Poločas obměny mastných kyselin v plazmě je pouhé 2 – 3 minuty. Mastné kyseliny, tedy nikoliv glukóza, jsou hlavním energetickým zdrojem pro obnovu hepatocytů.
Při hladovění, diabetu anebo hyperkatabolických stresových stavech, kdy lipolýza v tukové tkáni může být aktivována na troj- až čtyřnásobek, může být koncentrace volných mastných kyselin v plazmě až 5 – 8krát vyšší. Aktivace lipolýzy však není vždy provázena úměrným zvýšením oxidace mastných kyselin. Mohou vznikat ketolátky anebo se více než 80 % uvolněných mastných kyselin v játrech znovu reesterifikuje (normálně asi 20 – 30 %) na triacylglyceridy a rozvíjí se lipotoxicita.
Jaterní poruchy provází dyslipidémie. Pro export lipoproteinů z jater jsou vedle apolipoproteinů naprosto nezbytné fosfolipidy. Pro jejich syntézu je nepostradatelný dostatečný přísun esenciální glukoplastické aminokyseliny methioninu, který je zdrojem aktivních metylových skupin (S-adenosylmethionin; vzniká přenosem adenosylové skupiny z ATP na atom síry methioninu). Alternativními zdroji metylových skupin jsou fosfolipidy, cholin, betain anebo karnitin, které však jsou v dietě zastoupeny v menším množství. Nedostatečný přísun methioninu při podvýživě anebo u alkoholiků je významným podpůrným činitelem steatózy a jejích dalších následků (steatohepatitida, cirhóza). Příznivá je suplementace methioninu dietními a léčebnými podpůrnými doplňky.
Pokud při jaterních onemocněních vázne odtok žluči, který je kritický pro zajištění rovnováhy metabolismu cholesterolu, vzniká dyslipidémie s vysokými plazmatickými koncentracemi cholesterolu. Takovou dyslipidémii často provází tvorba podkožních xantelasmat, která bývají patrná v oblasti víček (xanthelasma palpebrarum). Při těžké cirhóze může naopak trpět vstřebávání tuků z nedostatku žluče, takže hladina cholesterolu může být nízká.
Metabolismus proteinů a aminokyselin
Játra denně syntetizují asi 30 g albuminu a 50 – 80 % všech globulinů obsažených v krevní plazmě. Albumin je hlavním udržovatelem onkotického tlaku a transportním proteinem se širokou vazebnou specifičností pro endogenní ligandy (např. ionty, mastné kyseliny, bilirubin) i exogenní ligandy (např. léčiva). Při hypalbuminémii, která může provázet postižení jater, dochází k tvorbě otoků, trpí transport ligandů a zvyšuje se účinnost jejich volných nenavázaných frakcí.
Mezi globuliny syntetizovanými v játrech zejména jsou:
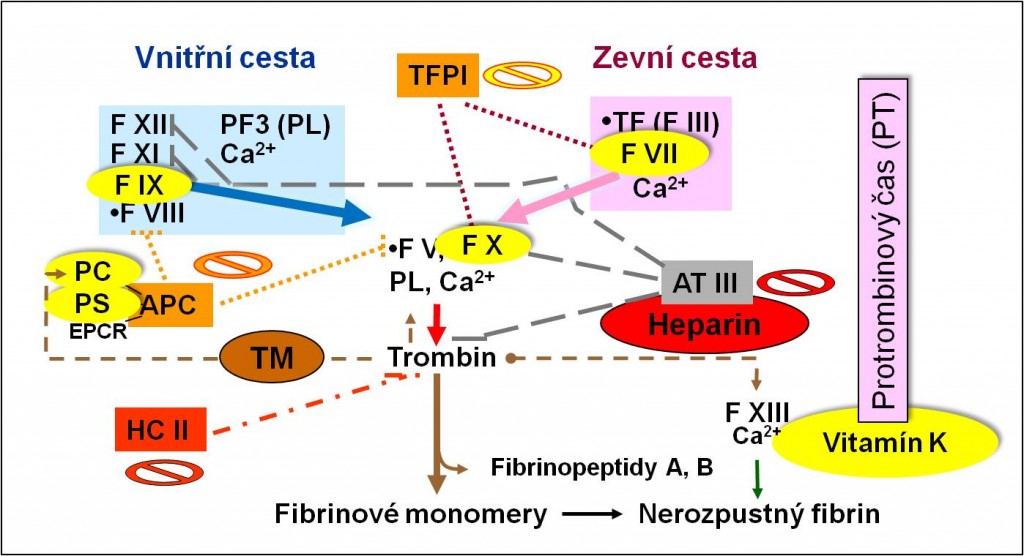
- Faktory koagulace a inhibitory koagulace:
- Při jaterních poruchách se snižují hodnoty vitamín K-dependentních i vitamín K-independentních složek. Některé z nich, které mají poločas obratu jen několik hodin, klesají velmi rychle. Vstřebávání vitamínu K navíc bývá narušeno nedostatkem solí žlučových kyselin. Vývoj krvácivé koagulopatie, která je refrakterní k podávání vitamínu K, se považuje za známku vysoce pokročilého poškození jater. Výpadek účasti jater při odstraňování aktivovaných koagulačních faktorů a degradačních produktů fibrinu se podílí i na vysokém riziku vzniku diseminované intravaskulární koagulopatie.
- Transportní proteiny, zejména:
- Apolipoproteiny:
- Postižení jater vede k dyslipidémii.
- Proteiny vázající a transportující hormony:
- Při postižení jater koncentrace těchto proteinů klesají, takže se zvyšují volné frakce, a tím i účinnost hormonů.
- Transportní proteiny pro vazbu a transport vitamínů a iontů (vitamín A, vitamín D, Fe2+, Cu2+ atd.). při postižení jater trpí metabolismus těchto iontů.
- Apolipoproteiny:
Obr. 3. Vitamín K-dependentní a -independentní složky koagulační kaskády.
Plazmatické aminokyseliny
Játra jsou odpovědná za udržování stálé koncentrace aminokyselin v krevní plazmě a zároveň za poměrné zastoupení jednotlivých aminokyselin v plazmě. Játra zřejmě dokážou nejrychleji ze všech tkání nejen syntetizovat, ale i degradovat tzv. labilní proteiny, a vrátit aminokyseliny do oběhu a udržovat jejich stálou koncentraci. Normální koncentrace volných aminokyselin v cirkulaci je asi 3 – 5 mmol/l. To je průměrně 150 – 250 μmol/l pro jednu aminokyselinu, ale aminokyseliny nejsou ve spektru zastoupeny rovnoměrně. Nejhojnější aminokyselinou v plazmě a v tělních tekutinách je glutamin. Játra dokážou dobře upravit i plazmatické spektrum aminokyselin mobilizovaných ze tkání kriticky nemocných při hyperkatabolismu, kdy jsou koncentrace aminokyselin v plazmě až 3x vyšší, ale jejich spektrum se nemění. Mobilizací aminokyselin však za podobných stavů výrazně trpí tkáně. Intracelulární koncentrace glutaminu ve vláknech kosterních svalů např. v kritických metabolických stavech klesá na 1/4 – 1/10 normálních hodnot, a proto je glutamin nutno substituovat terapeuticky.
Glutamin má významné trofické (anabolické) účinky. Je substrátem pro glukoneogenezu a stimuluje syntézu glykogenu v játrech. Je donorem dusíku pro syntézu purinů, pyrimidinů a aminosacharidů. Je nepostradatelný pro imunitní funkce. Významně se účastní regulace acidobazické rovnováhy. Podílí se na detoxikaci dusíku.
Další důležitou veličinou je poměr větvených plazmatických aminokyselin k aromatickým aminokyselinám. Větvené plazmatické aminokyseliny jsou v játrech zdrojem ketolátek pro ostatní orgány. Jsou také významně metabolizovány svaly a jinými tkáněmi. Normálně je poměr větvených plazmatických aminokyselin k aromatickým mezi 1,4 – 2,0. Při selhání jater hodnota tohoto poměru klesá; poměr menší než 1,0 je vždy spojen s jaterní encefalopatií, která provází tvorbu falešných mediátorů.
Syntéza močoviny
S metabolismem proteinů a aminokyselin úzce souvisí detoxikace amoniaku pocházejícího z deaminace aminokyselin. Během jednoho dne se ve tkáních dospělé osoby obmění celkem asi 400 g proteinů. Tento obrat proteinů poskytne asi 9 – 12 g dusíku ve formě amoniaku. Játra mění toxický amoniak na močovinu, která se vyloučí hlavně močí. Lze připomenout význam těchto údajů pro výživu. Uvedených 9 – 12 g N odpovídá asi 56 – 75 g oxidovaných tkáňových aminokyselin (proteinů), které je třeba dodat v dietě. Při vyrovnané dusíkové bilanci se asi 90 % přijatého N vylučuje do moče ve formě močoviny, kyseliny močové, kreatininu a případně NH4Cl. Zbytek, asi 10 % N, se vylučuje střevem. Pro zjištění množství (g) proteinů odbouraných v těle za 24 hodin měříme denní ztráty N močí (v g), násobíme 1,1 (10 % ztrát stolicí) a dále násobíme 6,25 (g aminokyselin odpovídající 1 g N). Malá frakce vyloučeného dusíku pochází z glutaminu; vylučuje se jako NH4Cl a její velikost roste při acidóze.
Váznoucí syntéza močoviny při postižení jater má za následek hromadění toxického amoniaku v krvi. Amoniak přestupuje krevně-mozkovou bariérou do centrálního nervového systému. Má inhibiční účinky na činnost neuronů, které se sčítají s účinky falešných mediátorů. Obě složky, amoniak a falešné mediátory, jsou spoluodpovědné za rozvoj jaterní encefalopatie. Jaterní encefalopatií se manifestuje nejtěžší anebo terminální postižení jater.
Detoxikační funkce a inaktivace hormonů
Oddělování detoxikačních funkcí jater od metabolických je stejně tak umělé jako oddělování obou těchto funkcí od funkcí sekrečních. Je však jednoznačně ospravedlněno lepším pochopením patologických pochodů, jejich diagnózy a terapie.
V játrech dochází k detoxikaci (inaktivaci) množství jak endogenních látek (amoniaku, bilirubinu, hormonů atd.), tak exogenních látek (složky potravy, léčiva atd.). Detoxikační reakce vyžadující zvýšený přísun kyslíku – tzv. detoxikační reakce fáze I – probíhají v zóně 1 jaterních lalůčků, zatímco detoxikační reakce fáze II, reprezentované konjugačními reakcemi, jsou hlavně situovány v hepatocytech zóny 3 jaterních lalůčků. Do jisté míry je paradoxní, že metabolickou modifikací původně málo účinné sloučeniny často ve fázi I vzniknou mnohem reaktivnější, a proto i toxičtější produkty nebo meziprodukty. V detoxikační fázi I i II jsou často různé sloučeniny metabolizovány jedním a tímtéž enzymovým systémem. Tím dochází k četným interakcím mezi zpracovávanými sloučeninami včetně léčiv. Terapeuti i pacienti musí těmto interakcím věnovat náležitou pozornost.
Důležitým metabolitem, který játra v rámci svých detoxikační a sekrečních činností vydávají do krevní plazmy i pro účely jiných tkání, je tripeptid glutathion (γ-glutamylcysteinylglycin). Je nepostradatelnou složkou ochrany proti oxidačnímu stresu. Vedle toho funguje jako dodavatel metabolicky důležitých γ-glutamylových skupin.
Inaktivace hormonů
Volné frakce hormonů kolujících v krvi, nevázané na proteinové nosiče, vstupují do hepatocytů, odkud jsou hormony po oxidačních a konjugačních úpravách vyloučeny do žluče. Část z nich podléhá enterohepatické cirkulaci. Při poruchách hepatocytů anebo při obcházení jater krví proudící portokaválními anastomózami vázne jak odstraňování původních hormonů, tak jejich modifikované cirkulující enterohepatální frakce. Za takových okolnostní např. je zhoršeno odstraňování aldosteronu a ADH. Oba hormony pak přispívají k tvorbě otoků, které provázejí jaterní selhání při cirhóze. Narůstá podíl metabolických přeměn hormonů v periferních tkáních. Androgeny se ve zvýšené míře přeměňují na estrogeny, což vede k feminizaci mužských pacientů.
Imunologické funkce
Kupferovy buňky v játrech odpovídají za očištění portální krve od bakterií a antigenů, které do krve pronikly střevní bariérou. Krev odchází z jater do duté žíly a dále do systémového oběhu sterilní. Makrofágy plní i další funkce, jako např.odstraňování poškozených krevních proteinů nebo strukturních fragmentů vzniklých degradací buněk. Kupferovy buňky jsou pro tyto činnosti vybaveny řadou povrchových receptorů, např. receptorem rozpoznávajícím specifické sekvence sacharidových komponent glykoproteinů, receptorem Fc znaku protilátek, receptorem pro C3 komponentu komplementu aj. Proto poškození jater, a zejména přítomnost portokaválních anastomóz, jimiž krev játra obchází, vystavuje pacienty mimořádně vysokému riziku vzniku sepse. V takových případech se naplňuje pravidlo, podle něhož „střevo je hnacím motorem sepse“.
Nejen Kupferovy buňky, ale i samotné hepatocyty mají na svém povrchu plejádu receptorů, jimiž významně zasahují jak do metabolismu, tak do koloběhu plazmatických proteinů. Lze např. připomenout receptory pro inzulín, glukagon, nervové mediátory, pro lipoproteiny atd. Mají receptor schopný rozpoznat modifikované sekvence sacharidových komponent glykoproteinů a použít ho k odstranění glykoproteinů z cirkulace. Dokážou odstraňovat aktivované složky krevní koagulační kaskády. Pokud tato schopnost utrpí, zvyšuje se riziko vzniku diseminované intravaskulární koagulopatie (DIC).
Vodní a iontová rovnováha
Normální činnost jater je naprosto nezbytným předpokladem pro normální vodní a iontovou homeostázu. Játra syntetizují krevní proteiny, na jejichž koncentraci závisí onkotický tlak, a tím objem krevní plazmy. Pokud se udržuje normální koncentrace plazmatických proteinů a pokud je zachována integrita cirkulace, objem plazmy věrně kopíruje objem ostatních extracelulárních tekutin. Objemem plazmy zase je dlouhodobě určen střední plnicí tlak v cirkulaci, žilní návrat, a tím srdeční výdej a systémový arteriální tlak. Arteriální tlak je kritickou determinantou tlakové diurézy, odpovědné za dlouhodobou bilanci iontů a tekutin v těle. To vše závisí na normální činnosti jater.
Při závažném jaterním postižení se snižují koncentrace plazmatických proteinů. Při snížených koncentracích krevních proteinů není možné upravit na normální výši ani koncentraci plazmatických iontů, ani objem intravaskulární tekutiny. Následně se aktivují kompenzační mechanismy. Dochází k retenci sodných iontů, ale tekutina se hromadí převážně extravaskulárně a způsobuje rozsáhlé otoky. Porucha jater sekundárně alteruje krevní zásobení ledvin. Pravidlem při postižení jater proto bývá hyponatrémie, hypokalémie a metabolická alkalóza následkem zvýšených hladin angiotenzinu, aldosteronu, antidiuretického hormonu a sympatického autonomního systému. Krajním stavem je hepatorenální selhání (hepatorenální syndrom).
Sekreční funkce jater a postižení žlučových cest
Sekreční funkce jater jsou mnohočetné. Sekrece glukózy, mastných kyselin, lipidů, aminokyselin, proteinů, močoviny anebo glutathionu, zmíněné výše, představují jen zlomek sekrečních funkcí, které se odehrávají na bazolaterálních membránách krevního pólu hepatocytů. V klinice se jako poruchy jaterní sekrece označují patologické změny sekrece žluče. Sekrece žluče probíhá apikálními membránami na biliárním pólu hepatocytů. Snížení až zástava sekrece žluče z jater do střeva se nazývá cholestáza. V popředí symptomů cholestázy jsou hyperbilirubinémie, poruchy vylučování žlučových kyselin a poruchy vylučování cholesterolu. Ostatní funkce hepatocytů často zůstávají zachovány.
Cholestáza může být způsobena:
- Defektem syntézy žlučových komponent v hepatocytech:
- Příkladem jsou poruchy konjugace bilirubinu spojené s nekonjugovanou hyperbilirubinémií. Někdy toto postižení může být selektivní, např. při blokádě některými léčivy.
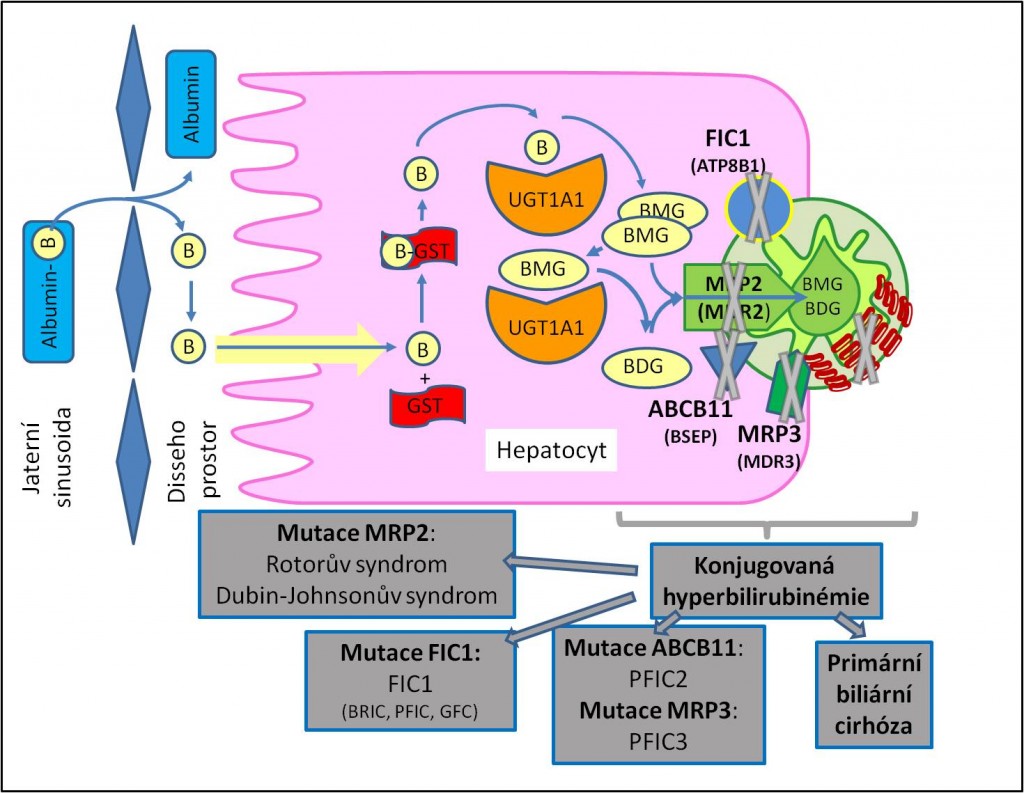
- Defektem transportu žlučových komponent apikální membránou hepatocytů a poškozením jemných intrahepatálních žlučovodů:
- Příkladem jsou poruchy transportu bilirubinu a léčiv při defektech přenašečů nadrodiny ABC proteinů MRP neboli MDR (multidrug resistance-associated proteins) spojených s konjugovanou hyperbilirubinémií). Dalšími příklady jsou familiální intrahepatické cholestázy spojené s poškozením jemných žlučových kanálků.
- Jiným příkladem poškození intrahepatálních žlučovodů je tzv. primární biliární cirhóza, kdy se žlučové cesty stávají objektem nehnisavé autoimunitní reakce. Primárně je napadán epitel lemující jemné žlučovody, takže morfologické změny začínají v portálních a periportálních polích. Až v 90 % jsou postiženy ženy. Progrese do cirhózy není tak častá, jak se dříve myslelo. Mnozí autoři proto soudí, že název nevystihuje povahu onemocnění.
- Obstrukcí extrahepatických žlučových cest:
- Příkladem jsou obstrukce žlučovými kameny.
Obr. 4. Přehled vybraných forem konjugované hyperbilirubinémie. B, bilirubin; BDG, bilirubindiglukuronid; BMG, bilirubin monoglukuronid; FIC1 (ATP8B1), protein familiární intrahepatické cholestázy – ATP-dependentní aminofosfolipidová translokáza – familiární intrahepatická cholestáza 1; ABCB11 (BSEP), bile salt export protein; GST, glutathion-S-transferáza; MRP2 (MDR2), multidrug resistance-associated protein 2; MRP3 (MDR3), multidrug resistance-associated protein 3; PFIC2, progresivní familiární intrahepatická cholestáza 2; PFIC3, progresívní familiární intrahepatická cholestáza 3; UGT, uridindifosfátglukuronyltransferáza. Podrobné vysvětlení je podáno v kapitole Patofyziologie metabolismu bilirubinu.
Poruchy sekrece žlučových kyselin a cholesterolu
Cholesterol se vylučuje žlučí hlavně ve formě žlučových kyselin. Žlučové kyseliny podléhají enterohepatálnímu oběhu. Žlučové kyseliny obsažené ve žluči jsou zčásti vytvořeny nově, zčásti jde o recyklované žlučové kyseliny. Zastoupení recyklovaných žlučových kyselin je důležité pro dosažení normální koncentrace žlučových kyselin ve žluči. Játra dokážou kompenzovat jen částečný výpadek enterohepatálního oběhu žlučových solí. Při cholestáze vázne vylučování žlučových kyselin do střeva. Vzestup jejich koncentrace v plazmě vede k jejich ukládání v kůži, kde způsobují intenzívní svědění (pruritus). Nedostatečné množství žlučových kyselin ve střevě má za následek maldigesci a malabsorpci lipidů s jejich průvodními komplikacemi (steatorhea, deficit vitaminů).
Hydrofobní volný cholesterol a jeho estery mohou být ve žluči přítomny pouze v micelách tvořených žlučovými kyselinami a fosfolipidy. K rozpustnosti žluče ve žlučových cestách dale přispívají četné ochranné faktory (glykoproteiny, hořečnaté ionty aj.). Vzestup koncentrací cholesterolu v plazmě je dyslipidémií spojenou s ukládáním cholesterolu v podkožních ložiscích (xantelasmata). Porucha viskozity žluče je spojena s tvorbou žlučových kamenů.
Poruchy krevních cest v játrech
Do jater přichází portální vénou za minutu asi 1500 ml krve ze žaludku, tenkého a tlustého střeva a sleziny (obr. 2) při nízkém hydrostatickém tlaku (5 – 10 mm Hg).
Proud v portální žíle se vzhledem k nízkému tlaku zpomaluje při každém zvýšení odporu, na který krev na své cestě játry do dolní duté žíly narazí. Potom ve vena portae vzniká portální hypertenze (> 12 mm Hg). Vena portae je za primární kapilární sítí, takže portální hypertenze se přímo nedotýká tlaku v systémové cirkulaci.
Tabulka: Přehled hlavních příčin portální hypertenze
| Přehled hlavních příčin portální hypertenze | ||
| Zvýšený cévní odpor | Prehepatické příčiny | Trombóza portální vény nebo jejích přítoků |
| Utlačení žíly vnějším útvarem (např. nádorem) | ||
| Hepatické příčiny | Jaterní fibróza anebo cirhóza | |
| Infekce, napadení parazity | ||
| Posthepatické příčiny | Omezení průchodnosti, např. trombóza žil vedoucích z jater (Budd-Chiariho syndrom) | |
| Chronické selhání pravého srdce | ||
| Konstriktivní perikarditida | ||
| Zvýšený průtok krve portálním řečištěm | Arterio-portální zkraty | |
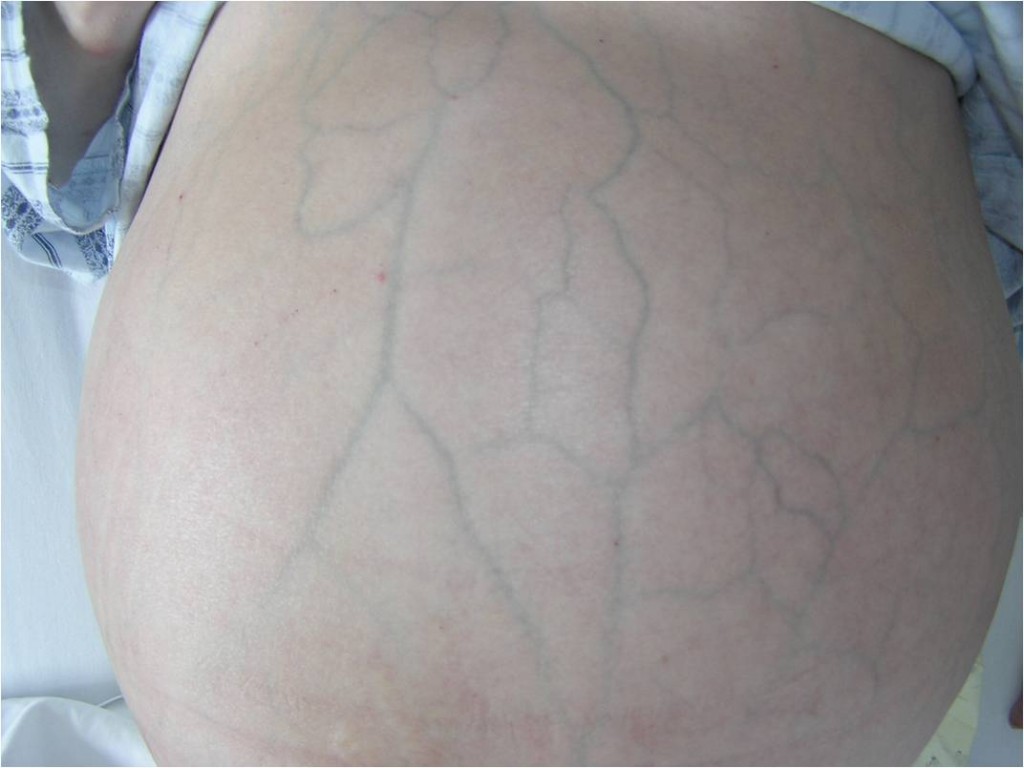
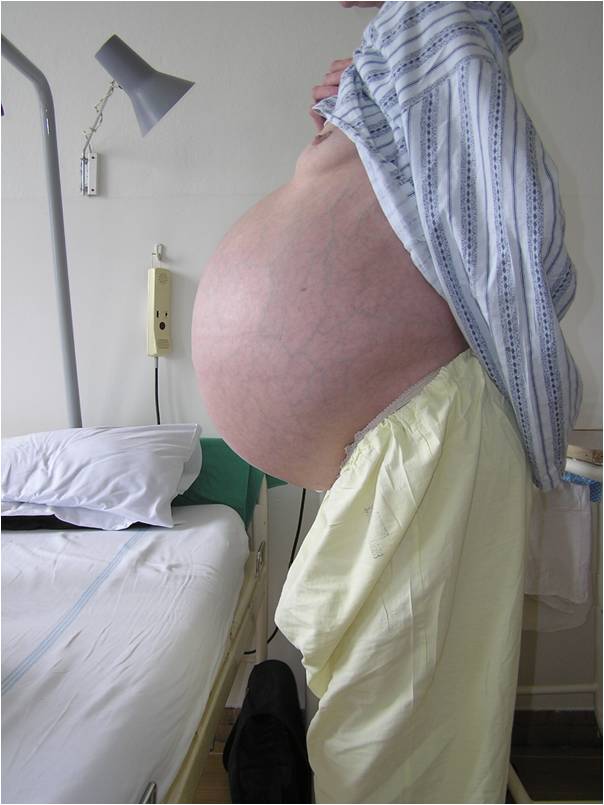
Porušené proudění krve játry a portální hypertenze ve velké míře určují symptomatologii finálního postižení jater a jaterní cirhózy. Samy o sobě dokonce přinášejí těžké komplikace také v případě, že se objeví i bez průvodního jaterního onemocnění. Vyvolávají jaterní hypoxii, která sama může vést až k zániku buněk (centrilobulární nekróza) a rozvoji fibrózy a cirhózy. To ovšem může nastat i naprosto nezávisle na portální hypertenzi, např. při hypoperfúzi a hypoxii jater při selhání oběhu. Další komplikací portální hypertenze ale je, že zvýšení tlaku v portálním řečišti vede k otvírání portokaválních anastomóz. Krev jimi jako výraznými portosystémovými zkraty obchází játra a vlévá se přímo do velkého oběhu. Rozšířené anastomózy vytvářejí v predilekčních místech varixy (caput medusae, jícnové varixy, rektální varixy). Taková situace má závažné průvodní následky:
- Výrazné oslabení, pokud ne vyřazení, metabolických regulačních funkcí jater;
- Výrazné oslabení, pokud ne vyřazení, filtračních imunologických funkcí jater;
- Dopady na krevní zásobení a funkce ledvin a na vodní a iontové hospodářství;
- Vysoké riziko krvácení z varixů účastnících se tvorby anastomóz, zejména krvácení z jícnových varixů.
Obr. 5. Caput medusae.
Portální hypertenze a portokavální anastomózy se tak výrazně podílejí na následujících průvodních klinických komplikacích těžkých jaterních onemocnění:
- Splenomegalie a hypersplenismus;
- Ascites - zvyšuje riziko bakteriální peritonitidy;
- Malabsorpce:
- Při portální hypertenzi vázne vstřebávání ze střeva;
- Vázne trávení a vstřebávání tuků a vitamínů pro nedostatek žlučových kyselin (nefungující enterohepatální oběh).
- Koagulopatie - nejen krvácivé projevy, ale může se rozvinout i DIC;
- Gastrointestinální krvácení z varixů;
- Jaterní encefalopatie;
- Hepatorenální syndrom.
Jaterní encefalopatie
Charakteristika
Jaterní neboli portosystémová encefalopatie je komplexní neuropsychiatrický syndrom. Má následující klinické známky:
- Změny osobnosti, poruchy chování, poruchy vědomí;
- Proměnlivé neurologické příznaky;
- Charakteristický třes označovaný jako asterixis neboli „flapping tremor“;
- Výrazné změny elektroencefalogramu.
Jaterní encefalopatie může být akutní a přechodná nebo chronická a postupně se zhoršující. Musí dojít k zániku funkcí 90 % hepatocytů, aby došlo k manifestaci selhání jater. Součástí encefalopatie, která vzniká u pacientů s akutním poškozením jater, je edém mozku. Edém mozku překvapivě neprovází encefalopatii pacientů s jaterní cirhózou. Finálními stádii jaterní encefalopatie jsou jaterní koma a smrt.
Patogeneze jaterní encefalopatie
Jaterní encefalopatie se rozvíjí na podkladě rozsáhlého poškození hepatocytů anebo na podkladě rozsáhlých portokaválních zkratů, kdy portální venózní krev míjí játra a dostává se přímo do systémového oběhu. Encefalopatie je výsledkem porušení rovnováhy mezi excitačními a inhibičními okruhy v centrálním nervovém systému. Rovnováha je vychýlena ve prospěch inhibice (koma).
Hlavními neurotoxickými složkami, kolujícími v krvi při jaterním selhání, jsou:
- Amoniak.
- Vzniká jako produkt oxidativní deaminace aminokyselin jak ve tkáních tělu vlastních, tak činností bakterií ve střevě.
- Krvácení do střeva a zvýšená tvorba amoniaku střevními bakteriemi může být vyvolávajícím momentem akutní portosystémové encefalopatie.
- Amoniak prochází krevně-mozkovou bariérou a přímo působí na synaptické receptory inhibičního neurotransmiteru kyseliny γ-aminomáselné (GABA), takže imituje jeho tlumivé účinky.
- Přestup amoniaku z krve do mozkomíšní tekutiny podporuje alkalóza, protože amoniak (NH4+) při alkalóze ztrácí proton a jako NH3 lépe prostupuje lipidy krevně-mozkové bariéry.
- Amoniak se také může ve zvýšené míře reabsorbovat z ledvin, kde jeho syntéza roste při hypokalémii. Hypokalémie s průvodní alkalózou bývá častým následkem hyperaldosteronismu při hypoproteinémii a ascitu, nebo může být způsobena diuretiky. Hypokalémie se rychle vyvíjí po punkci ascitu. Hypokalémie může být vyvolávajícím momentem portosystémové encefalopatie.
- Vzniká jako produkt oxidativní deaminace aminokyselin jak ve tkáních tělu vlastních, tak činností bakterií ve střevě.
- Relativní nadbytek aromatických aminokyselin v krevní plazmě v poměru k aminokyselinám s větveným řetězcem, kterých je nedostatek. Příčinou je selhání homeostatické funkce jater. Normálně je poměr větvených plazmatických aminokyselin k aromatickým mezi 1,4 – 2,0. Při selhání jater hodnota tohoto poměru klesá a poměr menší než 1,0 je vždy spojen s jaterní encefalopatií. Větvené a aromatické aminokyseliny spolu soutěží o jeden a týž transportní systém, který zprostředkovává jejich přestup přes krevně-mozkovou bariéru. Nedostatek větvených aminokyselin usnadňuje vstup aromatickým aminokyselinám. Aromatické aminokyseliny jsou prekurzory mozkových katecholaminů. Nadměrná nabídka aromatických aminokyselin se však v CNS zpracovává náhradními cestami, při nichž vznikají tzv. falešné mediátory (fenyletanolamin, oktopamin). Podobně jako amoniak, GABA a glutamin mají i falešné mediátory převážně inhibiční účinky na neurony.
- Nadbytek glutaminu, který vzniká jako náhradní produkt detoxikace amoniaku namísto močoviny;
- Kyselina aminomáselná (GABA) v krevní plazmě pravděpodobně pochází ze střeva anebo jde o GABA z CNS, která se nedostatečně inaktivuje v játrech.
- Thiolové sloučeniny (merkaptany) vznikající činností střevní mikroflóry degradací aminokyselin obsahujících síru;
- Fenoly, které produkují střevní bakterie.
- Mastné kyseliny s krátkým řetězcem, které syntetizují bakterie v tlustém střevě z nestrávených zbytků sacharidů.
Na základě výše uvedeného lze shrnout faktory, které zvyšují riziko jaterní encefalopatie při těžkém postižení jater anebo portálního oběhu:
- Zvýšená tvorba amoniaku v gastrointestinálním traktu (GIT):
- Neadekvátní perorální přívod proteinů;
- Krvácení do GIT;
- Porucha střevní mikrofóry (hnilobná anebo kvasná dyspepsie);
- Zácpa.
- Střevní mikroflóra může uvolňovat amoniak i z močoviny, která proniká do střeva.
- Zvýšená tvorba amoniaku v tělních tkáních:
- Katabolické stavy, zejména zhmoždění tkání (operace), polytrauma, ischémie, infekce, SIRS, sepse, MOF.
- Dysbalance vodního a iontového hospodářství:
- Hypoproteinémie, hypovolémie;
- Hypokalémie;
- Alkalóza;
- Diuretika.
- Podání léčiv s tlumivým účinkem na CNS:
- Hypnotika (barbituráty aj.);
- Psychofarmaka (benzodiazepiny aj.).
Ascites
Charakteristika
Ascites je nahromadění tekutiny v peritoneální dutině (hydroperitoneum). Normální množství tekutiny v peritoneální dutině je asi 150 ml. Už nahromadění malého množství ascitické tekutiny (100 ml) lze odhalit ultrazvukovým vyšetřením.
Obr. 6. Ascites.
Podle původu tekutiny se ascites klasifikuje na:
- Transudativní ascites:
- Tekutina je nezánětlivého původu. Protože jde o filtrát, neobsahuje proteiny, nebo jen malé množství. Tekutina vystupuje ze splanchnických kapilárních sítí v. portae do břišní dutiny po spádu tlakového gradientu. Nejčastěji se tak děje při portální hypertenzi anebo při hypoproteinémii. Příčinou může být postižení jater (fibróza, cirhóza), trombóza portální žíly, Budd-Chiariho syndrom, selhání pravého srdce, perikarditida, podvýživa, nadměrné ztráty plazmatických proteinů ledvinami, kůží nebo střevem apod.
- Exsudativní ascites:
- Tekutina je zánětlivého původu. Uvolňuje se do břišní dutiny aktivně jako součást zánětlivého výpotku, jehož tvorbu stimulují mediátory zánětu. Na rozdíl od transudátu obsahuje vysokou koncentraci proteinů. Tvoří se např. při akutní pankreatitidě, peritonitidě, ileu, rozsevu nádoru v břišní dutině apod.
Lépe než podle samotné koncentrace proteinů lze ascites klasifikovat na základě stanovení schodku (gradientu) koncentrací sérového a ascitického albuminu (SAAG). Při cirhóze se koncentrace plazmatického albuminu obvykle drží na hodnotách o nejméně 10 g/l vyšších než ascitický albumin. Rozdíl v koncentracích albuminu vyšší než 11 g/l svědčí pro transudát, menší než 11 g/l pro exsudát.
Vznik ascitu provázejícího selhání jater
Na vzniku ascitu provázejícího selhání jater se podílí řada faktorů:
- Portální hypertenze. Zvyšuje hydrostatický tlak v kapilárách splanchnického řečiště. Pokud přesáhne onkotický tlak proteinů, tekutina se hromadí extravazálně.
- Přetížení anebo postižení lymfatické drenáže jater a střev. Lymfa spolu s krví odvádí plazmu z Disseho prostor do dutých žil systémového oběhu. V játrech, na rozdíl od střevní stěny, proteiny přestupují přes fenestrovaný endotel do Disseho prostor, takže zde chybí onkotický gradient mezi krevními sinusoidami a tkáňovým intersticiem. Při cirhóze, kdy krev naráží na odpor na konci sinusoid, jsou kladeny mimořádné požadavky na lymfatickou drenáž. Únik velkého množství lymfy do ascitické tekutiny, ke kterému někdy dochází, může vysvětlit paradoxně vysoké koncentrace proteinů v ascitickém transudátu. Často se tak děje při pravostranném srdečním selhání anebo při Budd-Chiariho syndromu.
- Hypoproteinémie, zejména hypoalbuminémie, která je častou součástí jaterního postižení. Snižuje onkotický tlak.
- Zvýšená reabsorpce Na+ v ledvinách. Je vyvolána sympatikem, renin-angiotenzinovým systémem a aldosteronem. Aktivují se jako odpověď na hypotenzi a hypovolémii, k nimž dochází následkem úniku tekutiny do peritoneální dutiny a současně systémové vazodilatace z nahromaděných vazodilatačních substancí v oběhu.
- Účinnosti natriumretenčních hormonů napomáhají dvě další okolnosti:
- Snížená degradace hormonů v selhávajících játrech;
- Snížené plazmatické koncentrace vazebných a transportních globulinů hormonů při hypoproteinémii.
Hepatorenální syndrom
Hepatorenální syndrom charakterizují symptomy oligurického renálního selhání spojeného s pokročilým akutním anebo chronickým jaterním onemocněním. Často jsou zároveň přítomny i ascites a jaterní encefalopatie. Hepatorenální syndrom se odlišuje od typického prerenálního selhání z hypovolémie anebo od jiných stavů se zvýšeným neproteinovým dusíkem v plazmě, jaké např. provázejí rozsáhlejší ztráty krve anebo tekutin. V periferním oběhu je obvyklá přítomnost hyperkinetické cirkulace z nadbytku kolujících nedetoxikovaných vazodilatačních produktů metabolismu a dále hypoproteinémie, hypovolémie a hypotenze. Současně je v ledvinách výrazná vazokonstrikce. Symptomatická hyponatrémie při hypoproteinémii je v souladu s nápadným poklesem iontů Na+ v moči (< 5 mmol/l – nižší než je obvyklé u typického prerenálního selhání, kdy bývá kolem 50 – 70 mmol/l). Ledviny reabsorbují Na+, ale voda se zřejmě vstřebává neefektivně. Na rozdíl od akutní tubulární nekrózy v moči chybí válce.
Hepatorenální syndrom často vznikne jako komplikace bez zjevné příčiny, ale někdy může být jeho začátek vyprovokován krvácením do gastrointestinálního traktu, paracentézou razantní diuretickou terapií, infekcí, sepsí, atd. Má nepříznivou prognózu.
Zpracovali: Jana Mačáková a Jaroslav Veselý. Ústav patologické fyziologie LF UP