Charakteristika
Poruchy trávení a vstřebávání tvoří velkou podkapitolu poruch výživy. Mohou se týkat jedné složky potravy nebo být komplexní. Jejich diagnóza a terapie vyžadují důkladnou znalost fyziologie a patofyziologie funkcí gastrointestinálního traktu. K trávení anebo vstřebávání dochází v celé délce trávicí trubice. Nejintenzivněji probíhají tyto procesy ve střevě.
Střevní sliznice
Střevní sliznice je kryta specializovaným jednovrstevným epitelem. Epitel je v celém rozsahu kryt vrstvou ulpívajícího hlenu, jehož hlavní složkou jsou glykoproteiny. Omezuje působení střevního obsahu a bakterií na epitel. K sekreci hlavně dochází činností specializovaných buněk v hloubi Lieberkühnových krypt mezi klky.
Epitel rychle proliferuje z center na dně Lieberkühnových krypt a během postupu na vrchol klků se diferencuje. Na vrcholu klků probíhají nejintenzivnější trávicí a vstřebávací procesy. Celý povrch tenkého střeva se obnovuje během každých 24 – 72 hodin. Rychlá proliferace epitelových buněk není samoúčelná. Dovoluje rychlé zacelení defektů, k nimž při trávení dochází. Usnadňuje odstraňování mutovaných buněk. V tračníku je výměna epitelových buněk pomalejší. Nádory tenkého střeva jsou mnohem méně časté, než je tomu v tlustém střevě. Pod sliznicí je střední, hladká svalová vrstva střevní stěny bohatě prostoupená nervovými pleteněmi.
Imunologické funkce střevního epitelu a imunologické soustavy střevní stěny
Střevní stěna je místem, kde se nachází jeden z největších oddílů imunitní soustavy lidského těla. Samotný střevní epitel je součástí systému nespecifické imunity. Tvoří účinnou fyzikální bariéru zpevněnou mezibuněčnými spojeními a těsnými spojeními, které uzavírají paracelulární prostory. Bariéra představuje rozhraní mezi střevní dutinou s jejím obsahem a osídlenou střevní mikroflórou (střevní mikrobiom) a vnitřním prostředím organismu.
Epitelové buňky jsou vybaveny řadou imunitních receptorů systému vrozené imunity. Neustále monitorují poměry ve střevním lumen a podávají o nich zprávy směrem do střevní stěny. Tuto funkci především umožňují receptory podobné receptorům Toll octomilky (TLRs; Toll-like receptors), které se nacházejí na povrchu i jiných savčích buněk odpovědných za nespecifickou imunitu (dendritických buněk, monocytů a makrofágů aj.). TLRs registrují obecné molekulární znaky patogenů (PAMPs; pathogen-associated molecular patterns). Znaky PAMPs mohou být bakteriální lipopolysacharidy, peptidoglykany, bakteriální RNA, bakteriální flagelin anebo lipoteichoová kyselina z Gram-pozitivních bakterií (např. stafylokoků anebo streptokoků) atd. Signály přenesené aktivovanými TLR do nitra buněk spouštějí syntézu prozánětlivých proteinů časné fáze, jako jsou TNF, IL-1β a interferon γ (IFN-γ). Tyto proteiny dále působí autokrinně, parakrinně a endokrinně s cílem mobilizovat imunitní odpověď. TLRs buněk nespecifické imunity mohou být aktivovány nejen cizími znaky PAMPs, ale jsou také schopny rozpoznávat a vázat znaky, které pocházejí z poškozených tělních tkání (DAMPs; damage-associated molecular patterns). Mohou tudíž být aktivovány i při patologických zánětech, ischemických změnách a jiných poškozeních střevních struktur.
Epitelové buňky střevní sliznice také fungují jako antigen-prezentující buňky. Vstřebávají a zpracovávají antigeny a předkládají je buňkám specifického imunitního systému střevní stěny. V této funkci jsou vydatně podporovány dendritickými buňkami střevní lymfatické tkáně. Dendritické buňky svými dlouhými výběžky zasahují přes epitel až do střevního lumen a prostřednictvím prezentace antigenů podobně jako epitelové buňky nepřetržitě podávají specifickému střevnímu imunitnímu systému zprávy o antigenních poměrech ve střevě.
Střevní epitel kromě krycích buněk obsahuje četné specializované buňky s obrannou funkcí, jako jsou pohárkovité buňky a Panethovy buňky:
- Pohárkovité buňky zajišťují:
- Produkci hlenu, jehož složení se mění v závislosti na podnětech, které buňky přijímají ze střevního lumen;
- Produkují cytokiny, které ovlivňují hojení defektů a průběh zánětů ve střevě.
- Panethovy buňky jsou uloženy při bázi Lieberkühnových krypt.
- Produkují zánětlivé cytokiny (TNF-α) a regulují zánět;
- Produkují antimikrobiální peptidy α-defenziny, lysozym a fosfolipázu A2; všechny slouží obraně proti bakteriím, kvasinkám a pravděpodobně i opouzdřeným virům.
Hlouběji ve stěně střeva, v lamina propria a v submukóze, je uložena rozsáhlá lymfatická tkáň střeva (Peyerovy plaky). Pokud bakterie nebo antigenní částice projdou epitelovou bariérou, setkávají se s dendritickými buňkami a makrofágy. Většina bakterií je zpravidla fagocytována. Peyerovy plaky jsou ve spojení s roztroušenými folikuly a s lymfatickými uzlinami v mezenteriu. Pokud rezidenční buňky samy nestačí, časná fáze zánětu pokračuje infiltračními vlnami neutrofilů, dendritických buněk, přirozených zabíječů a monocytů a následně se aktivuje specifická imunitní odpověď s účastí lymfocytů.
Jednou z fascinujících vlastností nespecifického i specifického střevního imunitního systému je schopnost rozpoznávat symbiotické a neškodné saprofytické mikroorganismy a netoxické antigeny od invazívních patogenů. Rovnováha mezi mechanismy tolerance a obrany ve střevě je zcela kritická. Zatímco u nespecifického imunitního systému vděčíme za tuto schopnost dlouhé evoluci a fixaci do genetického materiálu, specifický imunitní systém se jí učí hlavně během časné ontogenezy.
Tolerance cizích antigenů pocházejících ze symbiontů a saprofytů, s nimiž se střevní imunitní systém neustále a ve velké míře setkává, je nezbytná. Osoby, jejichž imunitní systém tuto vlastnost dobře nerozvinul, trpí střevními záněty z nepřiměřených hypersenzitivních reakcí na přítomnost neškodných imunologických znaků. Rovnováha mezi mechanismy je příliš vychýlena na stranu obrany.
Schopnosti tolerovat cizí antigeny se imunitní systém učí brzy po narození. Důležitá úloha v tomto procesu se přisuzuje kontaktům enterocytů, dendritických buněk a dalších imunokompetentních buněk, včetně buněk specifické imunity, s antigeny běžných, evolučně starých průvodců člověka, komensálů, kteří během vývoje už pozbyli svou nebezpečnost pro lidský organismus. Počítají se k nim např. laktobacily, saprofytická mykobakteria atd., a také červi. Antigeny těchto organismů mohou modulovat vývoj imunokompetentních buněk během jejich zrání, kdy získávají své specifické vlastnosti.
Nepřitomnost takových antigenů v ranném vývoji vede k tomu, že imunitní systém se nenaučí je tolerovat, a při pozdějším kontaktu na ně reaguje se vší razancí, která poškozuje vlastní tkáně. To je obsahem hypotézy „starých souputníků“ („old friends“ hypothesis), která učí, že včasné kontakty střevního imunitního systému s mikroorganismy jsou kritické pro jeho správný vývoj. Komplementární k hypotéze starých souputníků je hypotéza „přílišné hygieny“ (hygienic“ hypothesis), podle které se lidé ve vyspělých státech, a ještě vice jejich děti, dostatečně nevystavují potřebným kontakům s neutrálními, komensálními mikroorganismy, které naopak jsou přehnanými hygienickými zásahy odstraňovány z jejich okolí. Absence včasných kontaktů s nimi potom způsobuje asbsenci tolerance k jejich antigenům při pozdějších expozicích.
Střevní mikrofóra (střevní mikrobiom)
Symbiotická střevní mikroflóra má důležité fyziologické funkce:
- Účastní se trávení, ovlivňuje motilitu a prokrvení střevní stěny;
- Produkuje důležité živiny;
- Dodává některé nepostradatelné (esenciální) složky potravy;
- Zajišťuje stabilitu mikrobiálního prostředí ve střevním lumen, brání proliferaci a invazi patogenů;
- Kritickým způsobem ovlivňuje rozvoj střevní imunitní soustavy.
Základní mikrobiální výbava je ve střevě přítomna už při narození, ale během prvního roku života se velmi rychle mění v souvislosti s narůstající šíří diety. U každého dospělého je dlouhodobě stabilní a jedinečná. Literární zdroje uvádějí, že ve střevním mikrobiomu je 10x více buněk než v celém lidském těle a 100x více genů než v lidském genomu.
Normální střevní mikroflóra je převážně anaerobní. Obsahuje také kvasinky, houby, plísně a viry. Její složení je rozdílné v jednotlivých etážích trávicí trubice. Aerobní a grampozitivní mikroorganismy převládají v žaludku a v orální části tenkého střeva včetně jejuna, jejíž osídlení žaludek ovlivňuje. Aborálně významně přibývá koliformních bakterií a anaerobů. V ileu už převládají gramnegativní bakterie a mikroflóra se podobá osídlení tlustého střeva. Souvisí to s pronikáním mikrobů z tračníku přes ileocékální chlopeň. Některé bakterie, např. E .coli, mohou adherovat na střevní sliznici a aktivně jí pronikat.
Ke změnám střevního mikrobiomu dochází hlavně při změnách diety anebo následkem onemocnění. Střevní imunitní systém se přitom neustále vylaďuje na nové faktory v prostředí střevního lumen.
Při prolomení bariéry patogeny se rozvíjejí střevní záněty. Může však vzniknout i nepřiměřený zánět při neadekvátní reakci střevní sliznice na nepatogenní anebo jen málo patogenní mikroorganismus anebo jeho produkty. Pokud se objeví eroze, nebo dokonce ulcerace, jsou poškozená místa přímo vystavena působení střevního obsahu. Rychlá proliferace epitelových buněk je důležitým pomocným mechanismem, který dovoluje opět získat kontrolu nad zánětem.
Patofyziologické základy diferenciální diagnózy poruch trávení a vstřebávání
Kromě tekutin přijatých s potravou gastrointestinálním traktem denně recirkuluje 8 – 10 l extracelulární tekutiny jako transcelulární tekutina. Tvoří se ve formě sekretů žlaz a opětovně se vstřebává sliznicemi. Fyziologické ztráty elektrolytů a vody jsou v porovnání s úpravami, které provádějí ledviny, zanedbatelné. Situace může být zcela odlišná za patologických situací spojených s průjmy anebo s porušením integrity střevní bariéry.
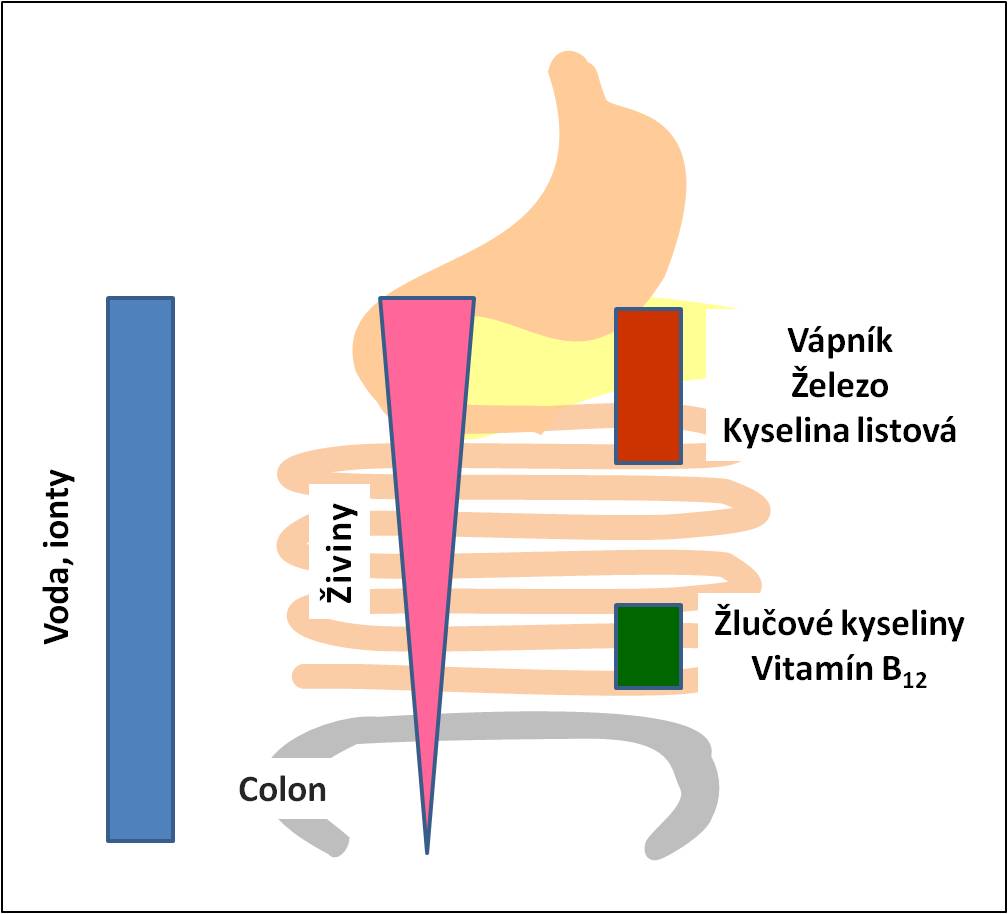
Voda a ionty se vstřebávají v tenkém i v tlustém střevě.
Živiny z potravy se až na výjimky (např. mastné kyseliny s krátkým řetězcem) téměř výlučně vstřebávají pouze v tenkém střevě a intenzita jejich vstřebávání je nejvyšší v jeho proximálních oddílech. Proto je porucha vstřebávání živin známkou poškození tenkého střeva. Některé nemoci, jako např. Crohnova chroba, však mohou současně napadat tenké i tlusté střevo.
Ionty vápníku, ionty železa a kyselina listová se absorbují pouze v proximálních oddílech střeva, zvláště v duodenu.
Žlučové kyseliny a vitamín B12 se absorbují pouze v ileu.
Obr. 1. Vstřebávání složek potravy v průběhu tenkého a tlustého střeva
Poruchy trávení a vstřebávání proteinů
Trávení proteinů spočívá v jejich štěpení na aminokyseliny, dipeptidy anebo tripeptidy. Tomuto účelu hlavně slouží žaludeční pepsin, pankreatické peptidázy trypsin a chymotrysin a střevní enterokináza a dipeptidázy. V pankreatické šťávě a střevní šťávě jsou vedle endopeptidáz obsaženy i exopeptidázy (karboxypeptidázy a aminopeptidázy).
Vrozenou poruchou trávení proteinů je chybění enterokinázy. Projevuje se průjmy, hypoproteinémii a zpomalením a poruchami růstu.
Vrozenými poruchami vstřebávání proteinů (aminokyselin) jsou Hartnupova nemoc a cystinurie.
- Hartnupova nemoc vzniká následkem izolovaného defektu transportu neutrálních aminokyselin ve střevě a v ledvinách. Projevuje se zánětlivými změnami na kůži, neutrální aminoacidurií a neurologickými a psychiatrickými symptomy.
- Podobně cystinurie vzniká následkem defektu transportního systému pro dibazické aminokyseliny, kterým se transportuje také cystin. Kromě cystinurie bývají přítomné ledvinové kameny a chronická pankreatitida.
Nejčastější získané poruchy trávení a vstřebávání proteinů jsou spojeny s onemocněními pankreatu, zejména akutní pankreatitidy, chronické pankreatitidy, popř. cystické fibrózy, anebo s onemocněními celých úseků střev, popř. s jejich chirurgickým odnětím.
K těžkému poškození střevní sliznice dochází při přecitlivělosti na složky potravy. Příkladem proteinové alergie je nesnášenlivost gliadinu (lepku) při céliakii. Jediným účinným řešením je vyloučení lepku z diety.
Poruchy trávení a vstřebávání sacharidů
Fyziologie trávení a vstřebávání sacharidů
Trávení sacharidů se účastní hlavně slinná amyláza (ptyalin), pankreatická amyláza a disacharidázy střevního kartáčového lemu. Optimum účinku ptyalinu je při pH 6,5, takže v žaludku působí po dobu asi 30 minut, než je jeho akce potlačena kyselostí žaludečního obsahu. Stejně jako pankreatická amyláza štěpí ptyalin škroby na dextriny a potom až na disacharid maltózu. Střevní prostředí potom obsahuje disacharidázy maltázu (štěpí maltózu na glukózu), sacharidázu (štěpí sacharózu na glukózu a fruktózu) a laktázu (štěpí laktózu na glukózu a galaktózu). Sacharóza kromě toho může být do jisté míry rozkládána kyselou katalýzou zprsotředkovanou HCl v žaludku.
Pentózy vznikají jednak jako konečný produkt trávení nukleových kyselin anebo nukleotidů a nukleosidů, jednak jako produkt trávení polysacharidů pentosanů. Pentosany obvykle obsahují xylózu (xylany), anebo arabinózu (arabany).
Vstřebávají se pouze monosacharidy. Glukóza a některé další monosacharidy (hlavně galaktóza) se vstřebávají sekundárním aktivním symportem s Na+. Fruktóza se vstřebává usnadněnou difúzí prostřednictvím transprotéru GLUT5. D-xylóza se téměř výlučně vstřebává v proximálním tenkém střevě. Sorbitol neboli D-glucitol, obsažený ve žvýkačkách anebo v přípravcích pro nemocné s diabetem, se téměř nevstřebává.
Galaktóza se v játrech mění na glukózu. Fruktóza se mění na glukózu v játrech i ve svalech.
Xylózový test
Test vstřebávání nemetabolizovatelné D-xylózy lze využít k vyšetření sliznice proximálního tenkého střeva. Vyšetřované osobě se perorálně podá dávka D-xylózy a sleduje se její vylučováí do moči (odtud název D-xylózový močový test). Abnormálně nízké množství D-xylózy v moči ukazuje na poruchu jejího vstřebávání ve střevě. Je nutno vyloučit hromadění tekutiny ve třetích prostorech, které by mohlo způsobit falešně patologický výsledek měření (např. ascites).
Poruchy trávení a vstřebávání sacharidů
Vrozený defekt kontrasportéru glukózy s Na+ postihne vstřebávání glukózy i vstřebávání galaktózy. Pokud jsou tyto sacharidy v potravě přítomny, objeví se průjmy (ne však v případě fruktózy).
Nadměrný příjem sorbitolu rovněž způsobí průjem (osmotický průjem).
Klinicky významnou poruchou je nesnášenlivost (intolerance) laktózy. Způsobuje ji defekt laktázy. Defekt může být vrozený, nebo získaný; může provázet jiná onemocnění, např. céliakii. Laktóza je při absenci tohoto enzymu nevstřebatelná. Nesnášenlivost laktózy vyžaduje její vyloučení ze stravy. Baktérie tlustého střeva částečně mohou substituovat střevní laktázu tím, že nevstřebanou laktózu mění na mastné kyseliny s krátkým řetězcem. Epitel tračníku využívá mastné kyseliny s krátkým řetězcem jako energetický substrát. Část se jich odvádí portální krví do jater.
Poruchy trávení a vstřebávání lipidů
Fyziologie a poruchy trávení lipidů
Při teplotě našeho těla je tuk z potravy ve střevě ve formě oleje. Trávení lipidů se začíná stykem se žaludeční lipázou. Její optimální pH je mezi 4,5 – 6,0. Žaludeční lipáza může obstarat asi 20 – 30 % všech lipolytických účinků v trávicím traktu. Dobře se štěpí zejména lipidy mléka, které jsou přijímány v emulgovaném stavu.
Za zbývající, největší část lipolýzy, je odpovědná pankreatická lipáza. Pankreatická lipáza je aktivní teprve poté, co vytvořila komplex s kolipázou. Komplex působí pouze v zásaditém prostředí. Prostředí o hodnotách pH < 7 komplex inaktivují. To činí pankreatickou lipázu zranitelnou:
- Při chronické pankreatitidě se snižuje nejen produkce lipázy, ale také hydrogenuhličitnových iontů v pankreatu. Klesá jejich množství v pankreatické šťávě dopravované pankreatickým vývodem do střeva. Nedostatek HCO3- může vést k neúčinné neutralizaci kyselé žaludeční šťávy v duodenu. Pankreatická lipáza nemůže v kyselém prostředí působit. Postižení pankreatu tak vede ke steatóze.
- Rovněž nadprodukce kyselé žaludeční šťávy při gastrinomu může vysoce převážit neutralizační kapacitu pankreatických hydrogenuhličitanových iontů. Symptomem gastrinomu proto může být průjem a steatorea.
Rychlost lipolýzy proporcionálně závisí na povrchu lipidové hmoty, ke které lipáza přistupuje. Účinek lipázy proto mimořádně vzrůstá, pokud jsou lipidy v micelách se solemi žlučových kyselin. Lipidy v takových micelách rovněž překračují tenkou vrstvu glykoproteinů, která souvisle pokrývá mikroklky a odděluje střevní lumen od slizničního epitelu, a postupují v této formě až k membránám enterocytů.
- Nedostatek konjugovaných žlučových kyselin ve střevě proto způsobuje steatoreu.
- Další příčinou průjmu a steatorey může být zvětšení tloušťky povrchové glykoproteinové vrstvy při její kolonizaci bakteriemi, jak se to děje při snížení motility anebo při funkční stáze střevního obsahu.
Fyziologie a poruchy vstřebávání lipidů
Lipidy se vstřebávají jako mastné kyseliny anebo jiné monomery (např. cholesterol), jako monoacylglyceroly i jako diacylglyceroly. Vstřebávání lipidů probíhá prostou difuzí anebo může být zprostředkováno přenašeči. Ke vstřebávání dochází až pod papila Vateri.
V enterocytech dochází k reesterifikaci lipidů a k jejich zabudování do lipoproteinů.
Primárním lipoproteinovou formou vydávanou enterocyty do mezibuněčné tekutiny jsou velké chylomikrony. Chylomikrony nevstupují do portální krve, ale pohybují se s lymfou lymfatickými cestami přímo do centrálních žil, takže obcházejí játra. Tato cesta se významně uplatňuje nejen při vstřebávání mastných kyselin (ve formě di- nebo triacylglycerolů) s dlouhým řetězcem (kyselina palmitová, stearová, olejová, linolová apod.), ale i při vstřebávání řady lipofilních léčiv. Pohybu lymfy napomáhá aktivní kontrakce svalových vláken střevních klků , které klky zkracují, a stlačují tak centrální chylové cévy, a také pohyby střeva a břišní lis.
Hlavním apolipoproteinem chylomikronů je apolipoprotein B-48. Při vrozené abetalipoproteinémii enterocyty nejsou schopny tvořit chylomikrony. Abetaliproteinémie se projevuje charakteristickými symptomy:
- Je přítomna steatorea;
- Enterocyty v bioptických vzorcích ze střevní sliznice jsou naplněné lipidy;
- Erytrocyty mají abnormání tvar (akantocytóza);
- Jsou známky neurologického postižení.
V postabsorpční fázi může dojít k poruše vstřebávání lipidů z důvodu lymfostázy. Příkladem jsou intestinální lymfangiektázie. Projevují se steatoreaou a ztrátami proteinů střevem.
Mastné kyseliny se středně dlouhým řetězcem (MCFA; 8 – 10 uhlíků) a triglyceridy s mastnými kyselinami se středně dlouhým řetězcem, které jsou složkou doplňků výživy (např. jako olej kokosových ořechů) se chovají odlišně v několika ohledech:
- Nevyžadují lipolýzu a přímo se vstřebávají;
- V enterocytech se nemusí reesterifikovat a nepotřebují chylomikrony;
- Z enterocytů vystupují do intersticiální tekutiny, pronikají do krevních kapilár a jsou unášeny portální krví přímo do jater.
Mastné kyseliny s krátkým řetězcem (SCFA; 2 – 4 uhlíky) se tvoří v tlustém střevě z nestrávených zbytků sacharidů činností bakterií. Mají několikerý význam:
- Slouží jako zdroj energie epitelových buněk tlustého střeva (z nich kyselina máselná jako hlavní energetická živina enterocytů tračníku);
- Velmi rychle se absorbují do portální krve;
- Stimulují reabsorpci Na+, Cl- a vody z lumen tlustého střeva, takže při jejich nedostatku - při nedostatku střevních bakterií - vzniká průjem (průjmy spojené s léčbou antibiotiky);
- Jsou nejhojnějšími organickými anionty ve stolici.
Trávení, vstřebávání a využití složek nukleových kyselin
Nukleoproteinové částice anebo nukleové kyseliny a jejich komponenty (nukleosidy a nukleotidy) z potravy se ve střevě štěpí na své základní stavební kameny (proteiny, puriny, pyrimidiny, pentózy a kyselinu fosforečnou), které se dále tgráví anebo vstřebávají svými specifickými mechanismy. Jen malá část uvolněných bází se však včleňuje do nukleových kyselin ve tkáních, pokud vůbec.
Poruchy vstřebávání iontů a vitamínů
Poruchy vstřebávání železa mohou být odpovědné za deficit tohoto iontu se symptomy únavy, latentní tetanie, anebo až anémie. Je namístě vyloučit zvýšené ztráty jako příčinu nedostatku železa.
Poruchy vstřebávání vitamínu B12 anebo kyseliny listové se mohou manifestovat makrocytární anémií. K vyšetření poruch vstřebávání kobalaminu se používá Schillingův test (téma Patofyziologie vstřebávání vitamínu B12 a Schillingův test).
Poruchy vstřebávání vitamínu K mohou vést k jeho nedostatku a prodloužení protrombinového času. Je namístě vyloučitz jaterní onemocnění, případně použití antagonistů vitamínu K.
Poruchy vstřebávání vitamínu D se mohou manifestovat poruchami metabolismu vápníku a kostního metabolismu.
Onemocnění se zvýšenou absorpcí ve střevě
Jsou pouze dvě klinický významná klinická onemocnění, při nichž je absorpce zvýšena:
- Hemochromatóza.
- Wilsonova choroba.
Průjem
Průjem často provází poruchy vstřebávání. Jsou některé výjimky, např. perniciózní anémie. Podle klasického vymezení jde o „příliš rychlou evakuaci příliš řídké stolice“ (Roux a Ryle, 1924). Objem stolice je > 200 g/den. Průjem v řadě případů komplikuje steatorea.
Při vzniku průjmu se obvykle kombinuje několik složek, přičemž některá může zcela převládat:
- Osmotická složka;
- Sekreční složka;
- Zvýšená střevní motilita a zrychlená pasáž; je obvyklou složkou průjmů.
Osmotický průjem
Hlavním patogenetickýnm faktorem osmotického průjmu je nahromadění osmoticky aktivních látek ve střevě. Zdrojem osmoticky aktivních látek je potrava. Příčiny, které způsobí nahromadění osmoticky aktivní látky, mohou být exogenní nebo endogenní:
- Exogenní příčiny:
- Nadměrný přívod mono- anebo disacharidů, sorbitol (žvýkačky), laxantiva, akarbóza, antacida atd.
- Endogenní příčiny:
- Nedostatečná funkce pankreatu, alergie na složky potravy, céliakie, nesnášenlivost laktózy, abetalipoproteinémie, střevní lymfangiektázie, syndrom krátkého střeva atd.
Protože zdrojem osmoticky aktivních látek v uvedených poruchách je potrava, hladovění trvající alespoň 24 hodin anebo déle může přinést úlevu a odeznění příznaků. Vv takovém případě hladovění má i diagnostikckou hodnotu.
Přítomnost osmoticky aktivních látek může prokázat vyšetření osmotického schodku stolice (stool osmotic gap). Je založeno na očekávání, že:
- Osmolalita stolice (mmol/kg) ≈ 2 x ([Na+stolice] + [K+stolice]) .
Nesplnění této podmínky, tj. rozdíl mezi skutečnou osmolalitou a vypočtenou osmolalitou › 50 mmol/kg, ukazuje na přítomnost dalších osmoticky aktivních látek ve stolici než jen Na+, K+ a jejich průvodních aniontů.
Sekreční průjem
Signálem ke zvýšení střevní sekrece obvykle je stimulace výdeje Cl- iontů z enterocytů, které jsou následovány ionty Na+ a pak vodou. Chloridové kanály enterocytů ovládá cAMP, jehož koncentrace závisí na aktivitách adenylcyklázy a fosfodiesterázy.
- Exogenní příčiny:
- Bakteriální toxiny:
- Cholera toxin aj.
- Rostlinné toxiny:
- Amanitin aj.
- Anorgaanické a organické toxiny (arzén aj.).
- Laxantiva (bisacodyl) a diuretika.
- Bakteriální toxiny:
- Endogenní příčiny:
- Žlučové kyseliny;
- Hormonálně aktivní nádory (VIPom aj.).
- Vrozené poruchy iontových přenašečů.
Průjmy spojené se střevními záněty
Průjmy provázející střevní záněty kombinují osmotickou i sekreční složku a zvýšenou motilitu. Aktivované imunitní buňky produkují řadu faktorů, které působí na krevní zásobení i sliznici a narušují jak sekreci, tak reabsorpci iontů a vody ve střevě. Jejich účinky se případně sčítají s už přítomnými toxiny ve střevním lumen.
- Infekční záněty mohu být způsobeny bakteriemi, viry, plísněmi, kvasinkami anebo parazity. Mohou pocházet zvenčí anebo může jít o kolonizaci vyšších oddílů střeva bakteriemi z tračníku (syndrom přemnožení bakterií).
- Alergické záněty mohou být způsobeny alergeny z potravy.
- U idiopatických autoimunitních zánětů jsou příčiny komplexní.
- Postcytostatické a postiradiační záněty ve střevě vznikají útlumem proliferace enterocytů a hojení defektů sliznice. Často se následně kombinují s infekčními záněty.
Patofyziologie vybraných střevních onemocnění
- Syndrom přemnožení bakterií
- Céliakie
- Nespecifické střevní záněty (NSZ, IBD)
- Crohnova choroba
- Ulcerativní kolitida (idiopatická proktokolitida)
- Enteropatie provázená ztrátou proteinů
- Whippleova choroba
- Tropická sprue
Syndrom přemnožení bakterií
Vzniká následkem kolonizace tenkého střeva bakteriemi z tračníku. Provází četná onemocnění. Projevuje se průjmem, steatoreou, příznaky podvýživy (poruchy růstu, anémie apod.). Hrozí rozšíření bakterií do tkání mimo střevo anebo do krve s následnou bakteriémií a sepsí.
Syndrom nejčastěji vzniká na podkladě zpomalené střevní pasáže anebo hromadění střevního obsahu. Velmi častými příčinami jsou místní zánětlivé změny ve střevní sliznici, které způsobují hypomotilitu anebo až zácpu nebo ileus. Zpomalení průchodu střevem podporuje přerůstání bakterií z tlustého do tenkého střeva. Predisponujícími okolnostmi jsou:
- Funkční poruchy;
- Sekundární poruchy při postižení žaludku, pankreatu, jater, po aplikaci některých léčiv apod.
- Anatomické překážky:
- Divertikly, striktury, nádory apod.
- Přímé spojky mezi tračníkem a tenkým střevem (píštěle, chirurgická spojení).
Jednou z důležitých cest prevence přerůstání bakterií je udržování vyváženého střevního mikrobiomu.
Nespecificé střevní záněty (NSZ, IBD)
Nespecifické střevní záněty (NSZ, IBD, inflammatory bowel disease) jsou pospány v samostatné kapitole(klinické téma Nespecifické střevní záněty) .
Céliakie
Často používanými synonymy pro toto onemocnění jsou gluten-senzitivní enteropatie, céliakální sprue, netropická sprue aj.
Příčinou céliakie je intolerance gliadinu, který je složkou glutenu. Protilátky nejčastěji jsou typu IgA. Gluten (lepek) je součástí zrn kulturních obilovin (pšenice, žita, ječmene, ovsa) a mouky, která se z nich mele. Gluten tvoří až 80 % všech proteinů zrn. Pomáhá náhrada rýží.
Imunitní reakce vede k těžkému poškození střevní sliznice, redukci jejího členění (vyhlazení mikroklků a klků, zmenšení trávicí a vstřebávací plochy; hyperplázii krypt). Symptomy se objevují už záhy v dětství po kontaktu s alergenem. Zahrnují průjmy se steatoreou, úbytek na váze, poruchy růstu, poruchy tvorby kostí, poruchy krvetvorby (anémie) a další (klinické téma Malasimilace, malasimilační syndromy, céliakie). K závažnosti symptomů přispívají:
- Váznoucí vstřebávání, a tím nedostatečný enterohepatální oběh žlučových kyselin;
- Steatorea;
- Ztráty vápníku;
- Nedostatečné trávení disacharidů (sekundární defekt laktázy);
- Zvýšená sekrece ze zbytnělých krypt.
Enteropatie provázená ztrátou proteinů
Jde o poměrně velkou skupinu stavů, při nichž dochází k nadměrné sekreci a neselektivním ztrátám proteinů do gastrointestinálního traktu. Ztrácejí se albumin i globuliny, a aniž jsou přítomny poruchy ledvin anebo jater, vyvíjí se hypoproteinémie s otoky. Příčinami mohou být:
- Poruchy propustnosti střevní slizniční bariéry bez vředových lézí (neulcerativní onemocnění, jako např. céliakie aj.);
- Onemocnění s vředovými defekty (ulcerativní onemocnění, jako např. IBD aj.);
- Poruchy lymfatické pasáže (venostáza, selhání pravého srdce, nádorové masy aj.).
V diferenciální diagnóze mohou pomoci následující poznatky:
- Při převažujícím úbytku sérového albuminu a normálních nebo téměř normálních sérových globulinech pravděpodobně jde o postižení jater anebo ledvin;
- Při převažujícím úbytku sérových globulinů a normálním albuminu zřejmě nejde o ztráty, ale o poruchu tvorby globulinů;
- Při poruchách lymfatické pasáže často bývá přítomen průjem se steatoreou a v krvi lymfopenie.
Enteropatii je možno ozřejmit následujícími testy:
- Stanovením α1-antitrypsinu ve stolici.
- α1-Antitrypsin tvoří téměř 4 % plazmatických proteinů. Je rezistentní proti proteolýze ve stolici, a proto je možno ho stanovit a určit jeho ztráty.
- Podáním radioaktivně značených proteinů do oběhu s následným stanovením jejich obsahu ve stolici.
Whippleova choroba
Vzniká infekcí bakterií Tropheryma Whippelii. Projevuje se břišními bolestmi, průjmy se steatoreou a úbytky na váze. Extraabdominální symptomatologie zahrnuje artralgie a artropatie, postižení srdce a postižení nervového systému.
Zpracoval: Jaroslav Veselý. Ústav patologické fyziologie LF UP