Nejčastější indikací ke scintigrafii plic je embolie do plicní tepny, kdy radionuklidová vyšetření umožňují získat informace o rozložení plicní perfúze a ventilace.
Charakteristika embolie do arteria pulmonalis
Akutní plicní embolie je považovaná za nejhůře rozpoznatelné kardiovaskulární onemocnění. Klinicko-patologické studie ukázaly, že v roce 1995 byla v USA plicní embolie nerozpoznána u 70 % nemocných, u nichž pitva prokázala plicní embolii jako hlavní nebo přispívající příčinu úmrtí. Správnost diagnózy klesá obecně s věkem nemocného, snižuje se u nemocných majících současně bronchopneumonii; stoupá naopak u nemocných s hlubokou žilní trombózou. Nejčastějším anamnestickým příznakem je náhle vzniklá nebo náhle zhoršená klidová dušnost (85 – 95 % pacientů), dále se vyskytují bolesti na hrudi (do 50 % nemocných), kašel, synkopa a hemoptýza (asi 20 %, 14 % resp. 7 % nemocných). Důležité je rozpoznání žilní trombózy, neboť indikuje zahájení léčby i při chybění známek plicní embolie. Pro diagnostiku žilní trombózy je důležitá duplexní sonografie. Formy plicní embolie jsou uvedeny v tabulce 2, mortalitu nejzávažnější akutní formy ukazuje tabulka 3.
| Tabulka 2. Formy plicní embolie |
| Akutní masivní plicní embolie |
| Akutní submasivní plicní embolie |
| Akutní malá plicní embolii |
| Subakutní masivní plicní embolii |
| Chronická tromboembolickou plicní hypertenze |
.
| Tabulka 3. Hospitalizační mortalita akutní plicní embolie v závislosti na jejím klinickém charakteru | |
| Hemodynamicky stabilní | 4 – 5 % |
| Nízký TK | 7 % |
| Kardiogenní šok | 24,5 % |
| Nutnost resuscitace | 64,8 % |
Kromě klinických příznaků svědčí pro embolizaci i laboratorní ukazatele, především D-dimery, které jsou konečným výsledkem působení plazminu na fibrin. Plazmin jako proteolytický enzym štěpí nejen fibrin a fibrinogen, ale i faktor V, faktor VIII a protrombin. Štěpné produkty vzniklé štěpením fibrinogenu jsou fibrinogen degradační produkty (FDP) zatímco degradací definitivního, zpevněného fibrinu plazminem vznikají D-dimery. Stanovení D-dimerů v klinické praxi je užitečné k vyloučení diagnózy plicní embolie či žilní trombózy při ambulantním vyšetření, protože výsledek D dimerů má vysokou negativní predikční hodnotu. Pozitivita D-dimerů však provází všechny stavy, které jsou synonymem fibrinémie, např. záněty, nekrózy, nádorová onemocnění, infekce a podobně, což je důvodem jejich nízké specificity. Z těchto důvodů je diagnostická hodnota D-dimerů u hospitalizovaných nemocných velmi problematická. Stanovení D-dimerů má tedy hlavní význam při vyšetřování ambulantních hemodynamicky stabilních nemocných. Specificita D-dimerů je také nízká u pacientů starších 80 let. Pokud je klinické podezření na plicní embolii vysoké, musí být i přes normální hodnoty D-dimerů plicní embolie vždy vyloučena zobrazovacími metodami.
Scintigrafie plicní perfúze a ventilace
V současné době je možno embolii do a. pulmonalis detekovat buď pomocí scintigrafie plic nebo CT angiografie. Výhodou scintigrafie je především to, že ji lze použít u pacientů s alergií na rentgenové kontrastní látky i u osob s renální insuficencí. Předností scintigrafického vyšetření je i nižší radiační zátěž, zejména pak na prsní žlázu u mladých žen ve fertilním věku, a rovněž v 1. trimestru gravidity. Naopak nevýhodou scintigrafie při srovnání s CT angiografií je horší dostupnost vyšetření, protože pracoviště nukleární medicíny nemívají kontinuální provoz. Avšak např. u pacientů s chronickou plicní hypertenzí a trombembolickou nemocí je podle současných doporučení České kardiologické společnosti perfuzní plicní scintigrafie předřazena před CT angiografii.
Scintigrafická diagnostika embolie do plicnice je postavena na hodnocení perfuze plic. V některých případech je však nutné doplnit i scintigrafií ventilační případně porovnat perfuzní skeny s RTG prostým snímkem nebo s CT plic. Je nutno mít na zřeteli, že samotný nález perfuzního defektu není pro embolizaci (tj. uzávěr a. pulmonalis nebo některé z jejích větví embolem) specifický. Perfuzní defekty mohou vznikat i v důsledku řady různých primárně plicních onemocnění, protože hypoventilovaná část plíce je v důsledku „alveolokapilárního reflexu“ také hypoperfundovaná. Tento jev zabraňuje tomu, aby plícemi protékala krev, aniž by byla okysličena. Například i při asthma bronchiale jsou prokazovány výrazné defekty plicní perfuze, i když struktura cévního řečiště není porušena a jde pouze o funkční záležitost.
Perfuzní scintigrafii plic se provádí makroagregátů albuminu značených 99mTc (99mTc-MAA), což jsou částice o průměrné velikosti 10-30 mm, tedy větší než je průměr plicních kapilár (7-10 mm) ale menší než je průměr prekapilárních arteriol (zhruba 35 mm). Po intravenózní aplikaci (kvůli gravitaci vleže) je depozice částic v plicním řečišti přímo úměrná regionální plicní perfuzi, oblasti se sníženou perfuzí se zobrazují jako fotopenické oblasti. Částice MAA zachycené plicním řečištěm podléhají následně mechanické degradaci a fragmentaci, jejich biologický poločas v plicích je přibližně 4–6 hodin. Důležitým faktorem pro úspěšné provedení vyšetření je aplikace optimálního počtu podaných částic. K dosažení kvalitního scintigramu s homogenním rozložením radiofarmaka v perfundovaném parenchymu je třeba injikovat minimálně 60 000 částic, optimálně až 400 tisíc částic, což odpovídá obstrukci jen malé frakce plicního řečiště (přibližně 0,3 %). Vyšetření plicní perfuze je proto bezpečné vyšetření bez výskytu závažných komplikací.
Při ventilační scintigrafii plic můžeme použít aerosoly nebo radioaktivní plyny. V současné době je v České republice nejčastěji používána inhalace 81mKr (krypton). Tento inertní radioaktivní plyn je vytvářen v generátoru z mateřského 81Rb (rubidium). Výhodou 81mKr je nízká radiční zátěž plynoucí z extrémně krátkého poločasu přeměny (13 sekund). Bohužel, poměrně krátký je i poločas přeměny mateřského radionuklidu 81Rb, který je pouze 4,6 hodiny. Tento generátor lze proto používat na pracovišti nukleární medicíny pouze po dobu jedné pracovní směny.
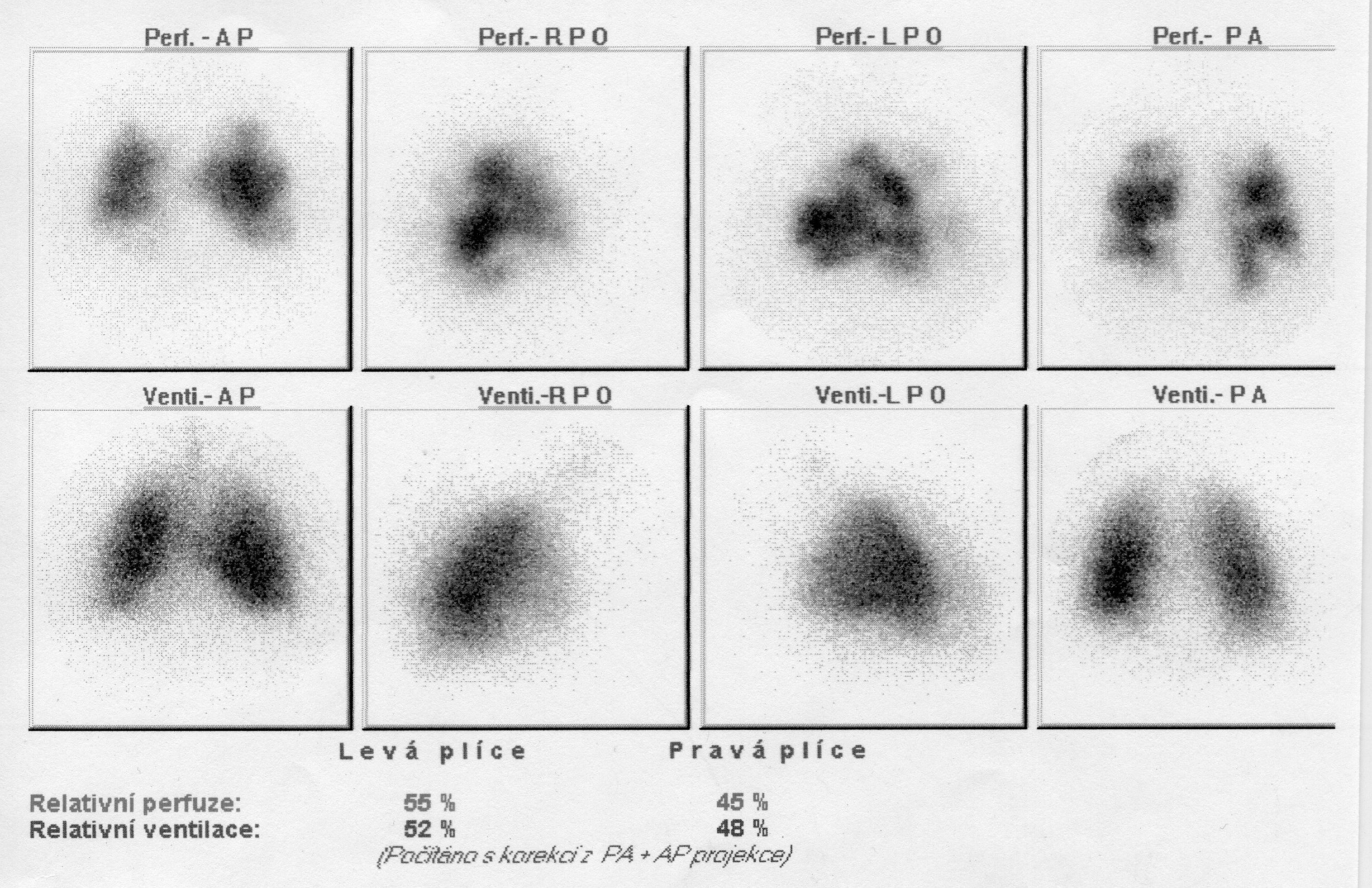
Akvizice dat. Při perfuzní i ventilační scintigrafii se zobrazují plíce statickými scintigramy ve 4 – 6 základních projekcích (přední, zadní a šikmé projekce, viz obrázek 1). V současné době je podle evropských doporučení preferované tomografické zobrazení (SPECT) nebo hybridní vyšetření (SPECT/CT).
Interpretace scintigrafických nálezů
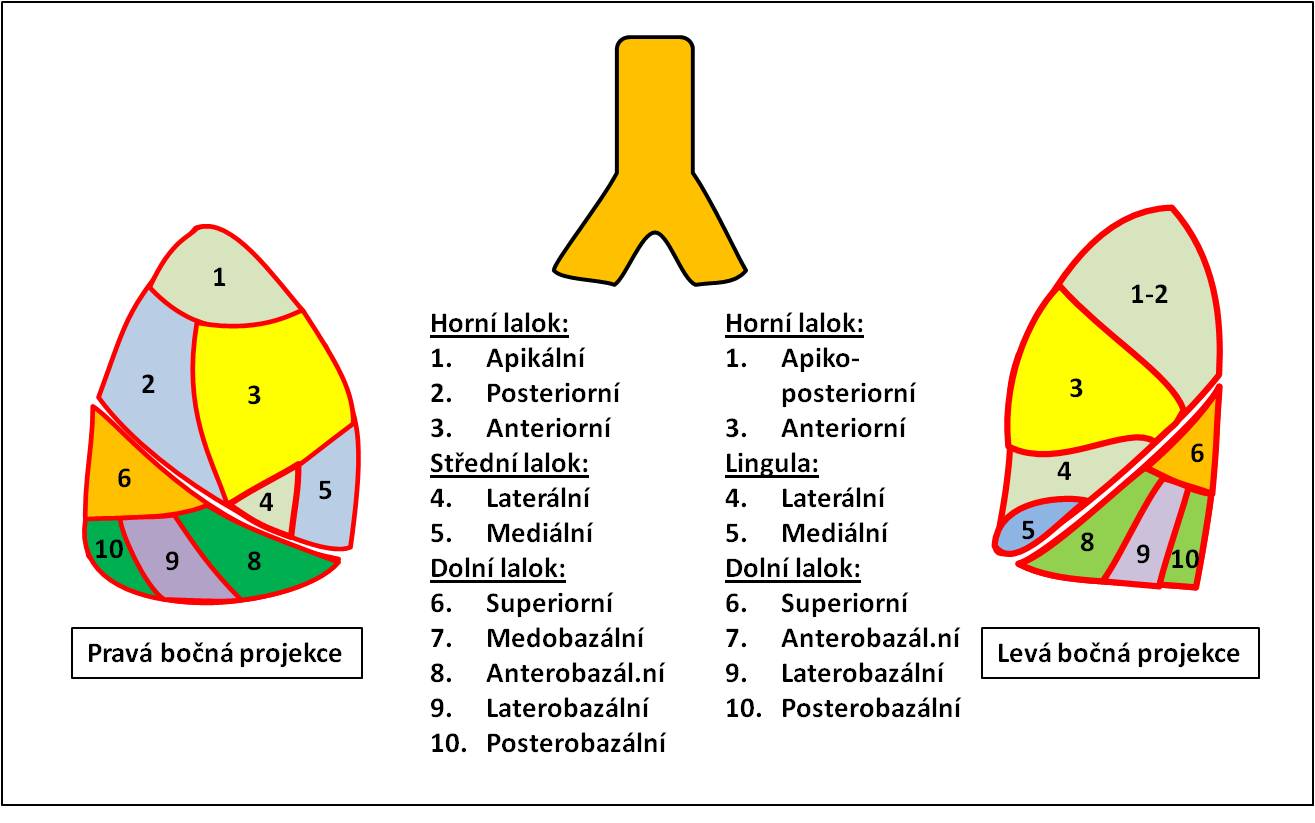
Perfuzní defekty v důsledku embolizace a. pulmonalis mají segmentální charakter a nejsou na rozdíl od primárně plicního onemocnění provázeny příslušnými defekty ventilace. Za segmentální charakter defektu se považuje nález, kdy ložisko alterované perfuze nasedá na konturu plíce, zcela typický nález má navíc i klínovitý tvar perfuzního defektu. Schéma plicních segmentů segmentů je na obrázku 2.
Obr. 1 Embolie do a. pulmonalis. Vícečetné defekty segmentálního charakteru na perfuzních scintigramech (horní řada scintigramů), žádné detekovatelné defekty na ventilačních scintigramech (dolní řada).
Obr. 2. Schéma plicních segmentů při planárním vyšetření (pravá bočná a levá bočná projekce).
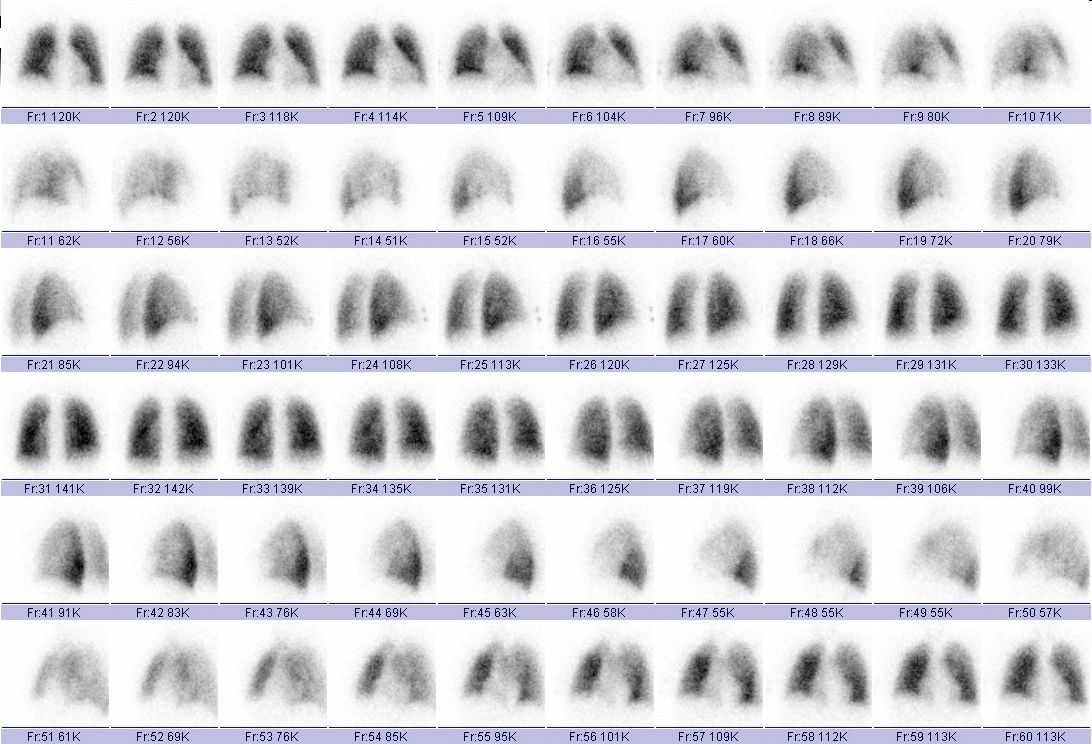
Obr. 3A Normální SPECT nález plicní perfuze u 38letého muže – nezpracovaná surová („raw“) data (60 projekcí získaných rotací dvoudetektorové scintilační kamery kolem těla pacienta)
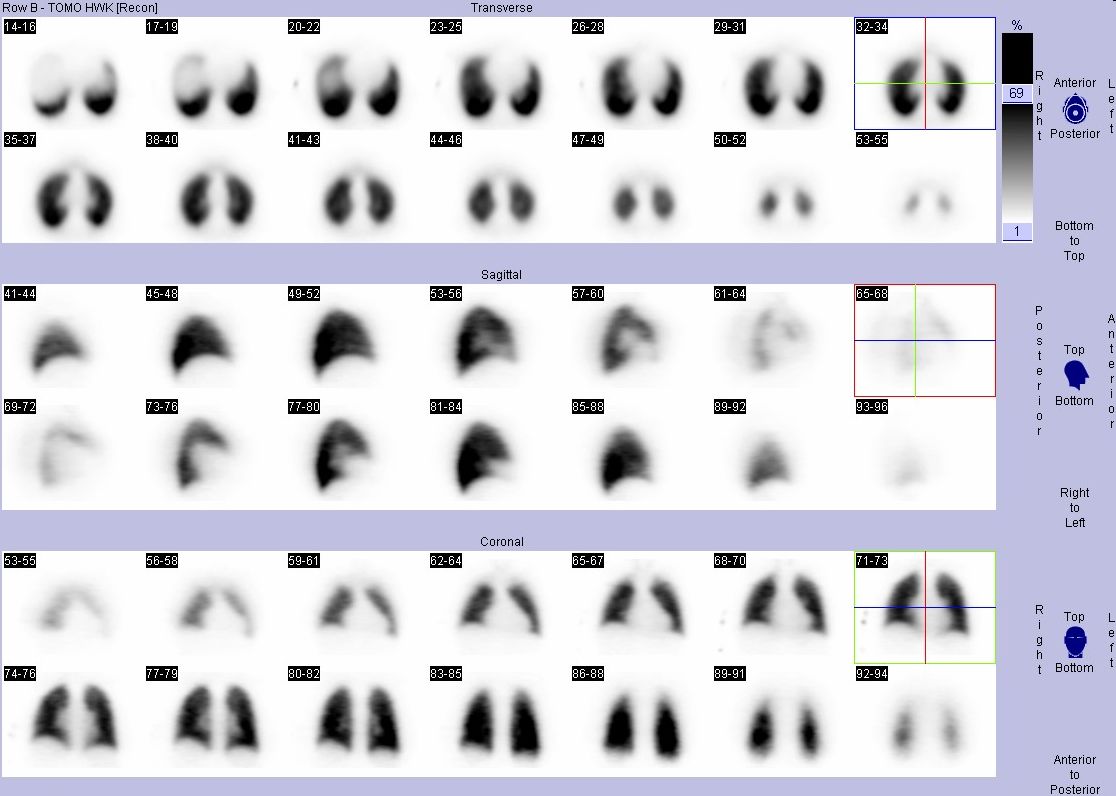
Obr. 3B Normální SPECT nález plicní perfuze u 38letého muže – tomografické řezy
Kromě hodnocení obrazů v jednotlivých projekcích a na tomografických řezech ve třech na sebe kolmých rovinách lze prohlížet i rotující 3D obrazy perfúze – viz Animace 1. Byla vypracována různá kritéria pro stanovení pravděpodobnosti plicní embolizace (PIOPED, PISAPED apod.). Při definitivní interpretaci scintigrafického perfuzního nálezu je však třeba zhodnotit i samotný klinický nález u pacienta. Například u pacienta s tromboflebitidou a bez známek chronické obstrukční bronchopulmonální choroby nebo jiného onemocnění plic je i méně rozsáhlý perfuzní defekt vysoce suspektní z embolizace. Dle některých současných autorů by při použití kvalitních scintilačních kamer a SPECT vyšetření měly být za nález svědčící pro plicní embolii považovány všechny střední a větší perfuzní defekty bez ventilačního korelátu. Důležitějším kritériem než velikost defektu se zdá být výše uvedený klínovitý tvar a lokalizace.
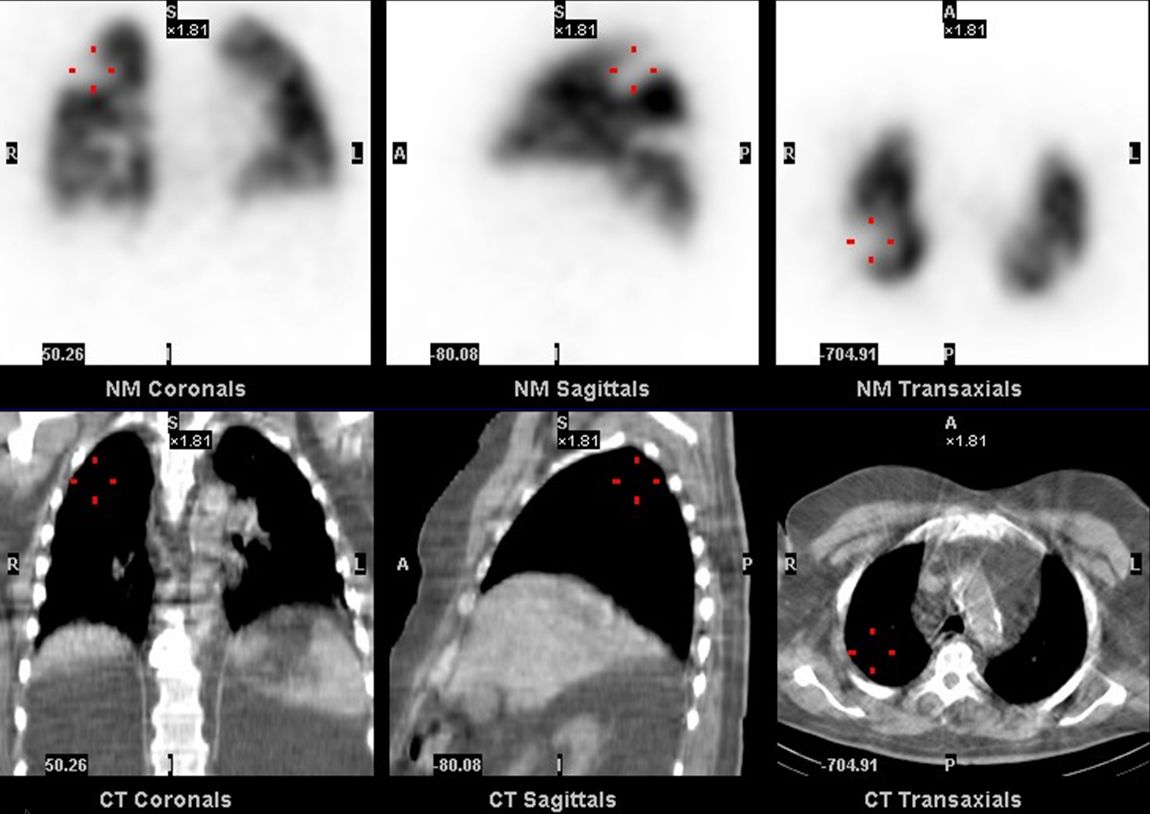
Pokud je ventilační vyšetření v daném okamžiku neproveditelné, významně pomáhá při interpretaci perfuzního defektu kromě klinického obrazu i zhodnocení rentgenového snímku plic nebo CT. Současné moderní přístroje jsou nyní většinou hybridní SPECT/CT systémy (obrázek 4), které umožňují korelaci perfuzního skenu s CT plic. Pokud by v oblasti perfuzního defektu bylo zřejmé zastření na rentgenovém snímku nebo na CT, pak by pravděpodobnost embolizace do a. pulmonalis byla nízká. Při embolizaci do a. pulmonalis není na rentgenovém snímku nebo CT plic v místě perfuzního defektu zřejmé zastření (obrázek 5), popřípadě se mohou objevovat méně výrazné nálezy, např. ploténkové atelaktázy.
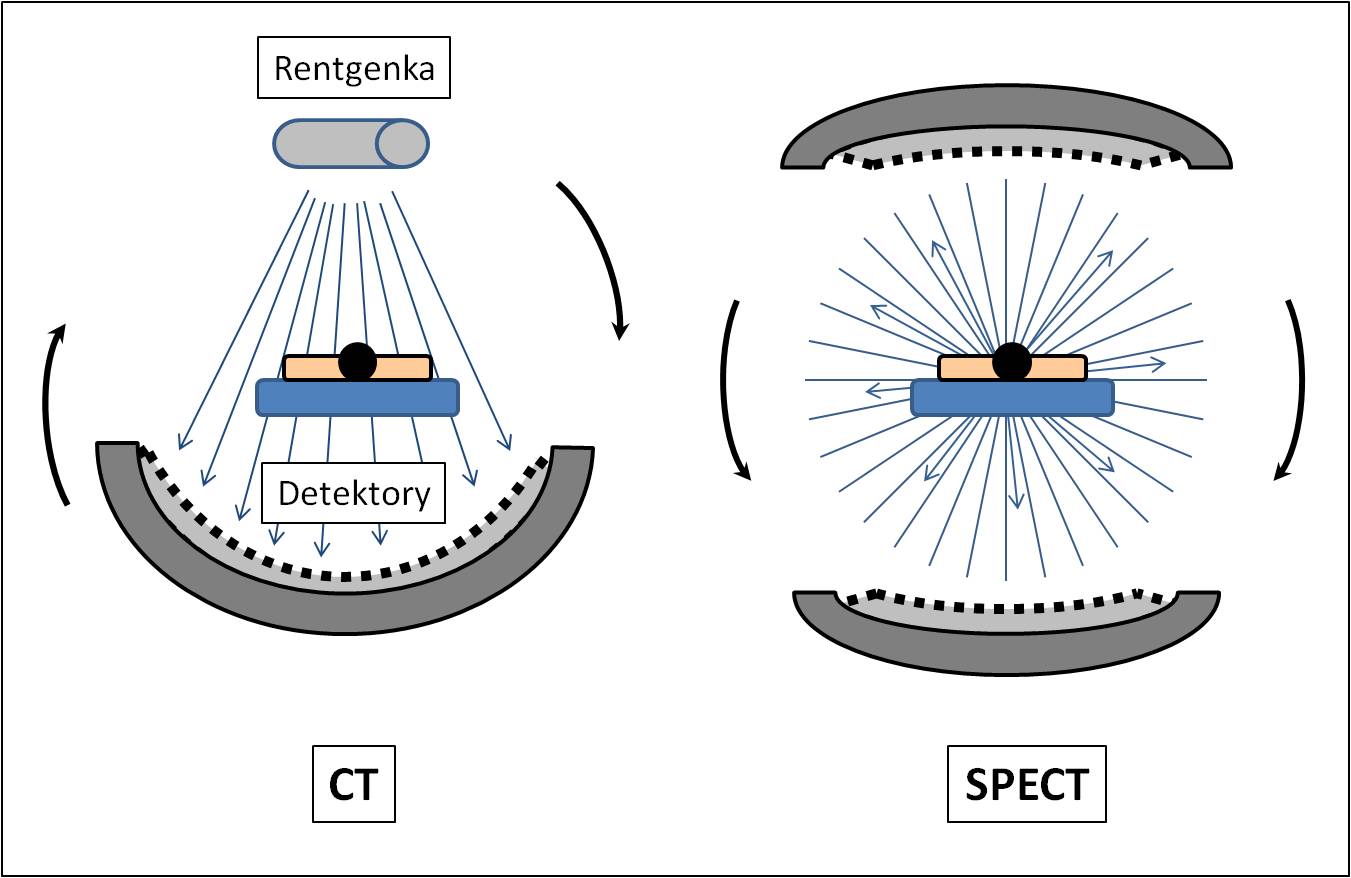
Obr. 4A Schéma transmisní (vlevo) a emisní (vpravo) výpočetní tomografie.
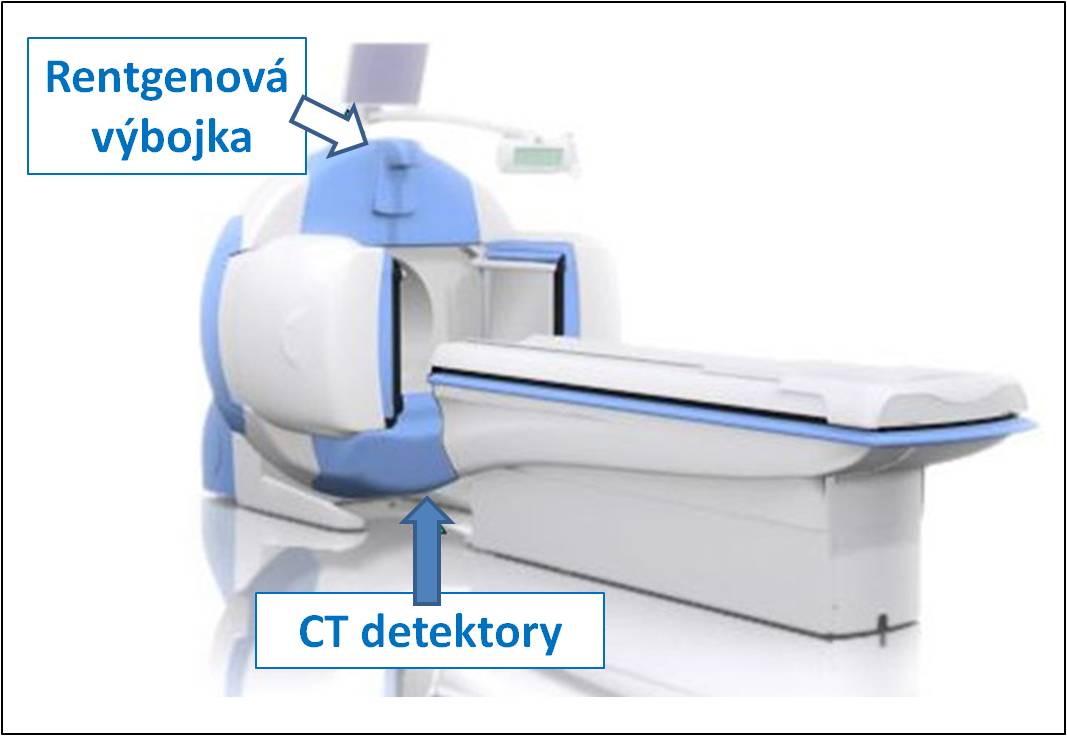
Obr. 4B Hybridní SPECT /CT kamera GE Infinia Hawkey 4
Obr. 5 Klínovité defekty plicní perfuze na SPECT (nahoře) bez zřejmého zastření na CT plic (dole). Nález svědčí s vysokou pravděpodobností pro embolizaci do plicnice
Zpracovali: Milan Kamínek, Pavel Koranda, Klinika nukleární medicíny LF UP a FN v Olomouci. Formálně upravil: Jaroslav Veselý, Ústav patologické fyziologie LF UP v Olomouci.
Literatura k dalšímu studiu:
Mettler FA, Guiberteau MJ. Essentials of Nuclear Medicine Imaging. Fifth Edition. London, Saunders Elsevier 2006.
Ziessman H, O´Maley J, Thrall J. Nuclear Medicine Requisities, Third Edition. London, Elsevier – Mosby 2006
Mysliveček M, Kamínek M, Koranda P, Hušák V. Nukleární medicína – 1. díl. Univerzita Palackého v Olomouci, Lékařská fakulta, 2007.
Bajc M, Neilly B, Miniati M, Mortensen J, Jonson B. Methodology for ventilation/perfusion SPECT. Semin Nucl Med 2010;40(6):415-25.
Bajc M, Neilly JB, Miniati M, Schuemichen C, Meignan M, Jonson B. EANM guidelines for ventilation/perfusion scintigraphy : Part 1. Pulmonary imaging with ventilation/perfusion single photon emission tomography. Eur J Nucl Med Mol Imaging. 2009;36(8):1356-70.
Bajc M, Neilly JB, Miniati M, Schuemichen C, Meignan M, Jonson B. EANM guidelines for ventilation/perfusion scintigraphy : Part 2. Algorithms and clinical considerations for diagnosis of pulmonary emboli with V/P(SPECT) and MDCT. Eur J Nucl Med Mol Imaging. 2009;36(9):1528-38.
Widimský J, Malý J, Eliáš P, Lang O, Franc P, Roztočil K. Doporučení diagnostiky, léčby a prevence plicní embolie. Doporučený diagnostický a lečebný postup České kardiologické společnosti. Cor Vasa 2008; 50(Suppl): 1S25–1S72
Jansa P, Popelová J, Al-Hiti H, Lindner J, Linhart A. Chronicka plicni hypertenze. Doporučený diagnostický a lečebný postup České kardiologické společnosti. Cor Vasa 2011; 53(3):169–182