autor: MUDr. Ondřej Veselý
pracoviště: Ústav patologické fyziologie LF UP Olomouc, Dětská endokrinologická ambulance Svitavské nemocnice a.s.
Úvod
Vitamin D představuje pozoruhodnou molekulu, která svou povahou z části patří mezi vitamíny a z části mezi hormony. Současně jde o molekulu, bez které se živé organismy neobejdou již mnoho a mnoho miliónů let. Charakterem svého účinku je blízkým příbuzným steroidních hormonů, ale není syntetizován žádnou klasickou endokrinní žlázou. Zároveň není klasickým vitamínem, protože většina potřeb vitaminu D v organismu (80 – 90 %) je pokryta jeho endogenní syntézou v kůži, kdežto přívod ve stravě nabývá na významu pouze v situacích, kdy je vlastní tvorba nedostatečná.
První popisy klinických projevů rachitidy pocházejí už z 16. a 17.století. Objev léku na rachitidu koncem 18.století byl dílem náhody, kdy lékárník pacientce trpící osteomalacií doporučil mazání bolavých kloubů rybím olejem, ta však jeho doporučení špatně pochopila a olej z tresky místo mazání pila. Výsledkem bylo „zázračné“ uzdravení a rybí tuk tak zahájil své vítězné tažení v boji s křivicí, i když podstata účinku zůstala skryta až do začátku 20.století, kdy byl vitamin D z rybího tuku izolován a současně byl objeven preventivní a léčebny účinek slunečního záření. I přes tyto objevy zůstala křivice až do poloviny 20.století jedním z nejčastějších onemocnění dětí útlého věku. V sedmdesátých letech 20.století pak byl popsán metabolismu vitaminu D a vznik jeho aktivní formy kalcitriolu po hydroxylaci v játrech a ledvinách. Od 90. let 20. století pak dochází k renesanci starého vitamínu v souvislosti s objevem receptoru pro vitamin D a jeho expresi v mnoha buňkách a tkáních, které primárně nesouvisí s kalciumfosfátovým metabolismem. V současné době je deficit vitaminu D velmi intenzivně zkoumán zejména v souvislosti s autoimunními chorobami, nádory, cukrovkou, hypertenzí, srdečním selháním. Jen pro ilustraci: V databázi Medline se zobrazí téměř 7000 příspěvků za poslední dekádu, které obsahují v názvu slovo vitamin D.
Zdroje vitaminu D pro lidský organismus
Ve stravě se vitamin D vyskytuje ve dvou formách:
- Vitamin D2 neboli ergokalciferol, který je původu rostlinného a je obsažen zejména v obilovinách a zelenině.
- Vitamin D3 neboli cholekalciferol, který je původu živočisného a jeho nejvydatnějším a všeobecně známým zdrojem je rybí tuk a dále játra, mléčné výrobky. Po stránce biologické efektivity je asi 3x – 10 x účinnější než vitamin D2, protože biologický poločas jeho produktu 25-hydroxy-cholekalciferolu (25-OH-D3) v séru je mnohem delší, pomaleji podléhá degradaci než 25-OH-D2.
Vitamin D je rozpustný v tucích a proto jeho vstřebání závisí na schopnosti digesce a absorpce tuků v GIT, což předpokládá zejména suficientí sekreci žluči, pankreatické šťávy a intaktní střevní sliznici. Po resorpci je vitamin D společně s tuky transportován v chilomikrech lymfou do cirkulace.
Podmínkou syntézy vitaminu D v kůži je dostatečná expozice slunečnímu záření (konkrétně UVB). Pokud je toto zajištěno, pak dochází v keratinocytech k tvorbě vitaminu D z provitaminu D, kterým je 7-dehydrocholesterol. Provitamin D3 nejprve vlivem UV záření (o vlnové délce 270 – 300 nm) fotokonvertuje na previtamin D3, který se v dalším kroku spontánně za účasti tepla ze slunečního záření přeměňuje na vitamin D3. Doba expozice nutná k zajištění dostatečné syntézy závisí na řadě faktorů:
- Typ kůže. Lidé tmavé pleti potřebují delší (3 x – 10 x) dobu expozice slunečnímu osvitu než lidé bílé pleti.
- Roční období. Vcelku pochopitelně vystavení se slunečnímu osvitu v létě je podstatně účinnější než v zimě. V létě fotony UVB záření urazí skrze atmosféru kratší cestu k naší kůži než v zimě. S čímž úzce souvisí také vliv dalšího faktoru a to je
- Zěměpisná šířka. Nedostatkem vitaminu D jsou ohroženy populace žijící nad 40.stupněm severní (jižní) zeměpisné šířky.
- Oblečení a sluneční krémy s UV filtrem. Rostoucí ozonová díra, stoupající výskyt rakoviny kůže (zejména maligního melanoblastomu) vede ke chválihodné snaze našich kolegů dermatologů edukovat obyvatelstvo stran ochrany před škodlivým vlivem slunečního záření. Na straně druhé, ale zahalování od hlavy až k patě v kombinaci s používáním ochranných krémů s vysokým UV faktorem limituje možnosti vlastní tvorby vitaminu D. V některých kulturách je pak zahalování součástí náboženských zvyklostí, což paradoxně může vést k výskytu deficitu vitamínu D i v regionech s celoročně dostatečným slunečním osvitem.
- Věk. S rostoucím věkem klesá schopnost tvorby vitaminu D v kůži, ve stáří až o ¾.
Nadměrná expozice slunci nevede k nadměrné tvorbě vitaminu D, protože pokračující expozice UV záření (o vlnové délce 315-330 nm) rozkládá provitamin D3 na inaktivní degradační produkty. Hypervitaminóza D proto může vzniknout jen při vysokém přívodu vitaminu D ve stravě.
Po vstupu do krevního oběhu je vitamin D transportován ve vazbě na vitamin-D-binding protein (DBP), ze skupiny alfa-2-globulinů. Přebytek vitaminu D se ukládá do zásob v tukové tkáni, ale také ve svalech a játrech.
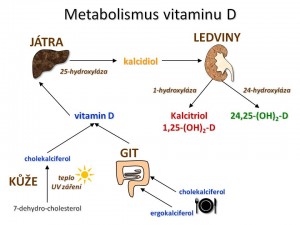
Metabolismus vitaminu D
Vitamin D je v podstatě provitaminem, který teprve aktivací v organismu nabývá biologické účinnosti. Místem aktivace vitaminu D jsou játra a ledviny.
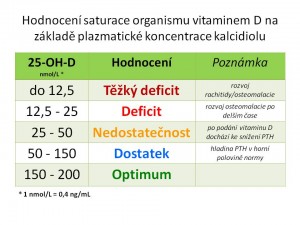
Prvním krokem v aktivaci je hydroxylace na 25. uhlíku, ke které dochází v játrech účinkem enzymu 25-hydroxylázy (kódované genem CYP2R1) za vzniku 25-OH-D neboli kalcidiolu. Po stránce kvantitativní je 25-OH-D hlavním metabolitem vitaminu D kolujícím v krvi s biologickým poločasem 20 – 30 dní. Současně není tvorba kalcidiolu zpětně regulována samotným kalcidiolem. Plazmatická koncentrace kalcidiolu proto představuje nejpřesnější ukazatel saturace organismu vitaminem D. Normální koncentrace kalcidiolu je udávána v rozmezí 20 – 100 ng/ml či 50 – 250 nmol/l (1 ng/ml = 2,5 nmol/l). Kalcidiol cirkuluje ve formě vázané na plazmatické proteiny, především na již zmiňovaný DBP. Volná, biologicky aktivní frakce kalcidiolu představuje asi 0,04 % cirkulujícího 25-OH-D.
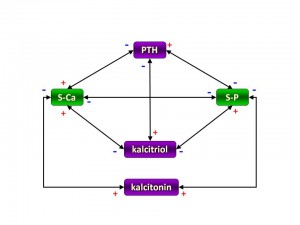
Druhý krok aktivace probíhá v ledvinách přesněji v mitochondriích buněk proximálního tubulu, kde účinkem enzymu 1-alfa-hydroxylázy vzniká nejúčinnější forma vitaminu D a to je 1,25-(OH)2-D neboli kalcitriol, který společně s PTH a kalcitoninem patří mezi hlavní regulační hormony kalciumfosfátového metabolismu. Aktivita 1-alfa-hydroxylázy a exprese jeho genu (CYP27B1) je regulována dle potřeb organismu resp. hladin vápníku a fosfátů v krvi. Hlavním aktivátorem 1-alfa-hydroxylázy je parathormon, jehož sekrece se zvyšuje při hypokalcemii a/nebo hyperfosfatemii. Aktivitu také zvyšuje samotná hypokalcemie a hypofosfatemie. Mezi další méně významné faktory zvyšující tvorbu kalcitriolu patří: estrogeny, růstový hormon, inzulin, prolaktin. Naopak tvorbu kalcitriolu snižuje zpětnovazebně samotný kalcitriol a to nepřímo přes snížení sekrece PTH, inhibiční účinek na 1-alfa-hydroxylázu má rovněž hyperkalcemie, hyperfosfatemie a také teofyliny či kyselina močová. Podmínkou aktivity 1-alfa-hydroxylázy je dodávka elektronů, jejich zdrojem v tomto případě je NADPH a přenašečem ferredoxin.
Schopnost tvorby kalcitriolu nemají jenom ledviny, ale i jiné tkáně jako například vlasové folikuly, makrofágy, lymfocyty, buňky Langerhansových ostrůvků pankreatu, mozek, nadleviny, placenta, mléčná žláza a další, ve kterých tvorba kalcitriolu není určována stavem kalciumfosfátového metabolismu, ale pouze nabídkou substrátu (kalcidiolu) a účinek vzniklého kalcitriolu není systémový (endokrinní), ale lokální (autokrinní či parakrinní).
Plazmatické koncentrace kalcitriolu jsou o 3 řády nižší než kalcidiolu, ale stejně jako kalcidiol je i plazmatický kalcitriol vázán na plazmatické bílkoviny na prvním místě DBP, volná frakce kalcitriolu představuje 0,4 %.
Degradace kalcitriolu probíhá v ledvinách, játrech, kostech, střevě a to konjugací s kyselinou glukuronovou, sulfatací a především vícečetnou hydroxylací (na uhlících 23, 24, 26). Vzniklé hydrofilní produkty se vylučují močí a žlučí. Klíčovým degradačním enzymem je 24-hydroxyláza (kódovaná genem CYP24A1), jehož účinkem z kalcitriolu vzniká biologicky neaktivní metabolit 1,24,25-(OH)3-D. Exprese genu pro 24-hydroxylázu je regulována ve smyslu plus hyperkalcemií, hyperfosfatemií a samotným kalcitriolem, naopak suprimována hypokalcemií, hypofosfatemií a parathormonem.
Tento enzym rovněž hydroxyluje kalcidiol za vzniku 24,25-(OH)2-D, který představuje kvantitativně druhou nejvýznamnější formu vitaminu D cirkulující v plazmě a který překvapivě není neaktivní, ale podílí se svým účinkem na objemu a mechanické odolnosti kosti a zřejmě se také účastní metabolismu lipidů.
Za zmínku stojí vzájemné vztahy mezi 25-OH-D, 1,25-(OH)2-D a 24,25-(OH)2-D. Zatímco hladina kalcitriolu je na hladině kalcidiolu obvykle nezávislá, naopak plazmatická koncentrace 24,25-OH-D obvykle kopíruje hladinu kalcidiolu. Obé svědčí pro důležitou regulační schopnost organismu udržet si změnou katalytické aktivity 1-hydroxylázy a 24-hydroxylázy hladinu klíčového aktivního metabolitu vitaminu D na potřebné úrovni bez ohledu na aktuální hladinu jeho prekurzoru. Výjimkou jsou situace těžké hypovitaminózy či hypervitaminózy D, kdy tento mechanismu selhává a hladina kalcitriolu se snižuje nebo zvyšuje mimo fyziologické meze.
Receptor pro vitamin D (VDR)
Účinky vitaminu D resp. kalcitriolu jsou zprostředkovány jeho interakcí s VDR neboli receptorem pro vitamin D. VDR patří do velké rodiny nukleárních transkripčních faktorů a má 5 domén (A – E). VDR vykazuje podobnost s receptory pro steroidní a tyreoidální hormony.
Gen pro VDR je u člověka lokalizován na dlouhém raménku 12. chromozomu. Gen pro VDR se v populaci vyskytuje v několika variantách, hovoříme o alelickém polymorfismu (podobně jako u krevních skupin). I když se jednotlivé varianty genu pro VDR od sebe prakticky neliší co do struktury a základní funkce VDR, byl prokázán vztah mezi genotypem na straně jedné a stupněm mineralizace či lineárním růstem kostí na straně druhé (např. chlapci s genotypem BB jsou menší při narození a během puberty, dospělý muži s genotypem BB mají nižší kostní denzitu).
Exprese genu pro VDR je stimulována:
- Kalcitoninem produkovaným parafolikulárními buňkami štítné žlázy
- Estrogeny, což je jeden z důvodů proč postmenopauzální ženy ohrožuje osteoporóza
- Vitaminem A, přesněji jeho aktivní formou v podobě kyseliny retinové
- Beta-kateninem který je součástí signalizační Wnt/b-cateninová cesty, jenž se mimo jiné podílí na proliferaci a diferenciaci osteoblastů.
Exprese genu pro VDR je potlačována:
- Glukokortikoidy, které tak funkčně představují antagonisty vitaminu D.
Receptor pro vitamin D se exprimuje nejen v tkáních souvisejících s metabolismem kostních minerálů jako je střevo, ledviny, kosti a příštítná tělíska, ale současně v mnoha dalších orgánech jako jsou vlasové folikuly, Langerhansovy ostrůvky pankreatu, hladká svalovina, myokard, mozek, gonády, nadledviny, děloha, placenta, slezina, brzlík, lymfocyty, makrofágy/monocyty a další. Proto je v současnosti upřena velká pozornost na studium nonkalcemických účinků vitaminu D a s tím souvisejícím vztahem nedostatku vitaminu D k mnohým civilizačním, metabolickým či autoimunním chorobám, o kterých pojednávají jiné příspěvky, například Vitamin D a metabolický syndrom
Genomické a negenomické účinky komplexu kalcitriol/VDR
Kalcitriol má dvojí typ účinků a to
- účinky genomické, které nastupují v časovém horizontu hodin až dnů a
- účinky negenomické, které nastávají během vteřin až minut.
Pro oba dva typy účinků je nutné spojení kalcitriolu s VDR. O typu účinku rozhoduje stereoizomerie, protože molekula kalcitriolu zaujímá v prostoru dvě izomerické podoby:
- forma trans je zodpovědná za pomalé genomické účinky kalcitriolu
- forma cis, která je zodpovědná za rychlé negenomické účinky
Mechanismus genomických účinků je následující: Molekula kalcitriolu je lipofilní a proto dokáže prostoupit buněčnou membránou. V cytoplazmě cílové buňky „potkává“ VDR, se kterým se spojí skrze jeho ligand – vázající doménu E a vytvoří společně komplex kalcitriol-VDR. Vzniklý komplex se dále spojuje s volným RXRa (Retinoid X Receptor Alfa) a vytváří heterodimer kalcitriol-VDR/RXRa. („volný“ RXRa znamená, že na něj není vázán jeho endogenní ligand, kterým je kyselina retinová). Heterodimer kalcitriol-VDR/RXRa se přesune do jádra, kde se váže na na VDRE (Vitamin D Response Element), což je sekvence DNA v oblasti promotoru vitaminem D regulovaných genů. Po navázání aktivovaného komplexu VDR/RXR na VDRE dochází ke změně (zvýšení/snížení) transkripce cílových genů. Mezi geny jejichž transkripci kalcitriol skrze VDR stimuluje a mají souvislost s obratem kostních minerálů patří: gen pro calbidin (kalcium vázající transportní protein), geny pro TRPV 5,6 (transportní kanály pro vápník), gen pro Na+/HPO42- kotransportér typ II (natriumdependentní přenašeč pro fosfáty), gen pro 24-hydroxylázu (tím zajišťuje degradaci sebe sama, tak aby nedošlo k nežádoucím projevům plynoucích z vysokých hladin kalcitriolu), gen pro osteokalcin (nekolagenní bílkovina kostní matrix produkovaná osteoblasty podílející se na mineralizaci kosti, biochemicky stanovitelný marker kostní formace pozitivně korelujícím s kostní denzitou), gen pro osteopontin (tato bílkovina hraje významnou úlohu v procesu remodelace a to jako inhibitor mineralizace a současně slouží k ukotvení osteoklastů na povrch kosti), gen pro RANKL (cytokinin produkovaný osteoblasty a stimulující diferenciaci preosteoklastů ve zralé osteoklasty). Mezi geny jejichž transkripci kalcitriol snižuje patří: gen pro PTH, gen pro PTHrP (parathormonu podobný protein), gen pro 1-alfa-hydroxylázu (tímto zpětnovazebně tlumí svou vlastní tvorbu).
Mechanismus negenomických účinků je ve stručnosti následující. Cis-forma kalcitriolu se váže na VDR receptory integrované do plazmatické membrány. Po navázání dochází k převodu informace přes některé klasické intracelulární signalizační kaskády jako například zvýšení aktivity adenylátcyklázy vedoucí skrze 2. posla v podobě cAMP k aktivaci proteinkinázy A nebo zvýšení aktivity fosfolipázy C, která vede k tvorbě 2.poslů IP3 a DAG, což mimo jiné otevřením vápníkových kanálů zvyšuje intracelulární koncentraci vápníku skrze uvolnění Ca2+ z intracelulární ch zásob. K dalším transdukčním systémům aktivovaných kalcitriolem patří: cesta MAP kinázy, cesta Jun-aktivovaníé kinázy. Mezi rychlé akce vitaminu D patří: vstup vápníku do některých buněk nebo třeba část účinků antiproliferačních. Rovněž se mohou rychlé účinky kalcitriolu cestou změny fosforylace proteinů podílet na podpoře zajištění účinků pomalých genomických.
Účinky kalcitriolu na kalciumfosfátový metabolismus a kosti
Účinky kalcitriolu si rozdělíme dle cílových tkání kalciumfosfátového metabolismu:
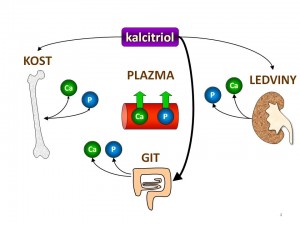
- Gastrointestinální trakt. GIT je hlavní cílovou tkání vitaminu D v regulaci Ca/P metabolismu. Kalcitriol zvyšuje kalcemii i fosfatemii tím že zvyšuje vstřebávání vápníku a v menší míře i fosfátů v tenkém střevě. Podstata účinku spočívá ve zvýšené expresi genů transportních proteinů pro kalcium (kalbidin), vápníkových kanálů (TRPV6), vápníkové pumpy (Ca-ATPáza) v buňkách střevní sliznice. K resorpci kalcia dochází především ve dvanáctníku a jejunu transcelulární cestou (skrze enterocyty). Resorpce fosfátů se odehrává hlavně v jejunu a ileu a děje se rovněž transcelulárně, kalcitriol zde zvyšuje expresi Na+/HPO42- kotransportéru typu II, který je zodpovědný za Na+ dependentní transport fosfátů přes luminální membránu enterocytů.
- Ledviny. Kalcitriol také zvyšuje kalcemii a fosfatemii tím, že zvyšuje zpětnou resorpci vápníku a fosfátů v ledvinných tubulech. V případě vápníku je mechanismus stejný jako ve střevě, tedy zvýšená exprese genů transportních proteinů a kanálů (kalbidin, TRPV5). Dále zpětnovazebně snižuje svou vlastní tvorbu útlumem 1-α-hydroxylázy a současně zvyšuje svou degradaci zvýšením aktivity 24-hydroxylázy.
- Příštítná tělíska. Kalcitriol snižuje tvorbu a sekreci parathormonu. To je účelné, protože PTH by jednak svým osteoresorpčním účinkem narušoval mineralizaci kostí podporovanou vitaminem D a současně by organismus byl ohrožen hyperkalcemií, protože PTH i kalcitriol plazmatickou koncentraci vápníku zvyšují.
- Kosti. Účinek kalcitriolu na kosti je komplexní a současně proměnlivý v závislosti na vstupních podmínkách. Za přiměřené saturace vitaminem D a při dostatečné dodávce vápníku ve stravě kalcitriol podporuje novotvorbu kosti, protože zvyšuje počet osteoblastů a stimuluje osteoblasty k syntéze bílkovin kostní matrix a k mineralizaci kosti. Při deficitu vápníku anebo při intoxikaci vitaminem D kalcitriol zvyšuje osteoresorpci, protože stimuluje diferenciaci osteoklastů. Mechanismus účinku, kterým tak činí, je nepřímý, zprostředkovaný systémem RANKL/RANK. RANKL (Receptor Activator of Nuclear factor Kappa B Ligand) je diferenciačním cytokininem produkovaný osteoblasty a určený pro prekurzory osteoklastů, které na svém povrchu exprimují receptor RANK. Po navázání RANKL na RANK se spustí signalizační kaskáda vedoucí k transkripci NF Kappa B dependentních genů, jejichž produkty pak zajistí diferenciaci preosteoklastů ve zralé osteoklasty.
Definice křivice a osteomalacie
Křivice je nedostatečná mineralizace kostní matrix u rostoucího dítěte, která vede k deformaci kostí, růstové retardaci a zvýšenému riziku zlomenin. Nedostatečná je zejména enchondrální mineralizace růstových chrupavek.
Osteomalacie je nedostatečná mineralizace kostní matrix skeletu dospělého člověka, která vede ke zvýšenému riziku zlomenin. Mineralizace je defektní jak v kosti trabekulární tak kortikální.
Základní rozdělení příčin křivice a osteomalacie
Základním minerálem kostní matrix je hydroxyapatit Ca5(PO4)3(OH) a k jeho formaci je jako substrátu potřeba vápníku a fosfátů. Z tohoto pohledu příčinou křivice může být: nedostatek vápníku a/nebo nedostatek fosfátů v organismu. Samotný nedostatek vápníku či fosfátů v kostech čili porucha jejich mineralizace může být z patofyziologického pohledu způsobena následujícími příčinami:
- Nedostatek vápníku a/nebo fosfátů ve stravě
- Malabsorpce vápníku a/nebo fosfátů z GIT
- Zvýšené ztráty vápníku a/nebo fosfátů ledvinami
- Porucha procesu mineralizace i přes dostatek vápníku a fosfátů
Křivice z nedostateku vápníku a/nebo fosfátů ve stravě
Patří v naší republice k příčinám vzácným vyjma některých specifických skupin v populaci. Do této kategorie co do nedostatečného příjmu vápníku zahrnujeme vegany, kteří odmítají nejen maso a vejce, ale i mléko a mléčné výrobky. Dále mají nedostatečný příjem Ca2+ staří lidé, kteří z úsporných důvodů žijí na „čaji a rohlících“. Jiná situace je u dětí z rozvojových zemí, u kterých může být obsah vápníku ve stravě natolik nízký, že i přes dostatečný přívod fosfátů a normální saturaci vitaminem D, se rozvíjí obraz křivice. Nedostatek fosfátů pro jeho obsah ve většině jídel je neobvyklý, rizikovou skupinu představují pacienti na parenterální výživě či třeba dívky s mentální anorexií. V neposlední řadě zmiňme nezralé novororozence, kteří, byť kojení, potřebují přídatnou suplementaci fosfátů.
Křivice z malabsorpce vápníku a/nebo fosfátů z GIT
Vápník se vstřebává v tenkém střevě, narušení tohoto procesu (dáme-li pro zatím stranou nedostatek vitamin D) může být způsobeno (a) stavy poškození střevní sliznice, které neumožní dostatečnou absorpci obvykle více živin, nejen vápníku, příkladem je celiakie nebo Crohnova choroba, (b) přítomnost látek bránících vstřebávání vápníku jako například fosfátů (Coca-Cola, tavené sýry) či oxalátů (kakao, špenát), obdobně vápník váže vláknina. Vstřebávání fosfátů z GIT blokuje přítomnost vyššího množství vápníku a hořčíku ve stravě, problém s resorpcí fosfátů mohou mít také lidé užívající velké množství antacid, protože fosfáty precipitují s kationty účinné látky léku snižujícího kyselost žaludeční, kterou je například hydroxid hlinitý.
Vitamin D deficitní křivice
Nedostatek vitaminu D vede k nedostatečné resorpci vápníku a fosfátů ze střeva a současně k poruše mineralizace osteoidu. Deficit sám o sobě má celou řadu příčin:
- Nedostatek vitaminu D ve stravě. Typicky kojené děti, protože mateřské mléko, ač jinak dokonalé ve svém složení, neobsahuje dostatek tohoto vitaminu.
- Nedostatečné vstřebáváním vitaminu D z GIT v rámci malabsorpčních syndromů. Vitamin D patří mezi vitaminy rozpustné v tucích a proto malabsorpce tuků přítomná u insuficience exokrinního pankreatu či tvorby žluči ohrožuje i resorpci tohoto vitaminu. Současně s první nebo druhou možností musí být přítomna
- Nedostatečná tvorba vitaminu D v kůži způsobená nedostatečným slunečním osvitem v zimních měsících, u malých dětí, u jedinců tmavé pleti, přiliš „dokonalé“ opalovací krémy, zahalování těla z náboženských důvodů.
Následkem nedostatečného vstřebávání vápníku a z toho plynoucí hypokalcemie se rozvíjí druhotná hyperparathyreóza, což na jedné straně zmírňuje hypokalcemii, zejména zvýšenou kostní resorpcí, ale na straně druhé prohlubuje hypofosfatemii ztrátou fosfátů ledvinami.
Laboratorní obraz vitamin D deficitní křivice zahrnuje přítomnost: normo/hypokalcemie, hypofosfatemie, snížení kalcidiolu, zvýšení/normu/snížení kalcitriolu, zvýšení PTH, zvýšení ALP.
Rizikové skupiny ohrožené deficitem vitaminu D. Obecně se jedná o část populace, u které je z nějakých důvodů snížený příjem vitamínu D ve stravě a/nebo snížená endogenní tvorba vitaminu D v kůži a/nebo zvýšená potřeba vitaminu D. Konkrétně se jedná o:
- plody in utero, děti, dospívající z důvodu růstu
- kojenci, protože obsah vitaminu D v mateřském mléce je nízký (asi jen 50 IU/L)
- těhotné a kojící ženy mají vyšší potřebu vitaminu D
- senioři, protože s věkem klesá schopnost tvorby vitaminu D v kůži a současně ubývá receptorů pro vitamin D ve střevě
- vegetariáni a zejména vegani mají snížený přívod vitaminu D, protože jeho hlavním zdrojem jsou živočišné bílkoviny, mléčné výrobky a vejce.
- pacienti s malasimilačními syndromy, kteří mají sníženou resorpci vitaminu D ve střevě. Příkladem je celiakie, cystická fibróza, obstrukce žlučových cest atp.
- obézní lidé, protože vitamin D uložený v tuku je hůře biologicky dostupný pro potřeby organismu
- lidé s nedostatečným kontaktem se slunečním zářením. Především se jedná o populace žijící blíže k zemským pólům (nad 40st severní a pod 40st jižní zeměpisné šířky), kde se v zimních měsících slunce pohybuje příliš blízko horizontu a současně se lidé pro chlad zahalují. Dále sem patří lidé zahalující se z kulturních, náboženských, zdravotních důvodů (kancerofobie) a malé děti.
Prevence deficitu vitaminu D. Ještě do nedávna byla všeobecně doporučována denní dávka vitaminu D 10ug = 400 IU pro děti i dospělé. Ve světle nových studií o vztahu vitaminu D nejen ke kalciumfosfátovému metabolismu, ale i k imunitnímu systému, kardiovaskulárnímu aparátu, metabolickým, onkologickým a dalším onemocněním je čím dál tím víc zřejmé, že tato dávka je nedostatečná. Nově je proto doporučeno 800 IU vitaminu D na den pro všechny bez rozdílu věku a pohlaví. U rizikových skupin ale může být dávkování ještě vyšší. Pro individualizování dávky by bylo potřeba stanovit hladinu kalcidiolu, který, jak už bylo řečeno výše, nejlépe odráží stav saturace organismu vitaminem D. Je jasné, že pokud má pacient nižší hladinu kalcidiolu, bude potřebovat iniciálně vyšší denní dávky pro její optimalizaci. Problém je, že zatím nebyla jednoznačně stanovena minimální hranice pro optimální hladinu kalcidiolu. V literatuře je žádoucí hranice, nad kterou by se měla hladina kalcidiolu pohybovat, uváděna nad 30 – 60 ng/ml = 75 – 150 nmol/l. Pokud dotyčný pobývá přiměřeně často na slunci je saturace dostatečná a perorální suplementace vitaminu D není nutná. Pro vytvoření 800 – 1000 IU vitaminu D je potřeba přímé vystavení kůže rukou a obličeje slunci po dobu 5 – 10 minut. Naopak, není-li sluneční osvit dostatečný či není efektivní (staří lidé), je potřeba zajistit přívod vitaminu D enterálně, za předpokladu, že není přítomen malabsorpční syndrom. K dispozici jsou preparáty s obsahem vitaminu D3 i D2. Biologicky účinnější je D3, což je výrobcem preparátů s vitamine D2 vyváženo tím, že na 1 kapku obsahuje více jednotek vitaminu D. V případě dětí je perorální podávání vitaminu D doporučeno (a) kojeným i nekojeným dětem (standartní nefortifikovaná umělá mléka (UM) obsahují sice více vitaminu D než mateřské mléko (MM 50 IU vit. D/L versus UM 50 IU vit.D /100ml), jenže i to je nedostatečné) od 2.týdne života do 1 roku u dětí narozených na jaře a do 1,5 roku u dětí narozených na podzim, (b) u všech dětí starších jednoho roku v zimních měsících (konec října až začátek dubna) a to až do puberty včetně. Základní podmínkou účinnosti vitaminu D je současná dostatečná dodávka vápníku ve stravě.
Křivice z poruch aktivace a účinku vitaminu D v organismu
Vitamin D prochází dvojí hydroxylací, první v játrech a druhou v ledvinách, která jeho účinnost zvyšuje o tři řády, současně musí být schopen vázat se a aktivovat VDR.
Přeměna vitaminu D na potentní kalcitriol či účinnost samotného kalcitriolu může být narušena z příčin získaných:
- Jaterní či renální selhání snižuje účinnost vitaminu D, protože je narušena přeměna vitaminu D na kalcidiol či přeměna kalcidiolu na kalcitriol. Příčiny a následky postižení skeletu u renálního selhání jsou ale složitější, kdy deficit kalcitriolu představuje jen jeden patogenetických činitelů. Výsledkem není v tomto případě osteomalacie, ale renální osteodystrofie, o které blíže pojednává příspěvek Doc.Dostálové o patofyziologických aspektech chronického selhání ledvin.
- Některá antikonvulziva jako fenytoin, fenobarbital inhibují aktivitu 25-hydroxylázy v játrech.
- K nedostatečné aktivaci vitaminu D v ledvinách dochází při primární hypoparathyreóze, protože chybějící PTH představuje hlavní stimul exprese a aktivity 1-alfa-hydroxylázy.
- Glukokortikoidy ať už endogenní či exogenní jsou antagonisty vitaminu D a to ze dvou důvodů: (a) snižují expresi genu pro VDR a tím snižují resorpci vápníku a fosfátu v GIT, (b) zvyšují vylučování vápníku a fosfátů ledvinami. Výsledkem jejich účinku ale není osteomalacie, nýbrž kortikoidní osteoporóza, protože kortikoidy přímo (c) inhibují osteoblasty a naopak (d) podporují osteoklasty. Postižena není jen mineralizace, ale i tvorba organické kostní matrix, protože kortikoidy mají všeobecně (e) proteolytický účinek, což se dotkne i kostních bílkovin, z nichž 90 % tvoří kolagen.
Následující přehled uvádí vzácné, ale patofyziologicky zajímavé vrozené příčiny poruch aktivace a účinku vitamínu D:
- Inhibiční mutace genu pro jaterní 25-hydroxylázu (CYP2R1). Zde se funkčně jedná o poruchu přeměny vitaminu D na kalcidiol. Tato mutace byla zatím popsána jen u 2 bratrů Nigerijského původu. Klinický a rentgenový obraz odpovídá křivici, laboratorně kromě hypokalcemie a hypofosfatemie, je nápadně nízká hladina 25-OH-D při normální či zvýšené hladině vitaminu D.
- Vitamin D dependentní křivice typ I, je autozomálně recesivně dědičná mutace genu pro renální 1-alfa-hydroxylázu (CYP27B1), která se funkčně projeví sníženou aktivitou tohoto enzymu a tím i nedostatečnou přeměnou kalcidiolu na kalcitriol. Od křivice způsobené nedostatkem vitaminu se odlišuje normální hladinou kalcidiolu při extrémně nízké hladině kalcitriolu. Onemocnění je léčitelné fyziologickými dávkami kalcitriolu, proto má v názvu „vitamin D dependentní“.
- Vitamin D dependentní křivice typ II je rovněž AR dědičné onemocnění, kdy cílové tkáně (především kost a ledviny) jsou rezistentní na účinek kalcitriolu, u části pacientů byl prokázán konkrétní defekt receptoru pro vitamin D. Časový nástup a tíže klinických projevů závisí na tíži mutace, obvykle se manifestuje už v raném dětsví, ale existují i lehké formy, které mohou být diagnostikovány až v dospívání či dospělosti. Laboratorní známkou této formy křivice je mimořádně vysoká hladina kalcitriolu, která je výsledkem stimulačních vlivů hypokalcemie, hypofosfatemie a sekundární hyperparathyreosy. Současně mívají postižení alopecii, jako výraz ztráty účinku vitaminu D na buňky vlasových folikulů. Onemocnění je léčitelné vysokými dávkami kalcitriolu. Existuje i forma bez alopecie, kdy je postižena vazba komplexu kalcitriol/VDR na VDRE, příčinou je nadměrná exprese jedné bílkoviny ze skupiny ribonukleoproteinů (gen HNRPA1), která se naváže na VDRE oblast DNA a zabrání tak navázání heterodimeru kalcitriol+VDR/RXRa a tím i transkripční aktivaci na VDRE. Samotná příčina nadměrné exprese genu pro ribonukleoprotein je nejasná.
Křivice ze zvýšených ztrát fosfátů ledvinami
Společnou známkou této skupiny je výrazná hyperfosfaturie, přičemž příčiny mohou být opět vrozené nebo získané.
- Familiární hypofosfatemické rachitidy, je skupina vrozených onemocnění, kdy pro tubulární defekt ledvin dochází k velkým ztrátám fosfátů močí s rozvojem příznaků křivice. Postižení neodpovídají na léčbu vitaminem D, proto patří do skupiny vitamin D rezistentních rachitid. Genetická podstata a dědičnost hypofosfatemických křivic je různá:
- X-vázaná hypofosfatemická křivice je gonosomálně dominantně dědičná (postiženi jsou muži hemizygoti a ženy heterozygotky) choroba s postižením resorpce fosfátů v proximálním tubulu s následnou hyperfosfaturií (proto se choroba někdy nazývá jako fosfátový diabetes). Příčinou je funkčně ztrátová mutace PHEX genu (phosphate regulativ endopeptidase homolog X-linked). Nedostatek této peptidázy vede k hromadění růstového faktoru pro fibroblasty FGF-23, protože tento není dostatečně degradován na biologicky inaktivní produkty. FGF-23 (a) inhibuje zpětnou natriumdependentní resorpci fosfátů v proximálních tubulech, protože snižuje expresi genu pro Na+/fosfát- kotransportér apikální membrány tubulárních buněk, (b) FGF-23 snižuje aktivitu 1-alfa-hydroxylázy a tím i syntézu kalcitriolu. Plazmatická hladina FGF-23 koreluje s tíží hypofosfatemie. V klinickém obraze chybí oproti jiným formám svalová slabost a tetanický syndrom. Laboratorně je normální hladina plazmatického vápníku, je snížená hladina fosfátů, normální PTH a koncentrace kalcidiolu v plazmě. Hladina kalcitriolu bývá také normální, ale je nepřiměřeně nízká vzhledem k hypofosfatemii, protože se nerozvíjí sekundární hyperparathyreosa pro normální hladinu vápníku. Samotný vitamin D či kalcitriol k léčbě nestačí, současně jsou potřeba dodávky fosfátů, ovšem dávky fosfátů nesmí být zase příliš vysoké, protože by vedly k nežádoucímu rozvoji sekundární hyperparathyreosy, což by zhoršovalo stav kostí postiženého.
- Autosomálně dominantně dědičná hypofosfatemická křivice je způsobena mutací v genu pro FGF-23, což vede k tomu, že se FGF-23 stává rezistentní na degradaci protézami a jeho hromadění vede výše zmíněným mechanismem k inhibici reabsorpce fosfátů v proximálním tubulu, hyperfasfaturii, hypofosfatemii a z ní plynoucímu obraz křivice. Klinický, laboratorní a rentgenový obraz je podobný jako u X-vázané formy, pouze je navíc přítomna i svalová slabost.
- Autosomálně recesivně dědičná hypofosfatemická křivice je způsobena homozygotním nosičstvím mutace v genu pro DMP1 (dentin matrix acid phosphoprotein 1). DMP1 patří do rodiny nekolagenních proteinů kostní a zubní matrix. Funkčně (a) reguluje zahájení nukleace a formace hydroxyapatitu, tedy při jeho defektu dochází k postižení mineralizace osteoidu. (b) snižuje expresi FGF-23, takže při nedostatku funkčního DMP1 dochází k hromadění FGP-23 s druhotným rozvojem hyperfosfaturie a hypofosfatemie.
- Autosomálně recesivně dědičná hypofosfatemická křivice s hyperkalciurií (hereditární hypofosfatemická křivice s hyperkalciurií) je způsobena mutací genu pro NPT2c, který kóduje sodíko-fosfátový kotransportér typu 2c. Nefunkční NPT2c pak vede k plýtvání fosfáty skrze ledviny pro jejich sníženou resorpci v proximálních tubulech. U této formy renální hypofosfatemické křivice, ale není postižena syntéza kalcitriolu (u předešlých 3 forem byla syntéza kalcitriolu snížená pro inhibici aktivity 1-alfa-hydroxylázy vysokými hladinami FGF-23) a proto jako reakce na hypofosfatemii stoupá tvorba kalcitriolu, tím pádem i resorpce vápníku ze střeva a to má za následek hyperkalciurii.
- Jiné vrozené tubulopatie spojené s hyperfosfaturií. Existuje celá řada dalších kongenitálních postižení nefronu, kde hyperfosfaturie je jeden z příznaků onemocnění, patří sem například: Fanconiho syndrom, Wilsonova nemoc, některé aminoacidurie, galaktosemie, intolerance fruktosy a další.
- Získané stavy spojené s hyperfosfaturií a hypofosfatemií. Ke zvýšeným renálním ztrátám fosfátů a dalších minerálů vede používání diuretik. K získanému renálních tubulů dochází při otravě rtutí, olovem či mědí, dále v transplantované ledvině či v rámci nefrotického syndromu. S hyperfosfaturií jsou rovněž spojeny hyperparathyreózy, zde však nejde o klasickou osteomalacii, protože postižení kostí je odlišné, mluvíme o tzv. hyperparathyreozní osteodystrofii.
Klinické příznaky křivice
- Kosti a zuby. U kojenců vídáme tzv. craniotabes, jedná se o měkkost kostí záhlaví, které je pohmatově pružné (hmatový vjem je připodobňován ke stlačení ping-pongového míčku). Vlivem poddajnosti skeletu lebky dochází při ležení k deformacím tvaru hlavy, caput quadratum (hranatá hlava). Velká fontanela se uzavírá se zpožděním. Zuby se prořezávají se zpožděním, mají defektní sklovinu a zvýšenou kazivost.Nedostatečně osifikovaný a mineralizovaný hrudní koš je poddajný, deformuje se (pectus carinatum, ptačí hrudník = hrudník je zploštělý ze stran a při bočním pohledu vyčnívá směrem vpřed hrudní kost) a je vtahován bránicí při dýchání, v místě jejího úponu za vzniku tzv. Harrisonovy rýhy. Na hranici mezi chrupavčitou a kostěnou částí žeber vznikají zduření, která připomínají korálky náhrdelníku, tzv. rachitický růženec. Nosné kosti dolních končetin se pod vahou těla ohýbají a vznikají šavlovité deformace, kolena jsou vybočena či vbočena (genua vara – dolní končetiny zaujímají tvar do „O“, genua valga – dolní končetiny jsou v postavení do „X“). Deformuje se také páteř a vzniká kyfoskolióza. Na horních končetinách vzniká viditelné zduření v oblasti zápěstí. Pro nedostatečný růst je dítě malé postavy. Děti mají zvýšené riziko fraktur. U dospělých s osteomalacií jsou příznaky méně nápadné, nejčastěji se jedná o bolesti v kostech.
- Nervosvalová dráždivost. Pokud je příslušný typ křivice provázen sníženou plazmatickou koncentrací vápníku (přesněji poklesu ionizované frakce vápníku) dochází ke zvýšení nervosvalové dráždivosti, protože při hypokalcemii se prahový potenciál, kdy se otvírají rychlé napěťově řízené sodíkové kanály, přesunuje do negativnějších hodnot, tím se zmenšuje napěťový rozdíl mezi prahovým potenciálem a klidovým membránovým potenciálem k vyvolání vzruchu pak postačuje podnět s nižší než obvyklou intenzitou tedy podnět podprahový. Klinickým projevem hypokalcemie jsou tetanické křeče. Pokud se křeče objevují jen po provokačním momentu (mechanická, elektrická stimulace, hypoventilace) mluvíme o tzv. latentní tetanii. Pokud se křeče objevují spontánně jde o tzv. manifestní tetanii. Podrobnější popis příznaků tetanického syndromu viz příspěvek „Vápník a poruchy jeho metabolismu“.
- Svaly. U dětí s vitamin-D-deficitní křivicí bývá svalová slabost a děti jsou motoricky opožděné ve vývoji, příležitostně se může vyvinout kardiomyopatie, která je po doplnění chybějícího vitamínu D reverzibilní.
Rentgenové příznaky křivice a osteomalacie
Celkově je na skeletu obraz snížené sytosti kostí = demineralizace, se ztenčením kortikalis, s prořídnutím spongiózy. Na snímcích dlouhých kostí bývá patrné rozvláknění metafýz, rozšíření epifýz, v případě kostí předloktí vzniká charakteristický obrázek tzv. rachitických pohárků (neostrost a nepravidelnost zóny provizorního zvápenatění na distálních koncích ulny a radia s konkávně prohnutým tvarem distálních metafýz). Na rtg snímcích mohou bý samozřejmě patrné výše uvedené deformity hlavy, hrudníku, páteře a dlouhých kostí. Méně nápadným projevem osteomalacie mohou být tzv. Looserovy zóny , jedná se o tenká proužkovitá projasnění příčně /kolmo k povrchu kosti jdoucí, jde o pseudofraktury hojící se osteoidním svalkem bez dostaku vápníku, nacházíme je hlavně na kostech sedacích, stydkých, dále v oblasti krčků femurů a humerů.
Diferenciální diagnostika příčin rachitidy dle laboratorních nálezů
K základním laboratorním parametrům, které je třeba při klinickém podezření na křivici či osteomalacii stanovit patří: plazmatická koncentrace vápníku, fosfátů, kalcidiolu, kalcitriolu, parathormonu a alkalické fosfatázy (event. její kostní frakci). Následující tabulka shrnuje shody a rozdíly mezi základními typy rachitid a dále srovnání s primární hyperparathyreózou a renální osteodystrofií:
Závěr
I když se díky preventivním opatřením obraz rozvinuté křivice v podmínkách Evropské Unie či USA vyskytne jen příležitostně (1 – 5 % dětí), není nedostatek vitaminu D zdaleka zažehnaný. Naopak z epidemiologických studií plyne, že sníženou saturací vitaminem D je ohroženo 30 – 50 % euroatlantické populace. Mírný nedostatek vitaminu D se neprojeví změnami osteologickým nebo jsou tyto změny diskrétní, ale nedostatečná hladina vitaminu D může mít souvislost s mnoha civilizačními chorobami, poruchami imunity nebo třeba se svalovou slabostí vedoucí k pádům u starých lidí. O vztahu deficitu vitaminu D k metabolickému syndromu, nádorům a autoimunním chorobám pojednávají další příspěvky na našem portále (odkazy).
Literatura
- BAYER M.Vitamín D ve světle staletí. Osteologický bulletin 2007; 12(2):47-48
- BAYER M. Vitamín D v pediatrické praxi. Postgraduální medicína 2010; roč.12, Příl. 2, s. 39-43
- BERNE RB, LEVY MN, KOEPPEN BM, STANTON BA. Physiology, 5th edition, Mosby 2004, pp. 801 – 805
- CIRMANOVÁ V. Vitamin D opět středem zájmu vědců i lékařů. Zdravotnické noviny 2011; roč. 13, č. 15, s. 18
- FERENCZOVÁ J., PODRACKÁ L. Vitamín D – nový pohľad na starý vitamín. Č-S Pediatrie 2009; 64(7-8):344-351
- GUYTON AC, HALL JE. Textbook of medical physiology, 11th edition, Elsevier Saunders 2006, pp. 983 – 985
- KALVACHOVÁ B. Vitamín D – nové poznatky a endokrinní mikrosystémy kalcitriolu. Osteologický bulletin 2007; 12(2):62-67
- KHOSLA S., Minireview: The OPG/RANKL/RANK Systém. Endocrinology 2001; 142(12): 5050-5055
- SPERLING MA. Pediatric Endocrinology, 3rd edition. Saunders Elsevier 2008; pp. 90-96, 723-734
- STÁRKA L, ZAMRAZIL V. Základy klinické endokrinologie, 2.vydání. Maxdorf 2005, str. 113-115
- ŠAŠINKA M, ŠAGÁT T a spol. Pediatria, 1.zväzok, 1.vydání, Satus 1998, str. 343 – 345
- ZIMA T. a kol. Laboratorní diagnostika, 2.vydání, Grada 2007, str. 253 – 254