autor: MUDr. Ondřej Veselý
pracoviště: Ústav patologické fyziologie LF UP Olomouc, Dětská endokrinologická ambulance Svitavské nemocnice a.s.
Úvod
Povrch alveolů představuje z fyzikálního hlediska rozhraní kapaliny a plynu. Na takové to rozhraní působí síla, která způsobuje, že se povrch tekutiny chová jako „pružná folie“ a tekutina se snaží zaujmout co nejmenší povrch, což je dáno sumou všech vzájemných interakčních sil mezi molekulami v dané kapalině, jedná se o tzv. povrchové napětí. Díky povrchovému napětí by tekutina v beztížném stavu zaujala tvar koule, protože koule má vzhledem k objemu ze všech geometrických těles nejmenší povrch. Pokud ale na tekutinu působí nějaké zevní síly (třeba gravitace), neumožní ji zaujmout ideální tvar. Molekuly kapaliny na povrchu by se ovšem „rády dostaly dovnitř“ do kapaliny, ale nemohou, protože místa uvnitř kapaliny jsou obsazena jinými molekulami této kapaliny, na povrchu vzniká „pnutí „ – povrchové napětí. Ze striktně fyzikálního pohledu jde o sílu působící ve směru tečny k povrchu na úsečku jednotkové délky, její jednotkou dle soustavy SI je N.m-1, co do velikosti jde o síly v hodnotách milinewtonů na metr (starší jednotka dyn/cm). Voda má hodnotu povrchového napětí asi 73 mN.m-1 (pro srovnání např. ethanol má povrchové napětí 22,5 mN.m-1, olivový olej 33 mN.m-1, rtuť 476 mN.m-1). Povrchové napětí vody je ve srovnání s jinými kapalinami relativně vysoké, díky jeho existenci mohou po vodě „běhat“ vodoměrky či „plavat“ mince položená naplocho na hladinu i přesto, že má větší hustotu než voda. Na druhé straně chceme-li zvětšit povrch tekutiny, musíme vynaložit energii – práci k překonání povrchového napětí.
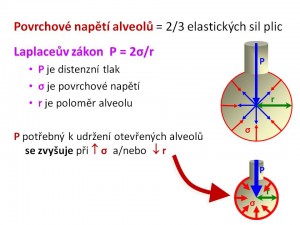
Vztaženo k respiračnímu systému představuje povrchové napětí alveolů odpor, který musí překonat dýchací svaly během nádechu svou prací, tj. musí být vynaložena energie na rozepětí alveolů. Povrchové napětí kapalin není veličina neměnná, snižuje se např. při zvýšení teploty (rychlejší pohyb molekul kapaliny) nebo přidáním povrchově aktivních látek. Proto dosáhneme větší efektivity při umývání, pokud použijeme teplou vodu a/nebo mýdlo, obé snížením povrchové napětí usnadňuje vodě přístup k povrchu umývaného objektu (ruce, nádobí, prádlo). Stejně tak díky účinku saponátů přidaného do vody můžeme vykouzlit velké bubliny, což by se nám s čistou vodou nepovedlo. Úlohu látky snižující povrchové napětí v alveolech hraje plicní surfaktant, tím že vytlačuje molekuly vody z rozhraní fáze kapalina/plyn. Pro pochopení účinku surfaktantu je pak potřeba ještě znalosti Laplaceova zákona, který popisuje vztah mezi povrchovým napětím (σ) a tlakem (P) uvnitř sférického dutého útvaru o daném poloměru (r), jehož stěna o tloušťce (h) je tvořena tekutinou, platí σ = P . r/2 . h. Pokud ho aplikujeme na plicní sklípky, pak platí, že distenzní tlak zabraňující kolapsu alveolu se zvyšuje při zvýšení povrchového napětí (např. deficit surfaktantu) nebo zmenšení velikosti poloměru alveolu.
Složení surfaktantu
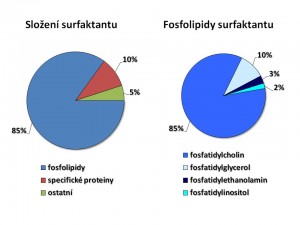
Surfaktant je svou biochemickou povahou lipoprotein resp. směs lipidů a proteinů. Podíl jednotlivých složek je přibližně následující:
- fosfolipidy 85 %
- specifické proteiny 10 %
- neutrální tuky 5 %
Fosfolipidy jsou nejvýznamnější složkou surfaktantu. Základem fosfolipidů je kyselina fosfatidová, jejíž centrální část představuje glycerol, který na straně jedné váže zbytek kyseliny fosforečné, na straně druhé dva acyly mastných kyselin, tedy jde o diacylglycerolfosfát. Ke kyselině fosfatidové je pak připojena další molekula cholin, ethanolamin, inositol, glycerol. Svými vlastnostmi patří fosfolipidy mezi amfifilní molekuly, tj. mají část, která je hydrofilní a část, která je lipofilní. Hydrofilní neboli polární část je ve vodě smáčivá, kdežto lipofilní neboli nepolární část je ve vodě nesmáčivá. Díky tomu se fosfolipidy hromadí na fázovém rozhraní, v případě alveolů tedy na rozhraní kapalina/plyn s orientací polárních částí směrem k vodné fázi, a vytváří na povrchu plicních sklípků jednovrstevný film. Kvantitativně hlavním fosfolipidem surfaktantu je fosfatidylcholin (PC) neboli lecitin tvořící 85 % fosfolipidů, další v pořadí je fosfatidylglycerol (PG) 10 %, fosfatidylethnolamin (PE) 3 % a fosfatidylinositol (PI) 2 % všech fosfolipidů. Z acylů mastných kyselin se ve fosfolipidech surfaktantu nejčastěji objevuje acyl kyseliny palmitové, takže nejčastější formou fosfolipidu je dipalmitoylfosfatydilcholin (DPPC), který kvantitativně představuje 40 – 55 % surfaktantu a je tak zároveň funkčně hlavní látkou snižující povrchové napětí alveolů.
Specifické proteiny po stránce kvantitativní tvoří jen malou část surfaktantu, ale mají značný význam funkční a to jak ve vztahu k účinnosti a stabilitě fosfolipidové vrstvy, tak ve vztahu k obranyschopnosti plic. Tyto specifické surfaktantové proteiny jsou čtyři a označujeme je velkými písmeny: SP – A (5 % z celkového složení surfaktantu), SP-B (2 %), SP – C (2 %), SP – D (1 %). Surfaktant získaný bronchiální laváží obsahuje i nespecifické proteiny, jedná se však o kontaminaci plazmatickými bílkovinami.
Neutrální tuky kvantitativně i funkčně nejméně významná složka surfaktantu. Počítáme sem cholesterol, triacylglyceroly, volné mastné kyseliny.
Biosyntéza surfaktantu
Epiteliální buňky plicních sklípků jsou dvojího typu. Pneumocyty I.typu mají tenký plochý tvar s redukovanými organelami v cytoplazmě. Co do počtu představují 40 % všech buněk alveolů, ale co do plochy pokrývají 95 %. Jejich výrazná „tenkost“ je klíčová pro výměnu dýchacích plynů mezi alveoly a kapilárami. Pneumocyty II. typu tvoří 60 % všech buněk alveolů, ale vystýlají pouze 5 % jejich povrchu. Mají kubický tvar a cytoplazmu bohatou na organely a jsou to právě ony, které produkují surfaktant. Pneumocyty II. typu jsou také odolnější vůči poškození a proto slouží jako rezervoár pro obnovu alveolární výstelky pomnožením a diferenciací na pneumocyty I. typu.
Syntéza složek surfaktantu probíhá v endoplazmatickém retikulu pneumocytů II. typu, z něho se pak jednotlivé komponenty surfaktantu přesouvají do Golgiho aparátu, kde dochází k jejich úpravě. Z Golgiho aparátu se odštěpují tzv. lamelární tělíska, ve kterých dochází k integraci jednotlivých komponent surfaktantu. Lamelární tělíska jsou následně secernována do alveolů, kde dochází k jejich „rozbalení“ a formaci surfaktantového filmu na povrchu plicních sklípků.
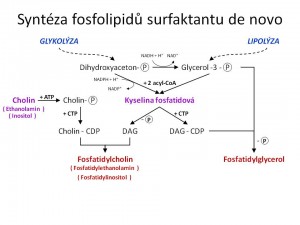
Syntéza fosfolipidů surfaktantu. Jejím úvodním krokem je syntéza kyseliny fosfatidové. Substráty jsou dihydroxyacetonfosfát (glykolýza) nebo glycerol-3-fosfát (fosforylace glycerolu z lipolýzy nebo redukce dihydroxyacetonfosfátu) a mastné kyseliny v podobě acyl-CoA (syntéza de novo přímo v plicích nebo volné mastné kyseliny z krve přitékající do plic). Oba substráty podstoupí dvojnásobnou acylaci (u dihydroxyacetonfosfátu navíc ještě redukce) tedy dojde k navázání dvou zbytků mastných kyselin na hydroxylové skupiny glycerolu na pozicích 1 a 2 a vznikne kyselina fosfatidová, která je pak základním kamenem pro syntézu všech jmenovaných fosfolipidů surfaktantu.
Syntéza surfaktantu začíná již prenatálně. Pneumocyty II. typu se diferencují v kanalikulárním stádiu vývoje plic v půlce těhotenství a od 22. – 24. týdne v nich lze prokázat lamelární tělíska svědčící pro syntézu surfaktantu. Ovšem teprve od 28. týdne začíná být tvorba surfaktantu kvantitativně významná. V dalším průběhu těhotenství jeho produkce dále stoupá a mění se jeho složení. Hlavním produkovaným fosfolipidem je od začátku fosfatidylcholin (PC), s postupujícím gestačním stářím stoupá jeho celkový podíl ve spektru fosfolipidů a zvětšuje se poměr saturovaného PC ku celkovému PC. Naopak podíl fosfatidylethanolaminu a fosfatidylinositolu v závěru těhotenství klesá. Fosfatidylglycerol se v surfaktantu objevuje až od 36. týdne těhotenství a jeho tvorba vytrvale roste až do porodu, jeho přítomnost tak svědčí pro plicní zralost.
Syntéza fosfatidylcholinu de novo je možná dvěma metabolickými cestami.
- První a klíčovou je tzv. CDP cholin transferázová cesta, využívající jako substráty kys. fosfatidovou a cholin. Cholin je potřeba nejprve energeticky povznést fosforylací a transferem na CDP (cytosin-difosfát) za vzniku CDP-cholinu. Z kys. fosfatidové odštěpením fosfátu vzniká diacylglycerol. Finální reakcí této cesty je pak spojení CDP-cholinu a diacylglycerolu, katalyzované enzymem cholinfosfotransferázou za vzniku fosfatidylcholinu.
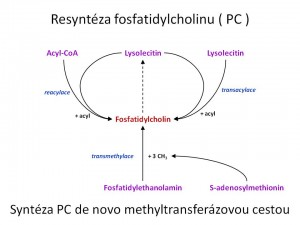
- Druhou a minoritní biochemickou dráhou vzniku PC de novo je tzv. metyltransferázová cesta. Substrátem je fosfatidyletanolamin. Podstatou jeho přeměny na fosfatidylcholin je trojnásobná metylace aminové skupiny. Donorem methylové skupiny je S-adenosylmethionin.
Resyntéza fosfatidylcholinu z lysolecitinu. Rozdíl mezi molekulami fosfatidylcholinu (lecitinu) a lysolecitinu činí počet acylů mastných kyselin. Lecitin má dva acylové zbytky a to v pozicích 1,2, kdežto lysolecitin pouze jeden acyl v poloze 1. Lysolecitin vzniká deacylací z lecitinu nebo je syntetizován de novo. Tak či onak může být použit pro syntézu/resyntézu fosfatidylcholinu a to buď procesem reacylace, kdy donorem acyl skupiny je acyl-koenzym A, nebo transacylací, kdy donorem acylu je druhá molekula lysolecitinu. Kvantitativně významnější je cesta reacylace. Vzájemné reakce mezi lecitinem a lysolecitinem mohou také vést k remodelaci fosfatidylcholinu, kdy je jeden typ acylu vyměněn za jiný, např. acyl kys. olejové za acyl kys. palmitové.
Syntéza fostadidylglycerolu jako výchozí molekulu rovněž využívá kys.fosfatidovou, z které se za účasti CTP formuje CDP-diacylglycerol. Tento pak v dalším kroku reaguje s glycerol-3-fosfátem za vzniku fosfatidylglycerolfosfátu, jenž se rychle defosforyluje na fosfatidylglycerol.
Syntéza fosfatidylethanolaminu je obdobná jako syntéza PC pomocí CDP transferázové cesty, s tím rozdílem že substrátem, který se aktivuje vazbou na CDP, není cholin, ale ethanolamin.
Syntéza fosfatidylinositolu rovněž využívá CDP. Substrátem, který je přenesen na CDP a tím aktivován, je v tomto případě diacylglycerol. Vzniklý CDP-diacylglycerol pak reaguje s inositolem.
Humorální regulace produkce surfaktantu
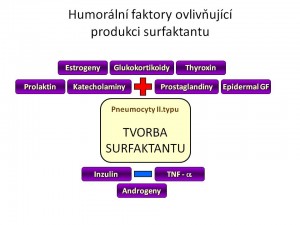
Syntéza a sekrece surfaktantu je pod vlivem řady hormonů, růstových faktorů či dalších působků:
- Glukokortikoidy jsou nejvýznamnějším endokrinním stimulem plicní maturace ve fetálním období a to jak po stránce morfologického zrání plic, tak po stránce produkce surfaktantu. Mechanismus účinku je dán vazbou kortikoidu na jeho receptora, vniklý komplex putuje do jádra, váže se na příslušnou hormon-responzivní oblast DNA a mění transkripci genů pro proteiny, které hrají buď úlohu strukturálních bílkovin, růstových faktorů či enzymů. Část účinků je ale zřejmě dána posttranskripčním efektem samotných glukokortikoidů. Ve vztahu k surfaktantu kortisol, případně exogenní kortikoidy
- zvyšují počet pneumocytů II. typu v plicních sklípcích vyvíjejícího se plodu
- zvyšují syntézu mastných kyselin potřebných pro syntézu fosfolipidů surfaktantu
- zvyšují syntézu těchto fosfolipidů stimulací enzymů cholin transferázové cesty
- zvyšují expresi genů kódujících specifické proteiny surfaktantu
- nepřímo zvyšují tvorbu a sekreci surfaktantu zvýšením počtu b-adrenergních receptorů pro katecholaminy na pneumocytech II. typu
- nepřímo zvyšují tvorbu a sekreci surfaktantu stimulací antioxidačních enzymů chránících alveolární výstelku před kyslíkovým stresem zejména při přechodu z nitroděložního relativně hypoxického prostředí do kyslíkově bohatého prostředí po narození.
- Katecholaminy vazbou na membránové b-adrenergní receptory zvyšují hladinu cAMP uvnitř buněk pneumocytů II. typu a tím tvorbu a sekreci surfaktantu, fyziologicky se jejich efekt uplatňuje zejména během porodu
- Thyroxin, Trijodthyronin hormony štítné žlázy zvyšují syntézu fosfatidylcholinu, nikoliv ale surfaktantových proteinů.
- Pohlavní hormony mají rozdílné účinky. Zatímco estrogeny stimulují syntézu fosfolipidů, naopak testosteron ji inhibuje a navíc zpožďuje vyzrávání pneumocytů II. typu. Mužské plody jsou proto co do plicní zralosti asi o jeden gestační týden opožděny oproti ženským plodům a novorozenci mužského pohlaví mají vyšší riziko rozvoje RDS.
- Inzulin je svým anabolickým účinkem antagonistou glukokortikoidů, inhibuje lipolýzu, glykolýzu a glykogenolýzu, tedy metabolické cesty dodávající potřebné substráty pro produkci fosfolipidů surfaktantu, navíc má i přímý inhibiční efekt na syntézu fosfatidylcholinu pneumocyty II. typu.
- Prolaktin je hormon mnoha tváří, mimo svého klasického účinku souvisejícího s laktací také mimo jiné zvyšuje syntézu fosfolipidů surfaktantu.
- Některé prostaglandiny a leukotrieny rovněž zvyšují syntézu a sekreci surfaktantu.
Plicní surfaktant a povrchové napětí alveolů
Vzhledem k tomu, že povrchové napětí alveolů je nejvýznamnější složkou retrakčních elastických sil plic (asi 2/3 z celkové hodnoty, zbývající 1/3 je dána obsahem elastických a kolagenních vláken, množstvím tkáňového moku, krve v kapilárách) představuje plicní surfaktant rozhodující faktor, který zvyšuje plicní poddajnost a tím snižuje velikost dechové práce. Plicní poddajnost (compliance, C) je opakem elasticity, matematicky vyjádřeno C = 1/E. Mírou poddajnosti je změna objemu plic (DV) na jednotkovou změnu tlaku (DP) vyvinutou dýchacími svaly, tedy C = DV/DP. Dechová práce (WD) je pak součinem velikosti změny objemu plic a změny tlaku k tomu potřebného, tedy WD = DV x DP. Poddajnost plic je tím vyšší, čím menší změna tlakového gradientu je potřeba na tutéž změnu objemu plic. Plicní surfaktant působí jako antiatelektatický faktor, bránící kolapsu alveolů zejména během výdechu a tím podporuje výměnu dýchacích plynů během celého dýchacího cyklu, protože snížením povrchového napětí dle Laplaceova zákona redukuje výši distenzního tlaku, v tomto případě transpulmonálního tlakového gradientu, potřebného k udržení alveolů v rozepjatém stavu. Transpulmonální tlak (PL) je tlakový gradient mezi tlakem alveolárním (PA) a tlakem v pleurální dutině (PPL), tedy PL = PA – PPL. Surfaktant snížením povrchového napětí též zabraňuje vzniku plicního otoku, protože jinak by povrchové napětí vedlo ke snížení hydrostatického tlaku v perikapilárním vazivu alveolokapilární membrány a tím podporovalo transudaci tekutiny ve směru kapilára – intersticium – alveoly.
Hlavní účinnou složkou surfaktantu snižující povrchové napětí jsou fosfolipidy a z nich na prvním místě fosfatidylcholin. Pro stavbu vrstvičky surfaktantu je důležitý také SP-A, protože na chemicko-fyzikální úrovni tvoří tento apoprotein „kostru“ pro ukotvení fosfolipidů, výsledná podoba surfaktantového filmu pak připomíná pravoúhlou trojrozměrnou „mříž“ z tubulárního myelinu. Pro účinnost fosfolipidů je důležitá přítomnost apoproteinů SP-B a SP-C, které zvyšují adsorpční kapacitu a stabilitu fosfolipidového filmu.
Plicní surfaktant a jeho imunologické funkce
Surfaktant představuje významný imunologický faktor lokální plicní obrany vůči mikrobiálním patogenům z řad bakterií, virů, plísní. Mechanismy, kterými tak činí, jsou dvojí:
- Neimunitní mechanismy. Vrstvička surfaktantu díky své stabilitě a přilnavosti k povrchu alveolů funguje jako účinná mechanická bariéru bránící adhezi a následné invazi mikroorganismů z alveolů do parenchymu plic. Kromě toho surfaktant usnadňuje mukociliární transport a tím očistu terminálních částí bronchiálního stromu, protože zvyšuje frekvenci kmitání ciliárního aparátu a zvyšuje hydrataci hlenu zřejmě ovlivněním chloridového kanálu epitelu dýchacích cest. Dále má surfaktant antioxidační schopnosti chránící alveolární epitel před oxidačním stresem, konkrétně je toto přisuzováno proteinům SP-A, SP-D a také byl v surfaktantu nalezen vitamin E jakožto známý „scavenger“ kyslíkových radikálů.
- Imunitní mechanismy. Proteiny SP-A a SP-D patří do skupiny tzv. kolektinů, molekul majících kolagenu podobnou doménu a lecitinovou doménu, pomocí které se za účasti vápenatých iontů vážou na oligosacharidové zbytky na povrchu mikrobů a jako nespecifické opsoniny usnadňují likvidaci patogenů neutrofily či jinými fagocytujícími buňkami. SP-A má chemotaktický a aktivační účinek na alveolární makrofág, které pak produkují prozánětlivé cytokininy (IL-1b, IL-6, TNFa). Interakce SP-A s makrofágem (SP-A se váže na makrofágový receptor pro C1q složku komplement) je také nutná pro uvolnění volných kyslíkových radikálů. SP-D má na alveolární makrofágy obdobný účinek jako SP-A. SP-D se vyskytuje nejen v surfaktantu, ale na všech slizničních površích a je jakýmsi nespecifickým partnerem sekrečního IgA. Na druhou stranu SP- A i SP-D tlumí proliferaci a aktivitu lymfocytů a SP-A snižuje aktivitu TNFa. Účinek surfaktantu je tedy v souhrnu imunomodulační a v mnoha ohledech je zde ještě řada nejasností, které komponenty surfaktantu a jak zasahují do jemného pletiva cytokininové sítě.
Terapeutické uplatnění surfaktantu
K dispozici máme několik typů léčebných preparátů obsahujících surfaktant či některé jeho složky různého původu:
- Humánní surfakant se získává s amniální tekutiny. Obsahuje všechny účinné složky surfaktantu potřebné k rychlému terapeutickému efektu a je odolný vůči inaktivaci. Vzhledem ke svému zdroji je ale problematický na výrobu.
- Animální surfaktanty získané z plic krav či prasat. Jejich výhodou je, že obsahují všechny jak fosfolipidy, tak apoproteiny SP-B a SP-C zvyšující efektivitu fosfolipidů, a jsou tedy účinnější než syntetický surfaktant. Také jsou odolné vůči inaktivaci. Nevýhodu je riziko přenosu infekce (vč. prionů) a riziko imunologického konfliktu vedoucí k senzibilizaci a alergické reakci u příjemce.
- Syntetické surfaktanty. Obsahují jen vybrané komponenty surfaktantu. Může se jednat o syntetické směsi povrchově aktivních lipidů, jejichž výhodou je cena, nulové riziko přenosu infekce a minimální imunogenita, ovšem vzhledem k chybění apoproteninů mají nižší účinnost a snadno podléhají inaktivaci. Nově jsou pak vyvíjeny syntetické surfaktanty obsahující lipidy a rekombinačně připravené peptidy, které jsou sekvenčně shodné či podobné fyziologickým specifickým proteinům surfaktantu. Svou účinností a odolností jsou srovnatelné s humánním inzulinem, ale zatím nejsou dostupné pro běžnou praxi, protože jejich vývoj je ve stádiu klinických studií.
Logickou léčebnou indikací podávání exogenní substituce surfaktantu je deficit surfaktantu, který může být etiologicky dvojího typu:
- Primární deficit surfaktantu. Příčinou je nezralost plic u předčasně narozeného dítěte resp. deficitní syntéza a sekrece surfaktantu nezralými pneumocyty II. typu. Tvorba surfaktantu je totiž nepřímo úměrná gestačnímu věku. Nedonošený novorozenec tak tvoří méně surfaktantu co do množství i účinnosti. Podrobněji viz samostatný příspěvek RDS novorozenců
- Sekundární deficit surfaktantu vzniká druhotným poškozením pneumocytů II. typu vlivem různých příčin, např. infekce lokální či celková, aspirace žaludečního obsahu, vody při tonutí, inhalace toxických plynů (vč. kouření), poruchy perfuze plic při úrazových či neúrazových šokových stavech. Poškozené pneumocyty pak nejsou schopny vytvořit dostatek surfaktantu. Podrobněji je problematika probrána v příspěvku ARDS dospělých
Teoretické terapeutické indikace léčby surfaktantem jsou širší:
- Pneumonie. Lokální infekce při zápalu plic samozřejmě také vede k poškození surfaktantu. Případná léčba exogenním surfaktantem v této indikaci by kromě příznivého účinku na mechaniku plicní ventilace navíc mohla mít i efekt antimikrobiální. Nicméně vzhledem tomu, že kauzální léčbou pneumonie je podání léků s antimikrobiálním účinkem a vhledem k ceně léčby surfaktantem jsou kazuistická sdělení vzácná, chybí kontrolované studie a na zvířecích modelech byly výsledky rozporuplné.
- Astma bronchiale. Vzhledem k imunomodulačnímu účinku některých složek surfaktantu by jeho deficit či změny ve složení mohli mít vliv na rozvoj a průběh alergického zánětu v plicích a dýchacích cestách astmatiků. Studie se zaměřují zejména na apoproteiny SP-A a SP-D, které svou vazbou na alergen mohou blokovat jeho interakci s IgE protilátkami a tím potlačovat uvolňování histaminu a dalších mediátorů žírných buněk. Z chronického pohledu tyto proteiny vazbou na povrchové molekuly či receptory lymfocytů blokují přijetí signálu, který by vedl k proliferaci a aktivaci lymfocytů.
- Chronická obstrukční bronchopulmonální nemoc (CHOPN). Její nejčastější zevní příčinou je kouření a cigaretový kouř prokazatelně alteruje systém plicního surfaktantu. Nemoc provází chronický zánět v dýchacích cestách, z aktivovaných neutrofilů a makrofágů se uvolňují protézy, které kromě destrukce alveolárních sept a plicní tkáně štěpí i apoproteiny SP-B, SP-C surfaktantua tím snižují jeho účinnost. Z opačného pohledu SP-A a SP-D by svým imunomodulačním účinkem mohly působit protektivně proti rozvoji chronického zánětu a plicní remodelace. Studie genetických polymorfismů SP-A, SP-B, SP-D u pacientů s CHOPN ve srovnání se zdravými kuřáky či nekuřáky svědčí pro skutečnost, že některé alely mohou být rizikovým jiné protektivním faktorem vzniku a rozvoje CHOPN.
Zdroje
- BLACKBURN S. T., Maternal, Fetal and Neonatal Physiology, a clinical perspective, 3th edition, Elsevier Saunders 2007, pp. 331 – 337
- FRERKING I. et al., Pulmonary surfactan: functions, abnormalities and therapetic options, Intensive Care Med, 27, 2001, pp. 1699 – 1717
- ROONEY S. A., Lung surfactant, Environmental Health Perspectives, Vol.55, 1984, pp. 205 – 226
- ZIBOLEN M., ZBOJAN J., DLUHOLUCKÝ S. a kol., Praktická neonatológia, Vydavateĺstvo Neografie, Martin 2001, str. 90 – 92