autor: MUDr. Ondřej Veselý
pracoviště: Ústav patologické fyziologie LF UP Olomouc, Dětská endokrinologická ambulance Svitavské nemocnice a.s.
Definice dehydratace
Dehydratace je definována jako snížený objem celkové tělesné vody (CTV), proto se též hovoří o hypovolémii. Primárně je zmenšen objem extracelulárního prostoru (ECT), zatímco objem buněk neboli intracelulární oddíl tělesných tekutin (ICT) může být zmenšený, nebo se nemění, nebo dokonce roste. Změny objemu ICT jsou až sekundární a vznikají jen tehdy, pokud je přítomen osmotický gradient mezi buňkami a jejich okolím.
Vyjádřeno symboly můžeme dehydrataci charakterizovat takto: ↓ CTV, ↓ ECT, ↓, nebo N, nebo ↑ ICT.
Obecná etiopatogeneze dehydratace
Dehydratace vzniká jako následek negativní bilance tělesných tekutin, tedy ztráty tekutin z organismu převažují nad jejich příjmem. Z tohoto pohledu pak můžeme jako obecné příčiny vedoucí k dehydrataci definovat následující varianty:
- Snížený přísun tekutin do organismu;
- Zvýšené ztráty tekutin z organismu (renální anebo extrarenální);
- Kombinace sníženého příjmu a zvýšených ztrát tekutin.
Tím, co „drží“ vodu v našem organismu, jsou ionty a soluty, a z nich je v ECT na prvním místě Na+ a jeho aniontoví souputníci. Negativní bilance sodíku proto vede k dehydrataci, na rozdíl od negativní bilance čisté vody, která za předpokladu, že je zachována sekrece a účinnost ADH a vnímání pocitu žízně, k dehydrataci nevede. V takové situaci totiž ztráta čisté vody ústí v hyperosmolaritu. Ta je přes ADH korigována zadržováním bezsolutové vody v ledvinách a zároveň je přes pocit žízně stimulován zvýšený přísun tekutin. Má-li postižený zachovaný přístup ke zdroji vody, zůstává euvolemický.
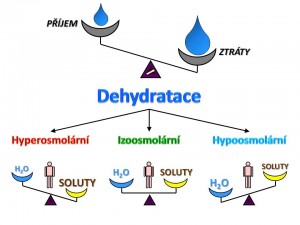
Dehydratace v naprosté většině klinických případů vzniká následkem negativní bilance soli a vody současně. Na vzájemném poměru vody a soli pak závisí výsledná tonicita vnitřního prostředí. Dle laboratorně zjištěné výše sérové osmol(r)ity pak rozlišujeme tři základní typy dehydratace:
- Izoosmolární dehydratace.
- Hyperosmolární dehydratace.
- Hypoosmolární dehydratace.
Nyní si tyto jednotlivé typy dehydratace přiblížíme po etiopatogenetické stránce.
Izoosmolární dehydratace
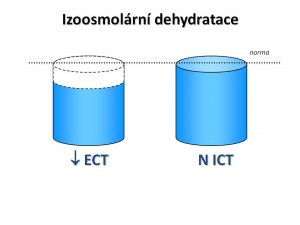
Je dehydratace s osmolaritou vnitřního prostředí stejnou anebo blízkou fyziologické tonicitě.
Osmolarita ECT a ICT je stejná, tudíž neexistuje osmotický gradient, který by vedl k přesunu vody, a proto se objem ICT nemění. To je sice na jedné straně výhodné, protože změny objemu nesou nelibě zejména buňky mozkové, na straně druhé ale izoosmolalita neumožňuje kompenzovat snížení objemu ECT přesunem vody z ICT, a to vede k rychlému rozvoji hemodynamických příznaků dehydratace. Při těžké dehydrataci a výrazném poklesu efektivního cirkulujícího objemu nakonec i přes centralizaci oběhu následně dochází k hypoperfúzi mozku s patřičnou neurologickou symptomatologií a ve finále k rozvoji hypovolemického šoku.
Charakteristika izoosmolární dehydratace: ↓ CTV, ↓ ECT, N ICT, S-osm 290 ± 10 mmol/kg H2O .
Obecnou příčinou vzniku izoosmolární dehydratace je ztráta izotonické tekutiny, tzn. voda a osmoticky aktivní ionty se ztrácejí v poměru 1 : 1, takže osmolarita zůstává normální.
- Krvácení. Může jít o krvácení zevní (úraz), kde je velikost ztrát vcelku zřejmá, nebo o krvácení vnitřní (úraz, vředová choroba, jícnové varixy), kde je diagnostika i odhad velikosti ztrát ztížený. Z patofyziologického pohledu ztráta krve znamená nejen efektivní hypovolémii, ale současně i ztrátu transportní kapacity pro kyslík. Obě tyto skutečnosti se vzájemně potencují v rozvoji následné hypoperfúze orgánů a rozvoji šokového stavu.
- Ztráty kůží – Popáleniny. Riziko rozvoje popáleninového šoku je dáno velikostí popálené plochy. Závisí také na věku (v dětském lékařství je procentuálně srovnatelná plocha popáleniny tím rizikovější, čím je dítě mladší). Na rozvoji popáleninového šoku se podílejí tři faktory: (1) samotná objemová ztráta plazmy, která prosakuje popálenými plochami, (2) bolest a (3) snížení onkotického tlaku pro ztrátu plazmatických bílkovin popálenou kůží. Snížený onkotický tlak plazmatických bílkovin narušuje Starlingovu rovnováhu v kapilárách a vede k úniku tekutiny skrze kapilární stěnu z intravaskulárního prostoru do intersticia (popáleninové otoky).
- Ztráty GIT. Vznik dehydratace následkem průjmu anebo zvracení je logický, ale tyto příhody spíše vedou k dehydrataci hyperosmolární než izoosmolární, protože trávicí šťávy jsou obvykle hypotonické. Teprve při těžších průjmech a větším zvracení vzniká izoosmolární porucha. Současně bývá přítomna hypokalémie (viz kapitola Draselný iont a poruchy jeho homeostázy) a porucha acidobazické rovnováhy (metabolická acidóza u průjmů ze ztráty bází, nebo metabolická alkalóza při zvracení žaludeční HCl) (kapitola Acidobazická rovnováha a její poruchy). K rozvoji izoosmolární dehydratace také může dojít při ztrátě tekutiny skrze pooperační drény z břišní dutiny nebo cestou píštělí.
- Ztráta tekutiny z třetího prostoru. Iatrogenně můžeme izoosmolární dehydrataci navodit při vypuštění většího množství ascitické tekutiny, která má u pacientů trpících cirhózou složení obdobné plazmě. Pokles hydrostatického tlaku v břišní dutině naruší pracně nabytou rovnováhu Starlingových sil ve splanchnických kapilárách, což vede k rychlé filtraci nové tekutiny z oběhu do břišní dutiny s poklesem efektivního objemu.
- Renální ztráty izotonické tekutiny. Ekvivalentní ztráty sodných iontů a vody mohou nastat u polyurických stavů různé etiologie. Může se jednat o neoligurické akutní renální selhání (ARS) anebo polyurickou fázi ARS, stejně tak o polyurii v rámci tubulointersticiálních nefritid, postobstrukčních stavů (po odstranění překážky v močových cestách, např. močového kamene) (viz např. kapitola Patofyziologie a klinické aspekty akutního selhání ledvin). Při tom je ovšem zapotřebí počítat s proměnlivostí poměru, se kterým jsou sodík a voda vylučovány, neboť dehydratace normonatremická může přejít v dehydrataci hyponatremickou. Klinicky významnou příčinou ztrát iontů sodíku je užití diuretik. Mezi nimi vyvolávají izonatremickou dehydrataci diuretika kličková, která blokádou Na-K-Cl kotransportéru v tlusté části vzestupného raménka Henleovy kličky blokují resorpci soli, což současně vede ke snížení hypertonicity dřeně ledvin, a tím narušení koncentrační schopnosti ledvin. Výsledkem je masivní diuréza s více méně proporcionální ztrátou vody a soli, takže výsledkem jejich účinku je objemová redukce, snížení tlaku, obvykle normonatrémie, ale současně hypokalémie.
Hyperosmolární dehydratace
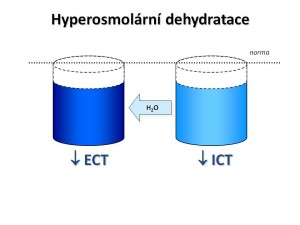
Hyperosmolární dehydratace je dehydratace se zvýšenou osmolaritou vnitřního prostředí.
Pokud je zvýšení celkové osmolarity zapříčiněno efektivními ionty a soluty, tj. osmoticky aktivními složkami, pro které je buněčná membrána jen minimálně permeabilní, pak je osmolalita ECT vyšší než osmolarita ICT. Vzniklý osmotický gradient povede k pohybu vody ven z buněk, takže objem ICT se snižuje. To sice částečně koriguje úbytek objemu v ECT, ale kombinace hyperosmolarity a hypovolémie vede k intenzivnímu pocitu žízně a k rozvoji příznaků, které jsou dány exsikací mozkových buněk.
Charakteristika hyperosmolární dehydratace: ↓ CTV, ↓ ECT, ↓ ICT, S-osm > 300 mmol/kg H2O .
Obecné příčiny vzniku tohoto typu dehydratace jsou několikeré - nedostatečný příjem vody, dále ztráta hypotonické tekutiny, tzn. ztrácí se více vody než iontů anebo solutů, nebo ztráta čisté vody. Podle hladiny plazmatického natria pak můžeme rozlišit hypernatremické hyperosmolární dehydratace, kdy je příčinou hyperosmolarity vysoká koncentrace Na+, nebo non-hypernatremické hyperosmolární dehydratace, kdy je příčinou hyperosmolarity jiná osmoticky aktivní složka (solut).
- Nedostatečný příjem vody vede k rozvoji hyperosmolarity z hypernatrémie, kterou si ale postižený nemůže sám korigovat, protože (1) pociťuje žízeň, ale není schopen se sám anebo bez potíží napít (malé děti, imobilní pacient, polykací potíže). (2) Má snížený pocit žízně (staří lidé) nebo žízeň vůbec nepociťuje (léze centra žízně v hypotalamu, pacient v bezvědomí).
- Ztráty GIT. Můžou být jednou z extrarenálních cest ztrát sodíku a vody z organismu. V případě lehčích infekčních průjmů a zvracení se složením jedná o tekutiny hypotonické s nízkým obsahem natria, takže výsledkem je hypernatrémie. Stejně tak bývá stolice hypotonická u osmotických průjmů. Příkladem je vrozený nebo získaný (častěji) deficit laktázy, kdy pacient není schopen pro nedostatek enzymu laktázy v kartáčovém lemu enterocytů v tenkém střevě štěpit mléčný cukr. Nerozložená laktóza není vstřebatelná, natahuje do lumina střeva vodu, což zvyšuje střevní motilitu; laktóza postupuje do tlustého střeva, kde probíhá její fermentace střevní mikroflórou za vedlejší produkce kvasných plynů a mléčné kyseliny. Výsledkem je meteorismus se vzedmutím břicha, průjem, stolice jsou napěněné, vodnaté, kysele páchnoucí. Na osmotickém principu fungují i některá projímadla používaná v léčbě zácpy jako je třeba lactulosa anebo solná projímadla. Stejně tak může vést k průjmu přijetí velkého množstvíovoce, džusů, které obsahují fruktózu (ta se sice v tenkém střevě vstřebává, ale při přijetí velkého množství je kapacita transportu přetížena). K úniku hypotonické střevní tekutiny také může docházet cestou různých píštělí anebo stomií. Vzácnější příčinou hypernatremické dehydratace může být nesprávně provedená peritoneální dialýza.
- Ztráty kůží a respirací. Perspiratio insensibilis, tj. samovolné odpařování vody z kůže a sliznic dýchacích cest, stejně jako ztráty hypotonické tekutiny pocením se zvyšují při horečce, při pobytu v horkém prostředí. V rámci dýchacích cest pak (nezávisle na kůži) ztráty vody rostou při tachypnoi anebo hyperventilaci.
- Osmotická diuréza. Vzniká ve dvou situacích:
- Zvýšená glomerulární filtrace osmoticky efektivního iontu anebo solutu. Tento faktor pak na sebe v tubulech váže vodu, která strhává i ionty z glomerulárního filtrátu. Zrychlený průtok moči distálním nefronem navíc neumožňuje dostatečnou zpětnou resorpci iontů sodíku a vody. Typickým představitelem tohoto typu osmotické diurézy je diabetická ketoacidóza (DKA), kde oním efektivním faktorem je jednak glukóza, jednak ketolátky. Laboratorně při DKA nacházíme hyperglykémii/glykosurii, metabolickou acidózu, ketonémii/ketonurii, hyperosmolaritu (↑ S-osm) a – trochu překvapivě – i hyponatrémii (↓ S-Na). Příčinou hyponatrémie je přesun vody z buněk, jenž nastává vlivem hyperosmolarity ECT způsobené glukózou; ta pro absolutní anebo relativní deficit inzulínu při cukrovce nemůže vstupovat do buněk, a tudíž se chová jako efektivní solut. Vztah mezi vzestupem glykémie a poklesem natrémie není lineární, nicméně pro snadné zapamatování můžeme počítat s poklesem natrémie o asi 2 mmol/l na každých 5 mmol/l zvýšení glykémie. Jiným takovým solutem, který se dostává přes glomerulární filtr, ale neresorbuje se v tubulech, je manitol, kterého se léčebně využívá u edémových stavů.
- Porucha zpětné resorpce fyziologických solutů v tubulech. Tato situace obvykle vzniká jako následek strukturního poškození tubulů v rámci etiologicky pestré palety renálních postižení- ischémie ledvin, toxického poškození tubulů, stavů po odstranění obstrukce atd.
- Vodní diuréza. Ke ztrátě čisté vody ledvinami dochází při poruše koncentrační schopnosti ledvin, kdy je narušena tubulární reabsorpce vody v distálních úsecích nefronu. Modelovým příkladem je diabetes insipidus (DI) - kdy je porucha koncentrační schopnosti ledvin způsobena sníženou sekrecí antidiuretického hormonu (centrální diabetes insipidus), nebo jeho sníženou účinností (nefrogenní diabetes insipidus).
Diabetes insipidus, žíznivka
Příznakem obou typů DI je polyurie, tj. diuréza velkého množství hypotonické moči (nad 3 l/24 h u dospělého, nebo nad 2 l/m2 u dítěte), z toho plynoucí polydipsie s rizikem rozvoje těžké hypernatremické dehydratace, pokud pacient nemá zachovaný přístup ke zdroji vody. V případě, že postižený má zachovaný pocit žízně a přístup k vodě, zůstává stav obvykle euvolemický. Laboratorně nacházíme zvýšení osmolality plazmy (P-osm nad 295 mmol/kg) a hypernatrémii (P-Na nad 145 mmol/l) při snížené osmolalitě moči (U-osm pod 300 mmol/kg resp. U-osm pod S-osm). Příčiny obou forem DI uvádí následující přehled:
- Centrální diabetes insipidus (CDI) při nedostatečné tvorbě ADH v hypotalamu. Příčinou je obvykle získané poškození mozku, popř. oblasti hypotalamu a neurohypofýzy traumatem, krvácením, hypoxií-ischemií, infekcí, neurochirurgickým zákrokem, nádorem (kraniofaryngeom, nádor vycházející z hypofýzy, leukémie/lymfom, metastáza jiného nádoru), granulomatózou (sarkoidóza, histiocytóza) anebo radiačním zářením. Vzácně jde o vrozenou příčinu, např. septo-optickou dysplázii, Wolframův syndrom nebo mutaci genu pro ADH anebo neurofyzin. U části pacientů příčinu neodhalíme - pak hovoříme o idiopatickém CDI; u části z nich lze předpokládat autoimunitní etiologii.
- Nefrogenní diabetes insipidus (NDI) při nedostatečné účinnost ADH v ledvinách. Mezi získané příčiny patří renální choroby (chronické renální poškození, chronická renální insuficience, polycystické ledviny nebo obstrukční uropatie). Někdy je NDI indukován léky, jako jsou např. demeklocyklin (viz níž SIADH), soli Li+, amphotericin B, kolchicin, ale také kličková diuretika (resorpce soli v Henleově kličce je jednou ze základních podmínek pro udržení osmotického koncentračního gradientu). Patogeneticky zajímavou příčinou NDI je deficit draslíku a hypokalémie, kde jsou možná dvě vysvětlení - deficit K+ vede k (a) narušení tvorby a udržení hyperosmolarity dřeně ledvin; nebo (b) k „rezistenci“ na účinek ADH ve sběracích kanálcích. Další iontovou odchylkou vedoucí k polyurii je hyperkalciurie. Její účinek se vysvětluje obsazením CaSR (calcium sensing receptor) vápníkem na luminální straně membrány tubulárních buněk, a to vede ke snížení hladiny cAMP, jenž je 2. poslem účinku ADH. Vrozené formy NDI jsou raritní. Z nich 90 % tvoří mutace V2 receptoru pro ADH v tubulárních buňkách sběracích kanálků, dědičnost je gonosomálně recesivní. Zbývajících 10 % vrozených NDI připadá na autozomálně recesivní mutaci genu pro aquaporin-2, tj. vodní kanálek umístěný na apikální membráně tubulárních buněk sběracích kanálků.
- Osmotická diuréza. Vzniká ve dvou situacích:
- (1) Zvýšená glomerulární filtrace osmoticky efektivního iontu anebo solutu. Tento faktor pak na sebe v tubulech váže vodu, která strhává i ionty z glomerulárního filtrátu. Zrychlený průtok moči distálním nefronem navíc neumožňuje dostatečnou zpětnou resorpci iontů sodíku a vody. Typickým představitelem tohoto typu osmotické diurézy je diabetická ketoacidóza (DKA), kde oním efektivním faktorem je jednak glukóza, jednak ketolátky. Laboratorně při DKA nacházíme hyperglykémii/glykosurii, metabolickou acidózu, ketonémii/ketonurii, hyperosmolaritu (↑ S-osm) a – trochu překvapivě – i hyponatrémii (↓ S-Na). Příčinou hyponatrémie je přesun vody z buněk, jenž nastává vlivem hyperosmolarity ECT způsobené glukózou; ta pro absolutní anebo relativní deficit inzulínu při cukrovce nemůže vstupovat do buněk, a tudíž se chová jako efektivní solut. Vztah mezi vzestupem glykémie a poklesem natrémie není lineární, nicméně pro snadné zapamatování můžeme počítat s poklesem natrémie o asi 2 mmol/l na každých 5 mmol/l zvýšení glykémie. Jiným takovým solutem, který se dostává přes glomerulární filtr, ale neresorbuje se v tubulech, je manitol, kterého se léčebně využívá u edémových stavů.
- (2) Porucha zpětné resorpce fyziologických solutů v tubulech. Tato situace obvykle vzniká jako následek strukturního poškození tubulů v rámci etiologicky pestré palety renálních postižení- ischémie ledvin, toxického poškození tubulů, stavů po odstranění obstrukce atd.
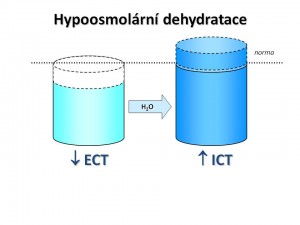
Hypoosmolární dehydratace
Hypoosmolární dehydratace je e dehydratace se sníženou osmolaritou vnitřního prostředí.
Zde, jak uvidíme dále, je snížení celkové osmolarity vždy spojeno s hyponatrémií. Chybění Na+ jako hlavního osmoticky efektivního iontu vede ke vzniku osmotického gradientu, kdy osmolalita ECT je nižší než osmolarita ICT, a voda proto vstupuje do buněk, takže objem ICT se zvyšuje. Tento přesun vody jednak prohlubuje hypovolémii ECT, a tím i manifestaci hemodynamických příznaků, a současně vzniklý edém buněk má nepříznivý vliv na fungování CNS.
Charakteristika hypoosmolární dehydratace: ↓ CTV, ↓ ECT, ↑ ICT, S-osm < 280 mmol/kg H2O. Hypoosmolární dehydratace je vždy spojena s hyponatrémií. Neplatí to ale naopak, hyponatrémie nemusí být provázena hyposmolaritou (viz výše – hyperglykémie s hyperosmolaritou ale s hyponatremií při diabetes mellitus).
Obecnou příčinou vzniku hypoosmolární dehydratace je renální ztráta hypertonické tekutiny, tzn. ztrácí se ledvinami více iontů než vody. Příčiny mohou být několikeré:
- Diuretika, která přímo inhibují zpětnou resorpci soli v průběhu tubulů, logicky mohou vést k rozvoji hyponatremické dehydratace. Ze solných diuretik inklinují k rozvoji hyponatrémie především thiazidová diuretika, která blokují Na+-Cl- kotransportér (NCC) ve stočené části distálních tubulů. Thiazidová diuretika ale nesnižují hyperosmolaritu dřeně, nenarušují koncentrační schopnost ledvin, takže diuréza je po nich sice menší, ale s relativně větší natriurézou než po kličkových diureticích; současně se rozvíjí hypokalémie. Tím se účinek thiazidů liší od tzv. kalium-šetřících diuretik, která působí až v druhé části distálních tubulů a vedou ke kombinaci hyponatrémie a hyperkalémie. Mechanismus účinku kalium-šetřících diuretik je dvojí – (a) buď kompetitují s aldosteronem v jeho vazbě na receptory v tubulárních buňkách (spironolakton), nebo (b) ruší účinek aldosteronu blokádou ENaC kanálů v distálním nefronu s následným snížením reabsorpce sodíku, a tím i exkrece draslíku (amilorid, triamteren).
- Salt-losing nefritis. Tento obecný pojem zahrnuje nefropatie charakterizované vysokými ztrátami iontů sodíku močí. Může se jednat o polyurickou formu akutního renálního selhání (ARS), o polyurickou fázi oligoanurického ARS (viz např. kapitola Patofyziologie a klinické aspekty akutního selhání ledvin), následek chronické tubulointersticiální nefritidy, postobstrukční polyurii, st.p. transplantaci ledvin apod.
- Deficit mineralokortikoidů. Chybějící sekrece anebo snížený účinek aldosteronu může mít řadu příčin. Výsledkem je zvýšený odpad sodíku močí, hyponatrémie, hyperkalémie se sklonem k metabolické acidóze, dehydrataci a rizikem rozvoje šoku a smrti organismu. Primární hypokorticismus vzniká při postižení kůry nadledvin, jako je tomu u Addisonovy choroby, což je autoimunitní postižení, které vede k chronickému hypokorticismu se sníženou sekrecí jak aldosteronu, tak kortisolu a nadledvinových androgenů. Akutní adrenokortikální insuficience může vzniknout při dekompenzaci u pacienta trpícího Addisononovou chorobou, který se dostane do stresové situace (nemoc, operace atp.), nebo při akutním krvácení do nadledvin při krvácivých chorobách, při traumatu (novorozenci) nebo jako Waterhouse-Friderichsenův syndrom v rámci meningokokové sepse. Sekundární hypokorticismus při nedostečné sekreci ACTH adenohypofýzou k hypoaldosteronismu nevede, protože sekrece aldosteronu na rozdíl od sekrece kortisolu je na stimulaci ACTH závislá jen minimálně. Některé z forem kongenitální adrenální hyperplázie (CAH) mohou být provázeny solnou poruchou z nedostatku aldosteronu (nejčastěji jde o deficit 21-hydroxylázy), nebo může jít o SW (salt wasting) formu, kdy je nedostatečná syntéza jak gluko- tak mineralokortikoidů a naopak je přebytek nadledvinových androgenů, které u děvčátek vedou k virilizaci genitálu a u chlapců k předčasné pubertě. Pseudohypoaldosteronismus je genetická porucha účinku aldosteronu, kdy pacienti nemají nízkou, ale naopak vysokou hladinu aldosteronu, ale příznaky jsou stejné jako u hypoaldosteronismu. U typu I dědičného autosomálně recesivního jsou přítomny inaktivační mutace některé z podjednotek epiteliálního sodíkového kanálu (ENaC) zajišťujícího resorpci Na+ v rámci odpovědi na aldosteron v distálním nefronu. U typu II dědičného autosomálně dominantního jde o mutaci mineralokortikoidního receptoru, který se normálně nachází v jádře buněk distálních tubulů a sběracích kanálků.
- Cerebral salt wasting syndrom (CSWS) může vzniknout při poškození mozku různé etiologie – neurochirurgickým zákrokem, kraniotraumatem, mozkovým nádorem, cévní mozkovou příhodou atp. Patogeneze tohoto syndromu není zcela jasná. Může se uplatňovat vystupňovaná sekrece natriuretických faktorů (ANF, BNF), tlaková diuréza, změna průtoku krve vlivem změny tonu sympatiku. Následky jsou ale stejné - vystupňování natriurézy, polyurie, hyponatrémie, dehydratace. Sekundárně k hypovolémii je zvýšena sekrece ADH (přes baroreceptorové stimuly), a vyvíjí se tedy hypoosmolární syndrom.
Hypoosmolární dehydratace často vzniká druhotným vývojem z dehydratace izo- anebo hyperosmolární, a to tehdy jestliže jsou ztráty vody a solutů hrazeny pouze vodou. Tím si sice postižený sníží hyperosmolaritu a pocit žízně, ale přijatá voda se v těle bez soli „neudrží“, pacient zůstává dehydratovaný, pouze klesá osmolarita jeho tělesných tekutin. Klasickým příkladem je nevhodně volená rehydratace hypotonickými roztoky anebo nápoji při průjmech a zvracení. Lidová moudrost, jak známo, doporučuje černý čaj, tedy obarvenou vodu bez solutů (viz Poruchy vnitřního prostředí – 3 kazuistiky). Stejnou chybu činí lékař, který takového pacienta rehydratuje roztoky 5% glukosy bez přidání krystaloidů; glukóza se v těle metabolizuje na CO2 a vodu a výsledkem je hypoosmolarita; je namístě uvědomit si, že infúze roztoků glukózy jsou infúzemi čisté vody.
Příznaky dehydratace
Pro větší přehlednost si je rozdělíme dle „místa“ projevu, tedy dle orgánových systémů.
Hemodynamické příznaky. Ztráta tělních tekutin vede k poklesu efektivního cirkulujícího objemu (Vef; v hemodynamice mu odpovídá veličina zvaná střední cirkulační plnicí tlak). Pokles Vef je zaznamenán baroreceptory a vyvolá poplachovou reakci sympatiku. Vlivem aktivace sympatiku má pacient tachykardii, dochází k centralizaci oběhu, krevní tlak díky tomu může zůstat normální. Při výraznějším poklesu Vef se ale rozvíjí hypotenze, což se ve vertikální poloze zprvu projeví sklonem k ortostatické synkopě. Hodnotu krevního tlaku (TK) je nutno obezřetně hodnotit u pacientů s arteriální hypertenzí, protože pokud jejich TK byl vlivem nedostatečné léčby před rozvojem hypovolémie vyšší, pak při rozvoji dehydratace může v absolutních hodnotách klesnout do pásma normy, ale ve skutečnosti jde o relativní hypotenzi. Při fyzikálním vyšetření nalézáme sníženou náplň krčních žil i v poloze horizontální. Má-li pacient zaveden centrální katétr, pak u pacienta v hypovolémii naměříme snížený centrální žilní tlak. Pokud je pokles Vef výrazný a není včas zahájena léčba, rozvíjí se šokový stav.
Kožní a slizniční příznaky. Vlivem omezené sekrece slin postižený pociťuje suchost v ústech a lékař při vyšetření nalézá oschlý, povleklý jazyk. Vlivem periferní vazokonstrikce je kůže bledá a při výraznější dehydrataci je snížen kožní turgor. (Pozor! Nezaměňovat sníženou elasticitu kůže u starých lidí s projevy dehydratace.) Závažným nálezem je zpomalený kapilární návrat (po stlačení prstu po dobu 5 s by se fyziologicky růžové prokrvení v nehtovém lůžku mělo znovu objevit do 2 vteřin), který svědčí pro hypoperfúzi kůže v rámci centralizace oběhu. Omezené prokrvení kůže také snižuje pocení, a proto nález zvýšené teploty u dehydratovaného nemusí nutně znamenat horečku v rámci zánětu, ale hypertermii z nedostatečného výdeje tepla z organismu.
Nervové příznaky. Hyper- anebo hypoosmolární dehydratace vedou vlivem přesunu vody po směru osmotického gradientu ke změně objemu buněk, a tedy i objemu buněk mozkových. Při hyperosmolární poruše se objem buněk zmenšuje, při hypoosmolární dehydrataci se objem buněk zvyšuje; obé alteruje fyziologické fungování CNS a může se to projevit jako neklid, zmatenost, nauzea, zvracení, bolesti hlavy, posléze apatie, somnolence, sopor, křeče a koma. Nicméně nervové buňky jsou schopny se na vzniklou poruchu osmolarity adaptovat aktivní změnou své intracelulární tonicity tak, aby se co nejvíce omezily výkyvy jejich buněčného objemu. Při hypoosmolaritě v ECT proto dochází ke snížení intracelulární tonicity mozkových buněk a ke zmenšení objemového přírůstku, kdežto při hyperosmolaritě v ECT se intracelulární tonicita neuronů zvyšuje, a tím se omezuje ztráta vody a objemu. Podstatou adaptace mozku na změny osmolarity ECT je změna obsahu iontů a solutů v jeho buňkách. Při hypoosmolalitě mozkové buňky obsah svých osmoticky aktivních iontů a solutů snižují, při hyperosmolalitě se naopak obsah iontů a solutů uvnitř buněk zvyšuje. O jaké osmoticky aktivní složky se jedná? Kvantitativně 1/2 až 2/3 z této změny činí změny obsahu hlavních iontů, tedy K+, Na+a Cl-, další 1/3 až 1/2 změny intracelulární tonicity je dána změnou obsahu drobných organických molekul, jako jsou glutamát, glutamin, kreatin, taurin, inositol a další. Klíčovým faktorem účinnosti této adaptace je čas ! Pokud jde o rychlou, akutní poruchu osmolarity, účinnost adaptace pokulhává, takže dochází ke zvětšení anebo zmenšení objemu mozkových buněk. Pokud ale jde o chronicky se rozvíjející změnu osmolarity, může adaptace dosáhnout 100% účinnosti, takže objem mozkových buněk se může normalizovat. Současně z toho vyplývá, že akutní změny osmolarity můžeme léčit razantněji, tzn. že jsou tolerovány větší a náhlejší změny S-osm v průběhu léčby, zatímco při chronické změně osmolarity musí být rychlost terapeutické korekce velmi pozvolná, aby měly buňky nervové tkáně čas na readaptaci! Pro praxi je třeba počítat se 48 hodinami; tento časový údaj je současně dělítkem akutních a chronických změn osmolarity a natrémie. Příznaky z postižení CNS se ovšem mohou vyvinout i při izoosmolární dehydrataci - jak už bylo řečeno výše, příčinou postižení v tomto případě není změna objemu buněk, ale hypoperfúze mozku při hypovolémii.
Ledvinné příznaky. Zde se situace různí podle toho, kde tkví příčina ztrát tělních tekutin:
Extrarenální příčina dehydratace. Pokud jsou ledviny zdravé, pak se snaží vzniklou dehydrataci kompenzovat zadržováním tekutin v organismu, což se u pacienta projeví jako:
- Oligurie (objem moči menší než 0,5 l/24 h nebo pod 20 ml/hod u dospělého nebo 0,5 – 1 ml/kg/hod u dítěte);
- FEH2O < 2 %;
- Moč, která vzniká, je hypertonická, U-osm > P-osm, U-osm obvykle nad 700 mmol/kg H2O (starší lidé a velmi malé děti ale mají koncentrační schopnost fyziologicky sníženou);
- Současně s vodou ledviny zadržují i sůl, protože nezávisle na natrémii je dehydratace spojena s deficitem sodíku, a proto bývá U-Na < 20 mmol/l a FENa < 1 %.
- V rámci centralizace oběhu také dochází k hypoperfúzi ledvin, což na jedné straně kompenzačně snižuje tvorbu moči, ale na druhé straně může vést až k ischémii ledvin a jejich poškození, takže při výrazné dehydrataci se může nejprve rozvinout prerenální akutní ledvinné selhání a následně přejít v intrarenální ledvinné selhání (viz kapitola Patofyziologie a klinické aspekty akutního selhání ledvin). Projevem hypoperfúze ledvin jsou stoupající hladiny močoviny a kreatininu v krvi (↑ P-Kr, ↑ P-U), přičemž relativně více stoupá hladina močoviny z důvodu vyšší zpětné tubulární resorpce při snížené diuréze (kapitola Patofyziologie a klinické aspekty akutního selhání ledvin a kapitola Laboratorní vyšetření ledvinových funkcí).
Renální příčina dehydratace. Postižení ledvin anebo regulačních smyček navázaných na ledviny jako efektorový orgán (ADH, RAA) neumožňuje rozvoj právě popsané kompenzace. Výsledkem je:
- Polyurie;
- FEH2O > 2 %;
- Tonicita moči závisí na tom, zda se jedná o vodní diurézu, a pak je U-osm < P-osm, U-Na < 20 mmol/l a FEosm < 3,5 %, nebo zda jde o osmotickou diurézu, kdy U-osm ≥ P-osm, U-Na > 20 mmol/l a FEosm > 3,5 % (kapitola Laboratorní vyšetření ledvinových funkcí).
Poznámka. Frakční exkrece osmolální (FEosm) je poměrem množství osmoticky aktivních látek v definitivní moči vůči množství osmoticky aktivních látek v glomerulárním ultrafiltrát a lze ji vypočítat dle vzorce: FEosm = (P-Kr x U-osm) / (U-Kr x S-osm), norma je 1 – 3,5 % (viz kapitola Laboratorní vyšetření ledvinových funkcí).
Použitá literatura a literatura pro další studium
- BAGSHAW SM, TOWNSEND DR, McDERMID RC. Disorders of sodium and water balance in hospitalized patiens. Can J Anesth. 2009, 56: 151-167
- BERNE RB, LEVY MN, KOEPPEN BM, STANTON BA. Physiology, 5th edition, Mosby 2004, pp. 643-683
- GUYTON AC, HALL JE. Textbook of medical physiology, 11th edition, Elsevier Saunders 2006, pp. 327-364
- HULÍN I. et al., Patofyziológia, 7.vydání. Bratislava SAP 2009, str. 250-254
- MAKARYUS , McFARLANE SI. Diabetes insipidus: diagnosis and treatment of a complex disease. Cleve Clin J Med. 2006 Jan;73(1):65-71.
- MASOPUST J. Klinická biochemie, požadování a hodnocení biochemických vyšetření, I,II část. Karolinum, Praha 1998, str. 218-227, 731-751
- McCANCE KL, HUETHER SE, BRASHERS VL, ROTE NS. Pathophysiology: the biological basis for disease in adults and children, 6th edition, Mosby Elsevier 2010, pp. 96-106
- NEČAS E. a kol. Obecná patologická fyziologie. Karolinum, Praha 2002, str. 232-236
- SCHÜCK O. Poruchy metabolismu vody a elektrolytů v klinické praxi. Grada, Praha 2000, str. 43-89
- VERBALIS JG. Brain volume regulativ in response to changes in osmolarity. Neuroscience. 2010 Jul 28;168(4):862-70
- VERBALIS JG, Disorders of body water homeostasis, Best Pract Res Clin Endocrinol Metab. 2003 Dec;17(4):471-503