autor: MUDr. Ondřej Veselý, Ústav patologické fyziologie LF UP Olomouc, Dětská endokrinologická ambulance Svitavské nemocnice a.s.
Úvod
Voda je základem života. Evoluce začala v prehistorických mořích a oceánech. Dávní předci suchozemských tvorů, a tedy i člověka, vodní prostředí sice opustili, ale životodárnou tekutinu si vzali s sebou jako vodu tělesnou. Stejně tak si s sebou na souš přinesli i sůl, která je nezbytným předpokladem pro udržení vody v organismu. Sůl a ostatní soluty díky své osmotické aktivitě jednak udržují vodu v organismu, ale též určují přesuny vody mezi jednotlivými tělními oddíly. Jak vodu, tak sůl člověk přijímá a ztrácí. K přežití organismu je třeba rovnováhy mezi příjmem a ztrátami vody a soli a též rovnováhy poměru tělesné soli k tělesné vodě (osmotická rovnováha). K zajištění vodní a osmotické rovnováhy je lidské tělo vybaveno celou řadou precizních regulačních mechanismů, se kterými se v tomto příspěvku podrobněji seznámíme.
Tělesná voda a její oddíly
Voda je hlavní složkou vnitřního prostředí. Celková tělesná voda (CTV), tj. součet vody všech oddílů tělesných tekutin, tvoří u dospělého člověka asi 60 % jeho tělesné hmotnosti. Množství CTV ve vztahu k hmotnosti těla je závislé na:
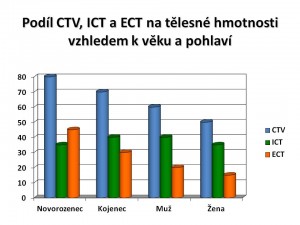
- Věku: Čím je jedinec mladší, tím vyšší je i podíl CTV na tělesné hmotnosti. U novorozenců tvoří CTV 75 – 80 % jejich hmotnosti. U kojenců se tento podíl pohybuje okolo 70 %. V průběhu dětství a dospívání postupně klesá na 60 %. V průběhu stárnutí ubývá aktivní svalové hmoty a přibývá tuku, a staří lidé proto mají menší podíl CTV na hmotnosti.
- Pohlaví: Ženy mají menší podíl CTV na tělesné hmotnosti než muži. U ženy tvoří CTV asi jen 50 %. Je to dáno větším podílem tělesného tuku a menším podílem svalové hmoty u žen než u mužů. Tato pohlavní odlišnost v dospělosti je dána účinkem pohlavních hormonů – estrogenů u žen a androgenů u mužů.
- Množství tělesného tuku: Tuková tkáň obsahuje jen málo vody, a proto nejen u žen, ale i obézních jedinců je podíl CTV na hmotnosti menší než u štíhlých.
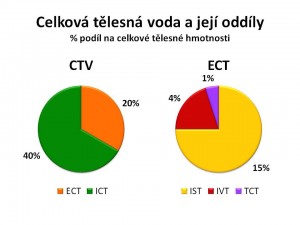
Rozlišujeme dva hlavní oddíly CTV a to:
- Vodu a v ní rozpuštěné ionty a soluty uvnitř buněk neboli intracelulární tekutinu (ICT), která tvoří asi 2/3 CTV, tedy 40 % tělesné hmotnosti (ionty jsou částice s nábojem, soluty jsou molekuly bez náboje, např. glukóza nebo močovina);
- Vodu mimo buňky neboli extracelulární tekutinu (ECT), která tvoří asi 1/3 CTV, tedy asi 20 % tělesné hmotnosti.
Oddíl extracelulární můžeme dále rozdělit na:
- Tekutinu uvnitř cév s odečtením korpuskulárních elementů, tedy intravaskulární tekutinu (IVT) neboli krevní plazmu, která představuje asi ¼ ECT, tedy 4 – 5 % tělesné hmotnosti;
- Tkáňový mok neboli intersticiální tekutinu (IST), která kvantitativně zaujímá ¾ ECT, tedy asi 15 % tělesné hmotnosti;
- Tekutinu v třetím prostoru neboli transcelulární tekutinu (TCT), která za fyziologických okolností není větší než 1 % tělesné hmotnosti.
Extracelulární tekutina
Jak bylo řečeno výše, představuje extracelulární tekutina u dospělého asi 1/3 CTV. Hlavní pododdíly ECT, tj. tkáňový mok a krevní plazmu, od sebe odděluje kapilární membrána, která je vysoce propustná, a proto složení moku a plazmy je velmi podobné – až na množství bílkovin. Hlavními extracelulárními ionty jsou Na+ a jeho aniontový souputníci Cl- a HCO3-. Krevní plazma obsahuje vysoké množství bílkovin, kdežto tkáňový mok jen malé množství bílkovin, příčinou rozdílu je nízká propustnost kapilární membrány pro molekuly bílkovin. Molekuly bílkovin jsou negativně nabité, tedy chovají se jako anionty, a to vede k dalšímu rozdílu ve složení plazmy a moku – anionty bílkovin přitahují kationty (Na+ a další), a proto je koncentrace kationtů v plazmě lehce vyšší (o asi 2 %) než v tkáňovém moku, a naopak anionty bílkovin odpuzují jiné anionty (Cl- a další), a proto je koncentrace ostatních aniontů v plazmě menší než v intersticiu.
Intracelulární tekutina
Intracelulární prostor tvoří asi 2/3 CTV a od extracelulárního prostoru je oddělen plazmatickou membránou buněk, která je semipermeabilní. Polopropustnost společně s existencí aktivních transportérů v buněčné membráně vede k značným diferencím ve složení mezi ECT a ICT. Hlavními intracelulárními ionty jsou K+, Mg2+ , fosfáty, sulfáty a organické anionty. Plazmatická membrána je volně propustná pro vodu, kdežto pro ionty je relativně nepropustná, navíc se ještě liší permeabilita pro ten který iont (pro draslík je asi 50 – 100 x vyšší než pro sodík) a v případě vzrušivých tkání (myokard, kosterní a hladké svalstvo, neurony) se může v čase měnit v závislosti na tom, zda je buňka v klidu (klidový membránový potenciál) nebo zda probíhá akční potenciál. Pro anionty bílkovin a organické fosfáty je nepoškozená buněčná membrána zcela nepropustná.
Bilance tělesné vody a soli
Stabilita tělesných tekutin je zajištěna díky schopnosti organismu udržet rovnováhu mezi příjmem a ztrátami vody a iontů v průběhu dne.
Příjem vody
Voda se do organismu dostává skrze GIT, nebo v něm – v malém množství – vzniká metabolickými pochody:
- Voda obsažená v tekutinách a potravinách, které vypijeme a sníme. Co do množství jde přibližně o 2,0 – 2,5 l/den.
- Voda metabolická, vznikající v průběhu chemických reakcí. Množství takto vytvořené vody při normálním stupni metabolismu činí asi 0,25 l/den.
Ztráty vody
Voda se z organismu ztrácí čtyřmi cestami:
- Moč. Tato cesta je co do objemu i regulace ztrát nejvýznamnější. V průměru se jedná o asi 1,5 – 2,0 l/den.
- Stolice. Za fyziologických okolností jde o ztráty zanedbatelné, asi 0,1 l/den.
- Respirace. Množství vody ve vydechovaném vzduchu u normálně ventilujícího dospělého jedince představuje ztrátu asi 0,3 – 0,4 l/den. Je součástí tzv. perspiratio insensibilis – viz kůže.
- Kůže. Prosté odpařování vody z kůže (a ze sliznic dýchacích cest), které není závislé na činnosti potních žláz, nazýváme perspiratio insensibilis. Děje se trvale a za běžných podmínek činí 0,3 – 0,4 l/den (tzn. celkové ztráty evaporací vody z kůže a dýchacího ústrojí činí asi 0,7 l/den). Perspiratio sensibilis je naproti tomu aktivní proces vylučování potu potními žlázami v závislosti na termoregulačních potřebách organismu a při běžné pokojové teplotě činí asi 0,1 – 0,2 l/den.
Příjem soli. Sůl stejně jako vodu přijímáme perorálně v tekutinách a jídle, sůl na rozdíl od vody lidský organismus metabolicky nevyrobí. Ke ztrátám soli dochází močí, stolicí a potem. Pro udržení tělesných tekutin postačuje denní příjem NaCl 0,5 g, v naší zemi je ale příjem soli výrazně vyšší (10 – 15 g/den), nadbytečný a nepříznivě zatěžující organismus rizikem rozvoje primární hypertenze. Podrobněji o bilanci soli pojednává příspěvek s názvem Sodný iont, hyponatremické a hypernatremické stavy.
Vylučování vody ledvinami
Hlavní cestu vyloučení vody z organismu a zároveň hlavní regulační orgán homeostázy vody, resp. tělesných tekutin, představují ledviny. V glomerulech je voda filtrována zcela volně, což při obvyklé rychlosti glomerulární filtrace 2 ml/s představuje okolo 170 – 180 l ultrafiltrátu denně. Chemické složení ultrafiltrátu je prakticky stejné jako složení plazmy až na téměř úplnou absenci bílkovin. V tubulech dochází ke zpětné resorpci 99 % vody a to znamená, že se z těla vyloučí pouhé 1 % objemu ultrafiltrátu, což představuje okolo 1,5 – 2,0 l definitivní moči za 24 h.
Exkreční frakce vody je poměr mezi objemem definitivní moči a objemem glomerulárního ultrafiltrátu za jednotku času a lze ji vypočítat dle vzorce
FEH2O = S – Kr / U – Kr x 100,
kde S-Kr koncentrace kreatininu v plazmě (tuto je nutné vynásobit 1000 x, protože je na rozdíl od U-Kr udávána v µmol/l) a U-Kr je koncentrace kreatininu v moči. Norma FEH2O je 1 – 2 %.
Zdravé ledviny jsou ovšem schopny v závislosti na měnících se potřebách organismu vytvořit i méně než 0,5 l hypertonické definitivní moči za den, nebo naopak vyloučit až 18 l hypotonické moči za 24 h, tzn. že FEH2O může v extrémních případech dosáhnout hodnot 0,4 % – 10 %. Tomu odpovídá i široké rozpětí dosažitelné močové osmolality (U-osm), které se pohybuje v rozmezí 50 – 1200 mosmol/kg H2O!
Nyní se podíváme na tubulární systém nefronu a podíl jeho jednotlivých částí na zpětném vstřebání vody a soli:
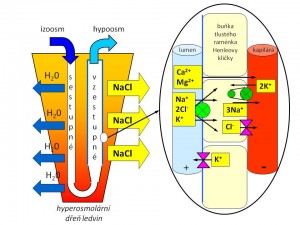
- Proximální tubulus. Tato část je dobře propustná jak pro vodu, tak pro sůl. Resorpce vody je pasivní a děje se po transtubulárním osmotickém gradientu, který vytváří aktivní resorpce iontů sodíku a dalších iontů a solutů. Voda difunduje jak transcelulárně skrze tubulární buňky, tak přes paracelulární štěrbiny a hromadí se v peritubulárním prostoru, což zde zvyšuje hydrostatický tlak. S takto vyvolanou změnou Starlingových kapilárních sil dochází k přesunu vody do peritubulárních kapilár. Vstřebávání vody, iontů a solutů je v proximálním tubulu proporcionální, tzn. že tekutina, která opouští proximální tubuly, je izoosmolární, a činí přibližně 70 % objemu profiltrovaného v glomerulech.
- Henleova klička, resp. její tenká sestupná část, je propustná pro vodu, které se zde resorbuje asi 15 %, ale není prostupná pro sůl. Opět jde o pasivní resorpci vody, jejíž hnací silou je hyperosmolarita dřeně ledvin. Na vrcholu Henleovy kličky dosahuje intraluminální osmolalita vznikající moči až 1200 mOsm/kg H2O. Vzestupná část Henleovy kličky (tenká i tlustá) je nepropustná pro vodu, ale naopak propustná pro NaCl. K resorpci soli proto dochází ve vzestupném raménku Henleovy kličky, a to pasivně v její tenké části a aktivně v její tlusté části, kde se sodík resorbuje společně s draslíkem a chloridy přes NKCC2 (Na-K-Cl-cotransporter). Zpětné vstřebávání soli ve vzestupné kličce dosahuje 20 % z jejího celkového množství původně obsaženého v ultrafiltrátu. Tekutina opouštějící Henleovu kličku je hypoosmolární, protože resorpce iontů a solutů v této části převažuje nad resorpcí vody.
- Distální tubulus. Stočená část je nepropustná pro vodu, k resorpci soli zde dochází aktivně přes luminální NCC (Na-Cl-cotransporter). Koncová část distálního tubulu je místem, kde se jak voda, tak sůl mohou, ale nemusí resorbovat. Tato část už totiž je pod hormonální kontrolou (viz níže). Obvyklé množství vody a soli, které se resorbuje v průběhu distálních tubulů, je asi 5 %. Moč opouštějící distální tubulus zůstává hypoosmolární.
- Sběrací kanálek. Tato část (funkčně zahrnuje i koncovou část distálního tubulu) odpovídá za finální úpravu množství moči dle potřeb organismu. Zpětná resorpce vody je zde pod hormonální kontrolou ADH, který vodě „otvírá“ vodní kanálky - aquaporiny – v apikální membráně. Bez ADH je sběrací kanálek pro vodu neprostupný. Zpětná resorpce sodíku je ve sběracích kanálcích pod hormonální kontrolou aldosteronu, který stimuluje jeho zpětné vstřebání přes epiteliální sodíkový kanál (ENaC), kdežto K+ unikají z buněk do lumina tubulů přes ROMK kanály. Ve sběracích kanálcích se obvykle resorbují asi 4 % profiltrovaného sodíku a asi 9 % profiltrované vody.
Ledviny jsou tedy hlavním efektorovým orgánem regulace vodního a minerálního hospodářství organismu. O složení finální moči rozhodují koncové části nefronu, přičemž jsou od sebe odděleny regulace exkrece vody od regulace exkrece iontů. Voda se tedy může vylučovat bez soli a sůl bez vody (toto neplatí absolutně, i maximálně naředěná moč obsahuje určité množství iontů a solutů). Nezbytnou podmínkou správného fungování ledvin je dostatečný krevní průtok. Ledviny dostávají 20 – 25 % minutového srdečního výdeje, což je dáno funkčními, nikoliv nutritivními požadavky ledvin. Ledviny současně mají výraznou schopnost autoregulace svého krevního průtoku, tzn. že jsou schopny udržet svoji perfúzi na konstantní úrovni, a to i přes značné výkyvy středního arteriálního tlaku. Největší část perfúze (90 %)připadá na prokrvení kůry ledvin. Energeticky nejnáročnější částí nefronu je proximální tubulus. Naopak dření ledvin protéká jen asi 10 % renálního průtoku, což usnadňuje udržení její hypertonicity, která je jednou z podmínek koncentrační schopnosti ledvin.
Osmotické síly, celková, efektivní a plazmatická osmolarita
Voda je malá elektroneutrální molekula, která zcela volně prochází biologickými membránami. Hlavní hnací silou přesunu vody mezi extracelulárním a intracelulárním prostředím je osmotický gradient. Podstatou osmotických sil je rozdíl v látkové koncentraci osmoticky aktivních částic v daném prostoru oproti prostoru sousednímu. Výsledkem je osmotický tlak, který žene vodu do prostoru s vyšší koncentrací osmoticky aktivních částic (jinak řečeno, voda se pohybuje do místa, v němž je její koncentrace – tedy její chemický potenciál – nižší). Tento přesun trvá do doby, než dojde k vyrovnání koncentrace osmoticky aktivních částic (iontů anebo solutů) na obou stranách semipermeabilní membrány. Dojde-li tedy ke zvýšení koncentrace osmoticky aktivních částic v ECT, pak voda začne rychle difundovat z buněk do ECT a objem buněk se zmenšuje. Naopak, při snížení koncentrace iontů anebo solutů v ECT, začne voda difundovat z ECT do buněk a objem buněk se zvětšuje. Difúze v obou příkladech končí ve chvíli, kdy se celková koncentrace iontů a solutů (resp. vody) v ECT a ICT vyrovná.
Mírou osmotické aktivity daného kompartmentu, tedy schopnosti udržet v tomto prostoru vodu, je osmolarita anebo osmolalita. Osmolarita je koncentrace osmoticky aktivních částic připadající na jednotkový objem roztoku; jednotkou je mol/l neboli osmol/l. Osmolalita je koncentrace osmoticky aktivních částic připadající na jednotku hmotnosti rozpustidla, tj. vody; jednotkou je mol/kg H2O neboli osmol/kg H2O.
Osmotické síly závisí pouze na počtu částic v daném objemu, tedy na jejich látkové koncentraci, nikoliv na jiných vlastnostech (jako je třeba hmotnostní koncentrace, nebo náboj). Ukažme si to na následujícím příkladu. Osmolarita roztoku, který v 1 litru obsahuje 1 mol glukózy, je 1 osmol/l. Naproti tomu osmolarita 1 l roztoku obsahujícího 1 mol NaCl je 2 osmol/l, protože jedna molekula NaCl disociuje na 2 ionty (Na+ a Cl-). Proto hlavními osmoticky aktivními částicemi v tělních tekutinách jsou malé ionty Na+, K+, Cl- atd., kdežto podíl např. bílkovin, které jsou vysokomolekulární, je velmi malý (v plazmě dosahuje asi 1 mosmol/l).
Celková osmolarita je dána součtem látkových koncentrací všech rozpuštěných solutů v příslušném oddíle tělesných tekutin. Celková osmolarita ale není totéž co efektivní osmolarita. Efektivní osmolarita je ta část celkové osmolarity, která způsobuje přesuny vody mezi jednotlivými kompartmenty. Je podmíněna těmi ionty anebo soluty, které jen velmi obtížně procházejí nebo vůbec neprocházejí biologickými membránami. Efektivní osmolarita se tak nejvíce blíží pojmu tonicita vnitřního prostředí. Příkladem efektivního solutu je Na+, který dominuje v ECT, ale jen minimálně prochází do ICT. Při zvýšení koncentrace Na+ v ECT začne voda přecházet z buněk do ECT. Při snížení koncentrace Na+ v ECT přechází voda z ECT do buněk. Neefektivní soluty jsou ty, které sice mohou zvyšovat celkovou osmolaritu, ale protože snadno procházejí biologickými membránami, jejich koncentrace vně a uvnitř buněk se rychle vyrovnají, a tudíž nevzniká osmotický gradient, a nedochází ani k významnějším přesunům vody. Příkladem neefektivního solutu je močovina. Zvláštní postavení mezi soluty rovněž zaujímá glukóza. Za fyziologických okolností, například při postprandiální hyperglykémii, se pod taktovkou inzulínu a díky glukózovým transportérům rychle přesouvá z plazmy do buněk, a tudíž se chová jako solut neefektivní. Ovšem za patologických okolností, kdy chybí účinek inzulínu, glukóza do většiny buněk volně vstoupit nemůže, a stává se solutem efektivním.
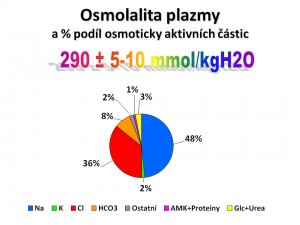
Celková osmolarita plazmy činí fyziologicky 290 mosmol/l ± 5 – 10 mosmol/l. Z celkové plazmatické osmolarity je procentový podíl jednotlivých osmoticky aktivních částic plazmy následující:
- Ionty 96 %;
- Glukóza a urea 3 %;
- Aminokyseliny a proteiny 1 %.
Rozhodujícími osmoticky aktivními částicemi plazmy a potažmo ECT jsou tedy ionty a z nich především Na+ a Cl-, které samy o sobě odpovídají za ¾ celkové osmolarity.
Osmolaritu plazmy anebo séra daného pacienta můžeme buď přímo změřit v laboratoři pomocí osmometru (přístroj měří osmolalitu, tedy v jednotkách mol/kg), nebo nepřímo odhadnout pomocí výpočtu z plazmatických koncentrací nejvýznamnějších iontů a solutů. K výpočtu osmolarity existuje řada rovnic. K nejběžněji užívaným patří tyto dvě:
- S-osm (mmol/l) = 2 x S-Na + S-glukóza +S-urea
- S-osm (mmol/l) = 2 x (S-Na + S-K) + 5
V klinické praxi nastávají situace, kdy je vhodné stanovení celkové osmolarity provést jak přímým změřením, tak i výpočtem a následně hodnoty porovnat. Mluvíme o tzv. osmolárním okně, OsmGap = S-osmzměřená - S-osmvypočítaná . Rozdíl mezi nimi obvykle nečiní více než 10 mmol/l. Je-li rozdíl větší a ve prospěch osmolarity změřené, poukazuje to na patologickou přítomnost jiných osmoticky aktivních částic (exogenních látek – např. etanolu, etylenglykolu při použití prvního vzorce, nebo glukózy, urey anebo exogenních látek při použití druhého vzorce). To může vyšetřujícímu lékaři pomoci v diferenciální diagnostice.
Je-li aktuální osmolarita plazmy pacienta menší než dolní hranice normy, tedy P-osm pod 280 mosm/l hovoříme o hypoosmolárním stavu a voda se za této situace přesunuje z ECT do buněk a objem ICT se zvětšuje. Naopak, je-li osmolarita plazmy vyšší než horní hrance normy, tzn. P-osm nad 300 mmol/l, jde o hyperosmolární poruchu vnitřního prostřed, kdy se voda po osmotickém gradientu přesunuje z buněk do ECT a objem ICT se zmenšuje. Jestliže dojde ke změně objemu tělesných tekutin bez změny osmolarity, tzn. S-osm zůstává mezi 280 – 300 mosm/l, pak mluvíme o izoosmolární poruše a voda se v tomto případě mezi ECT a buňkami udržuje v rovnováze a objem ICT se tak nemění.
Monitorování stavu tělních tekutin
Monitorování je nezbytným předpokladem funkce každého regulačního okruhu. Uskutečňuje ho senzor, který do regulačního centra přináší informace o změně sledované veličiny. Vyhodnocování stavu tělních tekutin se v našem organismu děje pomocí dvou parametrů:
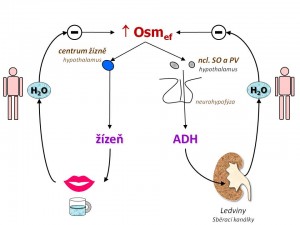
- Efektivní osmolalita (OSMef), jak již víme z předchozího výkladu, je ta část celkové osmolality, která způsobuje přesuny vody mezi jednotlivými kompartmenty a která je dána přítomností nepenetrujících anebo pomalu penetrujících iontů a solutů. Změny efektivní osmolarity monitorují specializované buňky, tzv. osmoreceptory. Mechanismus, kterým jsou schopny tyto buňky zaregistrovat změnu OSMef , je spojen se změnou jejich objemu (zvětšení při hypoosmolaritě, zmenšení při hyperosmolaritě). Centrální osmoreceptory se nacházejí v hypotalamu a to v jeho anterolaterální oblasti. Osmoreceptory ovšem můžeme najít i mimo CNS. Jde o tzv. periferní osmoreceptory, které jsou uloženy v játrech a mají velký význam v monitorování osmolarity v portální cirkulaci a v předcházení výkyvů osmolarity ECT po příjmu tekutin a stravy v době, kdy ještě nemůže dojít ke stimulaci centrálních osmoreceptorů.
- Efektivní cirkulující objem (Vef) je ta část celkového objemu ECT, která zajišťuje patřičnou perfúzi tkání, a je tak dostačující vzhledem k jejich metabolickým požadavkům. V hemodynamice odpovídá této veličině tzv. střední cirkulační plnicí tlak (viz kapitola Hemodynamika a kapitola Fyziologie a patofyziologie regulace krevního tlaku). Stejně jako v případě efektivní osmolarity není ani efektivní objem totéž co celkový objem. Za fyziologických okolností závisí efektivní cirkulující objem na (a) celkovém objemu ECT, resp. objemu krve v cirkulaci, a dále přímo úměrně závisí na (b) srdečním výdeji a arteriálním tlaku. Pokud dojde ke snížení objemu ECT, snížení objemu krve v cirkulaci, poklesu srdečního výdeje anebo poklesu arteriálního krevního tlaku, pak dojde i k poklesu Vef. Naopak, vzestup výše uvedených ukazatelů vede k vzestupu Vef. Ovšem existují patologické situace, kdy je objem ECT nebo objem krve v cirkulaci zvýšený, ale Vef přesto může být snížený - klasickým příkladem je srdeční selhání.
- Na rozdíl od efektivní osmolarity ale nemáme žádné volumoreceptory, které by přímo měřily objem tělesných tekutin anebo absolutní náplň řečiště. Máme pouze baroreceptory, které monitorují relativní náplň řečiště, tj. poměr objemu náplně ku kapacitě řečiště, tj. krevní tlak – přesněji řečeno, tyto receptory reagují na tlakem indukovanou změnu napětí stěny orgánu, ve kterém jsou uloženy. Kde baroreceptory najdeme? Především v cirkulaci. Podle toho, ve které její části jsou uloženy, je dělíme na vysokotlaké a nízkotlaké baroreceptory. Vysokotlaké baroreceptory monitorují systémový arteriální tlak a jsou uloženy v aortálním oblouku a karotickém sinu. Jejich signály jsou vedeny cestou IX. a X. hlavového nervu do mozkového kmene a zde do nucleus tractus solitarii, který je viscerosenzitivním jádrem; odpovědí je změna aktivity sympatiku. Nízkotlaké baroreceptory monitorují centrální žilní tlak a jsou uloženy ve stěně srdečních síní, ale také ve velkých plicních cévách. Jejich signály jsou vedeny cestou nervus vagus do téhož centra jako v případě vysokotlakých baroreceptorů. Další baroreceptory se nacházejíí v klíčovém orgánu objemové rovnováhy, kterým jsou ledviny. Konkrétně jde o juxtaglomerulární buňky a. afferens, které na změnu renálního perfúzního tlaku odpovídají (a) změnou sekrece reninu (viz níže) a (b) myogenním reflexem, kterým se mění tonus a.afferens, a tím i GFR.
- Jelikož objem tělených tekutin kriticky závisí na přítomnosti soli, resp. iontů sodíku, je další možností, kterou organismus využívá pro monitorování Vef, sledování množství Na+ anebo Cl- pomocí chemoreceptorů. Klasickým příkladem je macula densa, která je součastí juxtaglomerulárního aparátu. Jde o skupinu specializovaných buněk na začátku distálního tubulu, které jsou citlivé na množství Na+ a Cl- v tubulární tekutině. Odpovědí na změnu koncentrace soli v tubulární tekutině je (a) změna sekrece reninu juxtaglomerulárními buňkami a (b) změna tonu a.afferens přes tzv. tubuloglomerulární zpětnou vazbu (TGF), jejímž úkolem je vyrovnávat oscilace v GFR. Chemoreceptory citlivé na přísun Na+ rovněž najdeme v CNS. Alterace obsahu sodíku v krvi přitékající do mozku nebo v cerebrospinálním moku vede ke změně renální exkrece NaCl, a to prostřednictvím změny tonu renálního sympatiku.
Regulace efektivní osmolality
V řízení efektivní osmolarity se uplatňují dva systémy a to:
- Antidiuretický hormon, který v ledvinách zadržuje čistou vodu, a tím snižuje osmolaritu.
- Pocit žízně, vlivem kterého se postižený jedinec napije, a tím sníží osmolalitu.
Antidiuretický hormon
neboli vazopresin je peptidový hormon (9 aminokyselin) syntetizovaný v hypotalamu, přesněji řečeno magnocelulárními buňkami v nucleus supraopticus a nucleus paraventricularis. Vytváří se jako prohormon ve vazbě na protein neurofyzin, pomocí kterého je transportován axony neurosekrečních buněk z výše uvedených jader do neurohypofýzy. Zde je skladován o odtud je vylučován do krve.
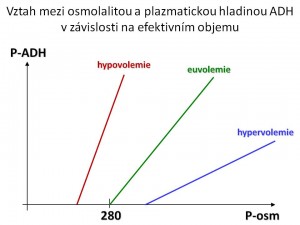
Hlavním podnětem pro sekreci ADH je zvýšení efektivní osmolality. Citlivost sekrece ADH na výkyvy osmolarity je velmi vysoká, ke změně sekrece ADH stačí změna osmolarity o 1 %. Mezi osmolaritou a hladinou ADH v plazmě je lineární vztah (změna osmolarity o 1 mmol/kg H2O vede ke změně hladiny ADH o 0,5 pg/ml). Osmotický práh, od kterého začíná vylučování ADH, je u euvolemického jedince 280 mmol/kg. To znamená, že pod touto osmolalitou nedochází k vylučování ADH, kdežto nad tímto bodem („set point„) se sekrece lineárně a rychle zvyšuje.
Druhým fyziologickým podnětem pro sekreci ADH je snížení efektivního objemu. Citlivost této odpovědi ADH na změnu Vef ale je podstatně menší než v případě změny osmolarity - musí dojít k poklesu efektivního objemu alespoň o 5 % – 10 %, aby došlo ke zvýšení sekrece ADH. Změna Vef ovšem současně mění nastavení osmotického prahu, tzn. že při hypovolémii se osmotický práh posouvá dolů, a tedy k vylučování ADH dochází už při hodnotách efektivní osmolality pod 280 mmol/kg, naopak při hypervolémii se „set point“ posouvá nahoru, tedy vylučování ADH nastává až při osmolalitě nad 280 mmol/kg. Současně změna objemu mění sklon křivky vztahu mezi S-osm a ADH, tzn. při hypovolémii vede stejná změna osmolality k vyššímu relativnímu vzestupu hladiny ADH, kdežto při hypervolémii vzroste při stejné změně plazmatické osmolality hladina ADH relativně méně. Jsou i další faktory, které zvyšují sekreci ADH, jako jsou nauzea/zvracení, bolest, stres, angiotenzin II, hypoxie, hypoglykémie, nikotin, sexuální vzrušení, nebo naopak sekreci ADH snižují např. ANF, etanol, glukokortikoidy, hormony štítné žlázy, pokles teploty apod.
Antidiuretický hormon neboli vazopressin je hormon dvou názvů, dvou hlavních receptorů a dvou účinků:
- Vazokonstrikce přes V1 receptory na odporových cévách. V1 receptor je spřažen s Gp proteinem, takže po navázání vazopresinu dojde k aktivaci fosfolipázy C, přeměně fosfoinositolbisfosfátu (PIP2) na diacylglycerol (DAG) a inositoltrisfosfát (IP3) s následným zvýšením intracelulární koncetrace iontů vápníku a vazokonstrikci. Tento účinek tedy spadá do regulace efektivního objemu.
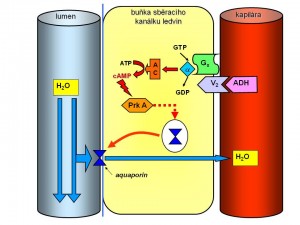
- Zpětná resorpce čisté vody v ledvinách, která je zprostředkována přes V2 receptory na bazolaterální membráně tubulárních buněk sběracích kanálků a koncových částí distálních tubulů. Receptory V2 jsou spřaženy s Gs proteiny, takže po navázání ADH dojde k aktivaci adenylátcyklázy s tvorbou 2. posla v podobě cAMP, který aktivuje proteinkinázu A s následnou fosforylací a přesunem vezikul obsahujících aquaporiny typu 2 k apikální membráně tubulárních buněk. Aquaporin 2 je vodní kanál, který po uvolnění z vezikul a vestavbě do apikální membrány zvyšuje permeabilitu distálního nefronu pro vodu. Voda se pak přesunuje po osmotickém gradientu nejprve dovnitř do tubulární buňky a následně přes bazolaterální membránu (aquaporin 3, 4) do hypertonické dřeně ledvin, odkud pak je odváděna peritubulárními cévami zpět do organismu. Výsledkem je malý objem (až pod 0,5 l/24h) hyperosmolární moči (U-osmmax. je 1200-1400 mosmol/kgH2O) – hovoříme o antidiuréze. Naopak, pokud ADH není přítomen, vodní kanálky se z apikální membrány vracejí zpět do cytoplazmy a do skladovacích vezikul, a sběrací kanálky jsou tak pro vodu neprostupné. Voda se tudíž nemůže v této části nefronu vstřebat zpět a odchází ve velkém množství (až 10 % GFR, tedy až 20 l/24h) hypotonické moči (U-osmmin. může klesnout až na 50 – 100 mosmol/kg H2O) pryč z organismu - hovoříme o vodní diuréze. Vztah mezi hladinou ADH a močovou osmolalitou (U-osm) je vztahem přímé úměry, tzn. že se stoupající hladinou ADH roste U-osm (přibližně +200 mosmol/kg H2O na každý +1 pg/ml plazmatické hladiny ADH), ale má své maximum, které je dáno výší hypertonicity dřeně (max. 1200 – 1400 mosmol/kg H2O). Při sérové osmolalitě mezi 290 – 295 mmol/kg (hladina ADH mezi 5 – 6 pg/ml) tak je dosaženo maximální účinnosti ADH, a přesto, že hladina ADH se stoupající S-osm dále stoupá, U-osm už nenarůstá Naproti tomu vztah mezi močovou osmolalitou a ADH na jedné straně a objemem moči (VU) je vztahem inverzním a exponenciálním, tzn. že stejný relativní vzestup hladiny ADH a U-osm vede k výraznější redukci VU při nižších absolutních hladinách ADH a U-osm. Biologický poločas ADH je krátký, maxima účinku je dosaženo za 15 – 20 min po změně efektivní osmolarity, což umožňuje velmi pružnou regulaci diurézy.
Sekrece a účinnost ADH (a tím permeabilita sběracích kanálků pro vodu) tak je nezbytnou podmínkou koncentrační schopnosti ledvin, jež dále závisí na hypertonicitě dřeně ledvin, která pak vytváří osmotický gradient, po němž voda zamíří z tubulů do peritubulárního prostoru. Hypertonicita intersticia dřeně ledvin je dána přítomností velkého množství iontů a solutů, přičemž asi polovinu tvoří NaCl a druhou polovinu močovina. Tyto aktivní složky je ovšem třeba do dřeně nějak dostat a udržet je tam. To je dáno
- Aktivní resorpcí soli v tlusté části Henleovy kličky;
- Protiproudovým uspořádáním Henleových kliček a vasa recta, které umožňuje dosáhnout osmotické stratifikace dřeně ledvin;
- Malým průtokem krve dření ledvin (jen 10 % celkového renálního průtoku), tak aby nedocházelo k odplavování solutů z dřeně;
- Recirkulací močoviny mezi nefronem a intersticiem.
Močovina (urea) se syntetizuje v játrech jako odpadní produkt degradace aminokyselin. Do tubulární tekutiny vstupuje volně přes glomerulární filtr. Většina délky nefronu je pro močovinu málo propustná, takže resorpcí vody v průběhu nefronu postupně dochází k navyšování koncentrace močoviny. ADH zvyšuje permeabilitu medulární části sběracích kanálků pro močovinu, a ta pak opouští sběrací kanálek po svém koncentračním gradientu směrem do dřeně ledvin, kde se hromadí. Část močoviny ze dřeně ledvin sice difunduje zpět do nefronu, a to v tenké části Henleovy kličky, ale tím se znovu dostává přes distální tubulus do sběracích kanálků a opět se vrací do dřeně - výsledkem tedy je „uvěznění“, recirkulace močoviny v ledvinách.
Pocit žízně
představuje druhý homeostatický mechanismus korigující vzestup efektivní osmolality. Centrum žízně v CNS je uloženo v předním hypotamalu, zřejmě v organum vasculosum laminae terminalis, ale je odděleno od center osmorecepce spojené s ADH (existují závažné formy diabetes insipidus, kdy pacient nepociťuje žízeň).
Hlavním podnětem pro stimulaci pocitu žízně je zvýšení efektivní osmolality - citlivost je vysoká, k vyvolání silného pocitu žízně stačí vzestup osmolality (natrémie) o 2 – 3 %. Osmotický práh, od kterého začíná člověk pociťovat žízeň, je někde mezi 290 – 295 mmol/kg H2O. Vyvolání pocitu žízně pak vede k příjmu tekutin s následným vstřebáním vody z GIT a ke korekci hyperosmolality, a tím i zahnání pocitu žízně.
Stejně jako u ADH je druhým stimulem pokles efektivního objemu, ale tento pokles musí činit 15 – 20 % aby došlo k vyvolání pocitu žízně. Významným žízeň podporujícím stimulem je také angiotenzin II, jehož tvorba rovněž souvisí s poklesem efektivního objemu. Další příčinou zvýšeného pocitu žízně je suchost sliznic v orofaryngeální oblasti, naopak rozepětí žaludku po příjmu tekutin a stravy potlačuje pocit žízně. Poslední dva zmíněné lokální faktory, zprostředkované receptory z horních partií GIT, brání „překorigování“, tj. přijetí příliš velkého množství tekutin, které by vedlo k nežádoucímu poklesu osmolarity až do pásma hypoosmolarity; svlažení sliznic tekutinou a roztažení žaludku sníží pocit žízně ještě před tím, než je dosaženo poklesu efektivní osmolarity, který je nutný jak pro definitivní potlačení pocitu žízně, tak pro útlum sekrece ADH.
Oba systémy (ADH a žízeň) se vzájemně doplňují.
- Zvýšení efektivní osmolality zvyšuje sekreci ADH, což vede k zadržování čisté vody v ledvinách, a pokud je překročen osmotický práh pro pocit žízně, který se kryje s osmotickým prahem maximálního účinku ADH (mezi 290 – 295 mosm/kg H2O), je současně stimulována žízeň, a tím doplnění chybějící vody příjmem tekutin.
- Snížení efektivní osmolality snižuje sekreci ADH, což vede k vodní diuréze; současně je utlumen pocit žízně, a tím se zabrání dalšímu příjmu vody.
Regulace efektivního objemu
Neurohumorální regulační systémy, které dostávají informace ze senzorů monitorujících efektivní objem (baroreceptory, chemoreceptory), mají za úkol korigovat výchylky efektivního objemu. Toho v podstatě mohou dosáhnout dvěma způsoby:
- Změnou kapacity řečiště prostřednictvím vazokonstrikce/vazodilatace. Do této skupiny počítáme „poplachové“ reflexy spojené s baroreceptory, sympatikem a katecholaminy, které sice odpovídají rychle na změnu Vef , ale jejich účinnost je omezená, protože se postupně adaptují na novou výši efektivního volumu a krevního tlaku.
- Změnou náplně řečiště přesunem tekutiny mezi intra- a extravazálním prostorem nebo snížením/zvýšením diurézy.
- První uvedené souvisí se změnou Starlingových kapilárních sil a z toho plynoucí změnou poměru filtrace a resorpce na kapilárách, kdy extravazální prostor může pufrovat výkyvy objemu v intravazálním prostoru.
- Druhé uvedené má společného jmenovatele, a to ledviny, na něž jako na efektor jsou napojeny četné regulační smyčky. Patří sem systém renin-angiotenzin II-aldosteron, ANF, urodilatin, ale i ADH. Z časového hlediska je účinek těchto systémů středně až dlouhodobě působící, tzn. nástup je sice pomalejší, ale zdravé ledviny regulují Vef, a tím krevní tlak, se 100% přesností.
- Současně do této skupiny patří i další systém anebo mechanismus, který reaguje na změny Vef prakticky okamžitě, a to na základě změny perfúzního krevního tlaku v ledvinách – tlaková diuréza (viz kapitola Hemodynamika a kapitola Fyziologie a patofyziologie regulace krevního tlaku).
Zvýšení efektivního objemu
Neurohumorální systémy zvyšující efektivní objem po jeho předchozím poklesu pod normu buď snižují kapacitu řečiště nebo zvyšují jeho náplň:
Sympatoadrenální systém
- Systémové účinky sympatiku a katecholaminů spočívají ve změně tonu odporových cév. O tom, zda nastane vazokonstrikce, nebo vazodilatace, rozhoduje aktivita/inaktivita sympatiku a také zastoupení podtypů adrenergních receptorů v příslušném orgánu. Katecholaminy, které se vyplavují buď ze zakončení eferentních nervů sympatiku anebo ze dřeně nadledvin, mají za úkol udržet perfúzi životně důležitých orgánů (mozek, srdce, pracující svaly), a to i na úkor jiných orgánů, které jsou pro přežití méně významné (kůže, splanchnikus). Výsledkem pak je tzv. centralizace oběhu. Jde tedy o systém nadstavěný nad systém lokální autoregulace perfúze, kterou si jednotlivé tkáně řídí sami na základě svých metabolických potřeb (viz kapitola Hemodynamika). Současně má sympatikus i účinky pozitivně chronotropní (zvýšení tepové frekvence) a ionotropní (zvýšení srdeční kontraktility), a tím zvyšuje minutový srdeční výdej, což rovněž vede ke zvýšení efektivního volumu. Zvýšený minutový srdeční výdej ovšem lze udržet jen pokud je zvýšen žilní návrat, protože srdce nemůže přečerpat více krve než do něho přiteče, a zvýšený žilní návrat je v této situaci dán právě „periferním“ účinkem sympatiku na cévy.
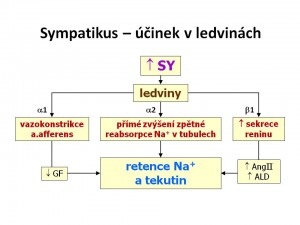
- Renální účinky sympatiku a katecholaminů spočívají ve zvýšení zpětné reabsorpce sodíku v nefronu a to od proximálního tubulu přes tlustou část Henleovy kličky a distální tubulus až po sběrací kanálky. Výsledným efektem tohoto působení je zvýšení efektivního cirkulujícího objemu. Mechanismus účinku sympatiku na ledviny je trojí:
- Zvýšení sekrece reninu z granulárních buněk juxtaglomerulárního aparátu přes β1 receptory, a tím zvyšení aktivity systému renin-angiotenzin II-aldosteron (RAA).
- Vazokonstrikce a. afferens přes α1-receptory a tím snížení hydrostatického tlaku v glomerulech, což má za následek snížení glomerulární filtrace.
- Přímé zvýšení reabsorpce sodíku tubulárními buňkami přes α2-receptory, především v proximálních tubulech a také v ascendentní části Henleovy kličky.
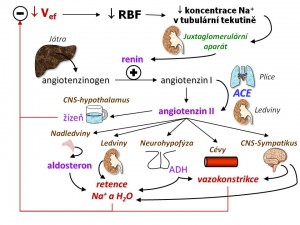
Systém renin-angiotenzin (RAS)
Renin je enzym (aminopeptidáza) vytvářený granulárními buňkami juxtaglomerulárního aparátu v ledvinách. Podněty pro tvorbu reninu jsou tři: (a) Snížený přítok NaCl tubulární tekutinou do oblasti macula densa jako následek snížené glomerulární filtrace, resp. jako následek poklesu renální perfúze (RBF = renal blood flow). (b) Zvýšená aktivita sympatiku, která zvyšuje sekreci reninu přes β1 receptory umístěné na povrchu granulárních buněk. (c) Pokles perfúzního tlaku v ledvinách, protože juxtaglomerulární buňky patří mezi baroreceptory, tj. jsou citlivé na změny krevního tlaku.
Angiotenzinogen je plazmatický alfa-2-globulin syntetizovaný játry. Slouží jako substrát pro renin. Angiotenzin I je oligopeptid, který vzniká zkrácením N-terminálního konce angiotenzinogenu účinkem reninu. Angiotenzin II (AngII) je pak vlastní účinný peptidický hormon systému RAS, který vzniká z angiotenzinu I účinkem angiotenzin-konvertujícího enzymu (ACE). Tvorba angiotenzinu II probíhá jak na úrovni systémové, a to především v plicích (dáno přítomností ACE), tak na úrovni ledvin – v endotelu renálních cév, přičemž jeho koncentrace v renálním parenchymu dosahují 1000x vyšších hodnot než v systémové cirkulaci. Vliv angiotenzinu II na buňky je zprostředkován přes jeho AT-receptory, kterých je několik podtypů. Podtyp AT1 je zodpovědný za převážnou část efektů. Angiotenzin II má ve vztahu k regulaci tělních tekutin tyto účinky:
- Vede k všeobecné vazokonstrikci arteriol a vén, a tím vede ke zvýšení krevního tlaku;
- Zvyšuje reabsorpci sodíku v proximálním tubulu;
- Zvyšuje tvorbu aldosteronu, a tím opět zvyšuje resorpci sodíku v koncové části distálního tubulu a sběracích kanálcích;
- Zvyšuje odpor a. efferens, a tím stabilizuje GFR při sníženém přívodu krve do ledvin, přitom současně poklesem hydrostatického tlaku v peritubulárním řečišti zvyšuje reabsorpci vody a sodíku v proximálních tubulech;
- Stimuluje pocit žízně;
- Stimuluje aktivitu sympatiku;
- Zvyšuje sekreci ADH, a tím resorpci H2O v koncových částech nefronu.
V souhrnu tedy můžeme říci, že RAS aktivovaný poklesem efektivního objemu vede vazokonstrikcí ke snížení kapacity cirkulace a retencí vody a soli ke zvýšení objemu cirkulace a ECT, a tím i k normalizaci efektivního objemu. Čas potřebný k plnému rozvinutí účinku systému RAS je 15 – 20 min.
Mineralokortikoidy
Aldosteron je mineralokortikoid kůry nadledvin (její zona glomerulosa). Nejvýznamnějším podnětem pro jeho tvorbu a sekreci je hyperkalémie, dále pak angiotenzin II, naopak ACTH ve fyziologických koncentracích se na přímém řízení jeho sekrece podílí jen málo – spíše zajišťuje růst a připravenost buněk zona glomerulosa. Aldosteron zvyšuje zpětnou resorpci sodíku a současně exkreci draslíku hlavními buňkami distálního nefronu a to následujícími mechanismy:
- Zvyšuje kapacitu systému Na-K-ATPáz v bazolaterální membráně (zvyšuje jejich počet);
- Zvyšuje permeabilitu apikální membrány pro ionty sodíku, protože zvyšuje počet sodíkových kanálů ENaC, kterými sodné ionty proudí po elektrochemickém gradientu z lumina tubulů do nitra hlavních buněk. Zvýšená resorpce sodíku je také hnací silou zvýšené sekrece draslíku, který naopak přes ROMK kanály přestupuje z nitra hlavních buněk do lumina tubulů. Aldosteron je steroid, jeho účinek se dostavuje s časovým zpožděním několika hodin.
Snížení efektivního objemu
Neurohumorální systémy snižující efektivní objem po jeho předchozím vzestupu nad normu zvyšují kapacitu řečiště anebo snižují jeho náplň:
Útlum aktivity sympatiku nastává reflexně po té, co baroreceptory zachytí vzestup krevního tlaku. Snížení aktivity sympatiku vede ke snížení tonu hladkého svalstva cév, a tím i periferního odporu a zvýšení kapacity řečiště. Současně je aktivován parasympatikus, který svým negativním inotropním a chronotropním účinkem snižuje minutový srdeční výdej.
Tlaková diuréza – natriuréza
Představuje kruciální fyziologický mechanismus regulace krevního tlaku a potažmo efektivního objemu (středního cirkulačního plnicího tlaku) . Ledviny udržují krevní tlak přizpůsobením objemu krve v cirkulaci kapacitě krevního řečiště. Při zvýšení arteriálního krevního tlaku, resp. perfúzního tlaku v ledvinách, dochází okamžitě (za 30 – 60 vteřin) k nárůstu natriurézy a diurézy a tento vzestup trvá do doby, než se krevní tlak vrátí k normě. Naopak pokles arteriálního a perfuzního tlaku v ledvinách vede ke snížení natriurézy a diurézy.
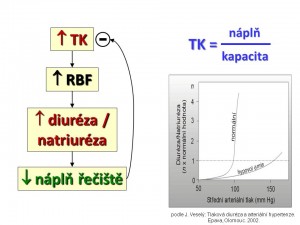
Tlaková diuréza
Grafickým vyjádřením tlakové diurézy je tzv. funkční renální křivka, z jejíhož strmého průběhu je patrné, že i malá změna krevního tlaku vede k velké změně natriurézy a diurézy. K tomuto dochází i přes známý fakt, že průtok krve glomeruly a peritubulární oblastí je i při značných výkyvech středního arteriálního tlaku udržován na konstantní úrovni (GFR zůstává stabilní při kolísání MAP v rozpětí 70 – 160 mm Hg). Z toho plyne, že za změnu exkrece iontů Na+ pravděpodobně nejsou odpovědné změny filtrace sodíku v glomerulech, ale především změny reabsorpce Na+ v průběhu tubulů. Přesný mechanismus tlakové diurézy není znám, za hlavního kandidáta na mediátora tlakové natriurézy je považován oxid dusnatý (NO). Představa o jeho úloze je následující: Zvýšení perfúzního tlaku v ledvinách zvyšuje smykové tření, což v endotelu renálních cév a především a. afferens indukuje expresi syntázy oxidu dusnatého typu 3 (NOS 3); vzniklý NO difunduje do krve a přes glomerulární filtr do tubulů, kde parakrinním způsobem zvýší tvorbu 2. posla v podobě cGMP, který inhibuje zpětnou reabsorpci sodíku tubulárními buňkami, a tím zvyšuje natriurézu. Krevní tlak se tak stává nástrojem ledvin pro udržení vyrovnané bilance tekutin. Pokud v organismu dojde k poruše rovnováhy příjmu a výdeje vody a soli, bude krevní tlak obětován na normalizaci bilance, protože nerovnováha mezi příjmem a výdejem tekutin vede rychle ke smrti organismu, kdežto změna výše krevního tlaku je dlouhodobě slučitelná se životem.
Atriální natriuretický faktor
ANF je peptidový hormon tvořený atriálními kardiomyocyty. Stimulem je zvýšené napětí stěny srdečních síní vlivem zvýšeného plnění síní při zvýšeném efektivním cirkulujícím objemu anebo i při fyzickém cvičení. Tvorbu a uvolnění ANF rovněž podporuje β1-adrenergní stimulace, fibrilace síní nebo endotelin. V ledvinách ANF zvyšuje vylučování jak Na+, tak vody několika způsoby:
- Dilatací a. afferens a konstrikcí a. efferens zvyšuje glomerulární filtraci, a tím i finální množství moči a obsah soli v ní.
- Snižuje reabsorpci sodíku a vody ve stočené části distálních tubulů a v kortikálních sběracích kanálcích vlivem cGMP dependentní fosforylace ENaC.
- Snižuje sekreci reninu a aldosteronu.
- Zvýšením průtoku krve přes vasa recta snižuje obsah iontů a solutů v dřeni ledvin, tím klesá koncentrační schopnost a tubulární reabsorpce tekutin.
Dopamin
Dopamin na rozdíl od ostatních katecholaminů působí prodiureticky, a to inhibicí zpětné reabsorpce NaCl v proximálním tubulu. Stimulem pro uvolnění dopaminu je zvýšení efektivního cirkulujícího objemu. Dopamin se v ledvinách jednak uvolňuje z dopaminergních neuronů (což je pro natriurézu nevýznamné) a jednak je tvořen buňkami proximálních tubulů. Syntéza dopaminu v proximálních tubulech není závislá na sympatiku. Substrátem pro syntézu je L-DOPA z glomerulárního ultrafiltrátu, jejíž přestup přes apikální membránu zajišťuje kontransportér stimulovaný sodnými ionty. Enzymem zajišťujícím syntézu je DOPA-dekarboxyláza, jejíž aktivita roste při zvýšeném přísunu soli. Nově syntetizovaný dopamin je pak vylučován do lumen tubulů a dostává se tak i do dalších etáží nefronu. Efekt dopaminu v ledvinných tubulech je zprostředkován především přes D1 receptory, pro které je 2.poslem cAMP, ale část účinku je zprostředkována i přes další dopaminergní receptory (D2-D5). Dopamin zvyšuje natriurézu několika způsoby:
- Snižuje aktivitu Na+/K+-ATPázy na bazolaterální membráně, a to ve všech typech tubulů, takže méně iontů sodíku se přesunuje směrem do peritubulárního prostoru, což snižuje koncentrační gradient pro přestup sodíku z lumina do tubulárních buněk po celé délce tubulů.
- Snižuje aktivitu Na+/H+ protitransportéru a Na+-P--kontransportéru v luminální membráně buněk proximálních tubulů, kterými sodné ionty vstupují do tubulární buňky. K tomu jako prostředníka využívá cAMP.
- Inhibuje Na+-HCO3- symportér na bazolaterální membráně buněk proximálních tubulů, což snižuje příznivý elektrochemický gradient pro resorpci iontů sodíku v této části nefronu.
- Inhibuje sekreci a antagonizuje účinek RAS, aldosteronu a ADH.
Urodilatin, guanylin a uroguanylin
Urodilatin je peptidový hormon velmi blízký ANF (je delší o 4 aminokyseliny). Tvoří se jen v ledvinách v distálních tubulech a sběracích kanálcích a má jen renální účinky, v systémové cirkulaci ho nenajdeme. Podnětem pro jeho tvorbu je opět zvýšení efektivního cirkulujícího objemu. Natriuretický účinek urodilatinu spočívá v inhibici zpětné reabsorpce Na+ v medulární části sběracích kanálků a je obdobně jako u ANF zprostředkován přes cAMP. Ve srovnání s ANF je mnohem účinnější, protože ANF je po vstupu do ledvin degradován endopeptidázou.
Guanylin a uroguanylin jsou peptidové hormony produkované střevním epitelem a působící na epitelové buňky ve střevě, v tubulech ledvin, v dýchacích cestách a ve vývodných cestách orgánů (játra, slinivka) cestou receptorů spřažených s guanylát-cyklázou anebo G-proteiny (odtud jméno). Tvoří páteř osy střevo-ledviny. Stimulují exkreci sodných iontů i draselných iontů (následky zvýšené produkce jsou např. průjem anebo zvýšená natriuréza).
Závěry
- Celková tělesná voda tvoří 50 – 60 % hmotnosti dospělého člověka, u dítěte ještě více. Z toho 1/3 představuje tekutina v extracelulárním prostoru a 2/3 tekutina v intracelulárním prostoru. Tyto prostory jsou odděleny buněčnou membránou. ECT má pak složku intravazální a extravazální, které jsou od sebe odděleny stěnou kapilár.
- Hlavním ECT iontem je sodík a proto je to on, kdo určuje objem ECT, protože voda bez soli se v organismu „neudrží“. Poměr mezi soluty tj. hlavně sodíkem a množstvím vody, pak určuje celkovou osmolaritu ECT.
- Hlavním ICT iontem je sice draslík, ale změny objemu ICT jsou prakticky vždy sekundární následkem změny osmolarity v ECT, tzn. že plazmatická koncentrace sodíku určuje i objem buněk, protože sodík je osmoticky efektivní iont, který jen minimálně prostupuje, a tak nemůže dojít k vyrovnání jeho koncentrací, pokud se v ECT změní jeho hladina.
- Voda se vždy přesunuje do prostoru s vyšší tonicitou (osmolaritou), tzn. pokud je EC prostor hypoosmolární, voda přestupuje do buněk, naopak, pokud je EC prostor hyperosmolární, voda vystupuje ven z buněk.
- Udržení objemové a osmotické rovnováhy celkové tělesné vody je nezbytným předpokladem fungování lidského organismu.
- Stabilita tělních tekutin je zajištěna jen tehdy, je-li příjem a výdej vody z organismu v rovnováze, stejně tak jako musí být v rovnováze příjem a výdej soli. Narušení této bilance vede ke změnám objemu tělesných tekutin, tzn. hypovolémii, nebo hypervolémii. Dále musí být vyvážený i vzájemný poměr mezi vodou a solí, a pokud tomu tak není, pak vznikají poruchy osmotické, tzn. hypoosmolární a hyperosmolární stavy.
- K zajištění homeostázy tělních tekutin se vyvinula celá řada regulačních okruhů. Jako vstupní veličina těchto regulačních smyček figuruje efektivní osmolarita a efektivní objem, které jsou monitorovány přes osmoreceptory, volumoreceptory a chemoreceptory citlivé na sůl umístěné především v CNS, v oběhu a v ledvinách.
- Regulace efektivní osmolarity se děje změnou příjmu vody a změnou vylučování čisté vody v ledvinách. Nástroji této regulace jsou ADH a žízeň.
- Regulace efektivního objemu se akutně děje hlavně změnou kapacity, dlouhodobě pak přizpůsobením náplně řečiště. Nástroji této regulace jsou tlaková diuréza, katecholaminy, sympatické autonomní nervstvo, RAS, aldosteron, ANF a další.
- Klíčovým orgánem, jenž jediný z dlouhodobého hlediska je schopen zajistit vyrovnanou bilanci tělních tekutin jsou ledviny, které zcela přesně přizpůsobují vylučování vody a soli potřebám organismu.
Použitá literatura a literatura pro další studium:
- GUYTON A.C. & HALL J.E. Textbook of medical physiology, 11th edition, Elsevier Saunders 2006, pp. 291 – 415
- BERNE R.B., LEVY M.N., KOEPPEN B.M., STANTON B.A. Physiology, 5th edition, Mosby 2004, pp. 3 – 30
- McCANCE K.L., HUETHER S.E., BRASHERS V.L., ROTE N.S., Pathophysiology: the biological basis for disease in adults and children, 6th edition, Mosby Elsevier 2010, pp. 96 – 125
- HULÍN I. et al., Patofyziológia, Bratislava SAP 2009, str. 237 – 292
- NEČAS E. a spol. Obecná patologická fyziologie. Nakladatelsví Karolinum Praha 2002, str. 216 – 231
- VERBALIS J.G., Disorders of body water homeostasis, Best Practice & Research Clinical Endocrinology & Metabolism, 2003, Vol. 17, No.4, pp. 471 – 2003
- VESELÝ J. Tlaková diuréza a arteriální hypertenze. Epava Olomouc 2002