autor: MUDr. Ondřej Veselý
pracoviště: Ústav patologické fyziologie LF UP Olomouc, Dětská endokrinologická ambulance Svitavské nemocnice a.s.
Úvod
Hořčík neboli magnézium (12Mg, Ar = 24,3) je z pohledu anorganické chemie tvrdý, lehký kov poměrně vysoké reaktivity, hojně se vyskytující ve své iontové formě jako součást různých sloučenin jak v zemské kůře (8. nejčastější prvek), tak zejména v mořské vodě (3. nejčastější prvek). Svůj název si vysloužil v minulosti, kdy byl jako hořká sůl neboli síran hořečnatý (MgSO4) využíván v léčitelství (projímadlo, sůl do koupele). Ve své elementární podobě byl poprvé izolován v r. 1808. V současné době se využívá např. v hutnictví v podobě oxidu hořečnatého, který je vysoce odolný vůči vysokým teplotám (vnitřní vyložení vysokých pecí) anebo v metalurgii k výrobě pevných slitin, jako je např. dural (95 % hliník, 5 % Mg + Mn + Cu), nebo elementární hořčík v hořlavých směsích určených k výrobě rachejtlí a ohňostrojů (v historii fotografie jako předchůdce „blesku“).
Z pohledu živých organismů představuje hořčík ve své iontové formě Mg2+ významný biogenní prvek, který zastává řadu fyziologických funkcí. Protože ale je jeho koncentrace v krevní plazmě, nejdostupnějším to vzorku tělních tekutin k vyšetření, velmi nízká, zůstává hořčík trochu opomenut ve stínu svých „silnějších“ iontových příbuzných a na poruchy jeho bilance není v klinické praxi často pomýšleno. Symptomatologie nedostatku nebo nadbytku Mg2+ v organismu je značně pestrá a jde napříč mnoha klinickými obory.
Cílem tohoto příspěvku je uvést hořčík do světla pomyslných reflektorů, tak aby student medicíny pochopil jeho fyziologický význam i patofyziologii jeho poruch a především si odnesl klinické výstupy z problematiky bilance iontů hořčíku v lidském organismu do své budoucí praxe. Jedině lékař, který na možnost hypomagnezémie nebo hypermagnezémie pomýšlí, je může odhalit a následně terapeutickou intervencí zvrátit k normě ve prospěch svých pacientů.
Zastoupení iontů hořčíku v organismu
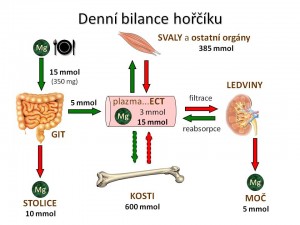
Ionty hořčíku jsou kvantitativně druhými nejvýznamnějšími intracelulárními kationty po iontech draslíku. Dalším iontem, se kterým má hořčík v organismu mnoho společného, je vápník. V těle dospělého člověka je obsaženo asi 25 g iontů hořčíku, což odpovídá asi 1000 mmol Mg2+. Po chemické stránce se hořečnaté ionty v organismu vyskytují ve třech podobách:
- v anorganické formě v krystalech kostní hmoty,
- v organické formě ve vazbě na proteiny,
- elektrolyt Mg2+ v tělních tekutinách.
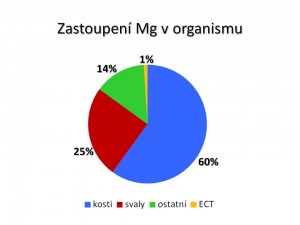
Rozložení celkového množství hořečnatých iontů v organismu je následující:
- 50 – 60 % je uloženo v kostech v pevné vazbě, nicméně část kostního magnézia je pomalu (týdny), ale přece jen mobilizovatelná.
- 20 – 30 % se nachází ve svalech. Svalové buňky tak představují další zásobník iontů hořčíku využitelný při jeho nedostatku v plazmě, mobilizovatelnost iontů magnézia ze svalů je pružnější než jejich dostupnost z kostí (řádově dny).
- 10 – 19 % se nachází ve zbývajících orgánech, z nichž především játra, ale i slezina představují orgány s rychlou schopností uvolnit nebo naopak vázat hořečnaté ionty ve svých buňkách (řádově hodiny), a tak napomáhat k udržení normomagnezémie.
- Pouhé 1 % Mg2+ se nachází v extracelulární tekutině, přičemž v plazmě je uloženo asi 0,3 % a v erytrocytech 0,5 %. Jsou to ovšem právě hořečnaté ionty v krvi, které jsou díky své mobilitě snadno a rychle dostupné pro potřebu buněk jednotlivých orgánů.
Normální hladina iontů hořčíku v plazmě je 0,7 – 1,1 mmol/l, přičemž rozlišujeme tři frakce:
- 65 % z celkové koncentrace představuje ionizovaný neboli volný Mg2+.
- 30 % je vázáno na plazmatické bílkoviny, především albumin Podobně jako u iontů vápníku je velikost této frakce závislá na množství plazmatických bílkovin a na pH.
- 5 % tvoří ionty hořčíku vázané v komplexech.
Hladina hořčíku v buňkách je asi o řád vyšší než v extracelulární tekutině. Značně kolísá podle typu buněk (např. svalové buňky obsahují asi 9 mmol Mg2+/kg, játra 7,5 mmol Mg2+/kg, mozek 5,5 mmol Mg2+/kg, erytrocyty 2 mmol Mg2+/l, tuková tkáň 0,8 mmol Mg2+/kg). V cytoplazmě je 90 % intracelulárního Mg2+ organicky vázáno (na ATP, nukleové kyseliny, fosfolipidy, buněčné proteiny), ionizovaná frakce představuje asi 10 % z celkového množství intracelulárních iontů hořčíku.
Klíčovými orgány pro Mg2+ homeostázu jsou STŘEVO, LEDVINY a KOST. Bilance iontů hořčíku v lidském organismu je pak dána na straně jedné jeho příjmem a na straně druhé jeho výdejem. Za normálního stavu jsou příjem a výdej hořčíku v rovnováze.
Příjem iontů hořčíku
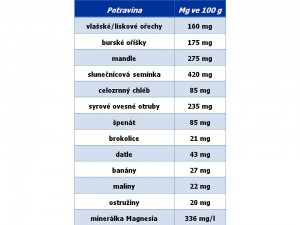
Doporučený denní příjem iontů hořčíku (DDDMg) pro dospělého muže je asi 400 mg a pro dospělou ženu asi 300 mg. V průměru tedy pro dospělého jedince asi 350mg/den, což odpovídá 15 mmol Mg2+. Ionty hořčíku se do těla samozřejmě dostávají přijatou stravou a tekutinami. Mezi potraviny bohaté na hořečnaté ionty patří různé oříšky, semínka, cereálie, otruby, špenát, brokolice, datle, banány, maliny anebo ostružiny, z nápojů některé minerální vody. Přibližný obsah iontů hořčíku ve jmenovaných potravinách uvádí tabulka. Z geografického pohledu je klíčový obsah hořčíku v půdě a spodních vodách, protože ten pak určuje obsah iontů hořčíku v pitné vodě přiváděné v dané oblasti do domácností („měkká“ versus „tvrdá“ voda) a může tak být oním pověstným jazýčkem na vahách dostatečnosti, či nedostatečnosti v příjmu iontů hořčíku.
Vstřebávání iontů hořčíku z GIT
Hlavním místem resorpce hořečnatých iontů z GIT je tenké střevo, nicméně ke vstřebání dochází i ve střevě tlustém. Z přijatého Mg2+ se vstřebá asi 30 – 40 % (1/3). , Při doporučeném denním příjmu 15 mmol Mg2+ se tedy z GIT absorbuje asi 5 mmol/den. Procento vstřebaných Mg2+ kolísá v závislosti na celkových zásobách Mg2+ v organismu. Při deficitu může stoupnout až na 75 %, při přebytku klesnout na 25 %. Část iontů hořčíku je v rámci enterohepatálního cyklu vyloučena zpět do GIT v trávicích šťávách a následně se může opětovně resorbovat.
Ionty hořčíku se ve střevě vstřebávají dvěma mechanismy:
- Pasívně paracelulárně, kdy hybnou sílu představuje koncentrační gradient mezi luminem střeva (vyšší koncentrace Mg2+) a intestinální kapilárou (nižší koncentrace) podpořený tahem rozpustidla (díky aktivní resorpci sodíku a následnému pohybu vody střevním epitelem). Tento mechanismus je pro resorpci Mg2+ ve střevě rozhodující a jeho podíl na celkové resorpci stoupá se zvyšujícím se přísunem Mg2+ do střeva (75 % při příjmu 100 mg/den, 90 % při příjmu 300 mg/den).
- Aktivně transcelulárně, a to prakticky výhradně v tlustém střevě. Mechanismus je umožněn díky existenci specifického iontového kanálu pro ionty hořčíku lokalizovaného na luminální straně epitelu. Jedná se o tzv. TRPM6 (transient receptor potential melastin 6). Najdeme ho jak na povrchu střevního epitelu, tak v tubulárních buňkách ledvin a jeho stavbu, funkci a regulaci jeho činnosti podrobně probereme v odstavcích o exkreci Mg2+ v ledvinách.
Míra vstřebání iontů hořčíku z GIT závisí kromě absolutního množství přijatých Mg2+ také na složení stravy a na přítomnosti nebo nepřítomnosti účinku některých hormonů.
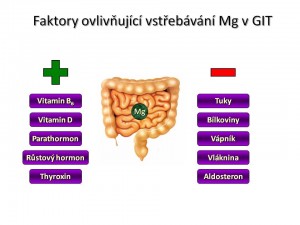
Mezi faktory zvyšující resorpci Mg2+ ve střevě patří:
- Vitamín D, popř. jeho aktivní metabolit kalcitriol, který resorpci zvyšuje přímo;
- Parathormon (PTH), který resorpci zvyšuje nepřímo tím, že zvyšuje přeměnu vitamínu D na kalcitriol;
- Růstový hormon;
- Tyroxin;
- Vitamín B6.
Mezi faktory snižující resorpci Mg2+ ve střevě patří:
- Strava bohatá zejména na lipidy a bílkoviny – důvodem je tvorba špatně vstřebatelných komplexů;
- Strava s vysokým obsahem iontů vápníku anebo zinku, protože tyto bivalentní kationty soutěží s ionty hořčíku o transportní systémy;
- Strava bohatá na vlákninu;
- Mineralokortikoid aldosteron.
Kosti jako rezervoár iontů hořčíku
Z odstavce o zastoupení iontů hořčíku v organismu plyne, že největší část tělových zásob hořečnatých iontů (50 – 60 %) je uložena v kostech v krystalické struktuře hydroxyapatitu. Tyto zásoby iontů hořčíku mohou sloužit k pufrování plazmatické hladiny magnézia při její déle trvající změně. Při deficitu Mg2+ dochází k uvolnění Mg2+ z kostí snížením počtu a funkce osteoblastů a zvýšením počtu a činnosti osteoklastů. Nedostatek Mg2+ tak je rizikovým faktorem rozvoje osteoporózy. Naopak při přebytku iontů hořčíku je stimulována novotvorba kosti se zabudováním nadbytečných Mg2+. Podíl mobilizovatelných iontů hořčíku z kostí závisí na věku - u dětí činí až jednu polovinu, u mladých dospělých jednu třetinu, kdežto u starých lidí pouze jednu desetinu.
Vylučování iontů hořčíku močí
Hlavní cestu exkrece iontů hořčíku z organismu a zároveň hlavní regulační orgán Mg2+ homeostázy představují ledviny. V glomerulech je filtrováno 70 % celkového plazmatického množství iontů hořčíku (nefiltruje se oněch 30 % iontů hořčíku vázaných na plazmatické bílkoviny). V tubulech dochází k mohutné zpětné resorpci 95 – 97 % profiltrovaných Mg2+, a proto normální exkreční frakce hořčíku (FEMg) činí pouze 3 – 5 %. Nicméně šíře schopnosti ledvin vylučovat nebo resorbovat hořčík je velmi široká. FEMg tak může dle potřeb organismu kolísat v rozmezí 0,5 % – 50 %.
Poznámka. Exkreční frakce hořčíku je poměr mezi množstvím iontů hořčíku obsažených v definitivní moči ku množství iontů hořčíku v primární moči ( = glomerulárním ultrafiltrát ). Lze ji vypočítat dle vzorce: FEMg =[(U – Mg x S-Kr)/0,7 x (S-Mg x U-Kr)] x 100, kde U-Mg je koncentrace iontů hořčíku v moči, S-Mg koncentrace iontů hořčíku v plazmě, S-Kr koncentrace kreatininu v plazmě a U-Kr koncentrace kreatininu v moči. 0,7 je vyjádřením faktu, že pouze 70 % Mg2+ je z plazmy filtrováno. (Pozor! U-Kr laboratoře obvykle udávají v mmol/l, kdežto S-Kr v μmol/l a proto je pak třeba ještě ve vzorci čitatel vynásobit 1000.) (Viz též téma Laboratorní vyšetření ledvinových funkcí.)
Podíl jednotlivých partií nefronu na zpětném vstřebání iontů hořčíku je následující:
- Proximální tubulus 15 – 25 %;
- Vzestupné raménko Henleovy kličky 60 – 70 %;
- Distální tubulus 5 – 15 %.
Z výše uvedeného je patrné, že kvantitativně nejvýznamnějším místem zpětné resorpce iontů hořčíku v ledvinách překvapivě není proximální tubulus (jako je tomu u ostatních iontů), ale Henleova klička, přesněji řečeno její vzestupná tlustá část. Kvalitativně nejvýznamnější místo, tedy to, které rozhoduje o finálním množství iontů hořčíku v definitivní moči, je distální tubulus. Hořečnaté ionty se stejně jako ve střevě resorbují i v ledvinách dvěma mechanismy:
- Pasívně paracelulárně. Tak je tomu v proximálním tubulu, kde hnací silou je tah aktivně resorbované soli a vody, a ve vzestupném raménku Henleovy kličky, kde motorem je aktivní resorpce iontů sodíku přes natrium-kalium-chloridový kotransportér (NKCC) na apikální membráně následovaná pak pohybem iontů přes Na+/K+-ATPázu na bazolaterální membráně tubulární buňky. Ionty hořčíku se pohybují po svém chemickém gradientu štěrbinami mezi epiteliálními buňkami pryč z tubulární tekutiny. To je podpořeno i gradientem elektrickým, protože intraluminálně je oproti bazolaterálnímu prostoru pozitivní náboj (asi + 15 mV), na jehož tvorbě se podílí Na+/K+-pumpa a recirkulace K+ iontů přes kaliový kanál ROMK (renal outer medulla K+ channel) na luminální membráně. Jak bylo uvedeno výše, většina filtrovaných iontů hořčíku se resorbuje v Henleově kličce. Proč? Protože paracelulární přesun Mg2+ je zde usnadněn proteinem claudin-16/paracellin-1, který je lokalizován v těsných spojeních (tight junction) tububulárních buněk. Reguluje mezibuněčný pohyb Mg2+ stejně jako Ca2+ (téma Poruchy hladiny plazmatického vápníku – hypokalcémie a hyperkalcémie).
- Aktivně transcelulárně. Tak je tomu v distálním tubulu, který je posledním místem resorpce Mg2+ v nefronu. Podobně jako v tračníku je i zde na luminální membráně přítomen specifický iontový kanál pro hořčík, tzv. TRPM 6 (transient receptor potential melastin 6), umožňující vtok iontů hořčíku do tubulární buňky. Rozdíl v koncentraci Mg2+ mezi luminem tubulu a buňkou je nevelký, a hořčík se proto skrze TRPM6 přesouvá především díky gradientu elektrickému (- 70 mV uvnitř buňky). Mechanismus, jakým Mg2+ následně tubulární buňku na bazolaterální membráně opouští, je nejasný (mohlo by např. jít o sekundárně aktivní protitransport výměnou za Na+)
Transient receptor potential melastin 6
TRPM6 představuje klíčový bod regulace celé Mg2+ homeostázy, protože kontroluje jak exkreci iontů hořčíku v ledvinách, tak absorpci iontů hořčíku v tlustém střevě v závislosti na potřebách organismu. TRPM6 je membránový protein vytvářející svou strukturou kanál pro ionty. Je kationt selektivní, přičemž přednostně vede Mg2+, méně Ca2+. Jeho aktivita a exprese podléhá četným pozitivním a negativním regulačním vlivům. Aktivita kanálu je řízena přes doménu s α-kinázovou aktivitou, která je umístěna intracelulárně, mechanismus inhibice spočívá v autofosforylaci této domény. Zvýšení aktivity TRPM6 vede ke snížení exkrece Mg2+ do moči, naopak snížení aktivity TRPM6 vede ke zvýšení exkrece Mg 2+ do moči. Základním podnětem pro změnu aktivity TRPM6 je logicky hladina Mg2+ extra- a intracelulárně. Existuje celá řada dalších lokálních anebo systémových podnětů ovlivňujících reabsorpci Mg2+ v distálním tubulu, nicméně ne u všech byla prokázána spojitost s TRPM6.
Poznámka: Mezi potvrzené faktory stimulující aktivitu anebo expresi TRPM6 patří pokles hladiny Mg2+ v ECT anebo v ICT, alkalózy, estradiol, epitelový růstový faktor (EGF). Mezi prokázané faktory inhibující aktivitu anebo expresi TRPM6 patří vzestup hladiny Mg2+ v ECT anebo v ICT, acidóza, thiazidová diuretika, cyklosporin, receptor pro aktivovanou C-kinasu 1 (RACK1) aj.
Regulace exkrece Mg2+ v ledvinách
Vezmeme-li v potaz regulační podněty měnící exkreci Mg2+ do moči, ať už cestou TRPM6 nebo cestou jinou, můžeme je rozdělit na dvě skupiny:
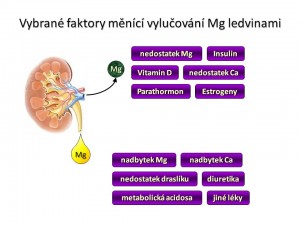
Faktory zvyšující reabsorpci Mg2+ v ledvinách
- ↓ Mg2+ v ECT, ↓ Mg2+ v ICT, ↓ Ca2+ v ECT.
- PTH, kalcitonin, vitamín D.
- Inzulín, glukagon.
- β-Adrenergní agonisté.
- Estrogeny.
- Prostaglandiny (PGE2)
- Metabolická alkalóza.
- Kalium šetřící diuretika.
Faktory zvyšující exkreci Mg2+ ledvinami
- ↑ Mg2+ v ECT, ↑ Mg2+ v ICT, ↑ Ca2+ v ECT
- Deplece iontů draslíku a fosfátů.
- Metabolická acidóza.
- Aldosteron (zřejmě nepřímo přes volumovou expanzi).
- Thiazidová diuretika (chronicky, nikoliv akutně).
- Aminoglykosidová ATB, cyklosporin.
Vylučování Mg2+ jinými cestami
Stolicí za fyziologické situace odchází asi 60 – 70 % iontů hořčíku přijatých s potravou, a jeho množství je tedy primárně určeno velikostí střevní resorpce.
Fyziologický význam iontů hořčíku v organismu
Hořečnaté ionty jsou pro správné fungování organismu zcela nepostradatelné, jeho fyziologické uplatnění si můžeme rozdělit na tři směry:
- Kofaktor enzymů;
- Antagonista iontů vápníku;
- Faktor mineralizace kostí.
Ionty hořčíku jako kofaktor enzymů
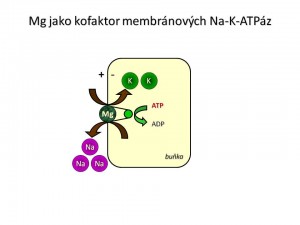
Mg2+ se jako kofaktor více než 300 enzymů účastní metabolismu základních živin, nukleových kyselin a zajištění energetické rovnováhy. Každá molekula ATP, která se má vázat do aktivního místa enzymů, tak činí v komplexu s Mg2+. Tím je dáno biochemické postavení těchto iontů. V metabolismu sacharidů je nalezneme v řadě reakcí glykolýzy. Tím se podílejí na využití glukózy a tvorbě energie ve všech buňkách. Rovněž podporují syntézu glykogenu v játrech, a tím i ukládání energie. S tvorbou energie souvisí i úloha iontů hořčíku v citrátovém cyklu, kde Mg2+ je společně s vitamínem B1 součástí enzymového komplexu potřebného pro přeměnu 2-oxo-glutarátu na sukcinyl~CoA. V metabolismu tuků se Mg2+ účastní jak syntézy, tak utilizace mastných kyselin. Co se týče nukleových kyselin, ionty hořčíku se v buněčném jádře jako kofaktor DNA polymerázy podílejí na replikaci DNA, reparaci DNA, jako kofaktory RNA polymerázy na transkripci genů, a tím v proteosyntéze a metabolismu proteinů. Ionty hořčíku jsou jako součást ATPáz a fosfatáz klíčem k utilizaci energie. Jako kofaktor enzymů vedoucích k produkci ATP a jako kofaktor membránové Na+/K+-ATPázy je Mg2+ zcela nezbytný k udržení dynamické elektrolytové rovnováhy, což je důležité nejen pro organismus jako celek, ale především pro buňky excitabilních tkání, tedy svaly a nervy schopné měnit svůj membránový potenciál. Hořečnaté ionty tak společně s dalšími ionty udržují normální neuromuskulární vzrušivost a vodivost. V mozku jako kofaktor glutamátdekarboxylázy se společně s vitamínem B6 účastní přeměny excitačně působící aminokyseliny glutamátu na inhibičně působící kyselinu γ-amino-máselnou (GABA), což je, jak uvidíme později, jen jedna z cest, kterými ionty hořčíku ovlivňují neurotransmisi.
Ionty hořčíku jako protihráč iontů vápníku
Ionty hořčíku antagonizují účinky Ca2+ iontů v buňkách, jednak přímo pro svou podobnost s Ca2+, jednak nepřímo jako blokátory kalciových kanálů, kdy brání vstupu iontů vápníku do buněk, nebo jako kofaktory kalciových pump, které odstraňují Ca2+ pryč z cytoplazmy (do ECT, do sarkoplazmatického retikula). Hořečnaté ionty tak mohou tlumit signalizační kaskády využívající Ca2+ jako 2. posla. Rovněž mohou snižovat uvolňování acetylcholinu na nervosvalové ploténce, které je závislé na vstupu Ca2+ do nervového zakončení. Ve svalstvu, ať už kosterním, či hladkém, vede blokáda Ca2+ hořečnatými ionty ke snížení kontraktility. V mozku hořečnaté ionty brání blokádou NMDA receptorových kanálů excitačnímu působení glutamátu, který depolarizuje neurony právě vstupem Ca2+.
Ionty hořčíku jako faktor mineralizace skeletu
Jako „stavební materiál“ se Mg2+ společně s ionty vápníku a fosforečnany podílí na mineralizaci kostí. Magnezémie stejně jako kalcémie zpětnovazebně ovlivňuje sekreci parathormonu, i když síla tohoto signálu (tzn. schopnost Mg2+ vázat se a stimulovat CaSR (calcium sensing receptor) buněk příštítných tělísek, a tím měnit sekreci PTH) je 2x – 3x nižší než síla iontů vápníku. Hypomagnezémie zvyšuje, kdežto hypermagnezémie snižuje sekreci PTH.
Ionty hořčíku v dalších úlohách v organismu
Mimo tyto tři základní směry uplatnění mají ionty hořčíku v organismu i řadu dalších funkcí, jako například:
- proliferace a diferenciace buněk, přežívání buněk, apoptóza;
- podíl při tvorbě cytoskeletu, stabilitě membrán;
- přispívají k funkci mediátorů v imunitních reakcích;
- inhibují tvorbu močových konkrementů;
- podporují fibrinolýzu.
Klasifikace poruchy homeostázy Mg2+
Rozlišujeme čtyři možné poruchy týkající se iontů hořčíku:
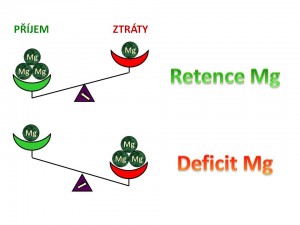
Deficit Mg2+ je porucha bilance iontů hořčíku v organismu, kdy výdej Mg2+ převyšuje jejich příjem.
Retence Mg2+ je porucha bilance hořčíku v organismu, kdy příjem Mg2+ převyšuje jejich výdej.
Hypomagnezémie je snížení koncentrace iontů hořčíku v plazmě pod dolní hranici normy, tedy pod 0,7 mmol/l.
Hypermagnezémie je zvýšení koncentrace iontů hořčíku v plazmě nad horní hranici normy, tedy nad 1,1 mmol/l.
K tomu je ovšem třeba dodat, že výše magnezémie je hodnota relativní, odrážející pouze poměr množství iontů hořčíku v plazmě ku objemu plazmy, a že množství iontů hořčíku v plazmě je pouhým zlomkem celotělových zásob těchto iontů (0,3 %). Proto koncentrace iontů hořčíku v plazmě není přesným odrazem stavu zásob Mg2+ v organismu a normální hladina nevylučuje poruchu homeostázy Mg2+!
Etiologie deficitu iontů hořčíku
Vyjdeme-li z definice, pak může být deficit iontů hořčíku způsoben buď poruchou na straně příjmu tj. nízký přísun Mg2+ anebo poruchou na straně výdeje tj. zvýšené ztráty Mg2+. Tyto dvě základní příčiny pak mají několik dalších variant.
Nízký přísun iontů hořčíku do organismu
Dietní nedostatek Mg2+ ve své mírné formě je častý, protože zejména naše „západní“ strava je na tyto ionty chudá. Ve větší míře dochází k nedostatku Mg2+ při déletrvajícím hladovění, které může mít řadu důvodů – například anorexii, malnutrici alkoholiků atd.
Snížené vstřebávání Mg2+ ze střeva může být způsobeno celou řadou chorobných stavů, jejichž společným jmenovatelem je malabsorpční syndrom. Počítáme sem například céliakii, chronické nespecifické střevní záněty, cystickou fibrózu, st. p. střevních resekcích, cholestázu, insuficienci pankreatu atd. Z patofyziologického pohledu jde především o absolutní anebo - častěji – relativní redukci střevní plochy schopné resorpce Mg2+. Porucha vstřebávání Mg2+ může být potencována hypovitaminózou D, která často provází malabsorpci tuků, a malabsorpce tuků zase může způsobit tvorbu nevstřebatelných komplexů mezi Mg2+ a mastnými kyselinami ve střevě.
Zvýšená spotřeba Mg2+ (relativně snížený příjem). Typickou fyziologickou příčinou je těhotenství a laktace, dále rychlý růst v dětství, zejména v období dospívání. Mezi patologické příčiny zvýšené potřeby Mg2+ (relativně sníženého příjmu) pak patří hypertyreóza s vystupňováním metabolického obratu, a tím i potřeby Mg.
Zvýšené ztráty iontů hořčíku z organismu
Zvýšené renální ztráty Mg2+. Porucha zpětné resorpce iontů hořčíku v nefronu, přesněji řečeno v tubulech, vede k nadměrným ztrátám hořečnatých iontů močí a k deficitu iontů hořčíku v organismu.
- Příčinou mohou být kongenitální tubulopatie jako např. Bartterův syndrom (genetická porucha resorpce soli v tlusté vzestupné části Henleovy kličky), Gitelmanův syndrom (genetická porucha resorpce soli v první části distálního tubulu), FHHNC (familiární hypomagnezémie s hyperkalciurií a nefrokalcinózou, kdy jde o mutaci proteinu claudin-16/paracellin-1 lokalizovaného v těsných spojeních mezi epiteliálními buňkami tlustého raménka Henleovy kličky) a další, tedy vrozené syndromy s určitým typem dědičnosti, jejichž podrobnější popis a patogeneze přesahují rámec tohoto sdělení.
- Druhou skupinu představují získané stavy narušující tubulární reabsorpci Mg2+ s následnou hypermagnezurii a z ní plynoucí hypomagnezémii jako např. osmotická diuréza při cukrovce anebo stavy po (st. p.) akutní tubulární nekróze, st. p. obstrukci vývodných močových cest a st. p. transplantaci ledvin spojené s polyurií a ztrátami dalších iontů.
- Ztráta iontů hořčíku ledvinami také nastává při terapii některými léky, přičemž u některých medikamentů jde o očekávanou součást jejich hlavního účinku, jako např. u kličkových nebo thiazidových diuretik, jindy se jedná o poškození ledvin v rámci nežádoucích vedlejších účinků daného léku. Tak je tomu u aminoglykosidů, jež přestavují skupinu antibiotik s nefrotoxickým potenciálem, který je odpovědný za reverzibilní hypermagnezurii a hyperkalciurii, jejichž výskyt by mohl souviset s aktivací CaSR (calcium sensing) receptoru umístěného na bazolaterální membráně tubulárních buněk. Aminoglykosidy se chovají jako polyvalentní kationty a stimulace CaSR, na nějž se mohou vázat, vede ke snížení resorpce iontů hořčíku i vápníku z tubulární tekutiny. Dalším případem je imunosupresívum cyklosporin, který snižuje expresi TRPM6 na buňkách distálního tubulu; jeho hypomagnezemický efekt je nicméně oslaben jeho glomerulotoxickým účinkem vedoucím ke snížení glomerulární filtrace, a tím i exkrece Mg2+ do primární moči). Dalšími kandidáty jsou např. amfotericin B (antimykotikum), cisplatina (cytostatikum) aj.
- Mezi další příčiny vedoucí ke zvýšeným renálním ztrátám iontů hořčíku patří poruchy homeostázy jiných iontů či acidobazické rovnováhy. Příkladem je deplece draslíku. Při ní dochází ke snížení resorpce Mg2+ jak v tlustém raménku Henleovy kličky, kde je při nedostatku K+ snížena resorpce NaCl a na ní závislá pasivní resorpce bivalentních kationtů Mg2+ a Ca2+, tak v distálním tubulu, kde ale mechanismus, kterým na úrovni buňky dochází ke snížení aktivní resorpce iontů hořčíku, není jasný. Další faktory vedoucí ke zvýšeným renálním ztrátám iontů hořčíku zahrnují hyperkalciurii (kompetice Mg2+ s Ca2+ o transportní mechanismy, jimiž se ionty vstřebávají zpět do těla), deplece fosfátů, metabolická acidóza (pokles aktivity a exprese TRPM6 změnou koncentrace protonů), hyperaldosteronismus aj.
Zvýšené non-renální ztráty Mg2+. Ke ztrátám hořečnatých iontů může docházet déletrvajícími ztrátami střevní tekutiny při chronických průjmech, kdy je obsah iontů hořčíku v průjmové tekutině vyšší než v normální střevní tekutině, protože se kombinuje porucha resorpce s vystupňovanou sekrecí Mg2+. Dále mohou nastat ztráty iontů hořčíku při zvracení, střevních píštělích, drénech stomiích a sondážích GIT. Ze ztrát Mg2+ mimo GIT ztrát jmenujme například ztráty potem při horečkách, nadměrné fyzické aktivitě anebo v horkém prostředí, případně z kožních defektů při popáleninách.
Etiologie hypomagnezémie
Snížená koncentrace iontů hořčíku v plazmě má tři obecné příčiny:
- Nízký přísun Mg2+ do organismu;
- Zvýšené ztráty Mg2+ z organismu;
- Porucha distribuce Mg2+ v organismu.
První dvě jsou shodné s příčinami deficitu Mg2+ a byly podrobněji probrány výše, třetí příčinu si probereme zde.
Porucha distribuce iontů hořčíku
Porucha distribuce iontů hořčíku v organismu nastává tehdy, když se ionty přesunují pryč z intravaskulárního prostoru, ale jejich celkové množství v těle zůstává zachováno.
Přesun Mg2+ do buněk. Při léčbě inzulínem vstupují ionty hořčíku společně s glukózou, draslíkem, fosforečnany atd. K obdobné situaci může dojít při realimentaci po těžkém hladovění anebo po výrazné fyzické zátěži. Při léčbě metabolické acidózy bikarbonáty se extracelulárně umístěné kationty Mg2+ (stejně jako kationty K+) směňují za intracelulárně nahromaděné H+. Při zvýšené hladině katecholaminů dochází k vychytávání Mg2+ adipocyty. Ionty hořčíku jsou z plazmy rovněž vytěsňovány při hyperfosfatémii. Při maligních onemocněních dochází k vychytávání Mg2+ nádorovými buňkami.
Přesun Mg2+ do kostí nastává při tzv. syndromu hladové kosti u pacientů po operativním odstranění příštítných tělísek pro primární hyperparatyreózu, kdy dochází k prudké remineralizaci kostí po odstranění příčiny excesivně zvýšené hladiny osteoresorpčně působícího parathormonu (téma Parathormon a poruchy jeho sekrece a účinku). Podobná situace nastává po vysazení kortikoidní léčby, jejímž vedlejším efektem je osteoporóza.
Přesun Mg2+ do nerozpustných komplexů vídáme při těžší akutní pankreatitidě, kdy se vazbou Mg2+ na uvolněné mastné kyseliny v tukové nekróze obklopující slinivku tvoří hořečnatá mýdla. Při masívní transfúzi krve obsahující citrát (zabraňuje vniku sraženin v krevní konzervě) dochází ke vzniku chelátu citronanu hořečnatého, a snížení hladiny ionizovaného Mg2+ v plazmě.
Příznaky deficitu iontů hořčíku a hypomagnezémie
Potíže a symptomy plynoucí z nedostatku iontů hořčíku v organismu si rozdělíme do několika okruhů:
Kardiální příznaky
Představují největší nebezpečí poruch bilance hořečnatých iontů, a to pro riziko náhlé kardiální smrti následkem srdeční arytmie. Ionty Mg2+ mají vliv jak na klidový membránový potenciál (KMP), tak na průběh akčního potenciálu (AP) všech vzrušivých tkání včetně srdečního svalu. Deficit iontů hořčíku vede k alteraci celé řady elektrických dějů na srdci, a to především cestou destabilizace dalších extra- a intracelulárních koncentrací iontů, které jsou klíčové pro normální KMP a průběh AP. Část změn na EKG je zejména vysvětlitelná změnami hladin iontů draslíku a vápníku.
Deficit iontů draslíku provázející hypomagnezémii prodlužuje 3. fázi akčního potenciálu, tedy fázi repolarizace. Na EKG pak vidíme oploštěnou, širší vlnu T a na ni navazující vlnu U. Protrahovaná repolarizace vede k oscilacím membránového potenciálu s rizikem vzniku časných následných depolarizací, které se mohou projevit jako komorové extrasystoly (KES), komorové tachykardie (u disponovaných jedinců se syndromem dlouhého QT může dojít ke komorové arytmii typu torsade de pointes), které mohou přejít do fatální komorové fibrilace. Nedostatečný repolarizační proud také způsobuje trvalou částečnou klidovou depolarizaci, která zprvu sice zvyšuje excitabilitu (stačí podprahový podnět k vyvolání dalšího AP), ale pokud dojde ke snížení polarizace nad úroveň, při které se otevírají rychlé natriové kanály, naruší se průběh 1. fáze AP a na EKG najdeme rozšíření a nižší voltáž QRS a event. i vlny P.
Supraventrikulární arytmie z deficitu Mg2+ jsou méně časté než arytmie komorové. Může se jednat o síňové nebo junkční extrasystoly (SVES), tachykardie (SVT) anebo fibrilaci síní.
Hypokalcémie provázející nedostatek iontů hořčíku prodlužuje 2. fázi akčního potenciálu, tedy fázi plateau, což se na EKG projeví prodloužením úseku ST a QT. Jak gradient Na+, tak gradient Ca2+ je udržován primárními aktivními transportními ATPázami, jejichž práce s ATP je přímo závislá na Mg2+ v roli kofaktoru. Ve 4. fázi AP, kdy by mělo dojít k úpravě iontových poměrů, je tudíž pro dysfunkci cytoplazmatického Na+/Ca2+-výměníku a Ca2+-pumpy na sarkoplazmatickém retikulu při hypomagnezémii kardiomyocyt přetížen kalciem pro jeho nedostatečné odčerpávání z buňky a to zvyšuje riziko pozdních následných depolarizací a vzniku tachyarytmií.
Vazospazmy při deficitu hořečnatých iontů mohou vést ke koronární hypoperfúzi a z toho plynoucím EKG projevům - depresím úseku ST anebo změnám vlny T. Ischémie myokardu vede k úniku Mg2+ z buněk a to zpětnovazebně prohlubuje deficit těchto iontů.
Samostatnou kapitolu představuje vztah iontů hořčíku a kardiotonika digoxinu. Jeho mechanismus účinku spočívá v blokádě myokardiální Na+/K+-ATPázy s následným vzestupem hladiny intracelulární koncentrace Ca2+ (výměnou za ionty sodíku neodčerpané z buňky Na+/K+-pumpou), což zvyšuje kontraktilitu (téma Srdeční výdej a jeho regulace). Digoxin ještě kromě toho poněkud paradoxně snižuje chrono- a dromotropii, a to cestou zvýšení tonu parasympatiku. Deficit Mg2+ a digoxin tak principiálně působí synergicky, oba zvyšují přetížení kardiomyocytu kalciem a snižují hladinu intracelulárních K+, což jako vedlejší efekt zvyšuje bathmotropii (vzrušivost) myokardu. Nedostatek iontů hořčíku tedy zvyšuje toxicitu digitalisu a zvyšuje riziko arytmií z toho plynoucích - miskovité deprese ST, paroxysmy SVT, KES (typicky vázané bigeminicky), ale i AV bloky. Vztah je oboustranný – digoxin prohlubuje deficit iontů hořčíku, protože zvyšuje jeho sekreci ledvinami.
Vaskulární příznaky
Hořečnaté ionty modulují cévní napětí a reaktivitu a to z několika důvodů. Jednak regulují transmembránový tok iontů Na+, K+ a Ca2+, dále vystupují jako protihráči iontů vápníku v buňce, ovlivňují tvorbu a činnost kontraktilních proteinů (aktinu a myosinu), účastní se metabolických cest zajišťujících dodávku energie pro svalovou kontrakci a mají vliv na cévní endotel a jeho funkce. V endotelu stimulují tvorbu vazodilatačně působícího oxidu dusnatého (NO) a prostacyklinu (PGEI2), naopak snižují tvorbu vazokonstrikčních působků, jako je endotelin-1 (ET1) a angiotenzin II (Ang II), a ovlivňují vazbu těchto působků na jejich specifické membránové receptory. Hořečnaté ionty v neposlední řadě snižují uvolňování noradrenalinu z nervových zakončení sympatiku. Není proto divu, že nedostatek iontů hořčíku zvyšuje cévní napětí a reaktivitu cév vůči vazokonstrikčním vlivům. Z krátkodobého pohledu to může iniciovat vazospasmy, které se mohou projevit jako migrenózní bolesti hlavy anebo angiózní bolesti na hrudi (variantní angina pectoris).
Z dlouhodobého hlediska hraje deficit iontů magnézia roli v rozvoji arteriální hypertenze. Zde by vysvětlení prostým zvýšením periferní rezistence nedostatkem iontů hořčíku nestačilo. Klíčem k dlouhodobé regulaci krevního tlaku jsou totiž ledviny, které propojují regulaci krevního tlaku s regulací objemu tělesných tekutin. Vysvětlení by mohlo spočívat v modulaci tlakové diurézy. Hořčík stimuluje syntézu a uvolňování oxidu dusnatého (NO) v endotelu a NO je jedním z důležitých kandidátů na mediátora tlakové diurézy prostřednictvím změny tubulární reabsorpce Na+, a tím regulace krevního tlaku. Ve shodě s těmito poznatky můžeme dedukovat následující hypotetický řetězec: Deficit iontů hořčíku sníží produkci NO v ledvinách s následným zvýšením tubulární reabsorpce iontů sodíku a vody a to vede k chronickému zvýšení krevního tlaku, tedy k arteriální hypertenzi. Epidemiologické studie prokázaly, že v oblastech, kde je „tvrdá“ pitná voda s vyšším obsahem Mg2+, má obyvatelstvo nižší riziko rozvoje hypertenze a smrti na kardiovaskulární choroby než v oblastech s „měkkou“ pitnou vodou s nižším obsahem hořečnatých solí. Studie rovněž prokázaly inverzní vztah mezi hladinou iontů hořčíku v plazmě a hladinou systémového arteriálního krevního tlaku. Nicméně ne všichni pacienti trpící hypomagnezémií mají hypertenzi a ne všichni pacienti trpící hypertenzí trpěli nebo trpí hypomagnezémií. Kromě toho výsledky klinických studií zaměřených na terapii hypertenze solemi hořčíku přinášejí rozporuplné výsledky. Proč? Nelze vyloučit, že v rámci etiopatogeneticky široké populace hypertenzních pacientů bude jen část z nich „magnézium senzitivních“ a bude příznivě odpovídat na prevenci anebo podpůrnou léčbu magnéziem. Rovněž je třeba vzít v úvahu i délku trvání hypertenzní nemoci. Těžko očekávat větší efekt magnézia u pacientů s rozvinutou hypertenzí při anatomicky zafixované vysoké periferní cévní rezistenci a po zhoubných účincích samotné hypertenze působících zpět na ledviny.
Neuromuskulární příznaky
Hořečnatý iont je jedním z iontů určujících nervosvalovou dráždivost (NSD). Podle známé rovnice s koncentracemi zúčastněných iontů v extracelulární tekutině, kdy NSD =[Na+]+[K+]/[Ca2+]+ [Mg2+]+[H+], je vztah mezi NSD a Mg2+ nepřímo úměrný, tedy při hypomagnezémii nervosvalová dráždivost stoupá, stejně jako stoupá při hypokalcémii a v alkalóze. Klinické příznaky plynoucí ze zvýšené vzrušivosti, ale i z chybění intracelulárního antagonizujícího účinku iontů hořčíku na vápenaté ionty, mohou zahrnovat zvýšené napětí svalů a křeče kosterního svalstva. Při mírnějších deficitech může pacient pozorovat parestézie (mravenčení) anebo fascikulace (záškuby jednotlivých svalových snopců), později typické karpopedální spasmy končetin, při těžkém deficitu pak je nutno počítat s možnosti závažného laryngospasmu (křečí svalů hlasové štěrbiny) a křečemi dýchacích svalů (bránice, mezižeberních svalů) s hrozbou udušení postiženého jedince. Projevy mohou být i ze strany hladkého svalstva GIT - ve formě odynofagie (potíže a bolest při polykání pro křeč svalstva jícnu) nebo břišní koliky – a hladkého svalstva dýchacích cest – v podobě bronchospasmu s expirační dušností. Vyšetřující lékař může zastihnout pozitivní příznaky latentní tetanie - Chvostkův příznak (záškub ústního koutku při poklepu na lícní nerv v jeho průběhu před ušním boltcem), Trousseaův příznak (ischemizace brachiálního nervu tlakem manžety tonometru napumpovaného nad systolický tlak po dobu 3 min vyvolá spazmus svalů ruky) – tzv. porodnická ruka (flexe zápěstí, extenze a addukce prstů), Lustův příznak (záškub laterálního okraje nohy dorsálně při poklepu na průběh peroneálního nervu za hlavičkou fibuly), celkově hyperreflexii (viz též téma Poruchy hladiny plazmatického vápníku – hypokalcémie a hyperkalcémie).
Neuropsychické příznaky
Jak bylo řečeno výše, hořečnaté ionty modulují neurotransmisi (blokádou NMDA receptorů pro excitační aminokyselinu glutamát, účastí na vzniku inhibičně působící GABA aj.), a tak při deficitu iontů hořčíku chybí jejich tlumivý vliv na CNS. Pacienti mohou vykazovat celou škálu nervových symptomů a duševních změn - nervozitu, pocit vnitřního neklidu a strachu, třes, ataxii (tj. porucha koordinace pohybů), depresi, zmatenost. Stejně tak může hypomagnezémie vyprovokovat epileptický záchvat. Při těžším deficitu může být postižený trochu paradoxně letargický a vzácně upadnout i do kómatu. U alkoholiků může deficit iontů hořčíku zhoršovat projevy Wernickeova–Korsakoffova syndromu, jehož základní příčinou je deficit vitamínu B1.
Iontové dysbalance
Deficit iontů hořčíku bývá často provázen i poruchami dalších iontů, zejména těch, se kterými mají hořečnaté ionty podobné vlastnosti anebo obdobný osud v organismu, tedy s ionty draslíku a vápníku. Hořečnaté ionty díky svému zapojení v reakcích směřujících k produkci, uskladnění a využití energie ve formě ATP jsou kritickým faktorem pro udržení iontových rozdílů mezi intra- a extracelulárním prostředím.
Ionty draslíku, přesněji jejich koncentrační gradient pak jsou rozhodující pro hodnotu klidového membránového potenciálu. Při deficitu iontů magnézia dochází k přímé (pokles aktivity) i nepřímé (porucha využití ATP) dysfunkci membránové Na+/K+-ATPázy, a to vede při relativně vysoké propustnosti klidové membrány pro draselné ionty k jejich úniku z buněk a jejich následným ztrátám močí (přebytek K+ v plazmě po jejich úniku z buněk stimuluje sekreci aldosteronu a tento hormon v distálním tubulu podporuje exkreci K+ výměnou za Na+), což ve finále ústí do deficitu iontů draslíku s hrozící hypokalémií a se všemi důsledky z toho plynoucími (svalová slabost, srdeční arytmie). Nedostatek iontů hořčíku snižuje mobilizaci iontů vápníku z kostí, protože ionty vápníku nahrazují ionty magnéza, které se z kostí uvolňují, aby doplnily hladinu Mg2+ v plazmě a v ostatních orgánech.
Druhou iontovou poruchou provázející deficit iontů hořčíku je hypokalcémie ze změny sekrece parathormonu. Akutní hypomagnezémie sice zvyšuje sekreci PTH, ale chronický deficit Mg2+ sekreci PTH snižuje. Jde o tzv. sekundární funkční hypoparatyreoidismus, kdy sekrece PTH je nepřiměřeně nízká ve vztahu k nízké hladině plazmatického kalcia. Hypokalcémie pak zhoršuje tetanické příznaky hypomagnezémie.
Jak hypokalémie, tak hypokalcémie spojené s hypomagnezémií špatně odpovídají na substituční terapii tabletami nebo infuzními roztoky s obsahem iontů draslíku anebo vápníku. K jejich úpravě naopak dojde po doplnění iontů hořčíku v organismu.
Deficit iontů hořčíku také zvyšuje fosfaturii a postupně tak vede k depleci fosfátů v těle.
Jiné příznaky
Ionty hořčíku vylučované do moči působí protektivně ve vztahu k urolitiáze. Deficit magnézsia je proto spojen se zvýšeným rizikem tvorby močových kamenů. Zajíavý je vztah iontů hořčíku k některým komponentám metabolického syndromu. Mg zvyšuje aktivitu tyrozinkinázy inzulinových receptorů a také aktivitu lipoproteinové lipázy (jde o enzym v endotelu kapilár periferních tkání, který hydrolyzuje triacylglyceroly z chylomiker, VLDL částic, ale také z HDL částic, což v HDL „uvolní místo“ pro další transport cholesterolu ze tkání). Deficit Mgě+ tak vede k dyslipidémii a inzulinorezistenci, které dláždí cestu k DM 2. typu anebo k ateroskleróze se všemi metabolickými a kardiovaskulárními důsledky. Nedostatek iontů hořčíku o něco snižuje délku života červených krvinek (dysfunkce membránové Na+/K+-ATPázy s hromaděním Na+ a H2O v erytrocytech omezuje jejich pružnost při průchodu slezinným sítem), a tím podporuje rozvoj chudokrevnosti. Klinicky to má význam zejména v terénu hemolytických anémií, jejichž závažnost se tímto zhoršuje. Deficit iontů hořčíku v těhotenství může mimo jiné přispět k potratu, předčasnému porodu, IUGR.
Poznámka. IUGR = intrauterinní růstové retardace. Dítě se rodí s hmotností anebo délkou menší než by odpovídalo gestačnímu věku, (přesněji pod -2 směrodatné odchylky od průměru).
Terapeutické využití iontů hořčíku
Viděli jsme, že deficit iontů hořčíku se podílí na patogenezi celé škály chorobných příznaků a nemocí. Nepřekvapí proto, že v praxi se magnézium používá v řadě indikací. Nicméně ne u všech, u kterých se léčba využívá, splňuje naše očekávání. U některých je spíše matkou záměru teorie, ale chybí dostatek důkazů z validně postavených studií.
Léčba hořečnatými solemi může být vedena buď perorální nebo parenterální cestou a její volba závisí na konkrétní diagnóze. U nás (v ČR) můžeme z dostupných preparátů pro perorální cestu použít například tablety mléčnanu hořečnatého (magnesium lacticum). Množství magneziumlaktátu v jedné tabletě je obvykle 500 mg, což odpovídá asi 60 mg elementárního Mg2+ (12 %). Doporučená denní dávka pro dospělého tak odpovídá 6 tabletám. Z parenterálních přípravků jmenujme síran hořečnatý (magnesium sulphuricum), dodávaný jako 10% nebo 20% injekční roztok po 10 ml, jde tedy o 1 000 mg nebo 2 000 mg MgSO4 v jedné ampuli, což odpovídá 100 mg nebo 200 mg elementárního Mg2+ (10 %).
Následující přehled uvádí základní léčebné indikace pro použití Mg2+:
Deficit iontů hořčíku
Na první pohled jasná indikace, ale problém je, jak ji prokázat. V prvé řadě je potřeba na tuto možnost pomýšlet v diferenciálně diagnostické rozvaze! Dalším krokem je stanovení magnezémie, ale to samo o sobě většinou nestačí, protože normální koncentrace plazmatického magnézia nevylučuje deficit hořčíku! Je prokázáno, že při použití obvykle udávané dolní hranice normy magnezémie 0,7 mmol/l uniká diagnóze deficitu Mg2+ 90 % pacientů, při posunutí cut-off na 0,75 mmol/l zůstane neodhaleno ještě 50 % pacientů a při posunutí hranice na 0,8 mmol/l nezachytíme ještě 10 % postižených nedostatkem hořčíku. Teprve dolní hranice 0,9 mmol/l dává 100 % senzitivitu, ale tímto zvýšením nám logicky klesne specificita, a zvýší se tak počet falešně pozitivních nálezů mezi zdravými jedinci. Diagnózu deficitu hořčíku podporuje nález hypomagnezémie současně s hypokalémií anebo hypokalcémií. Ve všech ostatních případech, tj. při izolované hypomagnezémii anebo normomagnezémii s podezřením na deficit Mg2+, je potřeba vyšetření odpadu hořčíku močí (dU-Mg), případně stanovení exkreční frakce FEMg.
Je-li při hypo-/normomagnezémii dU-Mg snížený (pod 1 mmol Mg2+/24 h) anebo je-li při hypomagnezémii snížená FEMg (pod 2 %) jde o deficit iontů hořčíku a musíme hledat příčinu na straně sníženého příjmu Mg2+, zvýšených non-renálních ztrát anebo přesunu Mg2+ do buněk.
Je-li při hypomagnezémii zvýšený dU-Mg (nad 1 mmol/24 h) anebo je-li zvýšená FEMg (nad 4 %), jde s velkou pravděpodobností o deficit Mg2+ ze zvýšených ledvinných ztrát a bude třeba (po vyloučení lékových vlivů) doplnit další vyšetření k jemnější diferenciaci stavu v rámci různých renálních tubulopatií.
Při normomagnezémii a dU-Mg nad 1 mmol/24 h se o deficit iontů hořčíku pravděpodobně nejedná, nicméně pokud za této situace trvá podezření na deficit Mg2+, pak je potřeba udělat zátěžový test s hořčíkem (perorální nebo parenterální) se stanovením % exkrece Mg2+ z rozdílu před a po zátěži hořčíkem. Je-li dU-Mg/24 h po zátěži dostatečně vysoký (nad 10 – 15 % u perorálního testu), o deficit se nejedná.
Substituční terapie hořčíkem u prokázaného deficitu Mg2+ se doporučuje v iniciální dávce aspoň 600 mg/den a trvání více jak jeden měsíc. Pokračovací dávka by měla být taková, aby hladina plazmatického Mg2+ neklesala pod 0,9 mmol/l .
Srdeční arytmie
Jako prokázaný, efektivní a bezpečný způsob léčby je popsáno použití intravenózního magnézia u ventrikulární tachykardie typu torsade de pointes a u rychlé síňové fibrilace. Preventivní orální suplementace hořčíkem snižuje výskyt komorových arytmií u pacientů se srdečním selháním následkem ICHS. Intenzívně je studován protektivní vliv iontů hořčíku na redukci mortality při akutním infarktu myokardu, dále jejich použití k prevenci arytmií při spojkových operacích (bypassy) na koronárních arteriích.
Primární arteriální hypertenze
Magnézium snižuje krevní tlak snížením cévního napětí a reaktivity svalové stěny a zřejmě zvyšuje tlakovou diurézu. V této indikaci lze soli hořčíku použít s preventivním nebo léčebným úmyslem, ale efektu dosáhneme jen u části pacientů –podrobněji viz odstavec o vaskulárních příznacích deficitu iontů hořčíku.
Preeklampsie a eklampsie
Postihuje těhotné ženy (asi 5 – 10 % gravidních, častěji u prvorodiček). Preeklampsie je charakterizována přítomností hypertenze, proteinurie a otoků a může vyústit do eklampsie s křečemi a poruchami vědomí provázenými hypoxií a edémem mozku. Zde se využívá vazodilatační a antikonvulzivní efekt magnézia v kombinaci s dalšími léky (antihypertenzivy, benzodiazepiny, manitolem).
Astma bronchiale
U středně těžkého nebo těžkého astmatického záchvatu zmírňuje intravenózně podané magnézium v kombinaci s β2-sympatomimetiky a kortikoidy reverzibilní obstrukci dýchacích cest svým účinkem na hladké svalstvo bronchů.
Migrenózní bolesti hlavy
Zde může magnézium pomoci jak v terapii akutního záchvatu, tak v prevenci, kdy snižuje výskyt migrenózních příhod.
Gastroezofageální reflux
Magnézium jako součást antacid (hydroxid hořečnatý) zmírňuje pyrózu, ale je v této indikaci pouze symptomatickým lékem, nikoliv lékem kauzálním.
Zácpa
Soli hořčíku ve vyšší dávce budou v gastrointestinálním traktu zadržovat vodu, a působit tak projímavě. Je potřeba dát pozor při léčbě solnými nálevy s obsahem solí hořčíku aplikovaných per rectum u malých dětí a pacientů s renální insuficiencí, protože může dojít ke vzniku život ohrožující hypermagnezémie.
Křeče (cramps)
Jsou náhle vznikající, mimovolní, silně bolestivé stahy svalu nebo svalových skupin s trváním ve vteřinách až minutách, typicky postihující zejména lýtkové svaly a zejména v noci. Jde o benigní záležitost a terapie magnéziem představuje lék 1. volby.
Dysmenorhea
Jde o menstruaci provázenou výraznými bolestmi v podbřišku, které narušují běžný život postižené, někdy se mluví o menstruačních křečích. Může být provázena nauzeou, zvracením, průjmem anebo zácpou, závratěmi, mdlobami, únavou, bolestmi hlavy, předrážděností (vůči dotyku, světlu, zvukům). Patofyziologicky hrají úlohu prostaglandiny, uvolněné z buněk endometria, které vedou k výrazné svalové konstrikci dělohy, útlaku děložních cév a hypoperfúzi dělohy. Magnézium svým myorelaxačním a vazodilatačním účinkem zlepší prokrvení dělohy, a tím zmírní potíže.
Cukrovka a metabolický syndrom
V odstavci o příznacích deficitu Mg2+ byl připomenut vztah iontů hořčíku k inzulinorezistenci, která představuje jeden z pilířů patogeneze metabolického syndromu. Využití hořčíku v prevenci anebo jako doplněk terapie DM 2. typu a metabolického syndromu proto je předmětem intenzívních studií, na jejichž závěry si ovšem musíme ještě počkat.
Etiologie hypermagnezémie a retence iontů hořčíku v organismu
Hypermagnezémie a retence iontů hořčíku v organismu se vyskytují méně často než hypomagnezémie nebo deficit iontů hořčíku. Patofyziologicky můžeme jejich příčiny rozdělit na tři základní mechanismy:
- Zvýšený přísun Mg2+ do organismu;
- Snížené vylučování Mg2+ z organismu;
- Poruchy distribuce Mg2+ v organismu.
Zvýšený přísun iontů hořčíku do organismu
Pokud má pacient zdravé ledviny schopné pružně zvýšit exkreční frakci hořčíku při jeho zvýšeném přívodu do organismu, lze hypermagnezémie dosáhnout jen velmi rychlým přívodem Mg2+ v krátkém časovém intervalu a – vzhledem k projímavému účinku většího množství horečnatých solí v GIT – prakticky jen parenterální cestou. Jde téměř výhradně o iatrogenní poškození pacienta rychle podaným infúzním roztokem s vysokým obsahem Mg2+; chybné je tedy složení anebo rychlost podané infúze.
Přetížení hořečnatými ionty enterální cestou při zdravých ledvinách bylo popsáno u malých dětí, které omylem rektálně dostaly velké množství solného nálevu s obsahem Mg2+ jako řešení akutní obstipace nebo k očistě střeva před rekto-/kolonoskopickým vyšetřením nebo zákrokem.
U některých chorobných stavů, jako je hypotyreóza anebo Addisonova choroba dochází ke snížení spotřeby iontů hořčíku celkovým útlumem metabolismu, a obvyklý přísun Mg2+ do organismu je pak relativně zvýšený.
Snížené vylučování iontů hořčíku z organismu
Hlavní cestou exkrece iontů hořčíku z organismu jsou ledviny. K retenci Mg2+ v organismu a k hypermagnezémii proto může vést renální insuficience nebo renální selhání, do kterých vyústí většinou chronická ledvinná choroba (chronic kidney disease, CKD), méně často akutní. K nedostatečné exkreci Mg2+ močí dochází při poklesu glomerulární filtrace (GF) na ¼ normy, tedy ≤ 30 ml/min. Při nedostatečném vylučování pak je určujícím faktorem homeostázy Mg2+ dietní přísun iontů hořčíku a u dialyzovaných pacientů je to koncentrace iontů hořčíku v dialyzačním roztoku. Riziko přetížení hrozí zejména tehdy, nepřizpůsobí-li se příjem Mg2+ aktuálnímu stavu snížených renálních funkcí.
Poznámka. Pacienti s CKD mohou mít i opačné problémy, tedy deficit iontů hořčíku, a to vlivem diuretické léčby, vlivem metabolické acidózy provázející tyto stavy, vlivem poklesu resorpce Mg2+ ze střeva pro poruchu aktivace vitaminu D v ledvinách (porucha přeměny kalcidiolu na kalcitriol hydroxylací v ledvinách) anebo při nízkých koncentracích Mg2+ v dialyzačním roztoku.
Poruchy distribuce iontů hořčíku v organismu
Přesun iontů hořčíku z buněk vlivem některých faktorů, jako je katabolismus, acidóza, cytolýza (popř. hemolýza), může vést k přechodné hypermagnezémii, ale při zachované funkci ledvin nevede k retenci Mg2+, protože přebytek iontů hořčíku v plazmě je odveden močí.
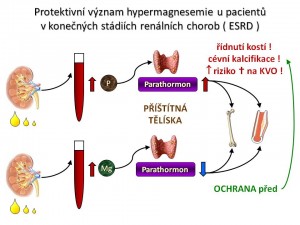
Protektivní význam hypermagnezémie u pacientů s poklesem renálních funkcí
Než přistoupíme k popisu symptomům nadbytku iontů hořčíku, je potřeba říci, že hypermagnezémie nehraje jen negativní roli, ale může mít i pozitivní efekty a to právě u pacientů v konečných stádiích renálních chorob (end-stage renal disease, ESRD) (téma Chronická ledvinová nedostatečnost a terminální stádia onemocnění ledvin, téma Patofyziologie a klinické aspekty chronických onemocnění a selhání ledvin, téma Manifestace, diagnóza a terapie poruch ledvin). Z fyziologie víme, že plazmatická hladina iontů hořčíku reguluje sekreci PTH - hypomagnezémie zvyšuje, hypermagnezémie snižuje sekreci PTH. Stejně tak víme, že ESRD jsou provázeny sekundární hyperparatyreózou, a protože se nevylučují fosfáty, vzniká hyperfosfatémie. Ta stimuluje sekreci PTH příštítnými tělísky, což se kombinuje jednak s nedostatečnou tvorbou kalcitriolu a jednak s rezistencí příštitných tělísek na kalcitriol. Zvýšená sekrece PTH pak společně s dalšími vlivy (acidóza, funkční deficit vitamínu D) demineralizuje kosti a vede k renální osteodystrofii. Dále nadbytek PTH iniciuje vznik a rozvoj cévních kalcifikací, čímž akceleruje už tak urychlený vývoj aterosklerózy, který je podpořen přítomností dalších rizikových faktorů (hypertenze, dyslipidémie, inzulinorezistence). Ty se u pacientů s ESRD vyskytují daleko častěji než v běžné populaci. To vše ve finále zvyšuje riziko smrti na kardiovaskulární choroby. Četné studie nám přinášejí důkazy o tom, že hořečnaté ionty hrají významnou protektivní roli v rozvoji a progresi renální osteodystrofie, vaskulárních kalcifikací a aterosklerózy u pacientů v ESRD, a to útlumem sekrece parathormonu.
Příznaky hypermagnezémie
Lehčí hypermagnezémie bývá asymptomatická. Střední hypermagnezémie už je provázena příznaky a těžká hypermagnezémie může být smrtící. Potíže a symptomy si opět pro větší přehlednost rozdělíme do několika okruhů:
Kardiální příznaky
Hypermagnezémie zřejmě přes ionty draslíku zkracuje 3. fázi akčního potenciálu, což se na EKG projeví štíhlými, vyššími vlnami T. Těžší hypermagnezémie působí negativně chronotropně a dromotropně, objevuje se bradykardie, SA bloky a AV bloky, rozšiřuje se QRS komplex a ve finále může dojít až k srdeční zástavě (asystolii), které někdy trochu paradoxně může předcházet komorová fibrilace.
Vaskulární příznaky
Hypermagnezémie snižuje cévní napětí a reaktivitu, a vede tak k hypotenzi, která je refrakterní na vazokonstrikční podněty a medikamenty (např. na katecholaminy).
Neuromuskulární příznaky
Hypermagnezémie snižuje nervosvalovou dráždivost, což vede ke slabosti kosterního svalstva, v těžkých případech k paralýze dýchacích svalů a respiračnímu selhání. Na hladkém svalstvu GIT se hypermagnezémie podepíše střevní hypomotilitou a stav může dospět až k paralytickému ileu.
Neuropsychické příznaky
Hypermagnezémie vede k útlumu CNS a s tím se pojí ospalost, letargie až kóma, kterým může předcházet nauzea a zvracení. V objektivním neurologickém nálezu je patrná hypo- až areflexie, sníženo je rovněž vnímání bolesti (= hypoalgezie).
Jiné příznaky
Hypermagnezémie snížením sekrece parathormonu snižuje kalcémii, ale bez tetanických projevů.
Použitá literatura a literatura k dalšímu studiu:
- ALEXANDER RT, HOENDEROP JG, BINDELS RJ. Molecular determinatns of magnesium homeostasis: Insights from human dinase, J Am Soc Nephrol. 2008 Aug;19(8):1451-8
- ASSADI F. Hypomagnesemia, an evidence based approach to clinical cases, Iran J Kidney Dis. 2010 Jan;4(1):13-9
- BERKELHAMMER C, BEAR RA. A clinical approach to common em,ectrolyte problems: 4. Hypomagnesemia, Can Med Assoc J. 1985 Feb 15;132(4):360-8
- Dai LJ, Ritchie G, Kerstan D, Kang HS, Cole DE, Quamme GA. Magnesium transport in the renal distal convoluted tubule. Physiol Rev. 2001 Jan;81(1):51-84
- GUERRERA MP, VOLPE SL, MAO JJ. Therapeutic uses of magnesium, Am Fam Physician. 2009 Jul 15;80(2):157-62.
- HARKER HE, MAJCHER TA. Hypermagnesemia in a pediatric patient, Anesth Analg 2000; 91: 1160-2
- LIEBSCHER DH, LIEBSCHER DE. About the misdiagnosis of magnesium deficiency. J Am Coll Nutr. 2004 Dec;23(6):730S-1S
- MORISAKI H, YAMAMOTO S, MORITA Y, KOTAKE Y, OCHIAI R, TAKEDA J. Hypermagnesemia-induced cardiopulmonary arrest before induction of anesthesia for emergency cesarean section. J Clin Anesth. 2000 May; 12(3): 224-6
- KANBAY M, GOLDSMITH D, UYAR ME, TURGUT F, COVIC A. Magnesium in chronic kidney disease: challenges and opportunities. Blood Purif. 2010;29(3):280-92.
- KILLILEA DW, MAIER JA. A connection between magnesium deficiency and aging: new insights from cellular studies. Magnes Res. 2008 Jun;21(2):77-82.
- PAVLIŠÁK V, LAZÚROVÁ I, magnézium – jeho význam pre klinickú prax. Via pract., 2006, roč. 3(1): 37-40
- SHARON MM, Disorders involving kalcium, phosphorus and magnesium. Prim Care. 2008 June; 35(2): 215-vi
- SONTIA B, TOUYZ RM. Role of magnesium in hypertension. Arch Biochem Biophys. 2007 Feb 1;458(1):33-9
- WILHELM Z, Co je dobré vědět o hořčíku. Prakt. Lékáren. 2007; 3(3): 132-8
- WILHELM Z, Klinický význam hořčíku, DMEV 2003; 5(2): 97 – 103
- WILHELM Z, Algoritmy vyšetření deficitů hořčíku v organismu, DMEV 2003; 5(2): 104 – 108
- WIKIPEDIA. Hořčík. www.cs.wikipedia.org
- Magnesium, www.magnesium.cz