Autor: MUDr. Ondřej Veselý
Pracoviště: Ústav patologické fyziologie LF UP Olomouc, Dětská endokrinologická ambulance Svitavské nemocnice a.s.
Definice
Metabolický syndrom (syndrom X, syndrom Reavenův, MeS) je soubor příznaků a abnormit, které ve svém důsledku zvyšují riziko rozvoje kardiovaskulárních onemocnění a cukrovky 2. typu a úmrtí na ně.
Dříve byl popisován jako syndrom 4H (anebo 5H):
- Hypertenze;
- Hyperinzulinismus;
- Hyperglykémie;
- Hyperlipidémie;
- (Hirsutismus).
Současná kriteria MeS podle mezinárodní diabetologické federace (IDF) zahrnují přítomnost centrální obezity a nejméně 2 další příznaky ze 4 možných - hypertriglyceridémii, snížený HDL-C, hypertenzi, hyperglykémii (podrobněji viz tabulku). V širším slova smyslu ale metabolický syndrom zahrnuje i další abnormity, a to jaterní steatózu anebo steatohepatitidu, protrombogenní a proinflamatorní stav a hyperandrogenémii. Pojďme se nyní podívat na jednotlivé nálezy patofyziologickou optikou.
Videozáznam přednášky: Syndrom inzulinové rezistence, metabolický syndrom
Centrální obezita
Nárůst výskytu obezity dosáhl v rozvinutých zemích nebývalé úrovně, a proto se právem hovoří o obezitě jako o epidemii 21. století. V České republice trpí obezitou přes 20 % mužů a přes 30 % žen, pokud ale vezmeme v úvahu i předstupeň obezity, tedy nadváhu, pak vyšší než přiměřenou tělesnou hmotností je zatíženo okolo 70 % obyvatel ČR. Obezita zatěžuje naši společnost zvýšenou morbiditou a mortalitou postižených, což s sebou přináší obrovské finanční náklady spojené s léčbou obezity a jejich komplikací a s finanční újmou společnosti při úmrtí člověka v produktivním věku.
Videozáznam přednášky: Nadváha a obezita
Příčina obezity tkví v kombinaci genetických predispozic a nevhodného životního stylu vyspělé civilizace. Genetické predispozice mají podobu energeticky spořivých genů, které se vyvinuly jako projev adaptace nutný pro přežití lidstva v dobách hladu. To zahrnuje prakticky celou éru vývoje s výjimkou posledních asi 75 let, kdy jsme se náhle ocitli v obezitogenním prostředí s přebytkem stravy a současně nedostatkem pohybu. Výsledkem je energetická nerovnováha, kdy příjem energie převažuje nad jeho výdejem. To je rozhodující faktor epidemie obezity.
Tuková tkáň ale není homogenní. Zahrnuje dva metabolicky odlišně se chovající kompartmenty, a to tuk podkožní a tuk viscerální. Ústředním problémem metabolického syndromu pak je akumulace centrálního – viscerálního – tuku, jehož základní endokrinní charakteristiky jsou:
- Inzulinorezistence, tedy snížená biologická odpověď na účinek inzulínu;
- Změna spektra adipokininů, tedy působků produkovaných adipocyty a majících rozsáhlý vliv nejen na energetickou rovnováhu, ale i na řadu vzdálených orgánů, jejichž fungování se pod přívalem adipokininů zásadním způsobem mění.
Inzulinorezistence tukové tkáně
Co je příčinou inzulinorezistence tukové tkáně? Primární inzulinorezistence je dána dědičně, a to v naprosté většině případů polygenně a na postreceptorové úrovni (existují sice např. i mutace genu pro inzulinový receptor, genetické poruchy funkce beta-buněk, ale jsou vzácné). Sekundární inzulinorezistence především vzniká jako následek hormonálních a metabolických změn provázejících obezitu centrálního typu.
- Mezi změny hormonální, zhoršující inzulinorezistenci, patří hyperinzulinémie, dysregulace sekrece a periferní aktivity kortikoidů, zvýšená hladina glukagonu, zvýšené hladiny katecholaminů, poruchy inkretinů a další.
- Mezi změny metabolické, zhoršující inzulinorezistenci, patří glukotoxicita z hyperglykémie, lipotoxicita z chronicky zvýšené hladiny volných mastných kyselin (VMK), případně osmotické změny a změny acidobazické rovnováhy.
- Další příčinou, která zvyšuje sekundární inzulinorezistenci je tvorba protilátek proti inzulinovému receptoru, které funkčně snižují vazbu inzulínu na jeho receptor anebo zvyšují degradaci inzulinového receptoru.
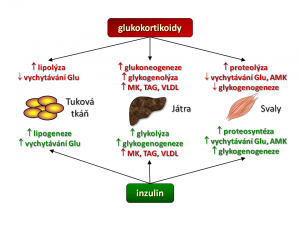
Jak již bylo řečeno v předchozím odstavci, je akumulace viscerálního tuku provázena mimo jiné i změnami v aktivitě glukokortikoidů v periferních tkáních, včetně tukové tkáně samotné. Klíčem k tomuto je 11-beta-hydroxysteroiddehydrogenáza typu I (11-beta-HSD1). Tento enzym in vivo konvertuje neaktivní kortizon na aktivní kortizol. Úkolem 11-beta-HSD1 tedy je intracelulární „recyklace“ kortizolu neboli zajištění dodávky kortizolu glukokortikoidním receptorům bez potřeby zvýšení sekrece anebo zvýšení plazmatické koncentrace kortizolu. 11-beta-HSD1 je vysoce exprimována v řadě tkání včetně tkání hrajících úlohu v patogenezi metabolického syndromu. Těmito tkáněmi jsou tuková tkáň, játra, kosterní svalovina a Langerhansovy ostrůvky pankreatu. Bylo zjištěno, že u obézních ve srovnání se štíhlými je zvýšená exprese a aktivita 11-beta-HSD1 v tukové tkáni (subkutánní i viscerální), byly nalezeny těsné pozitivní korelace mezi zvýšením 11-beta-HSD1 na straně jedné a BMI, obvodem pasu a objemem viscerální tukové tkáně na straně druhé. Zvýšená produkce kortizolu v adipocytech zhoršuje jejich inzulinorezistenci, protože kortizol stimuluje lipolýzu. Současně ale ve viscerálním tuku stimuluje diferenciaci pre-adipocytů ve zralé adipocyty, což podporuje nárůst masy viscerálního tuku. Dále se také kortizol vytvořený ve viscerálním tuku dostává ze splanchnické oblasti portální žílou do jater, kde významně přispívá k hepatální inzulinorezistenci, protože zvyšuje glukoneogenezi a výdej glukózy játry.
Inzulinorezistence viscerální tukové tkáně má za následek snížení lipogeneze, zvýšení lipolýzy spojené se zvýšeným uvolňováním volných mastných kyselin (VMK) a chronický vzestup jejich plazmatické koncentrace s následnými projevy tzv. lipotoxicity v řadě tkání a orgánů. Působí jak cestou funkční (sekundární zvýšení inzulinorezistence těchto orgánů), tak cestou organickou (ukládání tuků).
- Játra. Zvýšený přísun VMK do hepatocytů zvyšuje glukoneogenezi (beta-oxidace mastných kyselin poskytuje energii pro glukoneogenezi) a syntézu triglyceridů. Zvýšená glukoneogeneze a výdej glukózy z jater zvyšuje glykémii a zhoršuje glukózovou toleranci. Triglyceridy vytvořené hepatocyty se mohou v játrech hromadit pod obrazem nealkoholické jaterní steatózy s rizikem přechodu do steatofibrózy až cirhózy.
- Kosterní svaly. Zvýšená nabídka mastných kyselin snižuje vychytávání glukózy svaly, a tím zhoršuje celkový stav inzulinorezistence.
- Cévy. Hromadění lipidů v jejich stěně je kritickým bodem patogeneze aterosklerotického procesu vedoucího k následným trombózám a kardiovaskulárním komplikacím typu ICHS a CMP.
- Myokard. Akumulace triglyceridů v kardiomyocytech snižuje čerpací schopnost srdce, což může mít v kombinaci s postižením koronárních tepen fatální následky.
- Pankreas. Hromadící se tuk přímo poškozuje beta-buňky Langerhansových ostrůvků, jednak funkčně – snížením jejich citlivosti a následným snížením sekrece inzulínu, jednak organicky – zvýšením jejich apoptózy.
Vybrané změny spektra adipokininů
Obézní mají vyšší hladinu leptinu, který by měl přes nucleus arcuatus fyziologicky tlumit centrum hladu, a naopak stimulovat centrum sytosti, a tím brzdit další příjem stravy. Tento mechanismus evidentně selhává, a to i přes hyperleptinémii přítomnou u obézních. Příčinou selhání zřejmě je rozvoj leptinorezistence výše uvedených center.
U obézních naopak klesá hladina adiponektinu, proteinu specifického pro tukovou tkáň, který má významné antiaterogenní a také protizánětlivé účinky. Adiponektin fyziologicky zvyšuje beta-oxidaci mastných kyselin a současně omezuje jaterní glukoneogenezi. Jeho snížená hladina provázející obezitu tak urychluje vývoj kardiovaskulárních a metabolických komplikací.
Další adipokininem produkovaným a secernovaným tukovými buňkami je rezistin. U obezních je hladina rezistinu vysoká. Název rezistinu je odvozen od jeho účinku, zvyšuje inzulinovou rezistenci, a působí tak prodiabetogenně.
Tuková tkáň obézních je prostoupena makrofágy, které se pak stávají zdrojem prozánětlivých cytokininů. Tyto cytokininy ovšem jsou produkovány i samotnými adipocyty. U obézních byly nalezeny zvýšené hladiny IL-6 a TNF-a. Jejich následkem ve vztahu k metabolickému syndromu je změna aktivity metabolických drah – mimo jiné narušením inzulinové signalizace v adipocytech a hepatocytech -, dále aktivace endotelu a podíl na aterogenezi. Nepřímou známkou tohoto proinflamatorního stavu je lehce zvýšená hladina CRP u obézních.
Hyperinzulinémie a hyperglykémie
Obezita je klíčový rizikový faktor rozvoje poruchy glukózové tolerance a cukrovky 2. typu. Až 80 % pacientů s cukrovkou 2. typu je obézních, a 20 – 30 % obézních má cukrovku 2.typu
Obezita je provázena inzulinorezistencí nejen v tukové tkáni, ale také v játrech a v kosterní svalovině. V játrech následkem inzulinorezistence stoupá glukoneogeneze a výdej glukózy hepatocyty. Zvýšená produkce glukózy játry je plně odpovědná za hyperglykémii a její udržování u nemocných diabetem. Navíc kosterní svaly vlivem inzulinorezistence nedostatečně vychytávají glukózu z krve. Glykémie proto narůstá, což stimuluje v pankreatu sekreci inzulínu beta-buňkami a vzniká hyperinzulinémie, která je i přes přítomnou inzulinorezistenci nějaký čas schopná udržet normoglykémii. Zvýšená zátěž ovšem beta-buňky funkčně vyčerpává, navíc jsou přímo poškozovány akumulací lipidů. V určitý moment vývoje stavu se nůžky mezi inzulinorezistencí a schopností beta-buněk secernovat inzulín začnou rozevírat, hovoříme o stadiu dysfunkce beta-buněk. Zejména klesá „pružnost“ reakce na rychlé výkyvy glykémie, mizí 1.fáze postprandiální sekrece inzulínu, a následně vznikají mírné hyperglykémie, zejména postprandiálně, rozvíjí ze porucha glukózové tolerance. K sekreční rigiditě beta-buněk přispívá i zvýšená exprese a aktivita 11-beta-HDS 1, která vede k lokální produkci kortizolu, a ten pak snižuje sekreci inzulínu beta-buňkami a zvyšuje apoptózu beta-buněk. Ve finále dochází k úplnému vyčerpání beta-buněk, selhání beta-buněk, k jejich zániku, snížení sekrece inzulínu, ke značným hyperglykémiím a k rozvoji diabetes mellitus 2. typu.
Videozáznam přednášky: Patologická a klinická fyziologie diabetes mellitus
Instruktážní video: Selfmonitoring glykemie na osobním glukometru
Dyslipidémie
Vlivem hyperinzulinémie a také zvýšené nabídky VMK uvolňovaných z viscerálního tuku dochází v játrech ke zvýšené produkci VLDL částic s vysokým obsahem triglyceridů (TAG). Výsledkem je hypertriglyceridémie. Následkem zvýšeného vychytávání HDL částic adipocyty v kombinaci se zvýšenou degradací apoproteinu AI je typickým nálezem u obézních jedinců snížená koncentrace HDL cholesterolu, což snižuje zpětný transport cholesterolu z periférie do jater. Dále bývá vlivem zvýšené endogenní produkce cholesterolu a snížené degradace apoproteinu B přítomna i zvýšená koncentrace LDL-C. Jedná se o malé denzní formy LDL částic, které snadno pronikají do stěny cév a také snadno podléhají oxidaci a neenzymové glykaci, což následně znesnadňuje jejich odstraňování cestou LDL-receptorů anebo - zejména po infiltraci stěn cév - SR-receptorů makrofágů. Hladina celkového cholesterolu se obvykle příliš nemění, protože LDL-C stoupá, kdežto HDL-C klesá. Vzniklá dyslipidémie je každopádně silně proaterogenní.
Hypertenze
Obezita představuje hlavní rizikový faktor rozvoje systémové arteriální hypertenze, což přesvědčivě dokumentují epidemiologická data. Zatímco u štíhlých jedinců se hypertenze vyskytuje asi v 8 – 10 %, u obezních je výskyt asi 3x častější. Redukce hmotnosti u obézního vede ke snížení krevního tlaku a třeba i možnosti vysazení antihypertenzivní terapie.
Změny poměru vazokonstrikčních a vazodilatačních působků sice vedou k proliferaci buněk hladké svaloviny a zvyšují periferní odpor s následnou fixací změn mikrocirkulace, ale samy o sobě k chronickému zvýšení krevního tlaku nestačí. K tomu je třeba změny náplně cirkulace, a ta může nastat jen změnou tlakové diurézy v ledvinách. Iniciálním krokem k rozvoji hypertenze v rámci obezity je tedy nedostatečná natriuréza v ledvinách za podmínek původně normálního krevního tlaku. Výsledkem je retence Na+ iontů, která vede ke zvýšení středního cirkulačního plnícího tlaku, zvýšení žilního návratu, zvýšení srdečního výdeje a nárůstu tlaku v systémové cirkulaci. Krevní tlak pak roste do té doby, dokud perfúzní tlak ledvin není dostatečný k obnově takové míry natriurézy, která udrží vyrovnanou bilanci soli a vody - jinak by během několika málo dní došlo k rozvoji edémů, přetížení oběhu a srdečnímu selhání. Daní za přežití je popsaný nárůst krevního tlaku. Co je příčinou změny tlakové diurézy při obezitě? V prvé řadě je třeba říci, že může jít o změny drobných preglomerulárních tepének, jejichž zúžení povede k rozvoji Goldblattovy hypertenze typu 2K1C (téma Patofyziologie systémové arteriální hypertenze). Může také jít o postižení postglomerulárního dřeňového cévního oddílu v parenchymu ledvin (snížení průtoku dření), které povede k nárůstu zpětného vstřebávání iontů a vody. Podstatou zvýšeného vstřebávání natriových iontů a tekutin však nemusí být jen změna míry glomerulární filtrace, ale zvýšená reabsorpce iontů Na+ tubulárním epitelem, kterou v souvislosti s obezitou pravděpodobně zapříčiňují změny v těchto systémech:
- Zvýšená aktivita sympatiku. Bylo prokázáno, že obézní mají vyšší aktivitu sympatiku, která mimo své vazokonstrikční účinky má i účinky renální: (1) Přes adrenergní β1-receptory přímo zvyšuje sekreci reninu z granulárních buněk juxtaglomerulárního aparátu, a tím zvyšuje aktivitu systému renin-angiotenzin II-aldosteron (RAA); (2) Účinkem přes α2-receptory přímo zvyšuje reabsorpci iontů sodíku tubulárními buňkami. Otázka zní, proč je aktivita sympatiku u obézních zvýšená? „Podezřelým“ mediátorem je leptin, který kromě center hladu a sytosti má své receptory v CNS i v ncl. paraventricularis, což je jádro s přímým stimulačním vlivem na centra sympatiku.
- Zvýšená aktivita systému renin-angiotenzin-aldosteron. Obézní mívají vyšší plazmatickou aktivitu reninu i koncentraci aldosteronu. Ke zvýšené retenci Na+ vede jak aldosteron, a to cestou distálních tubulů a sběracích kanálků za cenu zvýšené exkrece K+ iontů, tak i angiotensin II, který kromě toho, že zvyšuje sekrece aldosteronu, cestou svých AT1 receptorů přímo zvyšuje reabsorpci Na+ v proximálních tubulech. Aktivita systému RAS je u obézních zvýšena jak celkově, tak lokálně. Příčinou je kromě výše uvedené zvýšené aktivity sympatiku také zvýšená produkce angiotenzinogenu v játrech vlivem lipotoxicity. Angiotenzinogen se zvýšeně tvoří i v hypertrofické tukové tkáni, současně se v adipocytech zvyšuje aktivita ACE, který konvertuje angiotensin I na účinný angiotensin II. Zajímavý je efekt dyslipidémie, kdy LDL částice stimulují expresi AT1 receptorů. Zvýšená aktivita RAS vedle svých účinků na tlak také zhoršuje inzulinorezistenci tím, že podporuje vývoj velkých inzulin-rezistentních adipocytů, a tím, že dochází ke vzájemnému sdílení společných cytoplazmatických článků v signálních kaskádách inzulinového receptoru a AT1 receptorů. Angiotenzin II navíc přispívá k hypertrofii glomerulů, a tím urychluje jejich glomerulosklerózu s následným poklesem vylučovacích schopností ledvin.
- Ateroskleróza velkých renálních cév vzniká jako následek endotelové dysfunkce, dyslipidémie a hyperglykémie a vede ke změnám intrarenálních tlaků. Zvýšený preglomerulární odpor pak posunuje renální funkční křivku s následným sníženým vylučováním solí a tekutin.
Hyperandrogenémie
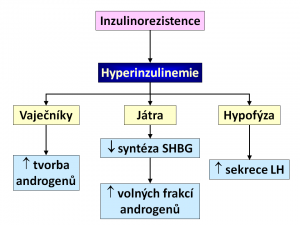
Nejčastější endokrinopatií u žen ve fertilním věku je tzv. syndrom polycystických ovarií (PCOS), dnes lépe nazývaný jako funkční ovariální hyperandrogenismus. Jedna z teorií o jeho etiopatogenezi staví na první místo hyperinzulinémii nasedající na obezitu a inzulinorezistenci. Některými autory je proto tento syndrom považován za jeden z projevů metabolického syndromu, což dokládá i skutečnost, že většina žen s PCOS je obézních. Možné vysvětlení vzniku tohoto syndromu skrze inzulinorezistenci je následující:
Inzulinorezistence vede k hyperinzulinémii.
- Ve vaječnících hyperinzulinemie zvyšuje tvorbu ovariálních androgenů.
- V játrech hyperinzulinémie snižuje tvorbu bílkoviny vázající pohlavní hormony (SHBG, sex hormon binding globulin). Na SHBG se mohou vázat jak androgeny, tak estrogeny, ale silnější je vazba androgenů. To má u postižené ženy za následek, že snížením hladiny SHBG se snižuje vázaná frakce androgenů a stoupá hladina volných androgenů, které jsou biologicky aktivní.
- V hypothalamo-hypofyzárním systému se vlivem hyperinzulinémie mění charakter sekrece gonadotropinů, dochází ke zvýšení amplitudy a frekvence sekrece luteinizačního hormonu. LH přes své receptory stimuluje thekální buňky folikulů ke steroidogenezi, ale tyto nejsou vybaveny aromatázou schopnou konvertovat androgeny na estrogeny. Aromatázou jsou vybaveny buňky granulózy, ty jsou ovšem stimulovány přes FSH. V důsledku změny na úrovni mozkových center tedy vzniká relativní převaha LH nad FSH, která má za následek vystupňování ovariální androgeneze.
Následkem hyperandrogenémie dochází u postižené k poruchám menstruačního cyklu ve smylu oligomenorhey, amenorhey, poruchy ovulace a s tím související poruchy fertility. Současně dochází k projevům hirsutismu s růstem ochlupení terminálního typu v typicky mužských lokalitách, jako jsou horní ret, brada, hruď včetně okolí prsních dvorců a střední břišní čára. Dalším následkem hyperandrogenémie je zhoršení kvality pleti v podobě akné a zvýšené vypadávání vlasů až charakteru androgenní alopecie.
O tom, že inzulinorezistence a hyperinzulinémie hraje klíčovou úlohu v patogenezi PCOS svědčí fakt, že k poklesu hladin androgenů, úpravě menstruačního cyklu a dalších projevů hyperandrogenémie dochází při léčbě tohoto onemocnění pomocí metforminu, tedy léku zvyšujícího inzulinovou senzitivitu, který jinak patří mezi standardní medikamenty používané v terapii diabetes mellitus 2. typu.
Protrombofilní stav
V důsledku zvýšené produkce prozánětlivých cytokininů stoupají u obézních hladiny fibrinogenu (FBG) a inhibitoru aktivátoru plazminogenu (PAI-1), a tím dochází k vychýlení hemostatické rovnováhy na stranu trombofilie (téma Trombofilie a trombóza). To v kombinaci se subklinickým zánětem provázejícím obezitu a akcelerací aterosklerózy zvyšuje riziko akutní kardiovaskulární příhody.
Kazuistika: Metabolický syndrom u adolescenta
Použitá literatura
1. ALDHOON-HAINEROVÁ I. Dětská obezita. Maxdorf Jessenius, 2009
2. BIČÍKOVÁ M., STÁRKA L. Inhibice 11-beta-hydroxysteroidní dehydrogenázy typu 1 jako možná cesta léčby diabetu, obezity a metabolického syndromu. DMEV, 2011, 14(2): 61-66
3. BIENERTOVÁ-VAŠKŮ J. Potenciál variability v genech kódujících adipokininy v neurobehaviorálním řízení příjmu potravy u české obézní a neobézní populace. Dizertační doktorandská práce. Masarykova Univeriza, Brno 2009, str. 21-35
4. BOSCARO M., GIACCHETTI G., RONCONI V. Visceral adipose tissue: emerging role og gluco- and mineralocorticoid hormones on the petting of cardiometabolic alterations. Ann. N.Y.Acad.Sci. 2012, 1264:87-102
5. CIBULA D., STÁRKA S., VRBÍKOVÁ J. a kol. Syndrom polycystických ovarií. Maxdorf Jessenius, 2004
6. Di DALMAZI G., PAGOTTO U., PASQUALI R. VICENNATI V. Glucocorticoids and type 2 diabetes: from fysiology to patology. J. of Nutrition and Metabolism, 2012, 2012:525093
7. HOLLIS G., HUBER R. 11-hydroxysteroid dehydrogenace type 1 inhibition in type 2 diabetes mellitus. Diabetes, Obesity and metabolism, 2010,13(1): 1-6
8. HULÍN I. et al., Patofyziológia, Bratislava SAP 2009, str. 1016-1037
9. JOHARAPURKAR A, DHANESHA N, SHAH G et al. 11-hydroxysteroid dehydrogenace type 1: potential therapeutic target for metabolit syndrome. Pharmacological reports, 2012, 64(5): 1055-1066
10. NEČAS E. a spol. Obecná patologická fyziologie. Nakladatelství Karolinum, Praha 2000, str. 309-313
11. RASHID S., GENEST J. Effect of obesity on high-density lipoprotein metabolism. Obesity (Silver Spring) 2007, 15(12):2875-88
12. STEPPAN CM, BAILEY ST, BHAT S, et al. The hormon resistin links obesity to diabetes. Nature, 2001, 409:307-312
13. ŠMAHELOVÁ A. Dyslipidémie a obezita. Postgraduální medicína, 2008, 10(6): 639-644
14. TEPLAN V. Metabolický syndrom. Postgraduální medicína, 2007, 9(8): 892-896
15. VESELÝ J. Nadváha a obezita. E-learningová podpora výuky patologické fyziologie na LF UP. CZ.04.1.03/3.2.15.3/048. http://pfyziol.upol.cz/cast/?p=78
16. VESELÝ J. Tlaková diuréza a arteriální hypertenze. Epava 2002, str.187-196
17. WAKE DJ., WALKER BR. 11-hydroxysteroid dehydrogenace type 1 inhibition in obesity and the metabolic syndrome. Molecular and Cellular Endocrinology, 2004, 215(1-2): 45-54