Pracoviště: Ústav patologické fyziologie LF UP Olomouc
Úvod
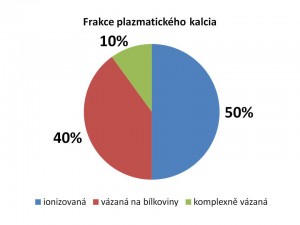
- Kalcium vázané (40 %) na plazmatické bílkoviny, především albumin;
- Kalcium ionizované – volné (50 %) v podobě kationtu Ca2+;
- Kalcium vázané v rozpustných komplexech a solích (10 %), jako jsou citrát, oxalát, fosfát anebo bikarbonát vápenatý.
Fyziologická úloha iontů vápníku
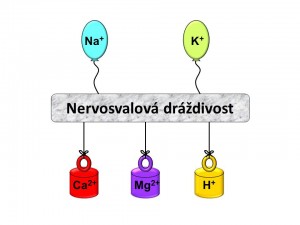
Nervosvalová dráždivost
Vápenaté ionty společně s dalšími ionty (Na+, K+, H+, Mg2+) určuje nervosvalovou dráždivost. Mírou nervosvalové dráždivosti je intenzita podnětu schopného vychýlit hodnotu klidového membránového potenciálu (KMP) na úroveň prahového potenciálu (PP), kdy dojde ke genezi akčního potenciálu (PP). V případě změn plazmatické koncentrace ionizovaného kalcia se nemění hodnota klidového membránového potenciálu. Mění se ale hodnota prahového potenciálu, tzn. úroveň napětí membrány, při níž se otvírají rychlé napěťově řízené kanály pro sodíkové ionty a dochází k depolarizaci.
Při hypokalcémii se PP přesunuje do negativnějších hodnot, tedy blíže hlubokému negativnímu KMP, a nervosvalová dráždivost roste, protože k vyvolání vzruchu postačuje podnět s nižší než obvyklou intenzitou, tzn. i podnět podprahový.
Při hyperkalcémii se PP stává méně negativní, tím se vzdaluje od negativního KMP, a podnět k vyvolání vzruchu pak musí mít nadprahovou intenzitu – tzn. že se nervosvalová dráždivost snižuje.
Stavební kámen kostí a zubů
Naprostá většina celotělového vápníku je uložena právě v kostech. Kost ovšem není statický orgán, jehož vývoj by končil uzávěrem růstových chrupavek. Po celý lidský život vykazuje nebývalý metabolický obrat, stále se v ní střídá novotvorba a odbourávání. Mluvíme o remodelačním cyklu. Jeho konstantní fází je i fáze mineralizace osteoidu, kdy se vápník zabudovává do organické matrix, a fáze resorpce, kdy se vápník činností osteoklastů uvolňuje z vazby v hydroxyapatitu.
Svalová kontrakce
Ionty vápníku se aktivně účastní svalového stahu. Vápenaté ionty se při depolarizaci buněčné membrány dostávají do cytoplazmy myocytu jednak z okolí buňky, jednak z intracelulárních zásobních organel. Jejich cílovou strukturou je troponin (v kosterní svalovině anebo v myokardu), anebo kalmodulin (v hladké svalovině), Výsledný komplex pak zajišťuje vzájemnou interakci aktinových a myosinových vláken, a tím i kontrakci.
Akční potenciál myokardu
Buňky srdečního svalu v zásadě mají třífázový akční potenciál – na rozdíl od dvoufázového akčního potenciálu ostatní svaloviny a nervů. Navíc je zde tzv. fáze plateau, kdy se po uzavření natriových kanálů vlivem již otevřených kaliových kanálů pozitivita membránového akčního potenciálu o něco sníží (na hodnoty lehce nad 0 mV), ale pak zůstává po značnou dobu (200 – 300 ms) neměnná. Příčinou jsou dva protichůdné iontové proudy: (a) Depolarizující proud kalciových iontů, kterým do buňky proudí ionty Ca2+ po svém koncentračním gradientu; (b) Proti němu působící repolarizující proud draselných iontů, kterým z buňky po svém koncentračním gradientu utíkají K+ ionty. Po dobu trvání fáze plateau zůstává kardiomyocyt absolutně refrakterní, tj. neodpovídá na žádný další přicházející vzruch. Fáze plateau, na které se ionty vápníku podílejí, tak chrání myokard před tetanickou křečí a současně poskytuje dostatek času pro vyvinutí takového stahu, který vypudí krev z příslušného srdečního oddílu. Změny kalcémie pak můžeme pozorovat ve změnách délky trvání fáze plateau.
Kalciový signál. Vápenaté ionty slouží jako 2. posel v buněčných kaskádách kontrolujících aktivitu mnoha buněčných procesů. Klasickou ukázkou je řetězec začínající stimulací receptorů spřažených s G proteiny, které po navázání ligandu aktivují fosfolipázu C. Fosfolipáza C štěpí fosfatidylinositolbisfosfát (PIP2) na inositoltrisfosfát (IP3) a diacylglycerol (DAG). IP3 pak přes své receptory otevírá zásobárny kalciových iontů v endoplazmatickém retikulu. Vzestup intracelulární koncentrace Ca2+ pak zajišťuje změnu aktivity řady enzymů a jiné pochody jako například uvolňování hormonů, proliferaci buněk, otevření/uzavření iontových kanálů, svalové kontrakce a jiné.
Koagulace
Vápenaté ionty jsou počítány mezi plazmatické koagulační faktory (v klasické hematologické škále těchto faktorů mají číslo IV). Účastní se reakcí zevní, vnitřní i společné části koagulační kaskády. Naopak vyvázání Ca2+ ze vzorku krve (např. pomocí EDTA) zabraňuje vzniku krevní sraženiny.
Laktace
Tvorba mateřského mléka by se stěží obešla bez dostatečného příjmu dostatečného množství iontů vápníku kojící matkou.
Vestibulární aparát
Drobné krystalky uhličitanu vápenatého nacházíme jako tzv. otolity ve vnitřním uchu, konkrétně v utrikulu a sakulu, které představují statickou část tohoto čidla a registrují působení gravitace. Tlak otolitů na stereocilie při gravitačním zrychlení pak dle jeho směru dráždí, nebo tlumí vláskové buňky, a to vede ke změně frekvence akčních potenciálů v VIII. hlavovém nervu.
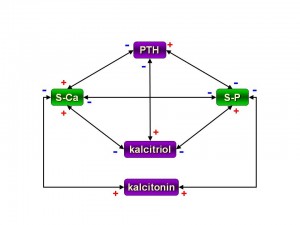
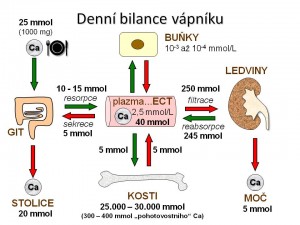
Regulace homeostázy iontů vápníku
- Mírou vstřebávání Ca2+ z GIT;
- Ukládáním/uvolňováním vápníku do/z kostí;
- Změnou vylučování Ca2+ ledvinami.
Ve všech těchto orgánech, a také v příštítných tělíscích a v jiných tkáních, se ionty kalcia vážou na receptor rozpoznávající kalcium (CaSR, calcium sensing receptor). Kromě vápenatých iontů váže i jiné dvojmocné ionty (např. Mg2+ nebo aminokyseliny). Sekundárními posly v signální kaskádě tohoto receptoru jsou G proteiny, snížení cAMP, zvýšení aktivity fosfolipáz s tvorbou IP3 a DAG anebo aktivace proteinkináz (blíže viz téma Parathormon a poruchy jeho sekrece).
Parathormon (PTH)
vytvářený v příštítných tělíscích, který kalcémii zvyšuje (téma Parathormon a poruchy jeho sekrece a účinku). Toto zvýšení se děje
- (a) jeho přímým účinkem na kosti, kde zvyšuje uvolňování iontů vápníku, dále
- (b) přímým účinkem v ledvinách, kde zvyšuje jejich tubulární reabsorpci a
- (c) nepřímým účinkem, když zvyšuje vstřebávání Ca2+ z GIT stimulací tvorby kalcitriolu v ledvinách.
Kalcitriol
1,25 – dihydroxycholekalciferol vytvářený v ledvinách hydroxylací kalcidiolu. Tento hormon-vitamín zvyšuje kalcémii
- (a) zvýšením resorpce iontů vápníku ze střeva tím, že ve střevní sliznici zvyšuje tvorbu proteinu odpovědného za transport Ca2+ přes luminální membránu enterocytů (CaBP, calcium binding protein), a dále
- (b) tím, že zvyšuje zpětné vstřebávání vápníku v ledvinných tubulech.
Za fyziologických koncentrací podporuje mineralizaci skeletu, při vyšších hladinách ale podporou kostní resorpce zvyšuje i uvolňování Ca2+ z kostí.
Kalcitonin
vylučovaný parafolikulárními buňkami štítné žlázy kalcémii snižuje sníženým uvolňování Ca2+ z kostí, protože inhibuje aktivitu osteoklastů. V ledvinách zvyšuje vylučování iontů kalcia útlumem jeho zpětné tubulární reabsorpce. V GIT blokuje vstřebávání iontů vápníku, ale ne za fyziologických okolností.
Vstřebávání iontů vápníku z GIT
-
Věk. S věkem atrofuje sliznice tenkého střeva a ubývá receptorů pro vitamín D.
- Dietní vlivy. Vstřebávání iontů vápníku mohou negativně ovlivňovat i určité složky ve stravě, které tyto ionty buď pevně váží (oxaláty, fosfáty) nebo s nimi kompetují o stejné transportní mechanismy (hořčík, zinek). Naopak jiné složky potravy nebo střevního obsahu mohou resorpci podporovat (např. vitamín C, glukóza, žlučové kyseliny, kyselé pH v trávenině aj.
-
Motilita střeva. Tak jako v případě jiných nutrietů i pro vápenaté ionty platí, že zvýšená střevní peristaltika snižuje míru resorpce.
Vylučování iontů vápníku ledvinami
- PTH a vitamín D (kalcitriol) zvyšují resorpci Ca2+ v distálním tubulu, kdežto
- mineralokortikoidy, glukokortikoidy a kalcitonin (ten pouze ve farmakologických dávkách) ji snižují.
- Změny objemu extracelulárního oddílu tělesných tekutin (ECV) a velikost glomerulární filtrace (GF). Vysvětlení je jednoduché - v proximálním tubulu a v Henleově kličce je resorpce iontů vápníku přímo úměrně vázána na resorpci Na+. Při hypervolémii (zvýšení ECV) se zvýší GF a zvýší se i průtok primární moče proximálním tubulem a Henleovou kličkou, což vede ke zmenšení zpětné resorpce Na+, a tím i Ca2+. Při hypovolémii a snížení GF je situace opačná a velikost denních odpadů iontů kalcia močí pak klesá.
- Plazmatické koncentrace iontů kalcia. Hyperkalcémie vede k hyperkalciurii a hypokalcémie k hypokalciurii. Proto při primární hyperparatyreóze je i přes vystupňovanou resorpci Ca2+ vlivem vysokých hladin PTH koncentrace iontů vápníku v moči zvýšená.
- Příjem fosfátů. Při zvýšeném dietním příjmu P se resorpce Ca2+ v tubulech zvyšuje, protože zvýšený přívod fosforečnanů a zvýšení fosfatémie zvyšují sekreci PTH, který stimuluje zpětnou tubulární resorpci Ca2+. Při sníženém přívodu fosforečnanů do těla se zpětná resorpce iontů vápníku v tubulech snižuje.
- Stav acidobazické rovnováhy. Acidóza zvyšuje vylučování iontů vápníku močí. Jednak vyvolává vyplavování vápenatých iontů z kostí, což zvyšuje nálož Ca2+ v ultrafiltrátu, jednak zřejmě snižuje resorpci Ca2+ v distálním tubulu při zvýšené sekreci H+ v tomto oddíle (mechanismus je nejasný). Alkalóza vylučování iontů vápníku snižuje, protože zvyšuje vazbu vápenatých iontů na plazmatické bílkoviny, a tím znemožňuje jejich ultrafiltraci přes glomerulární membránu.
- Diuretika. Kličková diuretika, jako je furosemid, vedou k hyperkalciurii, protože zablokování Na+-K+-2Cl--kontransportéru v tlusté části Henleovy kličky, a tím i recirkulace K+ iontů přes ROMK, snižuje pozitivitu elektrického gradientu, který „tlačí“ vápenaté ionty přes paracelulární štěrbiny. Naopak thiazidová diuretika blokující Na+-Cl-- kontransportér v první části distálního tubulu vedou k hypokalciurii. Vysvětlení by mohlo spočívat v tom, že snížení intracelulární koncentrace Na+ zvyšuje aktivitu 3Na+/Ca2+ výměníku na bazolaterální membráně, který tak doplní chybějící Na+ v buňce výměnou za Ca2+. Další vysvětlení uváděné v literatuře je, že thiazidy zvyšují koncentraci calbindinu v tubulární buňce, který usnadňuje vstup Ca2+ přes apikální membránu do tubulární buňky - zvýšení intracelulární koncentrace Ca2+ pak zvyšuje výměnu vápenatých kationtů za sodné ionty na bazolaterální membráně přes výše uvedený výměník.
- Fyzická aktivita/inaktivita. Při tělesné zátěži je krev vlivem vazodilatace ve svalech odvedena od ledvin, což snižuje GF, a tím i vylučování iontů vápníku. Naopak delší imobilizace zvyšuje uvolňování iontů vápníku z kostí a jeho exkreci ledvinami tak, aby byla udržena normokalcémie.
- Těhotenství. V graviditě je zvýšená potřeba iontů vápníku, protože tělo těhotné musí zajistit jejich dostatečný přívod vyvíjejícímu se plodu.
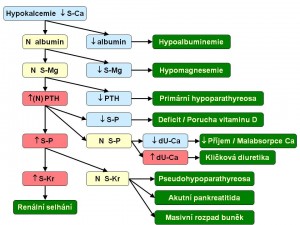
Hypokalcémie
Příčiny hypokalcémie
Absolutně snížený přívod iontů vápníku ve stravě. V podmínkách našich zeměpisných šířek do této kategorie patří rigidní vegetariáni, kteří odmítají nejen maso a vejce, ale i mléko a mléčné výrobky. Dále mají nedostatečný příjem vápníku staří lidé, kteří z úsporných důvodů žijí na „čaji a rohlících“.
Zvýšená potřeba iontů vápníku (= relativně snížený přívod iontů vápníku). Příkladem jsou děti, jejichž kosti budující organismus musí mít pro zdárný vývoj zajištěnu pozitivní bilanci iontů kalcia. Stejně tak těhotná a kojící žena potřebuje zvýšený přívod iontů vápníku.
Snížené vstřebávání iontů vápníku ze střeva z nehormonálních příčin. Může jít o
- stavy poškození střevní sliznice, které obvykle neumožní dostatečnou absorpci více živin, nejen vápníku (příkladem je céliakie nebo Crohnova choroba), nebo
- přítomnost látek bránících vstřebávání iontů vápníku, jako je například přítomnost fosfátů (Coca-Cola, tavené sýry) anebo oxalátů (kakao, špenát).
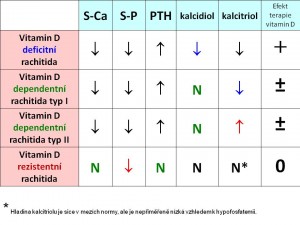
Deficit vitamínu D a jeho účinků (= snížené vstřebávání Ca2+ ze střeva z hormonálních příčin). Nedostatek vitamínu D, popř. jeho aktivního metabolitu kalcitriolu, vede ke snížené tvorbě vazebného (calcium binding) proteinu v enterocytech, a tím k nedostatečné resorpci iontů vápníku ze střeva. Deficit sám o sobě může mít celou řadu příčin:
- Nedostatek vitamínu D ve stravě. Typicky u kojených dětí, protože mateřské mléko, ač jinak dokonalé ve svém složení, neobsahuje dostatek tohoto vitamínu.
- Nedostatečným vstřebáváním vitamínu D z GIT v rámci malabsorpčních syndromů. Vitamín D patří mezi vitamíny rozpustné v tucích, a proto malabsorpce tuků přítomná u insuficience exokrinního pankreatu nebo u insuficience tvorby žluči ohrožuje i resorpci tohoto vitamínu.
-
Současně s první nebo druhou možností ovšem také musí být přítomna nedostatečná tvorba vitamínu D v kůži způsobená nedostatečným slunečním osvitem v zimních měsících – u malých dětí, u jedinců tmavé pleti, u osob používajících příliš „dokonalé“ opalovací krémy.
- Poruchy aktivace a účinnosti vitamínu D v organismu. Vitamín D prochází dvojí hydroxylaci, první v játrech a druhou v ledvinách, která jeho účinnost zvyšuje o tři řády. Proto je jeho tvorba anebo účinnost snížená u jaterního anebo renálního selhání. Některá antikonvulzíva (fenytoin, fenobarbital) inhibují aktivitu 25-hydroxylázy v játrech. K nedostatečné aktivaci vitaminu D v ledvinách dochází i při primární hypoparatyreóze, protože chybějící PTH představuje hlavní fyziologický stimul aktivity ledvinové 1α-hydroxylázy.
- Do skupiny „renálních“ rachitid můžeme zařadit i některé vrozené stavy. Prvním je vitamín D-dependentní křivice typu I. Jde o autozomálně recesivně (AR) sníženou aktivitu renální 1α-hydroxylázy, a tím i sníženou přeměnu kalcidiolu na kalcitriol. Vitamín D-dependentní křivice typu II je rovněž AR onemocnění, při němž jsou cílové tkáně (především kost a ledviny) rezistentní na účinek kalcitriolu. U části pacientů byl prokázán konkrétní defekt receptoru pro vitamín D. Oba tyto vrozené stavy jsou léčitelné vysokými dávkami vitamínu D (proto „vitamín D-dependentní“) – na rozdíl od vitamín D-rezistentní rachitidy neboli familiální hypofosfatemické rachitidy, což je gonosomálně dominantně dědičná choroba s postižením resorpce fosfátů v proximálním tubulu. Laboratorně kromě hypokalcémie dominuje výrazná hypofosfatémie z hyperfosfaturie (proto se choroba někdy nazývá fosfátový diabetes); samotný vitamín D nebo kalcitriol zde k léčbě nestačí a současně je potřeba podávat vysoké dávky fosforečnanů.
- Účinky vitamínu D blokují endogenní anebo exogenní glukokortikoidy.
Deficit parathormonu a jeho účinků (= snížená mobilizace iontů vápníku z kostí a současně zvýšené ztráty iontů vápníku ledvinami). Do této skupiny počítáme
- primární hypoparathyreózu, kdy je nedostatečná sekrece PTH z důvodů vrozených anebo získaných. Mezi získané příčiny primární hypoparatyreózy patří na prvním místě poškození příštítných tělísek v souvislosti s operacemi na štítné žláze, dále poškození příštítných tělísek autoimunitním procesem, jejich zničení radiací či ukládáním toxických látek v rámci metabolických střádavých chorob, vzácné jsou vrozené formy postihující jen vývoj příštítných tělísek (kongenitální AR, AD či X-vázaná hypoparathyreóza) nebo i vývoj dalších orgánů (DiGeorgeův syndrom = aplázie příštítných tělísek + aplázie thymu + vrozené vývojové vady srdce a velkých tepen).
- pseudohypoparathyreóza, kdy chybí účinek PTH i přes jeho dostatečnou, nebo dokonce zvýšenou tvorbu, protože cílové tkáně jsou na PTH rezistentní.
Zvýšené renální ztráty = hyperkalciurie. Příčinou mohou být vrozené nebo získané poruchy tubulů. Patří sem například Fanconiho syndrom, kdy je vrozené postižení funkce proximálního tubulu, nebo Bartterův syndrom s poškozením funkce Henleovy kličky. Z toxických příčin jmenujme poškození tubulů těžkými kovy anebo některými nefrotoxickými léky. Příčinou hyperkalciurie také může být léčba kličkovými diuretiky anebo ischemické poškození.
Rychlý přesun iontů vápníku mimo plazmu. Příkladem je hypokalcémie při syndromu hladové kosti po odstranění hyperfunkčního adenomu příštítných tělísek. Tento biologicky benigní nádor po dobu své existence vedl k dlouhotrvající hyperkalcémii, která utlumila nepostižený zdravý parenchym příštítných tělísek. Po odstranění adenomu vzniká hypokalcémie z nedostatečné sekrece PTH potencovaná zvýšeným vychytáváním iontů kalcia kostmi po odstranění tumoru. Hyperfosfatémie vede k precipitaci kalciumfosfátu a jeho přesunu do tkání. Typologicky jiný přesun představuje hypokalcémie ze zvýšené sekvestrace vápenatých iontů při akutní hemoragicko-nekrotické formě pankreatitidy, kdy lipázy uvolněné z poškozené slinivky štěpí tukovou tkáň v okolí slinivky a uvolněné mastné kyseliny reagují s ionty vápníku za vzniku nerozpustných vápenatých mýdel.
Rychlý pokles ionizované frakce vápníku při nezměněné celkové kalcémii. Učebnicovým příkladem je metabolická nebo respirační alkalóza, kdy vlivem vzestupu pH plazmy dochází k uvolňování H+ iontů z karboxylových (-COOH → -COO- + H+), aminových (-NH3+ → -NH2 + H+), fosforečných aj. skupin plazmatických bílkovin a na jejich místo se vážou volné kationty Ca2+. Volná frakce iontů vápníku klesá na úkor frakce vázané na bílkoviny. Podobná situace může nastat při masívních transfúzích krve konzervované citráty, kdy volná frakce iontů vápníku klesá na úkor vzestupu frakce vázané v komplexech s anionty citrátu.
Deficit iontů hořčíku. Nedostatek iontů hořčíku snižuje mobilizaci iontů vápníku z kostí. Ionty vápníku nahrazují ionty magnézia, které se z kostí uvolňují, aby doplnily hladinu Mg2+ v plazmě a v ostatních orgánech. Jinými slovy klesá odpověď kostí na účinek PTH. Druhým důvodem hypokalcémie provázející deficit iontů hořčíku je změna sekrece parathormonu. Akutní hypomagnezémie sice zvyšuje sekreci PTH, ale chronický deficit Mg2+ sekreci PTH snižuje. Jde o tzv. sekundární funkční hypoparatyreoidismus, kdy sekrece PTH je nepřiměřeně nízká ve vztahu k hladině plazmatického kalcia.
Hypoalbuminémie vede ke snížení celkové kalcémie, protože klesá vázaná frakce. Hladina ionizovaného kalcia se ale nemění, a postižení jsou proto bez klinických projevů tetanie. Příčinou hypoalbuminémie může být jaterní selhání, nefrotický syndrom, kwashiorkor nebo exsudativní enteropatie.
Tetanický hypokalcemický syndrom
Představuje hlavní a potenciálně život ohrožující následek hypokalcémie. Může ovšem vzniknout i při normokalcémii (viz např. alkalóza, téma Acidobazická rovnováha a její poruchy). Podstata tetanie spočívá ve zvýšené nervosvalové dráždivosti následkem hypokalcémie (snížena je koncentrace vápenatých iontů v celém extracelulárním prostoru). Zvýšená nervosvalová dráždivost je vysvětlitelná posunem prahového potenciálu do více negativních hodnot. To se projeví ve fázi, kdy se otvírají rychlé natriové kanály odpovědné za depolarizaci. Posun prahového potenciálu do více negativních hodnot zmenší potenciálový rozdíl mezi normálním hluboce negativním klidovým membránovým potenciálem a prahovým potenciálem, jehož překonání je nutné pro vyvolání akčního potenciálu. Přicházející podnět pak potřebuje k vyvolání akčního potenciálu menší intenzitu (normálně podprahovou). Výsledkem je hyperexcitabilita nervových a svalových buněk, jejímž klinickým odrazem je vznik tetanických křečí.
V závislosti na tíži hypokalcémie může být přítomna jen zvýšená pohotovost ke vzniku křečí za určitých provokačních momentů (mechanické dráždění, ischémie, elektrická stimulace). Pak hovoříme o LATENTNÍ TETANII, k jejím známkám patří:
Chvostkův příznak. Při klepnutí do oblasti průběhu n. facilais před ušním boltcem dojde ke stažení ústního koutku, nosního křídla a očního koutku.
Lustův příznak. Poklepem na průběh n. peroneus pod hlavičkou fibuly dojde k dorzoflexi a abdukci nohy.
Trousseaův příznak. Spočívá ve vyvolání karpálního spasmu při stažení paže manžetou tonometru na úroveň systolického tlaku po dobu asi 3 minut.
Erbův příznak. Dráždění periferního nervu stejnosměrným proudem vede ke vzniku tetanického stahu příslušné svalové skupiny již při malé intenzitě (pod 5 mA) tohoto proudu.
Jindy dochází ke vzniku křečí spontánně. Pak jde o MANIFESTNÍ TETANII.
K vyvolání tetanického záchvatu inklinují všechny situace, které jsou spojeny s hyperventilací a respirační alkalózou jako například fyzický či emoční stres, protože při alkalóze plazmatické bílkoviny uvolňují H+ ionty a vyvazují Ca2+, čímž dochází ke snížení hladiny ionizované frakce vápníku.
Mezi první (prodromální) příznaky patří parestézie prstů, rtů, jazyka, které jsou projevem zvýšené excitability periferních senzitivních nervů. Dále mohou být pozorovány fascikulace (drobné jemné záškuby svalových snopců). Postižený si stěžuje na pocit tuhnutí anebo napínání svalů.
Pokud vezmeme v úvahu kosterní svalovinu, pak vlastní tetanický záchvat nejčastěji probíhá ve ve formě karpopedálních spasmů. Zápěstí horní končetiny je ve flexi, palec ruky je addukován do dlaně, postavení je přirovnáváno k tzv. porodnické ruce. Křeč se může šířit proximálně a vyvolat flexi v lokti a addukcí v rameni. Na dolních končetinách jde noha do plantární flexe, koleno je v extenzi. Tetanické stahy jsou značně bolestivé. Při těžší hypokalcémii dochází k jejich generalizaci. Obvykle začínají na akrech a směřují proximálně, jsou bolestivé, na rozdíl od epileptických záchvatů pacient zůstává při plném vědomí! Nejnebezpečnější je postižení svalů hrtanu a svalů dýchacích, postižený jedinec má inspirační stridor, dusí se, bývá patrná cyanóza. Laryngospasmus a spasmus respiračních svalů může vést k fatálnímu konci.
Zvýšenou excitabilitu vykazuje i hladká svalovina. To se může projevit bronchospasmy s expiračním stridorem, dysfágií pro spasmus jícnového svěrače, křečemi v břiše pro stahy hladké svaloviny střev, žlučníkovou kolikou atp. Hypokalcémie logicky ovlivňuje i elektrické děje na myokardu. Na EKG nacházíme prodloužení ST úseku, a tím i QT intervalu, které je dáno prodloužením fáze plateau akčního potenciálu na komorách. Pravděpodobné vysvětlení lze zřejmě odvodit ze skutečnosti, že při hypokalcémii je chemický gradient pro vstup Ca2+ menší, a proto je doba, po kterou jsou otevřeny kalciové kanály, kterými Ca2+ proudí do kardiomyocytů, prodloužena. Nedostatek vápenatých iontů uvnitř pracovního myokardu pak snižuje jeho inotropii, což může vést k poruše kontraktility srdce a ve finále k srdečnímu selhání.
Hyperkalcémie
Příčiny hyperkalcemie
Zvýšený přívod iontů vápníku per os. Může se vyskytnout u pacientů léčených například pro osteoporózu, kteří ve snaze „urychlit“ svou terapii, záměrně překračují doporučené dávkování tablet s obsahem kalcia. Snad do historie už patří tzv. milk-alkali syndrom, kdy jedinou dostupnou farmakologickou léčbou vředové choroby byl přívod alkalických antacid a mléka; v tomto případě hyperkalcémii mimo vlastního vysokého přívodu Ca2+ zvyšovala i alkalóza, protože ta stimuluje tubulární reabsorpci iontů vápníku.
Zvýšené vstřebávání iontů vápníku z GIT. Typickým příkladem je předávkování (intoxikace) vitamínem D, které někdy postihne malé kojence, jejichž „pečlivé matky“ v dobrém úmyslu zvýší dávkování kapek preparátu Infadin nebo Vigantol používaných v prevenci křivice. V minulosti bývaly v této souvislosti pozorovány intoxikace při preventivním podávání depotních preparátů vitamínu D u malých dětí. Zajímavou příčinou hyperkalcémie je zvýšená endogenní tvorba kalcitriolu u granulomatozních chorob, jako je sarkoidóza, TBC a Wegenerova granulomatóza. U Addisonovy choroby (primární hypokorticismus) je příčinou chybějící efekt kortikoidů, které jsou antagonisty vitamínu D, a resorpce kalcia z GIT je proto zvýšená. Vzácnou odchylkou (1 : 7.500 - 1 : 20.000 živě narozených) je tzv. Williamsův syndrom způsobený delecí na dlouhém raménku 7. chromozomu. Jedním z jeho projevů je hyperkalcémie ze zvýšené resorpce Ca2+ ve střevě. Klinicky se manifestuje v kojeneckém věku, ale v dalším věku se zpravidla upravuje. K nápadným rysům takto postižených dětí patří elfí tvář (špičaté uši, malý nos, široká ústa s plnými rty), je přítomna lehká až středně těžká mentální retardace a častější výskyt vrozených srdečních vad (stenóza aorty nad chlopní, stenóza plicnice).
Zvýšená osteoresorpce vedoucí ke zvýšenému vyplavování iontů vápníku z kostí je nejčastějším mechanismem vzniku hyperkalcémií.
Její příčinou může být primární hyperparatyreóza, kdy podkladem zvýšené sekrece PTH je autonomní adenom jednoho z příštítných tělísek, méně často hyperplázie všech příštítných tělísek. Je buď primární-idiopatická, nebo někdy vzniká druhotně při dlouhodobě trvajícím stimulu k sekreci PTH (např. u hyperfosfatémie při renálním selhání) a přetrvává i po odstranění příčiny (transplantace ledviny) - pak hovoříme o tzv. terciární hyperparatyreóze (podrobněji viz téma Parathormon a poruchy jeho sekrece a účinku).
Vystupňovaný kostní obrat se sklonem k hyperkalcémii vídáme i u některých dalších endokrinopatií, jako je hypertyreóza (hyperfunkce štítné žlázy) anebo akromegalie (zvýšená tvorba růstového hormonu po ukončení růstu).
Závažnou diagnózu představuje paraneoplastická hyperkalcémie provázející nádorová onemocnění. Jedná se zejména o dlaždicobuněčný karcinom plic, karcinom prsu, děložního čípku nebo prostaty a obvykle je projevem již pokročilého nádorového procesu. Příčinou hyperkalcémie je zde parathormonu podobný peptid (PTHrP), který na systémové úrovni napodobuje účinek PTH. Jako lokální faktor produkovaný kostními metastázami současně stimuluje aktivitu osteoklastů a kostní resorpci, což zvyšuje kalcémii a vede ke vzniku osteolytického ložiska v okolí metastáz. Osteolýza je navíc doprovázena uvolňováním tkáňového růstového faktoru β (TGFβ), který zpětnovazebně zvyšuje expresi genu pro PTHrP v nádorových buňkách.
Imobilizační hyperkalcémie. Déletrvající imobilizace vede k převaze osteoresorpce nad novotvorbou kosti a negativní bilanci kalcia, ale ne vždy vyústí v hyperkalcémii. Zvýšená plazmatická koncentrace iontů vápníku ohrožuje zejména imobilizované děti v období růstu anebo pacienty s frakturou při Pagetově chorobě (metabolická osteopatie s ložiskově vystupňovanou kostní remodelací).
Metabolická acidóza, pokud trvá déle, je provázena demineralizací kostí. Zvyšuje se především ionizovaná frakce plazmatického kalcia, protože acidóza je pufrována plazmatickými bílkovinami, které vychytávají ionty H+ za současného uvolňování Ca2+ (téma Acidobazická rovnováha a její poruchy a téma Patofyziologie a klinické aspekty chronických onemocnění a selhání ledvin).
Zvýšená zpětná resorpce anebo snížená exkrece iontů vápníku v ledvinách může být způsobena zvýšenou hladinou parathormonu při hyperparatyreóze. Z léků vedou k hypokalciurii thiazidová diuretika (vysvětlení viz výše v odstavci o vylučování iontů vápníku ledvinami). Renální exkrece iontů vápníku je snížena obecně u všech stavů spojených s hypovolémií a sníženou glomerulární filtrací, kdy je vznik hyperkalcémie potencován i současnou hemokoncentrací. Snížené odpady iontů vápníku močí nacházíme také u jedinců s familiární benigní hypokalciurickou hyperkalcémií (FBHH). Postižení jedinci jsou heterozygotní nositelé inaktivační mutace v genu pro CaSR (výše už zmíněný calcium sensing receptor) s autozomálně dominantním typem dědičnosti. Funkčním následkem je snížená citlivost příštítných tělísek na výši kalcémie, takže k útlumu sekrece parathormonu dochází až při vyšších hladinách plazmatické koncentrace iontů vápníku, což znamená, že normální hladiny iontů kalcia jsou příštítnými tělísky vnímány jako nízké (téma Parathormon a poruchy jeho sekrece a účinku). Nositelé jsou v naprosté většině případů asymptomatičtí a k podrobnějšímu diagnostickému pátrání vede až náhodný nález mírné hyperkalcémie, která je provázena hypokalciurií a hladinou PTH při horní hranici normy, která není v souladu s aktuální kalcémií.
Hyperproteinémie vede k vzestupu vázané frakce plazmatického kalcia bez větší změny frakce ionizované. Mezi její hlavní příčiny patří nádorová onemocnění, jako je mnohočetný myelom, Waldenströmova makroglobulinémie apod.
Hyperkalcemický syndrom
Je souborem příznaků, jejichž podkladem je patologicky zvýšená hladina plazmatického vápníku. Pacient současně může mít příznaky onemocnění, které hyperkalcémii způsobilo. Spektrum a míra potíží závisí především na tíži hyperkalcémie. Postiženy jsou především vzrušivé tkáně (nervový systém, srdce, svaly) a ledviny.
Lehká hyperkalcémie (P-Ca 2,75 – 3,0 mmol/l) je obvykle bez klinických projevů, tedy asymptomatická.
NEUROMUSKULÁRNÍ PROJEVY. Jedním z hlavních následků hyperkalcémie je snížení nervosvalové dráždivosti. To je vysvětlitelné posunem prahového potenciálu, při němž se otvírají rychlé natriové kanály odpovědné za depolarizaci, do méně negativních hodnot, tzn. blíže k nule. Tím dochází ke zvětšení potenciálového rozdílu mezi hlubokým klidovým membránovým potenciálem a potenciálem prahovým. Přicházející podnět pak musí mít nadprahovou intenzitu, aby došlo k otevření napěťově řízených natriových kanálů, které odpovídají za zahájení depolarizace a akčního potenciálu. Klinickým korelátem snížené nervosvalové dráždivosti je svalová slabost, zvýšená unavitelnost svalů, snížené svalové napětí. Projevem snížené hypoexcitability hladkého svalstva může být úporná zácpa.
KARDIÁLNÍ PROJEVY. Hyperkalcémie narušuje srdeční rytmus, což se může projevit bradykardií. Ta je vysvětlitelná snížením nervosvalové dráždivosti s posunem prahového potenciálu blíže směrem k nule, což zvětší potenciálový rozdíl mezi maximálním diastolickým potenciálem a tímto prahovým potenciálem. Následkem je prodloužení doby nutné k překonání tohoto rozdílu, a tedy zpomalení spontánní rytmické diastolické depolarizace v SA uzlu. Na EKG nacházíme zkrácení QT intervalu. Je dáno zkrácením fáze plateau akčního potenciálu na komorách. Kalciové kanály, kterými kationty Ca2+ proudí během fáze plateau do srdečních buněk, se totiž uzavírají poté, co je dosaženo určité intracelulární koncentrace iontů vápníku. Při hyperkalcémii je chemický gradient pro vstup Ca2+ větší, a tak je uzavírací koncentrace vápenatých iontů v kardiomyocytech dosaženo dříve - QT, popř. ST úsek se tedy zkracuje. V souladu s tím se při zhoršení hyperkalcémie se objevují i blokády převodu různého stupně.
NEUROPSYCHICKÉ PROJEVY. Pacienti si stěžují na slabost, bolesti hlavy, jsou apatičtí, mají deprese, poruchy spánku, dále se mohou objevit halucinace, paranoidní pocity, stavy dezorientace.
RENÁLNÍ PROJEVY. Mezi poruchy funkce ledvin způsobené hyperkalcémií především patří snížená koncentrační schopnost ledvin, která je dána
- (a) osmotickou zátěží z hyperkalciurie a hyperfosfaturie,
- (b) sníženou resorpcí iontů sodíku z proximálního tubulu přímým vlivem zvýšené hladiny PTH, a
- (c) sníženou účinností ADH (aktivace výše už zmíněného CaSR ve sběracích kanálcích snižuje intracelulární koncentraci cAMP, který je zároveň 2. poslem ADH).
Klinickým projevem snížené koncentrační schopnosti ledvin je polyurie a z ní plynoucí polydipsie s rizikem rozvoje dehydratace. Morfologicky jsou ledviny postiženy vznikem nefrokalcinózy a nefrolitiázy. Nefrokalcinóza je zvýšené ukládání solí vápníku do parenchymu ledvin, jejím funkčním následkem je pokles renálních funkcí, glomerulární filtrace, který může skončit až selháním ledvin. Nefrolitiáza je charakterizována tvorbu a přítomností ledvinných kamenů ve vývodném systému ledvin, které se mohou klinicky manifestovat renálními kolikami (téma Urolitiáza).
GIT PROJEVY. K nespecifickým projevům hyperkalémie patří nechutenství, nauzea, zvracení. K dalším postižením v rámci zažívací soustavy patří vředová choroba žaludku a duodena. Patofyziologickým vysvětlením je zvýšená sekrece HCl a gastrinu cestou aktivace CaSR hyperkalcémií. Pacienti s déle trvající hyperkalcémií mají častější výskyt akutní a chronické pankreatitidy, především biliární etiologie, protože k precipitaci solí vápníku nedochází jen v ledvinách, ale i ve žluči. Samotná cholelithiáza se může manifestovat biliární kolikou.
Použitá literatura a literatura k dalšímu studiu
- BERNE RB, LEVY MN, KOEPPEN BM, STANTON BA. Physiology, 5th edition, Mosby 2004, pp. 694 – 698
-
BRUNA J., BRUNOVÁ J. Klinická endokrinologie, 1. vydání. Maxdorf, 2009, str. 109 – 147
-
HULÍN I. et al., Patofyziológia, 7. vydání. Bratislava SAP 2009, str. 235 – 243
-
JABOR a kol. Vnitřní prostředí. 1. vydání, Grada 2008, str. 72 – 84
-
McCANCE KL, HUETHER SE, BRASHERS VL, ROTE NS. Pathophysiology: the biological basis for disease in adults and children, 6th edition, Mosby Elsevier 2010, pp. 111 – 113
-
MUNDY GR, EDWARDS JR. PTH-related peptide in hypercalcemia. J Am Coc Nephrol, 2008, 19: 672-675
-
SILBERNAGL S., DESPOPOULOS A. Atlas fyziologie člověka, 2. vydání. Grada, 1993, str. 254 – 257
-
SLÁMA O. Hyperkalcemie u maligních onemocnění. Paliativna medicín a liečba bolesti, 2009, 2(2): 84-85
-
STÁRKA L., ZAMRAZIL V. Základy klinické endokrinologie, 2. vydání. Maxdorf, 2005, str. 109 – 147
-
ŠAŠINKA M., ŠAGÁT T. a spol. Pediatria, I a II. zväzok, Satus, 1998, str.343 – 345, 885 – 893