autor: MUDr. Ondřej Veselý, Ústav patologické fyziologie LF UP Olomouc, Dětská endokrinologická ambulance Svitavské nemocnice a.s.
Mikrocirkulace
Z anatomického úhlu pohledu je mikrocirkulace úsek krevního řečiště, který zahrnuje mikrocévy (cévy s průměrem menším než 150 µm) - malé tepénky, kapiláry a malé žilky (téma Hemodynamika). Po stránce funkční představuje mikrocirkulace tu část oběhu, která:
- Uspokojuje metabolické nároky jednotlivých tkání a orgánů;
- Pomáhá udržovat dostatečný perfuzní tlak v celé cirkulaci.
Metabolickými nároky míníme požadavky tkání na dodávku živin a odvod zplodin. Tyto požadavky tkání se mění v závislosti na jejich aktuální aktivitě anebo vytížení. Mikrocirkulace se měnícím metabolickým potřebám pružně přizpůsobuje změnou perfúze dané tkáně. Změna perfúze je akutně uskutečňována pomocí změny průsvitu arteriol. Průsvit arteriol se mění vlivem změny lokálních podmínek, především změnami pO2, pCO2, pH. Při snížení pO2, zvýšení pCO2 anebo snížení pH dochází k arteriolodilataci, zvýšení perfúze, a tím zvýšenému přísunu O2 a zvýšenému odsunu CO2 a H+ ze tkáně. Tím dojde k úpravě lokálních podmínek. Při zvýšení pO2, snížení pCO2 anebo zvýšení pH dochází k opačné změně, tedy k arteriolokonstrikci. Mluvíme o lokální autoregulaci perfúze, tj. o schopnosti orgánů přizpůsobovat si prokrvení dle vlastních potřeb (téma Hemodynamika). Stupeň autoregulace je v různých orgánech vyvinut různě . Mezi orgány schopné udržet si konstantní perfúzi i přes značné výkyvy středního systémového arteriálního tlaku patří mozek, srdce a ledviny.
Kapiláry jsou vlastním místem výměny živin a zplodin. Kapilární síť představuje ohromnou výměnnou plochu o rozloze asi 500 – 1000 m2. Stěna kapilár je velmi tenká, tvořená pouze jednou vrstvou buněk – endotelem nasedlým na bazální membránu. Navíc je kapilární stěna fenestrována velkými póry (6 – 8 nm). To vše usnadňuje snadnou a rychlou výměnu mezi krví a intersticiem. Opět existují značné orgánové rozdíly co do hustoty kapilární sítě, počtu a velikosti pórů.
Výměna tekutiny mezi krví a intersticiem
Kapilární membrána představuje hranici mezi intravaskulárním a intersticiálním oddílem tělesných tekutin. Právě na této hranici dochází k výměně mezi krevní plazmou a tkáňovým mokem. Kapilární membrána je vysoce propustná, a proto krevní plazma a tkáňový mok mají velmi podobné složení, a to až na množství bílkovin. Krevní plazma obsahuje vysoké množství bílkovin, kdežto tkáňový mok jen malé množství bílkovin. Příčinou rozdílu je nízká propustnost kapilární membrány pro molekuly bílkovin. Ionty a molekuly se dle své biochemické povahy mohou přes kapiláru dostávat cestou pórů (ionty, glukóza, v omezené míře albumin), cestou transcelulární přes endotelové buňky (liposolubilní látky, urea, krevní plyny) anebo využívají obě cesty (voda).
Výměna látek v kapilárách probíhá dvěma mechanismy:
- Difúze je přesun látek po koncentračním gradientu. Látka se přesunuje z prostoru, kde má vyšší koncentraci, do prostoru, kde má nižší koncentraci. Difúze probíhá po celé délce kapiláry, a to oběma směry, tedy z kapiláry do intersticia a naopak z intersticia do kapiláry. Díky tomu dochází k „promíchávání“ plazmy a intersticiální tekutiny a k vyrovnávání rozdílů nutrientů, dýchacích plynů a metabolitů v rámci extracelulárního prostoru. Po kvantitatvní stránce se díky difúzi přesunuje velký objem látek, ale pro vlastní tvorbu tkáňového moku je rozhodující druhý mechanismus.
- Filtrace/Resorpce je proces, jehož výsledkem je vznik tkáňového moku a jehož hybateli jsou Starlingovy kapilární síly. Směr toku tekutiny mezi intravaskulárním a intersticiálním prostorem je pak určen poměrem těchto sil, přičemž na arteriálním konci tekutina vystupuje z kapiláry ven do intersticia, kdežto na venózním konci se vrací zpět do kapiláry.
Starlingovy kapilární síly
Starlingovy kapilární síly představují hnací sílu filtrace anebo resorpce. Tyto síly jsou celkem čtyři:
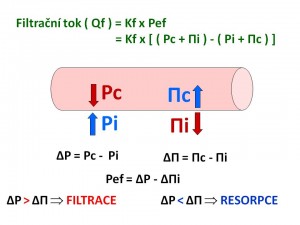
- Hydrostatický tlak v kapiláře (Pc), který tekutinu žene z kapiláry do intersticia - podporuje filtraci a brání resorpci. Jeho hladina se v průběhu kapiláry snižuje. Vyjádřeno čísly, dosahuje na arteriálním konci kapilár systémového oběhu hodnot mezi 30 – 35 mm Hg, kdežto na venózním konci kapiláry klesá na 10 – 15 mm Hg. Podstatný vliv na výši kapilárního hydrostatického tlaku mají:
- Arterioly a prekapilární sfinktery (jejich napětí). Při arteriolokonstrikci dochází ke snížení tlaku v kapiláře, naopak při arteriolodilataci se hydrostatický kapilární tlak zvyšuje.
- Střední arteriální tlak. Při jeho zvýšení roste tlak v kapilárách, kdežto při jeho snížení kapilární tlak klesá.
- Žilní tlak, resp. odpor v žilní cirkulaci. Při jeho nárůstu hydrostatický tlak v kapiláře stoupá a naopak.
- Hydrostatický tlak v intersticiu (Pi), který tekutinu tlačí z intersticia do kapiláry. Podporuje resorpci a brání filtraci. Jeho hodnota se fyziologicky pohybuje okolo 0 mm Hg, a to proto, že většina profiltrované tekutiny se opět vrací do kapiláry a zbytek je odveden lymfatickým systémem.
- Onkotický tlak v kapiláře (Πc), který tekutinu drží v kapiláře, tedy brání filtraci a podporuje resorpci. Tento tlak je určen množstvím plazmatických bílkovin, z nichž rozhodující podíl má albumin (80 % Πc). Onkotický tlak je vlastně osmotický tlak. Plazmatické proteiny se sice na celkovém osmotickém tlaku plazmy podílí jen asi 0,5 %, ale na rozdíl od iontů, které určují celkový osmotický tlak plazmy, nemohou bílkoviny volně prostupovat skrze stěnu kapiláry, a proto spolurozhodují o výměně tekutiny na kapiláře. Hodnota onkotického tlaku je na arteriálním i venózním konci téměř stejná a je okolo 25 mm Hg (přesněji řečeno, lehounce stoupá, asi o 1 mm Hg, a to relativním zakoncentrováním bílkovin po přesunu vody, která následuje ionty do intersticia).
- Onkotický tlak v intersticiu (Πi), který tekutinu drží v intersticiu. Podporuje filtraci a brání resorpci. Je dán množstvím bílkovin v intersticiu. Jelikož 90 – 100 % plazmatických bílkovin zůstává v kapilárách a ty bílkoviny, které do intersticia přece jen proniknou, jsou průběžně odváděny lymfou, je celkové množství bílkovin v intersticiu minimální. Proto je i onkotický tlak v intersticiu nízký - do 5 mm Hg.
Filtrační tok a rovnice kapilární rovnováhy
Tok tekutiny přes kapilární membránu a závisí na dvou faktorech:
- Efektivním filtračním tlaku (Pef), což je rozdíl mezi těmi Starlingovými silami, které filtraci podporují, tedy hydrostatickým tlakem v kapiláře a onkotickým tlakem bílkovin v intersticiu na straně jedné, a těmi Starlingovými silami, které naopak filtraci brání, tedy hydrostatickým tlakem v intersticiu a onkotickým tlakem plazmatických bílkovin na straně druhé.
- Kapilárním filtračním koeficientu (Kf), který je určen permeabilitou a velikostí plochy kapilár v dané tkáni. Kf je za fyziologických okolností v dané tkání konstatní, ale mezi jednotlivými tkáněmi a orgány existují velké rozdíly, které mohou být i více jak stonásobné. V dalších podkapitolách pak uvidíme, že permeabilita kapilár se může měnit, resp. zvyšovat, vlivem řady patologických příčin.
Velikost Pef a Kef pak určuje tzv. filtrační tok (Qf). Matematicky vyjádřeno:
- Qf = Kf x Pef = Kf x [(Pc + Πi) - (Pi + Πc)]
Po dosazení výše uvedených hodnot jednotlivých Starlingových sil je zřejmé, že na arteriálním konci kapiláry převažují síly podporující filtraci, kdežto na venózním konci převažují síly filtraci bránící, a tudíž dochází k resorpci.
Vzorec pro výpočet filtračního toku lze číst i z jiného úhlu pohledu:
- Qf = Kf x [(Pc - Pi) - (Πc - Πi)].
Z tohoto zápisu vidíme, že na arteriálním konci kapiláry převažuje gradient tlaků hydrostatických nad gradientem tlaků onkotických, a proto tekutina směřuje z kapiláry do intersticia, a na venózním konci naopak převažuje gradient tlaků onkotických nad gradientem tlaků hydrostatických, a proto tekutina směřuje zpět z intersticia do kapilár.
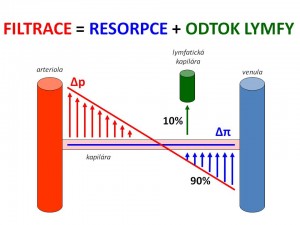
Po dosazení velikostí jednotlivých tlaků do výše uvedeného vzorce je zřetelný i další fakt, a to, že rozdíl ve Starlingových silách je na arteriálním konci větší (10 – 15 mmHg) než na konci venózním (5 – 10 mm Hg). Tento rozdíl je příčinou mírné převahy filtrace nad resorpcí. I za fyziologických okolností se resorpcí zpět vrací pouze 90 % filtrátu a zbývajících 10 % odvádí lymfatický systém. Denně se vytvoří asi 20 l tkáňového moku, a to znamená, že celé 2 l tkáňového moku se vrací do oběhu lymfou.
Na základě výše uvedených poznatků můžeme formulovat základní rovnici kapilární rovnováhy:
- FILTRACE = RESORPCE + ODTOK LYMFY.
Definice a dělení otoků
Otok neboli edém vzniká nahromaděním tekutiny ve tkáni.
Otoky lze dělit dle různých hledisek, například na lokalizované (oteklá končetina, obličej či jiná část těla) a generalizované (až anasarka, kdy jde o prosáknutí celého těla).
Jiné dělítko je podle úlohy ledvin. Podle tohoto hlediska rozlišujeme primární otoky, při nichž jsou ledviny příčinou vzniku otoku, protože nejsou schopny vyloučit dostatek vody a soli, a tak dochází k „přelití či přeplnění“ organismu vodou, a otoky sekundární, kdy jsou ledviny v pořádku, ale tekutina uniká z oběhu do intersticia anebo do třetích prostorů, což vede ke kompenzační odpovědi ledvin spočívající v následné retenci soli a vody a „doplňování“ chybějící intravaskulární tekutiny, ale celkové množství tělesné vody je v součtu zvýšeno.
Celková tělesná voda má dva oddíly, buněčný (ICT) a mimobuněčný (ECT). Z tohoto úhlu pohledu pak otoky dělíme na intracelulární a extracelulární otoky:
Patogeneze intracelulárníchj otoků
Intracelulární edémy jsou charakterizovány zvětšováním objemu buněk. Patogeneticky můžeme vystopovat následující obecné příčiny otoku buněk:
- Hypotonicitu extracelulárního prostoru s následným přestupem vody po osmotickém gradientu do buňky, jejíž cytoplazma je ve srovnámí s okolním mezibuněčným prostorem relativně hyperosmolární. Takový pohyb vody vídáme při hyponatremických stavech anebo při neadekvátně rychlé léčbě hyperosmolárních stavů.
- Depleci intracelulárních zásob ATP jako následek útlumu anebo zablokování energetického metabolismu buňky. Vzniká při hypoxii/ischémii, hypoglykémii atp. Následně vázne činnost membránové Na+/K+-ATPázy a hromadění iontů sodíku, a tím i vody, v buňkách.
- Zvýšení permeability buněčné membrány, např. v rámci zánětu vlivem proinflamatorních cytokininů.
Patogeneze extracelulárních otoků
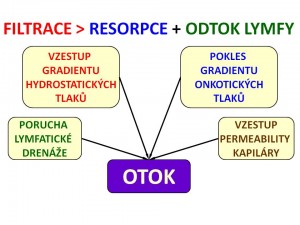
Extracelulární edémy vznikají při hromadění tekutiny v intersticiu anebo ve třetích prostorech, jako je dutina hrudní nebo břišní. Základním předpokladem pro vznik otoku je takové porušení rovnice kapilární rovnováhy, kdy filtrace převáží nad resorpcí a odtokem lymfy:
- FILTRACE > RESORPCE + ODTOK LYMFY
Patofyziologicky se v genezi mimobuněčných otoků uplatňují čtyři základní mechanismy:
- Vzestup rozdílu (gradientu) kapilárních hydrostatických tlaků.
- Pokles rozdílu (gradientu) onkotických tlaků bílkovin.
- Vzestup permeability stěny kapilár.
- Porucha lymfatické drenáže.
Vzestup rozdílu kapilárních hydrostatických tlaků
Zvýšení hydrostatického tlaku (Pc) v kapilárách. Pokud vyjdeme z výše uvedených faktorů určujících hydrostatický tlak v kapilárách, potom můžeme příčiny jeho zvýšení rozdělit na tři skupiny:
- Pokles odporu arteriol – arteriolodilatace – vlivem vazodilatačně působích léků, nebo v horkém prostředí, při insuficienci sympatiku atd.;
- Zvýšená retence tekutin ledvinami provázená vzestupem cirkulačního plnicího tlaku a následně arteriálního tlaku při akutním anebo chronickém renálním selhání, při primárním hyperaldosteronismu anebo pseudohyperaldosteronismu apod.;
- Zvýšení žilního tlaku při selhání srdce, kdy dochází k městnání krve před selhávající komorou, nebo obstrukce žil při flebotrombóze anebo zvnějšku nádorem. Dále ke zvýšení venózního tlaku vede také insuficience žilní systému při selhání svalové pumpy v rámci delší imobilizace, obrny svalů, nedomykavost chlopní v žilách u varixů dolních končetin.
Snížení hydrostatického tlaku (Pi) v intersticiu. Ke snížení hydrostatického tlaku v intersticiu může dojít vystavením tkání nižšímu atmosférickému tlaku - ať už v lokálním anebo celkovém rozsahu. Setkáváme se s ním v denním životě, při haváriích (porušení kabiny letadla, dekomprese) anebo při některých léčebných praktikách (přikládání teplých baněk na kůži). Zvláštním případem je nemožnost splasknutí nevzdušné plíce po její fixaci v hrudní dutině pleurálními srůsty – takový stav vede k absorpci plynu a k hromadění tekutiny v plicní tkáni.
Pokles rozdílu onkotických tlaků bílkovin
Snížení onkotického tlaku Πc v kapiláře. Snížení koncentrace proteinů v krevní plazmě může mít v zásadě čtyři příčiny:
- Nedostatečný příjem bílkovin ve stravě, jak je tomu u proteinoenergetické malnutrice (téma Patofyziologie podvýživy, hladovění a poruch příjmu potravy, téma Klinický obraz podvýživy).
- Sníženou proteosyntézu v játrech v rámci různých hepatopatií (téma Patofyziologie poškození a selhání jater).
- Zvýšenou spotřebu bílkovin při stavech spojených se stresem a stresovým hladověním. Příklady jsou sepse, polytraumata, šokové stavy, multiorgánová selhání, nádory anebo jiné těžké choroby s vystupňovaným katabolismem, proteolýzou a abnormální syntézou proteinů účastnících se zánětlivé odpovědi (téma Klinická fyziologie stresového hladovění, vztah s MODS, SIRS).
- Ztráty bílkovin z organismu, které jsou možné:
- Gastrointestinálním traktem při exsudativních enteropatiích. Příkladem je morbus Gordon, což je kongenitální intestinální lymfangiektázie, kdy pro poruchu odtoku lymfy dochází k prosakování bílkovin do střeva (téma Fyziologie a patofyziologie trávení a vstřebávání, téma Malabsorpční syndrom).
- Ztráty kůží při popáleninách anebo při rozsáhlejších mokvavých kožních chorobách.
- Ztráty ledvinami při nefrotickém syndromu, mezi jehož diagnostická kritéria patří právě hypoalbuminémie a otoky následkem vysoké proteinurie (téma Patofyziologie a klinické aspekty akutního poškození a selhání ledvin, téma Chronická ledvinová nedostatečnost a terminální stádia onemocnění ledvin, téma Manifestace, diagnóza a terapie poruch ledvin, kazuistika Nefrotický syndrom).
Zvýšení onkotického tlaku (Πi) v intersticiu. Ke zvýšení koncentrace proteinů v intersticiu, a tím i intersticiálního onkotického tlaku podporujícího přesun tekutiny do extrakapilárního prostoru, typicky dochází při destrukci anebo rozpadu tkání (úrazem – vzpomeňte na svou poslední bouli na čele, při ichémii, při zánětu, toxickými vlivy apod.). Další okolnosti jsou zmíněny níže.
Vzestup kapilární permeability
Typicky provází infekční i neinfekční záněty. Příčinou zvýšené propustnosti jsou prozánětlivé cytokiny jako IL-6, TNF-α, serotonin atd. U alergických reakcí zprostředkovaných protilátkami IgE dochází ke zvýšení propustnosti vyplavením histaminu a bradykininu z žírných buněk. K poškození kapilár, a tím zvýšení jejich permeability, vede i prolongovaná ischémie, popáleniny nebo některé hadí toxiny. Zvýšená propustnost pak vede k úniku plazmatických bílkovin do intesticia se zvýšením onkotického tlaku v tomto prostoru a – jak bylo uvedeno v předchozím odstavci – k narušení zpětné resorpce intersticiální tekutiny zpět do kapilár.
Porucha lymfatické drenáže
Vede k hromadění tekutiny s vysokým obsahem bílkovin. Vzniká lymfatický otok neboli lymfedém, který je klinicky bledý, nebolestivý, zprvu měkký, později vlivem fibrózy podkoží tuhý a provázený sekundárními změnami na kůži (hyperkeratóza, puchýře, vřed). Rizikem jsou infekční komplikace, jako je erysipel, nebo i nádorové bujení (lymfosarkom).
Podle etiologie rozlišujeme primární lymfedém, jehož příčinou je vrozená porucha lymfatického systému. Může být dědičná, kdy v rodokmenu postiženého nacházíme další příbuzné se stejným problémem, nebo vzniká jako mutace de novo v průběhu embryogeneze. Sekundární lymfedém vzniká druhotně poškozením lymfatického systému v rámci jiného onemocnění. Může jít například o útlak anebo obstrukci lymfatických cest nádorem, infekcí (parazit vlasovec mízní vyskytující se v tropických oblastech) anebo o poškození, či dokonce přerušení, lymfatických cest v rámci léčby nádorů chirurgicky (po resekci lymfatických uzlin postižených tumorem) nebo radioterapií.
Použitá literatura a literatura k dalšímu studiu
- GUYTON AC & HALL JE. Textbook of medical physiology, 11th edition, Elsevier Saunders 2006, pp. 185 – 190, 302 – 305
- KLENER P a kol., Vnitřní lékařství, Díl II., Karolinum, Praha 1998, str. 35 – 37
- McCANCE KL, HUETHER SE, BRASHERS VL, ROTE NS, Pathophysiology: the biological basis for disease in adults and children, 6th edition, Mosby Elsevier 2010, pp. 98 – 101
- PAULEV PE, ZUBIETA G. New Human Physiology: Textbook in medical physiology and pathophysiology essentials and clinical problems, 2nd edition, http://www.zuniv.net/physiology/book/index.htm
- SILBERNAGL S, DESPOPOULOS A., Atlas fyziologie člověka, 2. české vydání, Grada 1993, str. 158-159
- TROJAN S a kol., Lékařská fyziologie, 4.vydání, Grada Publishing 2003, str. 255 – 261