Autor: MUDr. Martin Dobiaš, Ústav patologické fyziologie LF UP Olomouc
Anatomie a fyziologie slinivky břišní
Pankreas neboli slinivka břišní je laločnatá šedorůžová žláza, která má obvykle tvar písmene J, měří přibližně 10 – 18 cm a váží asi 60 – 100 g. Je uložena před zadní břišní stěnou transversálně od duodena směrem ke slezině a zasahuje do retroperitonea. Drobné lalůčky v pankreatu jsou kryté vazivem, které vytváří interlobulární septa a přechází do povrchového pouzdra. V septech vedou cévy a nervy.
Slinivku můžeme anatomicky rozdělit na tři základní části – hlavu (caput pancreatis), tělo (corpus pankreatis) a ocas (cauda pancreatis). Hlava pankreatu zasahuje do duodenálního okna a vystupuje z ní hlavní pankreatický vývod, který ústí ve Vaterově papile. Sekundární větve pankreatického vývodného systému přivádí sekret z interlobulárních a intralobulárních vývodů. U většiny lidi ústí hlavní pankreatický vývod do duodena společně s ductus choledochus.
Podle druhu sekrece rozlišujeme v pankreatu část exokrinní a část endokrinní.
Exokrinní část pankreatu
Exokrinní část pankreatu tvoří acinózní buňky a buňky pankreatických vývodů. Šest až osm acinózních buněk tvoří acin. Díky acinům se produkuje pankreatický sekret, který se odvádí do terminálních vývodů. Jako centroacinózní buňky se označují buňky vývodů, které vycházejí z acinů. Tubulární buňky produkují vodu a hydrogenuhličitany.
Pankreatická šťáva je alkalická tekutina. Je produkována tubuloalveolární žlázou z exokrinní části slinivky břišní. Za den se ji vyloučí do duodena asi 1 – 1,5 l. Obsahuje anorganické a organické složky. Významné jsou hlavně hydrogenuhličitanové ionty, neutralizující žaludeční šťávu přicházející do střeva a vytvářející alkalické prostředí pro činnost střevních enzymů, a dále voda a trávicí enzymy nutné pro štěpení tuků, sacharidů, peptidů a jiných látek v chymu.
Složení pankreatické šťávy
- Peptidázy – trypsin, chymotrypsin, elastáza, karboxypeptidáza;
- Enzymy štěpící škrob – α-amyláza;
- Lipolytické enzymy – lipáza, fosfolipáza A1, A2, cholinesteráza, nespecifické esterázy;
- Enzymy štěpící nukleové kyseliny – deoxyribonukleáza, ribonukleáza;
- Anorganické látky pankreatické šťávy – voda, HCO3-, Cl-, Na+, Ca+, K+, Mg+.
Regulace tvorby pankreatické šťávy
Nervová
- Parasympatikus (vlákna vagu ). Acetylcholin působí na muskarinové receptory v acinech. Po stimulaci parasympatiku dochází ke zvýšení sekrece enzymů.
- Sympatikus - působí inhibičně na sekreci pankreatické šťávy. Sympatikus ovlivňuje hlavně cévy.
Hormonální – dva hlavní hormony produkované sliznicí duodena, které regulují činnost pankreatu, jsou sekretin a cholecystokinin (CCK).
- Sekretin – působí zejména ve vývodech exokrinní části pankreatu. Obohacuje pankreatickou šťávu o vodu a HCO3-. Podnětem pro jeho uvolnění jsou peptidy, tuky a snížená hodnota pH v duodenu.
- Cholecystokinin – působí hlavně na buňky acinů a vyvolává zmnožení obsahu enzymů v pankreatické šťávě. Navíc potencuje účinek sekretinu.
Postprandiálně dochází k stimulaci sekrece cholecystokininu, který aktivuje aferentní vagové nervy. Ty stimulují centra v mozku a ta skrze eferentní vlákna zvyšují pankreatickou sekreci. Tato zvýšená sekrece přetrvává, dokud se potrava nestráví úplně. Nadbytkem enzymů je inaktivován CCK-RF (cholecystokinin realising factor), a tak je ukončena sekrece cholecystokininu.
Protektivní faktory chránící před autodigescí
Pankreas je chráněn před předčasně intrapankreaticky aktivovanými enzymy těmito mechanismy:
- Teprve až extrapankreatickou aktivací trypsinogenu;
- Inhibující bílkovinou trypsinu;
- Konfigurací molekuly trypsinu;
- Oddělenou tvorbou enzymů v Golgiho aparátě.
Příčiny nedostatečné funkce pankreatu
Příčinou insuficience pankreatu může být akutní nebo chronická pankreatitida, podvýživa (kwashiorkor), toxické poškození (alkohol), nádory.
Pankreas reaguje citlivě na poruchy metabolismu bílkovin. Dlouhodobé hladovění anebo podvýživa vedou až k atrofii acinózních buněk a fibróze pankreatu a mohou být nevratné (nebezpečí trvalých následků u mentální anorexie). Sníženou produkci pankreatických enzymů může způsobit snížená sekrece proenzymů anebo jejich nedostatečná intraluminální aktivace. Při deficitu trypsinogenu (např. při celiakální sprue) automaticky klesá produkce enzymů, které trypsin aktivuje. Zvýšená intraluminální inaktivace enzymů amylázy a lipázy se vyskytuje při gastrinomu.
Akutní pankreatitida
Akutní pankreatitida je akutní zánětlivý proces spojený s destruktivní autodigescí pankreatu a variabilním postižením sousedních tkání. Strukturní i funkční změny se obvykle vrací do normálu. Rizikem ale zůstává návrat onemocnění, pokud nejsou odstraněny etiologické faktory.
Epidemiologie
Studie zabývající se výskytem akutní pankreatitidy jsou zatíženy značnými rozdíly. Důležitou roli hrají kvantitativní rozdíly v etiologických faktorech, změny v diagnostice onemocnění a způsob sběru dat. Určitá část akutních pankreatitid se určí až po smrti. Odlišnosti vyplývají nejenom ze spotřeby alkoholu a výskytu cholelitiázy v jednotlivých částech světa, ale i z klasifikačních nejasností (hodnocení ataky alkoholické pankreatitidy jako akutního zánětu nebo jako exacerbace chronického onemocnění?). Incidence akutní pankreatitidy mírně stoupá hlavně se vzrůstající spotřebou alkoholických nápojů a v důsledku špatného stravování, ale i díky zlepšené diagnostice. Pacienti s akutní pankreatitidou tvoří asi 1 – 2 % pacientů hospitalizovaných na chirurgických odděleních. Mortalita těžkých forem se pohybuje mezi 15 – 50 % (podle té které studie). V Evropě se incidence v jednotlivých studiích pohybuje mezi 5,4 – 78,9/100 000 obyvatel/rok.
Etiologické faktory
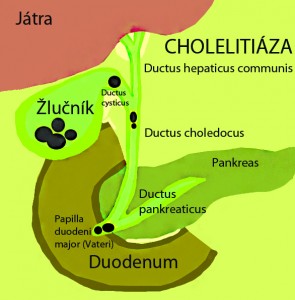
- Cholelitiáza a alkoholismus (nejčastější);
- Nemoci dvanáctníku;
- Infekce;
- Endokrinní poruchy (DM, hyperkalcémie – fyziologické zvýšení iontů kalcia má oscilační charakter a vede k zvýšené sekreci, dlouhodobé patologické zvýšení vede k buněčnému poškození);
- Operace, poranění;
- Toxické látky;
- Hereditární faktory;
- Akutní ischémie (šok);
- Idiopatická pankreatitida.
Vztah genetiky k akutní pankreatitidě
Akutní pankreatitida se neřadí mezi dědičné onemocnění, přesto genetické faktory jsou schopné ovlivnit jak její vznik, tak i průběh.V posledních letech se podařilo identifikovat tři hlavní typy mutací, které souvisí s pankreatitidou – mutace genu pro trypsinogen (PRSS1), mutace tzv. SPINK-1 genu (gen pro proteázový inhibitor) a gen pro CFTR (cystic fibrosis conductance regulator).
Všechny tyto poznatky vedly k formulování tzv. SAPE hypotézy (sentinel acute pankreatitis event), kdy po akutní pankreatitidě dojde buď k úplnému vyhojení postižené tkáně, nebo k pokračování zánětlivého procesu s přechodem do chronické fáze. Hypotéza SAPE říká, že akutní pankreatitida má dvě fáze. Prozánětlivá fáze začíná autoaktivací trypsinogenu, což má za následek autodigesci binárních buněk. Dochází k aktivaci neutrofilů, monocytů, lymfocytů, ale i stelárních buněk. Tento proces regulují prozánětlivé mediátory (např. TNF-α). Druhou fázi, která nastává, je fáze hojení, která je spojena s aktivací protizánětlivých mediátorů (např. IL-10). Aktivní stelární buňky se podílejí na syntéze kolagenu.
Pankreas po zhojení může být plně funkční a nemusí vykazovat nějaké větší morfologické odchylky. Tento proces je typický po překonání jedné epizody akutní biliární pankreatitidy. Pokud na slinivku permanentně působí určitá forma stresu (ischémie, alkohol), jsou buňky imunitního systému a stelární buňky v aktivním stavu. Rozvíjí se protizánětlivá odpověď, vzniká postupná fibrotizace tkáně, která ponechává acinární buňky v trvalém stresu (metabolickém) a vede k ireversibilnímu poškození slinivky.
U pacientů s alkoholickou pankreatitidou mutace genů PRSS1, SPINK-1 a CFTR nehrají významnou roli. Zde se uplatňuje široká škála jiných genů.
Patogeneze
U více než ¾ pacientů se v anamnéze vyskytuje nadměrná konzumace alkoholu a cholelitiáza. Přesto patogenetické mechanismy nejsou úplně jasné:
- Zvýšený tlak v pankreatickém vývodu, např. po uzávěru společného vývodu pankreatu a žlučovodu konkrementem, který může vyvolat akutní pankreatitidu. Kromě toho reflex žluči do pankreatu poškozuje epitel vývodu a celý proces urychluje (natrávením tuků).
- Mechanismus aktivace trypsinu při uzávěru pankreatického vývodu je nejasný.
- Při uzávěru duodena a duodeno-pankreatickém refluxu se aktivované enzymy vracejí zpět do pankreatu.
- Zvýšenou permeabilitu epitelu pankreatických duktů vyvolává alkohol, histamin, kyselina acetylsalicylová aj. Enzymy unikají do periduktulárního intersticia. Alkohol vede k denaturaci proteinů ve vývodech, čímž se zvyšuje tlak v proximálním úseku vývodu.
- Porucha separátní tvorby enzymů v Golgiho aparátě – narušeno oddělení lyzosomových enzymů a H+-ATPáz na jedné straně a secernování pankreatických enzymů na druhé straně.
Proces autodigesce parenchymu pankreatu je spuštěn předčasnou aktivací proenzymů v acinárních buňkách a patologicky zvýšenou permeabilitou duktů pro aktivované enzymy. Při porušeném intracelulárním transportu se v acinárních buňkách hromadí proenzymy, které vedou ke vzniku vakuol. Kyselé pH a lysosomální enzymy aktivují proenzymy, které se vylučují skrz bazolaterální membránu acinů. Zvýšená permeabilita duktů slinivky vzniká následkem zvýšeného intraduktálního tlaku, alkoholu, akutní hyperkalcémie atd..
Prvním aktivovaným enzymem je trypsin (za fyziologických okolností vzniká z trypsinogenu, který je v tenkém střevě aktivován účinkem enteropeptidázy. Pokud se trypsin aktivuje v buňkách acinu, je rychle inhibován proteinem inhibujícím trypsin. V situaci, kdy trypsinu vzniká hodně a není možné ho dostatečně inhibovat anebo když je trypsin aktivován v luminu vývodných cest slinivky, dochází k samonatrávení pankreatu. Usuzovalo se, že trypsin je aktivován katepsinem B. Některé jiné studie ale tuto teorii zpochybnily, když jako prevenci pankreatitidy podávaly inhibitory katepsinu B.
Trypsin následně aktivuje ostatní enzymy – kromě enzymů, které jsou uvolňovány v aktivní formě z poškozených acinárních buněk (např. lipáza). Malé množství proteáz, které se dostávají do krve, je inaktivováno cirkulujícími inhibitory – α1-antitrypsinem, α2-makroglobulinem aj.
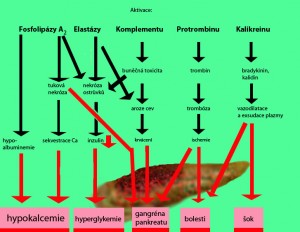
Intracelulární nebo extracelulární aktivace trypsinu působí přímo proteolyticky, poškozuje buněčné membrány a aktivuje další faktory - elastázu, kalikrein, chymotrypsin a fosfolipázu A2. Spouštěcí moment, který aktivuje trypsinogen, je různý vzhledem k různým etiologickým faktorům. Proces patogeneze je však univerzální. Elastáza má kromě poškození elastinu v cévních stěnách i širokospektré proteolytické účinky. Poškození elastinu vede k hemoragiím. Aktivní trypsin aktivuje kromě enzymů také komplementový systém, kalikrein-kininový systém a koagulační systém.
Aktivací kalikreinu se zvyšuje plazmatická koncentrace kininů, která v systémové cirkulaci má vazodilatační účinek, zvyšuje cévní permeabilitu, vyvolává bolest a akumuluje neutrofily. Tyto mechanismy přispívají k rozvoji šokového stavu.
Poškození endotelu, intersticiální edém s místní vazokonstrikcí a volné enzymy vedou ke snížení intrapankreatické perfúze. Ischemické okrsky se rozšiřují dál díky tvorbě mikrotrombů vznikajících v důsledku aktivace trombinu. To společně s pankreatickou lipázou a fosfolipázou A2 vede k nekróze pankreatu a sousedních tkání. Následné reperfuzní poškození vzniká působením volných kyslíkových radikálů, které poškozují buněčné membrány a dávají za vznik nekrózám.
Při destrukci endokrinní části pankreatu (Langerhansovy ostrůvky) vázne produkce inzulínu a vzniká hyperglykémie a sekundární diabetes mellitus.
Pankreatické a peripankreatické nekrózy vytvářejí mýdla spotřebovávající kalciové ionty Ca2+, a podílejí se tak na rozvoji hypokalcémie. Při nekróze se uvolňují cytosiny IL-1, TNF anebo substance P, což jsou iniciátory lokálního zánětu.
Z morfologického hlediska charakterizuje akutní pankreatitidu zánět, otok, hemoragie a nekróza tkáně. Nekróza je způsobená proteolytickými a lipolytickými enzymy a může postihnout i extrapankreatické tkáně v břišní dutině. Destrukce zasahuje i cévy a je příčinou intersticiálního krvácení. U některých pacientů převládá hemoragie nad nekrózou, proto rozlišujeme akutní hemoragickou a akutní nekrotickou pankreatitidu.
Klinické známky a komplikace akutní pankreatitidy
Subjektivní známkou akutní pankreatitidy je bolest. Je to velmi významný průvodní jev. Akutně vzniklá nesnesitelná bolest se promítá do epigastria a do zad. Je vyvolaná otokem, distenzí pankreatických vývodů a acinů, drážděním peritonea, příp. obstrukcí žlučových cest. Doprovází ji nevolnost, nauzea a zvracení bez pocitu úlevy.
V systémové cirkulaci nacházíme zvýšené slinivkové markery (téma Klinická fyziologie exokrinního pankreatu), proteiny akutní fáze, hypokalcémii (riziko tetanie) a hypoalbuminémii.
Zánět způsobuje masivní exsudaci do retroperitonea (pankreas je uložen za peritoneem). Ztráty tekutiny z oběhu, k nimž tímto způsobem dochází, jsou srovnávány se ztrátami tekutiny při popáleninách („retroperitoneální popáleniny„). Mohou vést k dehydrataci, hypovolémii a oběhovému šoku s rizikem smrti (téma Akutní selhání cirkulace).
Častou komplikací je paralytický ileus (téma Střevní neprůchodnost). Dalším projevem pankreatitidy je zvýšené napětí břišní stěny následkem peritoneálního dráždění.
Průvodní komplikací navazující na akutní pankreatitidu následkem šoku může být akutní syndrom dechové tísně (ARDS) anebo akutní selhání ledvin. Velmi závažnou komplikací je rozvoj diseminované intravaskulární koagulopatie (DIC). Mohou se objevit i poruchy centrálního nervového systému, které označujeme jako pankreatická encefalopatie.