Charakteristika ARDS
ARDS je výsledkem nepřiměřené zánětlivé reakce v plicní tkáni, která vede k těžké hypoxémii, hypoxii a velmi často ke smrti. Takovou zánětlivou reakci moho vyvolat nejen infekční, ale také neinfekční faktory. ARDS charakterizují tři hlavní změny:
- Změny v cévní složce – zhoubný nárůst permeability alveolárních krevních kapilár.
- Akumulace tekutiny v parenchymu a v alveolech. Tekutina je bohatá na proteiny (rozdíl oproti tekutině hromadící se v plicích při levostranném srdečním selhání).
- Změny v alveolární epitelové složce – zhoubné difúzní poškození epitelových buněk alveolů.
Nejzávažnějším symptomem ARDS je hypoxémie, která rozhoduje o dalším osudu nemocného.
ARDS je nutno odlišit od tzv. akutního poškození plic, které je mírnější formou plicního postižení. Liší se od ARDS kritériem paO2/FIO2:
| Hodnota paO2/FIO2 asi 500 mm Hg (normální) | Normální stav |
| Hodnota paO2/FIO2 ≤ 300 mm Hg (bez ohledu na hodnotu PEEP) | Akutní poškození plic |
| Hodnota paO2/FIO2 ≤ 200 mm Hg (bez ohledu na hodnotu PEEP) | ARDS |
(paO2= parciální arteriální tlak O2; PEEP = pozitivní end-exspirační tlak; FIO2 = inspirační frakce O2 neboli frakce inspirovaného O2 v dýchané plynné směsi).
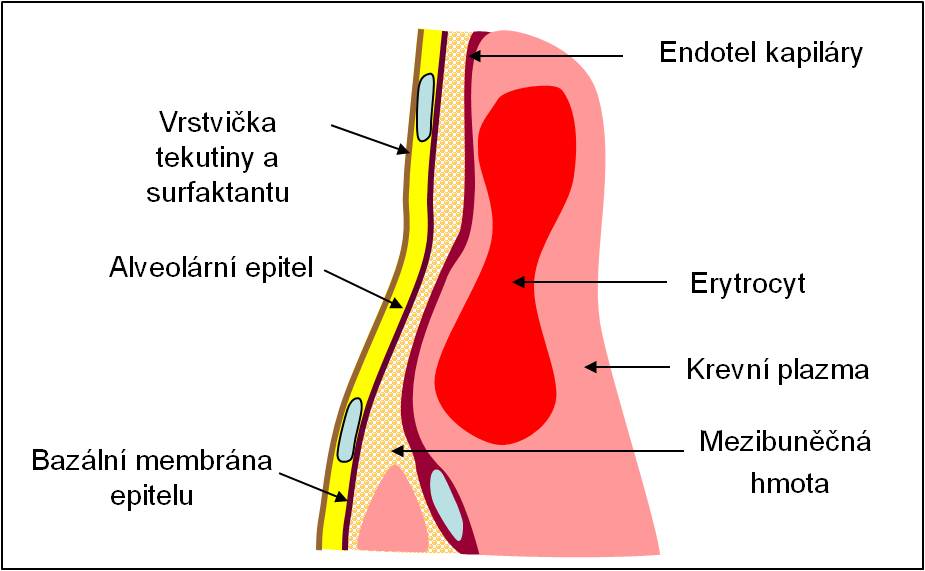
Alveolo-kapilární membrána
Alveolo-kapilární membrána je tenká, asymetrická struktura. Na její krevní straně je v prostoru kolem kapilár mnohem více vaziva než bezprostředně pod bazální membránou, na níž jsou uchyceny pneumocyty alveolárního epitelu.
Obr. 1. Schéma alveolo-kapilární membrány. Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.
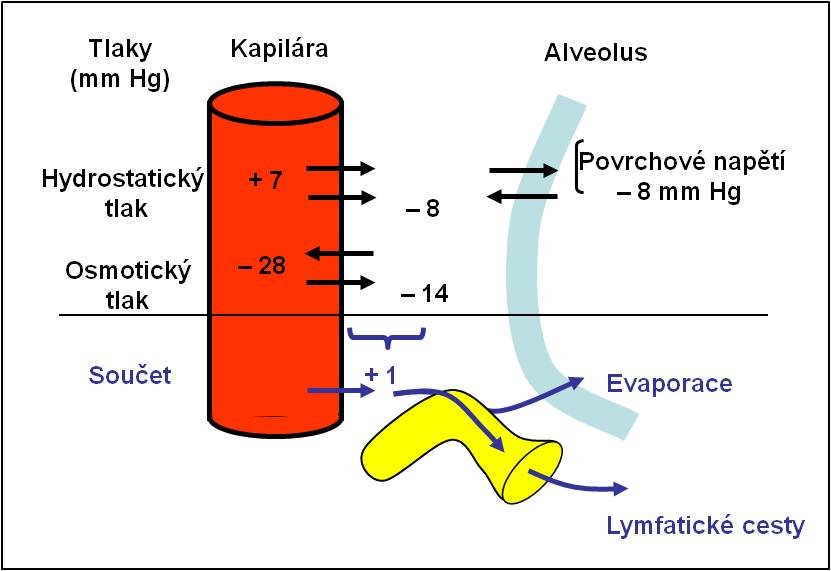
Proti hromadění tekutiny v alveolo-kapilární membráně působí mechanismy, které se shrnují po názvem bezpečnostní faktor. Bezpečnostní faktor má tři hlavní složky:
- První složkou je rezervní prostor v perivaskulárním vazivu. V případě potřeby se může zvětšit až 1,4krát.
- Druhá složka je dynamická a je určena samotnou tekutinou pronikající do intersticia, která ředí tkáňový mok. Tím se
- zvyšuje hydrostatický tlak v intersticiu, což brání přesunu další tekutiny do intersticia, a
- posiluje funkce osmotického gradientu ve směru do cév.
- Třetí, rovněž dynamickou složkou je nárůst kapacity lymfatické drenáže pro odvod tekutiny z plic. Může se zvětšit až 10násobně.
Obr. 2. Bezpečnostní faktor odvodu tekutiny z plic. Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006.
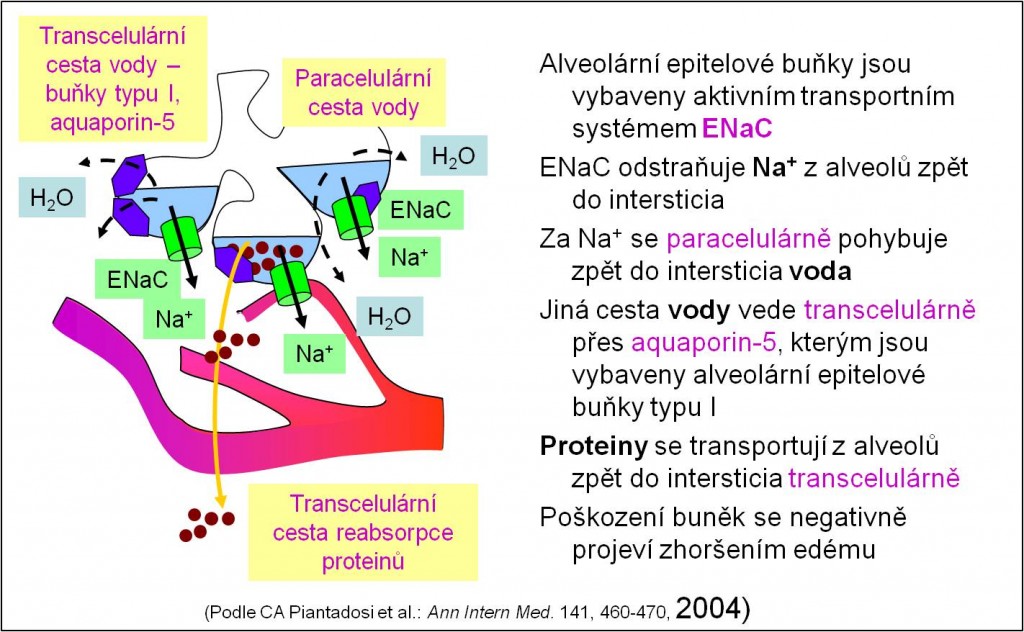
Epitelové buňky, které vystýlají alveoly, jsou trojího typu:
- Pneumocyty typu I
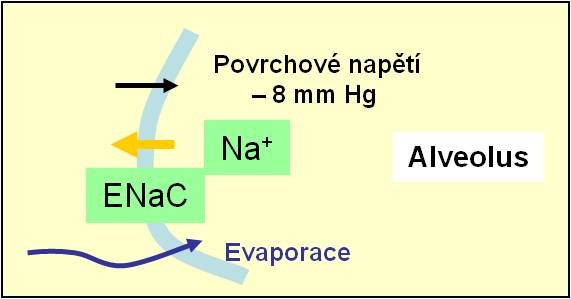
- Jsou tenké, rozprostřené do plochy a vystýlají více než 95 % plochy alveolů. Jsou přizpůsobeny pro výměnu plynů. Zároveň jsou vybaveny výkonnými transprotními mechanismy pro vstřebávání vody, iontů Na+ a ostatních iontů (solí) a také proteinů. Jsou to tedy ony, jež zajišťují, že za normálních okolností alveoly zůstávají suché (obr. 3, obr. 9).
- Alveolární buňky jsou polární. Na své apikální membráně mají epitelové kanály ENaC. Kanály významně usnadňují přesun Na+ z alveolů napříč epitelem do intersticia.
- Za ionty Na+ následuje pohyb vody do intersticia převážně cestou paracelulárních zkratů.
- Pneumocyty typu I však jsou hojně vybaveny aquaporiny 5 pro transcelulární pohyb vody.
- Proteiny se vstřebávají z alveolů do intersticia transcelulární cestou.
- Při poškození, nebo dokonce degeneraci pneumoctů typu I se pronikavě snižuje proces odstraňování tekutiny a proteinů z alveolů (obr. 3, obr. 9).
- Jsou tenké, rozprostřené do plochy a vystýlají více než 95 % plochy alveolů. Jsou přizpůsobeny pro výměnu plynů. Zároveň jsou vybaveny výkonnými transprotními mechanismy pro vstřebávání vody, iontů Na+ a ostatních iontů (solí) a také proteinů. Jsou to tedy ony, jež zajišťují, že za normálních okolností alveoly zůstávají suché (obr. 3, obr. 9).
- Pneumocyty typu II
- Jsou kubické. Za normálních okolností jsou početně zastoupeny v poměru 1 : 1 k buňkám typu I, ale pokrývají jen asi 2 – 5 % plochy alveolů. Produkují surfaktant, a tím zajišťují vysokou poddajnost plic a nízkou námahu nutnou k rozepnutí alveolů.
- Při poškození plic se aktivují, proliferují a diferencují v pneumocyty typu I
- Při některých chorobách, např. při fibróze plic, proliferují, ale nediferencují se, a pokrývají téměř celý povrch plic. Protože nejsou tak dobře přizpůsobeny pro výměnu krevních plynů, vázne difúze plynů.
- Pneumocyt typu III
- Jsou v malém počtu, mají kartáčový lem a soudí se, že plní receptorové funkce.
Obr. 3. Epitelový Na+-Cl- kanál a jeho funkce při udržování suchého povrchu alveolů.
Klasifikace syndromů dechové tísně
- Akutní syndrom dechové tísně (ARDS; akutní respirační distresový syndrom)
- Syndrom dechové tísně nedonošených (RDS; respirační distresový syndrom)
Akutní syndrom dechové tísně – ARDS
Synonyma:
- Šoková plíce
- Syndrom propustných kapilár
- Kongestivní (městnavá) atelektáza
- Plíce Da Nang
- Respirační distresový syndrom dospělých (dřívější, opuštěný název)
Frekvence výskytu ARDS se udává mezi 1,5 – 13 případy/100 000 pacientů za rok.
Prognóza ARDS je neradostná. Mortalita dosahuje 50 – 70 %.
- Časná úmrtí (do 72 hodin) spadají na vrub zejména vyvolávajícímu onemocnění nebo stavu.
- Pozdější úmrtí (po 3 dnech) mají na svědomí MODS, sekundární infekce anebo rozvoj sepse, nebo respirační selhání.
U pacientů, kteří přežijí, dochází za 3 – 6 měsíců ke znatelné obnově respiračních funkcí.
Asi u 50 % přeživších pacientů však zůstávají trvalé následky v podobě restrikční poruchy a snížené difúzní kapacity.
Příčiny ARDS
Příčiny ARDS jsou mnohočetné a rozmanité. Tři hlavní příčiny ARDS jsou uvedeny níže (ARDS se vyvíjí průměrně u každého třetího z následujících pacientů):
- Infekce
- Lokalizované (plicní) infekce
- Generalizované infekce (septické stavy, systémová zánětlivá reakce – SIRS)
- Těžké infekce odpovídají za 50 % vzniku ARDS
- Traumata
- Zhmoždění plic při poraněních hrudníku
- Celková těžká poranění, i když přímo nezasahují hrudník (polytrauma, multiorgánové poškození, multiorgánový distresový syndrom – MODS, cirkulační šokové stavy)
- Aspirace žaludečního obsahu
Příklady přímých poškození plic, která mohou vyústit v ARDS, jsou následující:
- Pneumonie a difúzní postižení plic infekcí
- Aspirace žaludečního obsahu
- Inhalace toxických plynů
- Tonutí
- Zmoždění plic provázející poranění hrudníku
Příklady nepřímých poškození plic, která mohou vyústit v ARDS, jsou následující:
- Těžké tělní infekce a sepse
- Cirkulační šokové stavy, kardiopulmonální zkrat
- Polytraumata, i když nezasahují hrudních
- Pokud se ARDS rozvine jako součást MODS, dosahuje mortalita až 40 %
- Opačně, samotný ARDS, který způsobuje orgánovou hypoxii, může vést k rozvoji MODS a smrti
- Akutní pankreatitis
- Objemné krevní transfúze
Klinický začátek a symptomy ARDS
- Nejčastějším prvním příznakem je tachypnoe
- Tachypnoe přechází do dyspnoe
- Hypoxie: paO2 je v té době už < 8 kPa (60 – 70 mm Hg)
- Pokles paO2 je první detekovatelnou objektivní změnou
- Nejsou žádné specifické laboratorní ukazatele, které by dovolily časné klinické odhalení nástupu ARDS
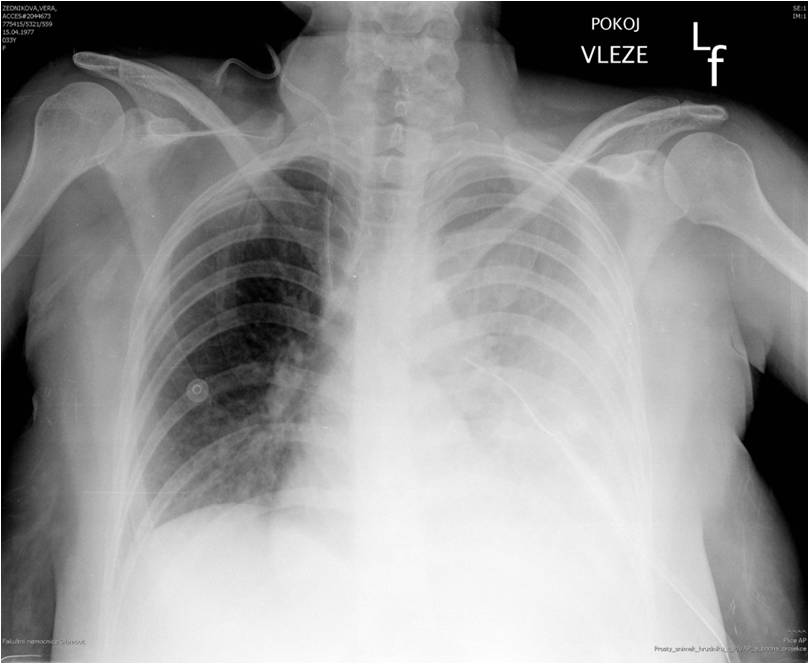
- Další známku jsou difúzní intersticiální anebo alveolární zastření na snímku RTG (Obr. 4A, 4B)
Obr. 4A. ARDS při SIRS. Prostý snímek hrudníku. (Laskavě poskytla B. Začalová, Ústav patologické fyziologie LF UP v Olomouci).
Obr. 4B. CT scan těžkého postižení plicní tkáně charakteru ARDS, vyžadující ventilaci pacienta v pronační poloze. Popis pronační polohy a její fotodokumentaci lze nalézt v příspěvku Mechanická podpora ventilace – intenzivní medicína v terapii akutního selhání cirkulace. (Laskavě poskytl R. Uvízl, Klinika anestezie, resuscitace a intenzivní medicíny LF UP a FN v Olomouci.)
S hromaděním tekutiny se rozvíjí hypoxémie, která postupně přestává odpovídat na terapii kyslíkem. Hypoxie je nejzávažnějším symptomem. Rozhoduje o osudu nemocného.
Průběh ARDS
Rozvoj ARDS se rozděluje na tři hlavní fáze:
- Exsudativní (akutní) fáze zánětu (několik dní)
- Pokud není smrtící, přejde tato fáze přímo do třetí fáze (fáze obnovy)
- Nebo přejde do druhé fáze (fáze fibrózy) a potom do třetí fáze (fáze obnovy)
- Proliferativní (fibrotická) fáze (nemusí být vyjádřena)
- Fáze obnovy (reparace) (týdny až měsíce)
První (exsudativní) fáze ARDS
První fáze je komplikovaná a probíhá ve třech překrývajících se stádiích:
- Ve stádiu iniciace způsobí patologický proces, který vovolal ARDS, uvolnění velkého množství cytokinů, chemokinů, lymfokinů a dalších zánětlivých mediátorů (TNF, IL-1, IL-8) z imunitních i neimunitních buněk. Na této produkci cytokinů se podílejí i aktivované lokální tkáňové makrofágy.
- Ve stádiu amplifikace cytokiny navozují dysfunkci endotelu a stimulují další efektorové buňky imunitního systému(např. leukocyty), které se hromadí ve tkáních a orgánech. Aktivované leukocyty v plicích následně uvolňují zánětlivé mediátory, reaktivní radikály (ROS) a proteázy, které poškozují okkolní struktury.
- Ve stádiu poškození dochází k alteraci alveolo-kapilární bariéry. Alterace při ARDS nejprve směřuje ke zhroucení kapilární bariéry. Později se přidává i zhroucení alveolární bariéry.
- Platí, že kapiláry bariéry jsou k poškození daleko citlivější než alveolární epitel.
- Změny permeability, provázející endotelovou dysfunkci, způsobí přestup tekutiny do tkáně. Tekutina prostupuje mezi endotelovými buňkami jednak do intersticia, jednak – v místech anatomického přechodu malých alveolárních duktů – do alveolárního epitelu.
- S tekutinou přestupují i plazmatické proteiny. Porucha bariéry je neselektivní, takže do intersticia přecházejí proteiny všech velikostí, včetně fibrinogenu (Mr ≈ 400 000), který se ve tkáni může měnit na fibrin a dále se organizovat.
- S hromaděním proteinů se zvyšuje osmotický tlak v intersticiu. To výrazně redukuje osmotickou složku bezpečnostního faktoru.
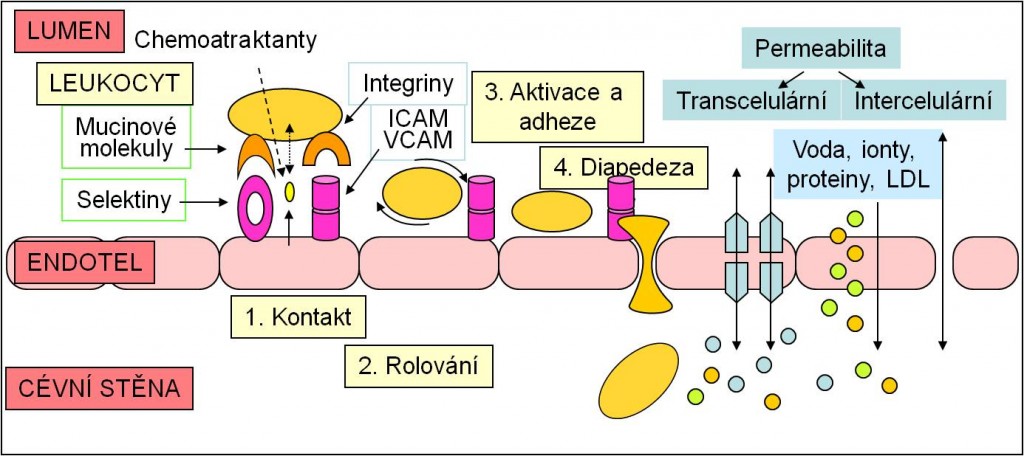
Obr. 5. Prostup leukocytů endotelovou bariérou (kontakt, rolování, adheze, diapedeza) a změny permeability endotelové bariéry pro vodu, ionty a proteiny. Toto schéma je možno zhlédnout i v animované podobě.
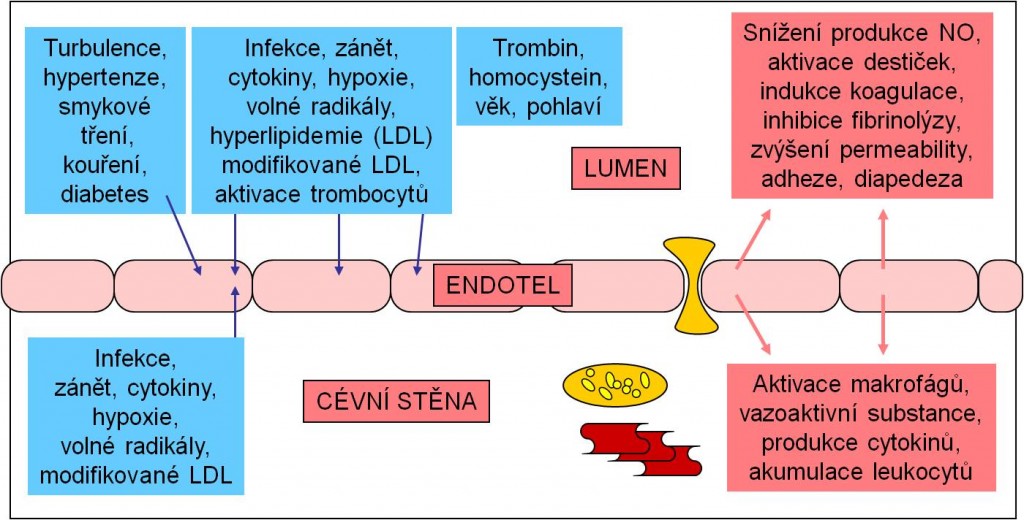
Obr. 6. Hlavní faktory aktivace endotelu (modře) a hlavní projevy endotelové dysfunkce (červeně) v lumen a ve stěně cévy.
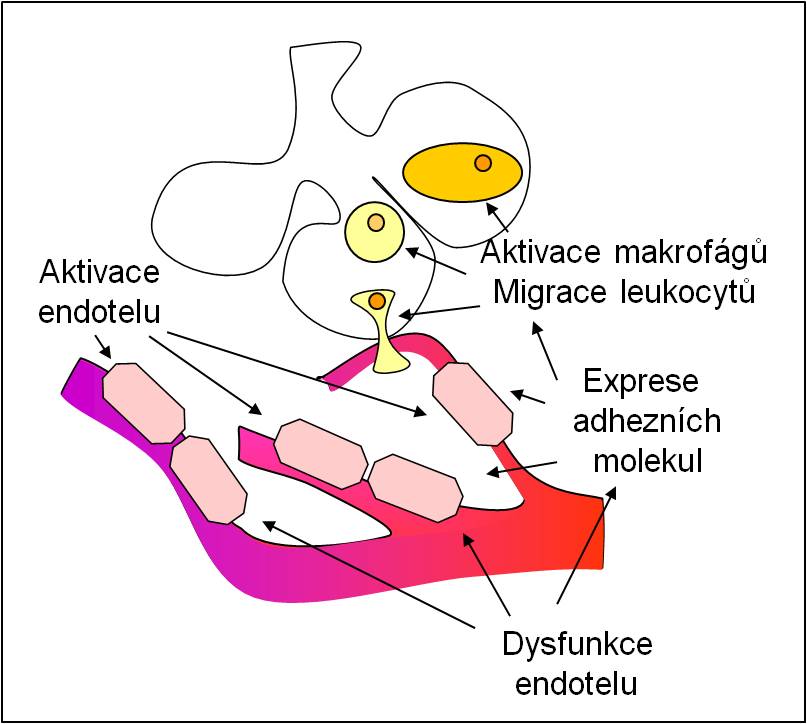
Obr. 7. Shrnutí počátečních změn, k nimž dochází v časné exsudativní fázi ARDS. Podle CA Piantadosi et al.: Ann Intern Med. 141, 460-470, 2004. Toto schéma je možno zhlédnout i v animované podobě.
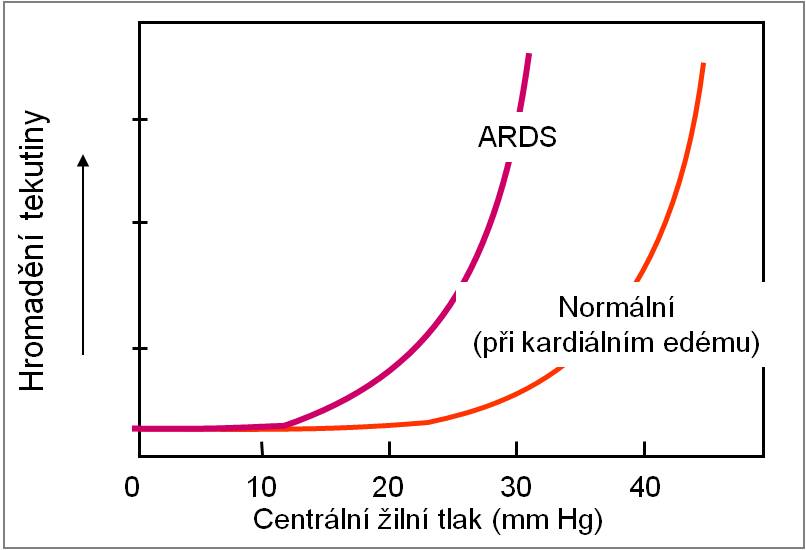
Vcelku bezpečnostní faktor klesá v průběhu první fáze ARDS na pouhou asi 1/2 své normální kapacity. Plicní edém zde proto vzniká už při daleko menším hydrostatickém tlaku. Bezpečnostní faktor je vyčerpán, když objem intersticiální plicní tekutiny vzroste asi o 40 %. Potom se bariéra náhle zhroutí.
Obr. 8. Výrazná redukce bezpečnostního faktoru u ARDS. Podle CA Piantadosi et al.: Ann Intern Med. 141, 460-470, 2004. Toto schéma je možno zhlédnout i v animované podobě.
Pokročilá exsudativní fáze potom zahrnuje:
- Přítomnost tekutiny bohaté na proteiny ve tkáni; proteiny s fibrinem se organizují a vytvářejí hyalinní membrány, které dále stimulují zánět. Z intersticiálního edému se postupně rozvíjí alveolární edém.
- Poškození alveolárního epitelu. Tekutinou nahromaděnou v intersticiu a bohatou na proteiny je zasažen také alveolární epitel.
- Dokud epitelové buňky zůstávají na místě, vstřebávání vody a solí je zachováno anebo intenzita resorpce dokonce roste (obr. 9).
- U dysfunkčního epitelu především začíná váznout jeho reabsorpční funkce. Poškozené epitelové buňky se odlupují z bazální membrány a nechávají ji obnaženou. Tekutina je hůře odstraňována z alveolů. Dysfunkce se tak podílí na stupňující se závažnosti edému (obr. 10).
- Alveolární epitel se zachovanou aktivitou dokáže asi u 1/3 pacientů s rozvíjejícím se ARDS odstranit tekutinu z alveolů do 12 hodin od začátku plicního poškození (obr. 9). Čím déle edém přetrvává, tím větší je riziko nevratných změn a fatální respirační insuficience.
- Pokud došlo k odloupání epitelových buněk, musí se epitel nejprve obnovit. Děje se tak ze zachovaných epitelových buněk typu II.
- Pokud jde o pneumocyty typu II, dochází k poklesu jednak produkce, jednak účinnosti surfaktantu inaktivovaného proteiny v tekutině.
- Obnova epitelové pokrývky alveolů předpokládá celistvou bazální membránu. Rekolonizace membrány vychází z alveolárních buněk typu II. Buňky proliferují a diferencují se v pneumocyty typu I. Obnova je pomalá, normálně se denně obmění asi 4 % buněk typu I, po poškození se však dynamika pravděpodobně může zrychlit.
- Buňky jsou k obnově stimulovány růstovými faktory. Pokusy o terapeutickou podporu obnovy se opírají o využití β-adrenergních agonistů, dopaminu anebo dobutaminu.
- Přítomnost aktivovaných fibroblastů. Připravuje se druhá (proliferativní, fibrotická) fáze.
Obr. 9. Schéma pohybu iontů, vody a proteinů alveolárním epitelem. Toto schéma je možno zhlédnout i v animované podobě.
Obr. 10. Shrnutí změn, k nimž dochází v pokročilé exsudativní fázi ARDS. Podle CA Piantadosi et al.: Ann Intern Med. 141, 460-470, 2004. Toto schéma je možno zhlédnout i v animované podobě.
Po prvních několika dnech trvání exsudativní fáze lze pozorovat zřetelné morfologické známky poškození plic:
- Zduření endotelu a rozšíření mezibuněčných štěrbin.
- Tvorbu trombů a fibrinových membrán v drobných cévách mikrocirkulace i ve větších arteriolách.
- Nahromadění zánětlivých elementů (neutrofilů).
- Degeneraci, deskvamaci a zánik epitelových buněk typu I s obnažením bazální membrány.
- Tvorbu hyalinních membrán tvořených aglomeráty fibrinu a proteinů matrix v drobných alveolárních duktech a terminálních dýchacích cestách.
- I když ARDS charakterizují hlavně změny v alveolech, mohou se ho účastnit také dýchací cesty přítomností zánětlivého edému sliznic, hypersekrece a bronchospasmů.
Změny v exsudativní fázi mají závažné patofyziologické důsledky pro výměnu plynů v plicích:
- Bariéra ztluštělá edémem představuje prodloužení difúzní dráhy a omezení difúze.
- Hromadící se tekutina vytlačuje vzduch z alveolů.
- Pokles účinnosti surfaktantu přispívá ke kolapsu alveolů. Většina alveolů je pak atelektatická anebo vyplněná tekutinou. Plíce jsou nevzdušné a může se rozvinout globální respirační selhání.
- Snížená poddajnost spolu s postiženými dýchacími cestami klade zvýšené nároky na dechovou práci.
Nejzávažnější změnou, ke které dochází v akutní fázi ARDS a která rozhoduje o osudu nemocného, je hypoxie. Vznik hypoxie je komplexní. Vyvíjí se z důvodů:
- Poruchy difúze.
- Poruchy ventilace.
- Poruchy poměru ventilace/perfúze.
- Narůstá zastoupení zkratů, roste venózní příměs
- Pokud vázne alveolární ventilace, aplikace kyslíku ztrácí účinnost.
Přidává se hyperkapnie, rozvíjí se globální respirační selhání.
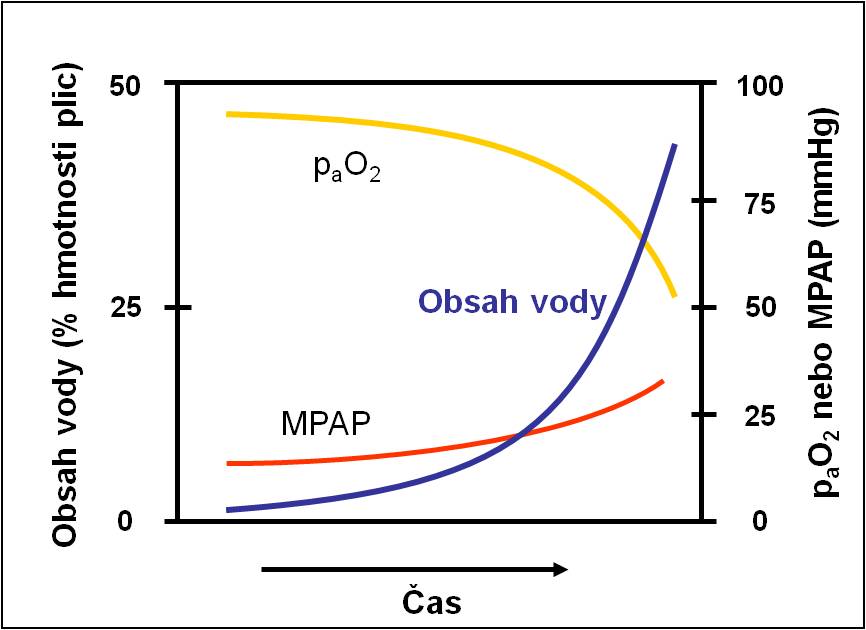
Obr. 11. Vztah mezi hromaděním tekutiny v plicích (modře) a rozvojem hypoxémie (žlutě). paO2 = arteriální pO2; MPAP = střední tlak v plicnici. Podle CA Piantadosi et al.: Ann Intern Med. 141, 460-470, 2004. Toto schéma je možno zhlédnout i v animované podobě.
Druhá (proliferativní, fibrotická) fáze ARDS
Pokud pacient přežívá a nepokračuje přímo do třetí fáze (reparace), rozvíjí se druhá fáze. V této fázi:
- Přetrvává plicní otok
- Přetrvává zánět.Na rozdíl od první fáze je akcentována fibróza a ukládání kolagenu.
- Bazální membránu kryjí hlavně kuboidální buňky typu II.
Po funkční stránce:
- Přetrvává hypoxie
- Zhoršuje se poddajnost
- Zvětšují se poruchy poměru ventilace/perfúze, narůstá mrtvý prostor
- Vyvíji se prekapilární plicní hypertenze
Třetí (reparační) fáze ARDS
Reparační fáze může trvat dny až týdny. Během nich probíhají následující procesy:
- Vytrácí se edém.
- Zmírňuje se až mizí hypoxie.
- Zlepšuje se poddajnost.
- Ustává zánět.
V převážném počtu případů však přetrvává intersticiální plicní fibróza se závažnými změnami plic a respiračních funkcí.
Kritéria diagnózy ARDS
- Akutní začátek.
- Hypoxémie ukazující na těžkou poruchu výměny kyslíku (objevuje se už před změnami RTG obrazu).
- Bilaterální difuzní plicní infiltráty na frontálním RTG snímku.
- Snížená poddajnost plic.
- Nepřítomnost zvýšeného tlaku v levé síni;
- Tzn. normální tlak v zaklínění (< 15 mm Hg), jež ukazuje na nepřítomnost postkapilární plicní hypertenze, tedy nekardiální původ edému.
Patofyziologické základy terapie ARDS
Není žádná specifická terapie ARDS. Proto je třeba klást důraz na důslednou prevenci léčbou stavů, které mohou ARDS navodit.
Pokud se přesto rozvine ARDS, je nutno zaměřit se na podporu dýchacích funkcí a oxygenaci krve umělou ventilací.
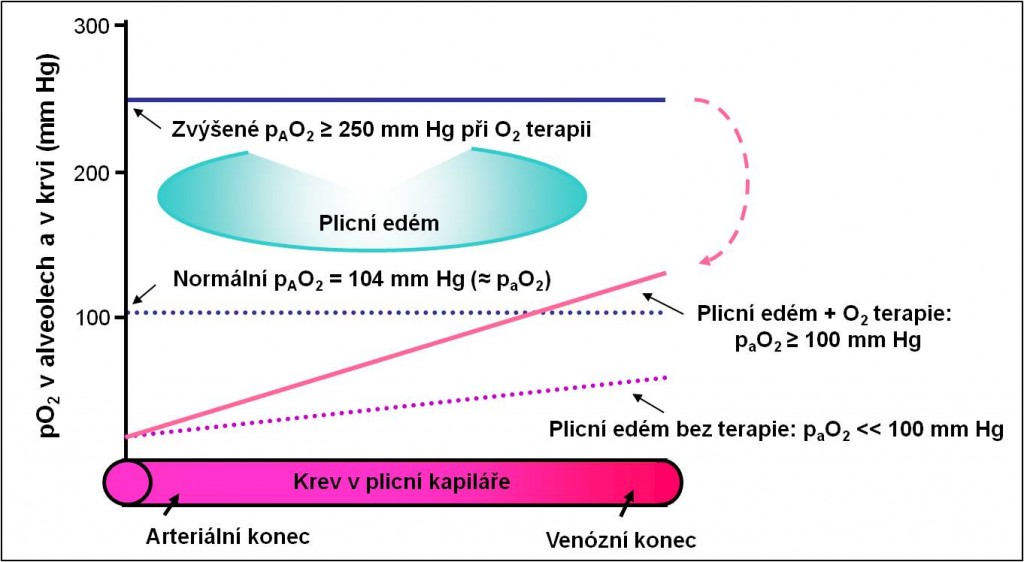
Obr. 12. Odůvodnění terapie kyslíkem při plicním edému. Podle AC Guyton a JE Hall: Textbook of Medical Physiology, 11th Ed. Elsevier/Saunders, Philadeplhia. 2006. Toto schéma je možno zhlédnout i v animované podobě.
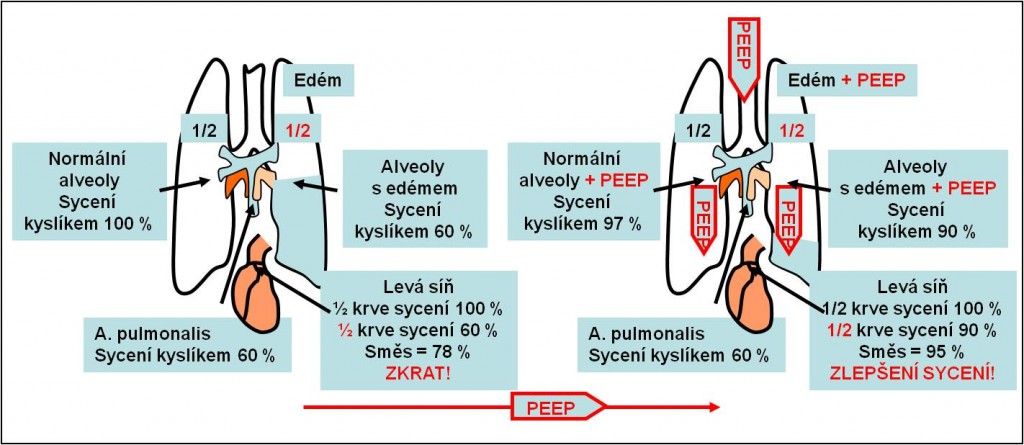
Obr. 13. Odůvodnění použití ventilace s pozitivním end-exspiračním tlakem PEEP při léčbě plicního edému.
Zásady farmakologické terapie ARDS
- Glukokortikoidy – studie udávají sporný efekt v časných fázích ARDS;
- Podání surfaktantu v aerosolové formě – výsledky studií jsou rovněž nejednoznačné;
- Inhalační podání NO – vazodilatace v plicích, zlepšuje oxygenaci, v oběhu je rychle inaktivován hemoglobinem, a proto nemá nežádoucí systémové účinky.
Zpracoval: Jaroslav Veselý, Ústav patologické fyziologie LF UP v Olomouci