Charakteristika a formy akutního selhání cirkulace
Akutní selhání cirkulace je selháním výkonu základních cirkulačních funkcí – rozvodu dostatečného množství krve do tkání. Charakterizuje ho nedostatečné zásobení tkání kyslíkem, živinami a regulačními faktory a nedostatečné odvádění produktů metabolismu z tkání.
Akutní selhání cirkulace má tři základní formy
- SYNKOPA
- ŠOK
- NÁHLÁ SMRT
Jednotlivé formy se od sebe liší rychlostí nástupu, délkou trvání, šířkou rozvinutí kompenzačních mechanismů a hloubkou postižení.
Synkopa – definice a klasifikace
Synkopa (mdloba) je náhlá, krátkodobá a vratná, spontánně ustupující ztráta vědomí. Trvá nanejvýš několik minut. Vzniká přechodným omezením dodávky krve do mozku (tedy nikoliv např. úrazem hlavy). Bezprostředně před synkopou se mohou objevit prodromální příznaky (pocity závratě, slabost, pocení, nauzea, zatmívání před očima, abnormální sluchové vjemy, zvýšené slinění, nucení na močení, defekaci apod.). Ztrátu vědomí provází ztráta svalového tonu, takže postižený padá k zemi a může se zranit. Puls je slabý. Synkopa se na rozdíl od kolapsu může dostavit i vleže, často však ji však lze odvrátit zaujetím polohy se zvýšenými končetinami. Postižený je na rozdíl od epileptického záchvatu bledý.
Synkopy mohou mít různé příčiny. Vznikají nedostatečným venózním návratem, neschopností srdce udržet normální srdeční výdej anebo překážkou na cestě krve dopravované do mozku. Lze je klasifikovat do skupin zahrnujících synkopy se sníženým krevním objemem (hypovolemické) a synkopy vznikající bez sníženého krevního objemu (normovolemické). Obě skupiny lze dále dělit podrobněji.
- Hypovolemická synkopa
- Normovolemická synkopa
- Distribuční synkopa
- Ortostatická synkopa
- Vazodepresorická synkopa
- Vazovagální synkopa
- Syndrom karotického sinu
- Postprandiální synkopa
- Mikční synkopa
- Kardiální (arytmická) synkopa
- Obstrukční synkopa
- Překážka plnění pravé komory
- Překážka plnění levé komory
- Překážka mezi srdcem a mozkem
- Distribuční synkopa
- Synkopy bez zjištěné příčiny (asi 10 % příhod)
Hypovolemická synkopa
Vzniká následkem nedostatečného žilního návratu při sníženém objemu krve (neuhašená žízeň, krvácení, po ztrátách tekutiny kůží – např. pocením, po ztrátách tekutiny z GIT – např. průjmy, zvracením, píštělí, při ztrátách tekutin ledvinami – např. vlivem diuretik, při ztrátách do třetích prostor atd.). Synkopa se může se manifestovat po změně polohy z pozice vleže nebo vsedě do vzpřímeného postoje, po fyzickém výkonu, vzrušení apod. Blízká je synkopa z omezení dodávky kyslíku po zátěži u nemocných s anémií nebo jinými formami hypoxie.
Normovolemické synkopy
Distribuční synkopy
Vznikají následkem sníženého žilního návratu při normálním objemu krve.
Ortostatická synkopa
Ortostatická synkopa je typickým příkladem distribuční synkopy. Často je spojena s ortostatickou hypotenzí. Projevuje se poklesem arteriálního krevního tlaku po změně polohy těla z pozice vleže nebo vsedě do stoje, kdy se v dolních končetinách vlivem gravitace hromadí 400 – 800 ml krve. Stav mohou výrazně zhoršovat varixy.
Podkladem ortostatické synkopy jsou oslabené sympatické reflexy, které vazokonstrikcí, venokonstrikcí a stimulací akce srdce zajišťují po změně polohy těla dostatečný žilní návrat. Sympatickou reakci navíc podporuje svalová pumpa. Ortostatická synkopa se častěji objevuje v obdobích nerovnoměrného růstu (v pubertě), v dospělém věku se častěji vyskytuje po delším upoutání pacienta na lůžko. Může být navozena farmakologicky (hypotenziva, antidepresiva apod.). Ortostatickou synkopu podporuje hypovolémie (neuhašená žízeň, krvácení, horečka, pocení, průjmy, zvracení, ztráty tekutiny ledvinami, vliv diuretik, ztráty tekutin do třetích prostor apod.), hypoxie (anémie, chronická respirační onemocnění, vysoké nadmořské výšky apod.), předchozí námaha (po skončeném fyzickém výkonu přestane působit svalová pumpa), přítomnost rozsáhlých žilních varixů a periferní vazodilatace po konzumaci alkoholu.
Vazodepresorická (neurovaskulární, „vazovagální“) synkopa
Podnětem k vazodepresorické synkopě může být nepříjemný emoční zážitek (pohled na něco odporného, psychický otřes, strach), dlouhodobé stání, zejména v horku, pobyt ve špatně větrané místnosti, náročný fyzický výkon (ponámahová synkopa; po skončeném fyzickém výkonu navíc přestane působit svalová pumpa) apod. Dochází k náhlé ztrátě sympatického tonu, periferní cévní rezistence a periferního cévního tonu a následně dramaticky klesá žilní návrat a systémový arteriální tlak. Tím je blízká ortostatické synkopě. Někdy je navíc zřetelně vyjádřena stimulace vagu, která se manifestuje poklesem srdeční frekvence až bradykardií.
Termín vazovagální synkopa je dnes spíše rezervován pro reflexní synkopu zprostředkovanou X. hlavovým nervem a vyvolanou neadekvátním anebo bolestivým drážděním v oblasti bronchů, horních cest dýchacích, hltanu anebo jícnu (při polykání, při bronchoskopii, endoskopii horních partií GIT apod.) nebo po dráždění pleury anebo peritonea. Zvýšená vagová aktivita může způsobit přechodnou bradykardii, A-V blokádu anebo až zástavu srdce.
Syndrom karotického sinu
U osob trpících zvýšenou citlivostí karotického sinu způsobí už mírný zevní tlak na sinus nadměrnou redukci aktivity sympatiku s následnou periferní vazodilatací a poklesem systémového arteriálního tlaku (tzv. vazodepresorická forma uvedeného syndromu). Srdeční frekvence přitom nemusí klesat, nebo může dokonce růst. Vyvolávajícím faktorem může být tlak vázanky, límce, pohyby hlavou, objímání se s jinou osobou a podobně.
Jindy mohou v symptomatologii převažovat známky vagové aktivace, jako jsou zpomalení tepové frekvence a vedení A-V uzlem s prodlouženým intervalem P-Q, opět při současném poklesu arteriálního tlaku (tzv. kardioinhibiční forma syndromu karotického sinu). Obě uvedené formy se mohou kombinovat.
Mikční synkopa
Mikční synkopa se projevuje poklesem periferního cévního odporu, reflexní bradykardií a snížením arteriálního tlaku po vyprázdnění močového měchýře a s ním spojeném úbytku obsahu břišní dutiny. Častěji postihuje starší muže při nočním močení. Proto se soudí, že tato synkopa může mít i složku obstrukční, když je návrat k srdci blokován Valsalvovým manévrem při zvýšeném mikčním úsilí (např. při hyperterofii prostaty).
Kardiální (kardiogenní) synkopy
Kardiální synkopy se nejčastěji spojují s poruchami srdečního rytmu. Mohou je způsobovat jak bradyarytmie, tak tachyarytmie.
- Příklady kardiálních synkop spojených s bradyarytmiemi jsou příhody vyvolané syndromem nemocného sinu, A-V blokádami II.-III. stupně (Adams-Stokesův syndrom), nebo prodlouženým Q-T.
- Skupinu kardiálních synkop spojených s tachyarytmiemi ilustrují paroxysmální supraventrikulární nebo komorové tachyarytmie.
Jindy se kardiální synkopy vážou na morfologickou anebo mechanickou překážku v srdci nebo v plicním oběhu (kardiální obstrukční synkopy).
- Při stenóze aortálního ústí, ústí plicnice, při prekapilární plicní hypertenzi, obstrukční kardiomyopatii nebo cyanotických vadách se tyto synkopy mohou manifestovat jako ponámahové synkopy.
- Intraluminální obstrukční cévní mechanismus se může uplatňovat při emboliích anebo při myxomu v levé síni.
- V jiných případech může být primární problém v omezení plnění srdce ze strany perikardu (nemoci perikardu, tamponáda).
Periferní (nekardiální) obstrukční synkopy
Nekardiální obstrukční synkopy mohou být vyvolány dočasným přerušením proudu krve směřujícího k srdci, nebo proudu krve směřujícího ze srdce do mozku.
- Do první skupiny patří synkopy opírající se o Valsalvův manévr. Zvýšení nitrohrudního tlaku při tomto manévru omezuje venózní návrat, a tím srdeční výdej. Klesá arteriální tlak. Patří sem synkopa při usilovném kašli (tusigenní synkopa) nebo defekační synkopa. Výše už bylo uvedeno, že stejný mechanismus se může uplatňovat i při mikční synkopě.
- Do druhé skupiny se řadí cerebrovaskulární onemocnění, zejména ateroskleróza mozkových tepen. Hemodynamicky významná ateroskleróza v povodí a. carotis může svou citlivostí na tlak imitovat syndrom karotického sinu. Rovněž ateroskleróza a. vertebralis může kriticky omezovat přítok krve do mozku a vyvolat synkopu při záklonu hlavy.
Zajímavým, i když málo častým mechanismem vzniku synkopy je tzv. zlodějský syndrom podklíčkové tepny (syndrom zlodějské sublávie). Při tomto syndromu je částečná obstrukce a. subclavia lokalizovaná v úseku před odstupem a. vertebralis. Při fyzické námaze stejnostranné horní končetiny, kdy klesá periferní odpor, a tedy i tlak v distálním a terminálním úseku povodí a. subclavia, může krev začít proudit z mozkového Willisova okruhu, napájeného oběma karotidami a druhostrannou a. subclavia, cestou stejnostranné a. vertebralis do namáhaných partií končetiny. Takové náhlé odčerpání krve z lebeční dutiny se pak projeví synkopou.
Šok – definice a charakteristika
Cirkulační šok je akutní a déletrvající pokles efektivního krevního zásobení tkání. Trvá desítky minut až desítky hodin. Je provázen vystupňovaným rozvojem kompenzačních mechanismů a hlubokým postižením tkáňového metabolismu a funkcí orgánů.
Cirkulační šok se může vyvinout nečekaně až překotně (3 – 10 minut), jak to např. ukazují hypovolemické šoky při ztrátách krve a tekutin, kardiální šok, toxický a anafylaktický šok nebo obstrukční šok při masivní plicní embolii.
Jindy se symptomy hlásí pozvolna a postupně nabývají na intenzitě, jako to např. ukazují prohlubující se hemoragický šok, popáleninový šok nebo šok ze zhmoždění měkkých tkání (crush syndrom).
Klasifikace šokových stavů
- Hypovolemický šok
- Šok ze ztrát krve
- Z vnějších ztrát krve
- Z vnitřních ztrát krve
- Traumatický šok a šok vyvolaný bolestí
- Šok ze ztrát plazmy a tekutin
- Cestou GIT (zvracení, průjmy)
- Cestou ledvin (vysoká diuréza - např. osmotická, při polyurickém selhání ledvin, při selhání regulací – např. endokrinní šok, po diureticích apod.)
- Cestou kůže (pocení, popáleniny)
- Ztráty tekutin do třetích prostor (přestup tekutiny do intersticia, do zhmožděných tkání, do břišní dutiny, hrudní dutiny, do střeva)
- Šok ze ztrát krve
- Normovolemický šok
- Distribuční šok
- (Anafylatický šok)
- Toxémický (toxický) šok
- Septický šok (sepse)
- Neurogenní šok
- Spinal shock
- Šok z endokrinních příčin
- Kardiální (kardiogenní) šok (selhání srdce jako pumpy, pokles srdečního výdeje)
- Obstrukční šok
- Pokles plnění pravé komory
- Pokles plnění levé komory
- Distribuční šok
Hypovolemický šok, kardiální šok a obstruční šok jsou šoky se sníženým srdečním výdejem. Naopak, při distribučním šoku může být srdeční výdej dokonce zvýšen. Proto nelze považovat snížený srdeční výdej za obecnou podmínku klinické diagnózy šoku. Distribuční šoky mohou být ve svém pokročilém stádiu provázeny hemokoncentrací z přestupu intravaskulární tekutiny do intersticia, edémy a odtud sníženým srdečním výdejem. Někdy se pak mylně klasifikují jako šoky hypovolemické.
Fáze (stádia) šoku
Vratné (reverzibilní) stádium
- Počáteční skryté, kompenzované stádium
- Manifestní progresívní, dekompenzované stádium
Nevratné (ireverzibilní) stádium
Kompenzované stádium šoku
Počáteční stádium šoku charakterizuje působení původní příčiny a poplachová (alarmová) aktivace sympatiku. Následně se spolu se sympatikem kompenzačních dějů účastní ještě další humorální faktory; v souhrnu tedy:
- Sympatikus
- Systém renin-angiotenzin-aldosteron-ADH
- Glukokortikoidy
Odpověď sympatiku začíná prakticky okamžitě a již během prvních 30 s se rozvíjí do maxima. Podporuje ji vyplavení katecholaminů z dřeně nadledvin. Akutní sympatickou odpověď spouštějí baroreceptorové reflexy, bolest anebo psychické vlivy. Hlavní účinky sympatiku na cirkulaci se shrnují do dvou skupin:
- Periferní vazokonstrikce
- Arteriolokonstrikce
- Venokonstrikce
- Centrální pozitivní účinky na srdce
- Inotropní
- Chronotropní
- Dromotropní
- Bathmotropní
- Lusitropní
V rámci poplachové reakce tak dochází k přerozdělení oběhu krve (redistribuční reakce). Oběh se centralizuje, krev je usměrňována k srdci a mozku. Konstrikce arteriol zvýší periferní odpor, a tím arteriální krevní tlak, současně však sníží žilní návrat. Svou druhou periferní komponentou, tj. venokonstrikcí a kontrakcí záložních zásobáren krve v těle, symptikus umožní zvýšit žilní návrat. Tento účinek, často nedoceňovaný, je kritický pro udržení dostatečného srdečního výdeje. Působení na srdce je vysoce účelové. Sympatikus však zároveň zvyšuje spotřebu kyslíku v myokardu a může prohloubit nepoměr mezi jeho nabídkou a poptávkou. Svým bathmotropním účinkem sympatikus navíc podporuje vznik arytmií.
Vzhledem k rozsáhlé arteriolokonstrikci jsou kůže, podkoží, splanchnická oblast a ledviny zásobeny méně krví a trpí hypoperfúzí. Ledviny vystavené účinkům sympatiku omezují diurézu, zvyšují reabsorpci soli a vody a uvolňují renin z macula densa. Reabsorpcí tekutin se zvyšuje náplň cirkulace, a tedy žilní návrat, a oddaluje se pokles tlaku. Alespoň po určitou dobu se tak může dařit udržet krevní tlak na normální výši – odtud pojmenování kompenzované stádium; normální krevní tlak tedy nevylučuje přítomnost šoku! Současně se ovšem objevují první klinicky zjevné symptomy sympatické aktivace – bledost, chladná zpocená kůže a tachykardie.
Pokud poškození trvá dále, rozvíjí se odpověď ledvin. Ledviny produkují renin, vytváří se angiotenzin. Angiotenzin II zužuje jak periferní arterioly, tak vény a přímým účinkem na epitely proximálních tubulů mimořádně účinně stimuluje reabsorpci soli a vody v ledvinách. Jeho účinek je kritický pro udržení objemu tekutin a náplně cirkulace. Odpověď s účastí angiotenzinu se rozvíjí se zpožděním. Začíná asi po 10 minutách a dosahuje plného účinku asi za 1 hodinu. V tomto časovém horizontu už jsou sympatikus a angiotenzin podporovány zvýšeným uvolňováním ADH a případně i narůstajícím palčivým pocitem žízně. Oba fenomény se rozvíjejí přibližně toutéž rychlostí. ADH má podobně jako angiotenzin vodu šetřící a vazokonstrikční účinky; vazokonstrikční účinky ADH jsou ovšem zřetelné až při jeho suprafyziologických koncentracích.
Časovou posloupnost na sebe navazujících článků kontroly náplně cirkulace zakončuje uvolnění aldosteronu. Sekrece aldosteronu je v souvislostech cirkulačnícho selhání stimulována akutním zvýšením angiotenzinu II v oběhu a snížením perfúze nadledvin. Na zprostředkování účinků aldosteronu se podílí specifický receptor v epitelu distálního tubulu. Působení aldosteronu vyžaduje aktivaci genů a syntézu nových buněčných komponent. Proto nezačíná dříve než téměř za hodinu. K rozvinutí do plné šíře potřebuje několik hodin.
Mezi humorálními faktory je nevyhnutelné pamatovat na účast glukokortikoidů. Šok je jednou z nejtěžších forem akutního stresu. Stresové hormony zajišťují zdroje pro pokračování poplachové reakce. Signály, které spouštějí sekreci ACTH, a tím aktivují stresovou osu, mohou být různorodé. Mimo jiné zahrnují bolest i působení katecholaminů. Glukokortikoidy se ve stresové reakci uplatňují jak svými účinky permesivními na působení katecholaminů, účinky metabolickými, tak účinky mineralokortikoidními. Spolu s katecholaminy jsou odpovědné za vznik inzulinové rezistence, která je součástí šokových stavů.
Z nehumorálních odpovědí, které zvyšují šance na přežití, protože oddalují moment zhroucení cirkulace, je namístě uvést následující faktory:
- Přizpůsobení cévního tonu spřažené s velikostí náplně cévy (reverse stress-relaxation);
- Absorpci tekutin z intersticiálního prostoru a – pokud je možné – také z GIT.
Spřažené přizpůsobení cévního tonu vede ke kontrakci cév při poklesu jejich náplně. Začíná se zpožděním asi 10 minut a ke svému plnému rozvinutí potřebuje asi 1 hodinu. Časově tedy nastupuje souběžně s účinky angiotenzinu a ADH.
Doplňování tekutin přesunem z extravaskulárních prostor je pomalé a může pokračovat desítky minut až desítky hodin. Při progresi šoku však je tento mechanismus naneštěstí vystřídán nastupující poruchou permeability, která vede k přestupu tekutin anebo plazmy do intersticia a k hemokoncentraci. Tím následně podporuje vznik DIC, SIRS a MODS.
Dekompenzované stádium šoku
Dekompenzované (manifestní) stádium reverzibilního šoku se také označuje jako progresivní šok. Nastává, když zmíněné kompenzační mechanismy nestačí zabránit dalšímu prohlubování oběhové nedostatečnosti. Vedoucím příznakem je pokles systémového arteriálního krevního tlaku. Pacient má závažnou až těžkou hypotenzi, tlak na paži může být dokonce neměřitelný. Má výraznou tachykardii, která může dosahovat hodnot 170/min nebo i více, a jeho studená zpocená kůže může získat šedou barvu anebo už být cyanotická. Je přítomna oligurie až anurie.
Po zhroucení tlaku už hypoperfúze nepostihuje jen periferní tkáně, ale potřebného tlakového gradientu se nedostává ani pro srdce a mozek. Snižuje se srdeční rezerva, mohou se objevit poruchy vnímání a vědomí. Přesto je možno adekvátním zásahem pacienta ze šoku ještě vyvést (proto pojmenování reverzibilní stádium šoku). Alternativně může dojít ke zvratu do dalšího, nevratného stádia šoku.
Nevratné (ireverzibilní) stádium šoku
Nevratné stádium se ohlašuje dalším rychlým poklesem tlaku. Příčinou je selhání vaskulárního tonu a povolení vazokonstrikce. Dochází k tomu z několika důvodů:
- Vazomotorické centrum v hypoperfundovaném mozkovém kmeni přestává vysílat vazopresorické impulsy;
- Hladká svalová vlákna arteriol jsou v hypoperfundovaných tkáních vystavena nedostatku kyslíku a lokálním toxickým vlivům a jejich následkem pozbývají schopnost reagovat na vazokonstrikční podněty.
Pokud jde o reakci vazomotorického centra na kritickou hypoperfúzi, nejprve se projevuje tím, že centrum po několik minut vysílá silné výboje navozující masívní aktivaci sympatiku (tzv. ischemická odpověď CNS). Toto poslední krizové vzepětí vazomotorické regulace ustává asi po 15 minutách, kdy už může aktivita centra zcela vymizet. Je ovšem vhodné mít na paměti, že průtok mozkem může být jeho autoregulačními mechanismy udržován na konstantní úrovni ještě při středním arteriálním tlaku 50 mm Hg.
Na periferii se v hypoperfundovaných tkáních rozvíjí anaerobní metabolismus. Hromadí se laktát. Z nedostatku ATP selhávají iontové pumpy a zanikají iontové gradienty na membránách. Z buněk vystupují do intersticia K+ ionty. Do buněk vstupují Ca2+ ionty a spolu s ionty H+ a dalšími faktory spouštějí procesy zániku buněk ve tkáních – autofágii, apoptózu a nekrózu. Aktivují se děje proteolýzy, lipolýzy a degradace nukleových kyselin. Štěpením vznikají biologicky aktivní peptidové a lipidové produkty, které se hromadí ve tkáních. Vznikají reaktivní kyslíkové radikály. To všechno negativně ovlivňuje stav hladkého svalstva cév. Je alterována permeabilita kapilár.
Jakmile dojde k povolení svěračů arteriol, přestává působit hlavní kompenzační mechanismus – centralizace oběhu. Do kapilár v ischemizovaných tkáních opět vstupuje krev. Z hlediska celkové regulace hemodynamiky jde o zvětšení prostoru, takže dále klesá tlak. To je závažný nepříznivý signál. Krev se navíc ve tkáních setkává se všemi nahromaděnými složkami (ionty, degradační produkty). Zároveň přestupuje porušenými kapilárními stěnami do intersticia, takže se zahušťuje. Krev, která nyní proteče tkáněmi a vrací se do oběhu, s sebou nese ionty a biologicky a imunologicky aktivní degradační produkty z ischemizovaných tkání. Produkty se dostávají i do centrálních orgánů (srdce, mozku), které před nimi dosud byly alespoň zčásti chráněny. Výsledkem může být tvorba mikrotrombů nebo stimulace zánětu, takže se může rozvinout DIC, SIRS a MODS.
Orgány v šoku
Poškození orgánů v průběhu šoku může vést k jejich selhání (selhání orgánů v šoku) a rozvoji SIRS anebo MODS. Někdy k selhání orgánů překvapivě dojde až s odstupem 2 – 3 dnů po prodělaném šoku, kdy se šok podařilo zvládnout a pacienta po stránce oběhu stabilizovat. V takových případech se používá označení šokový orgán (šoková ledvin, šoková plíce atd.).
Ledviny
Časnou změnou v hypoperfundované ledvině je redistribuce průtoku s přednostním zásobením ledvinové dřeně na úkor kůry. Po dosažení kritického prahu hypoperfúze může dojít k akutnímu poškození ledvin anebo až k nekróze tubulárních buněk a k jejich deskvamaci od bazální membrány (akutní tubulární nekróza).Tyto změny mohou vést k selháním ledvin. Je nezbytné mít na paměti, že selhání ledvin se může rozvinout i s odstupem až 48 – 72 hodin po odeznění šoku (šoková ledvina).
Plíce
Šok provází zvýšené dechové úsilí z hypoxie a metabolické acidózy. V pokročilých stádiích hrozí nekardiální plicní edém a selhání respirace (ARDS). Je nezbytné mít na paměti, že podobně jako selhání ledvin se ARDS může rozvinout s odstupem 48 – 72 hodin po tom, co šok odezněl a pacienta se podařilo oběhově stabilizovat.
Bránice a kosterní svaly
K selhání respirace může přispět zhoršení funkce a výkonnosti kosterních svalů a bránice při výrazné hypoperfúzi.
Žaludek
Šok je významným rizikovým faktorem vzniku stresových žaludečních vředů. Příčinou je hlavně hypoperfuze a tím snížená viabilita žaludeční sliznice.
Střevo
Hypoperfúze až ischémie střevní stěny při šoku může způsobit poruchu permeability střevní bariéry s přestupem toxinů anebo bakterií do krevního oběhu a následným rozvojem toxémie a bakteriémie. Střevo se oprávněně považuje za hnací motor SIRS a sepse.
Játra
Při hypoperfúzi jater se v jaterních lalůčcích mohou objevit centrální nekrózy provázené zvýšením plazmatických markerů jaterního poškození. Klinické selhání jater při šoku však je vzácné.
Krev
Krev v periferních orgánech teče pomalu a v cévách se rozvíjí endotelová dysfunkce. Ve tkáních dochází k hemokoncentraci pro poruchu permeability kapilár. Následkem může být tvorba mikrotrombů a vznik DIC. Nejtěžší komplikací DIC je tzv. purpura fulminans, při níž vznikají rozsáhlé kožní a slizniční nekrózy a následně i gangrény; často se pozoruje při sepsi.
Srdce
Srdce vystavené účinkům katecholaminů při šoku má vyšší nároky na dodávku kyslíku. Navíc je náchylné ke vzniku arytmií. Arytmie jsou podporovány hromaděním H+ iontů a K+ iontů v intersticiu při anaerobním metabolismu. Zvyšuje se objem svalových vláken (intracelulární otok). V pokročilých fázích se objevují subendokardiální nekrózy. Po funkční stránce klesá poddajnost srdeční stěny a klesá ejekční frakce. Může se rozvinout srdeční selhání.
Mozek
Průtok krve mozkem se autoregulací udržuje konstantní až do poklesu středního arteriálního tlaku pod 50 mm Hg. Pod touto hranicí mozek reaguje přechodnou masivní aktivací sympatiku, tzv. ischemickou mozkovou odpovědí. Řada symptomů poškození mozku při šoku (bolesti hlavy, zmatenost atd.) se může odvozovat od metabolického rozvratu (acidóza, rozvrat vodního a solného hospodářství).
Hypovolemický šok
Příčinami hypovolemického šoku jsou ztráty krve, plazmy anebo vody a elektrolytů.
- Ztráty krve
- Vnější krvácení
- Vnitřní krvácení
- Krvácení do tkání
- Ztráty plazmy
- Popáleniny
- Střevo (těžké infekce, např. cholera)
- Ztráty vody a elektrolytů
- Kůží (pocení, popáleniny)
- GIT (zvracení, průjmy, anastomózy, píštěle)
- Ledviny (selhání ledvin)
- Ztráty do třetích prostor (rozsáhlé otoky, ascites, hydrothorax apod.)
- Přídatné ztráty hyperventilací (např. při horečce)
- Nemožnost přijímat tekutiny
Důvodem rozvoje hypovolemického šoku je kritický pokles žilního návratu po vyčerpání možností a rezerv kompenzačních mechanismů.
Traumatický šok
Traumatický šok je nejčastěji vnímán jako hemoragický šok, a proto se řadí k hypovolemickým šokům. Je vhodné mít na paměti, že může jít jak o vnější, tak o vnitřní krvácení.
Zvláštním případem jsou rozsáhlé hematomy, kdy se krev nevylévá do dutin nebo dutých orgánů, ale do tkání. Hematomy a zhmožděné tkáně jsou osmoticky aktivní, takže v postižených místech se může nahromadit velké množství tekutiny. Při uzavřené zlomenině pánevních kostí nebo femuru může lokální množství tekutiny dosáhnout 1 – 3, popř. 5 litrů. Podcenit tuto skutečnost znamená vystavit pacienta vysokému nebezpečí nedostatečné péče.
Podobné znaky má syndrom zhmožděných měkkých tkání (crush syndrom). Vyskytuje se u pacientů s rozsáhlými úrazovými pohmožděninami anebo u jedinců vysvobozených po zasypání, kdy byly tkáně, především svaly, dlouhodobě ischemizovány stlačením. Po uvolnění tlaku tekutina přestupuje z cév do postižených tkání. Vytvářejí se masívní otoky, které mohou vést k hypovolémii. Zároveň se do krevního oběhu dostává velké množství myoglobinu a hemoglobinu. Jejich molekuly vytvářejí v ledvinových glomerulech agregáty, které spolu s hypovolémií mohou způsobit akutní selhání ledvin. Nefunkční ledviny nejsou v první, oligourické až anurické fázi akutního selhání schopny vylučovat draslík, jehož zdrojem rovněž jsou zhmožděné tkáně. Vyvíjí se hyperkalémie, která může být smrtící. Pokud pacient přežije, rozvíjí se druhá, polyurická fáze akutního selhání ledvin.
Na rozvoji traumatického šoku se ovšem může významnou měrou podílet bolest. Intenzivní bolest je sama schopna vyvolat těžký oběhový šokový stav dokonce i tehdy, když působí za podmínek normovolémie. Potom jednoznačně jde o distribuční šok. Proto je tak nutné ve všech případech, kdy je bolest přítomna, dbát na její tišení.
Distribuční šok
Anafylaktický šok
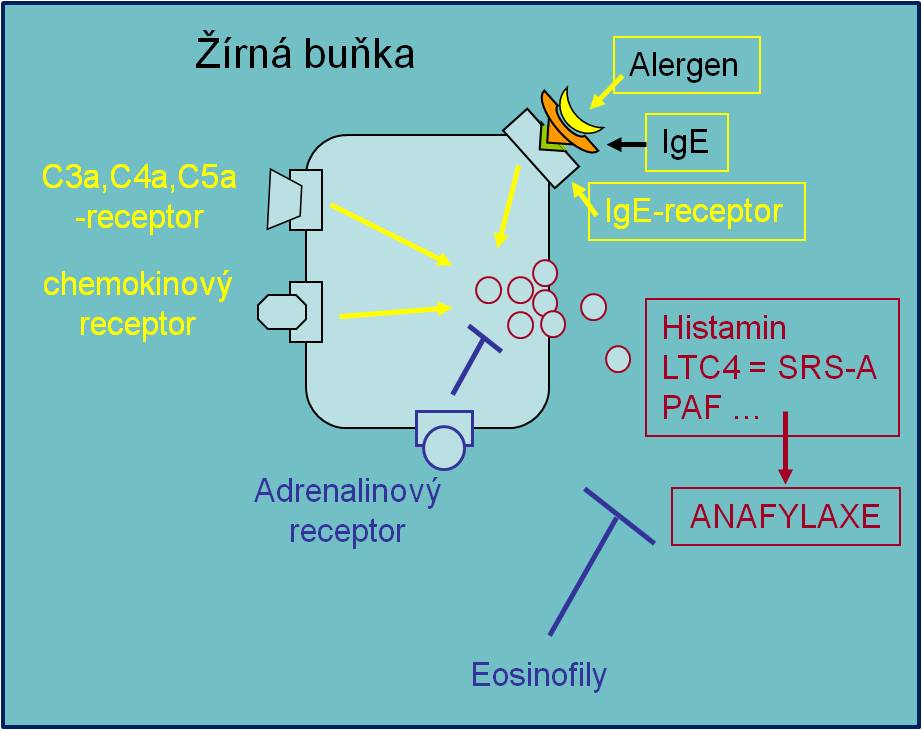
Anafylaktický šok se rozvíjí jako distribuční šok na podkladě alergické (anafylaktické) reakce (reakce hypersenzitivity typu I s podílem specifických protilátek třídy IgE).
Dominujícími prvotními příznaky anafylaktické reakce jsou
- Postižení dýchacích cest
- Bronchokonstrikce
- Edém sliznice
- Tvorba hlenu
- Postižení periferní cirkulace
- Dilatace arteriol, pokles periferní rezistence
- Těžké porušení permeability kapilár s tvorbou rozsáhlých edémů
Postižení dýchacích cest vede k obstrukční hypoxii až dušení. Postižení periferních cév nejprve způsobuje hyperkinetickou cirkulaci, později vede – z důvodu přestupu tekutin do intersticia a tvorby rozsáhlých edémů – k hemokoncentraci, hypovolémii, poklesu žilního návratu a srdečního výdeje. Proto kliničtí autoři někdy klasifikují rozvinutý anafylaktický šok jako šok hypovolemický.
Obr. 1. Reakce hypersenzitivity typu I.
Od anafylaktického šoku se etiopatogeneticky odlišuje anafylaktoidní šok, při jehož spuštění se neuplatňují protilátky IgE. Klinicky ovšem probíhá stejně jako šok anafylaktický. Anafylaktoidní šok se rozvíjí po destabilizaci žírných buněk a bazofilů následkem překotné aktivace komplementu. Žírné buňky mohou být aktivovány také iatrogenně některými léčivy (včetně aspirinu) anebo radiokontrastními látkami. Těžká anafylaktoidní odpověď může být součástí reakce vyvolané hadími jedy anebo hmyzím bodnutím.
Toxický šok
Toxický (toxémický) distribuční šok je po hemodynamické stránce blízký anafylaktickému a septickému šoku. Podobně jako septický šok může být provázen exantémem (kůže tedy zpočátku není bledá, jak je to obvyklé u hypovolemických šoků). Toxiny přímým účinkem na cévy vyvolávají periferní vazodilataci s následným zvýšením žilního návratu a rozvojem hyperkinetické cirkulace. Na vazodilataci se také může podílet inhibiční účinek toxinů na vazomotorická centra (neurogenní šok).
Septický šok
Sepse, správněji septický nebo infekční SIRS, se rozvíjí následkem invaze baktérií do krevního oběhu. Sepse je tedy vždy spojena s bakteriémií. Významnými primárními patogenetickými stimuly septického šoku jsou lipopolysacharidy bakteriálních stěn a bakteriální exotoxiny a exoenzymy.
Sepse se zpravidla ohlašuje prudkým vzestupem teploty se zimnicí a třesavkou. Kůže je při horečce suchá a teplá, může být přítomen exantém. Mohou se objevit příznaky ze strany GIT (průjem) anebo ze strany alterace CNS (zvracení, postižení psychiky). Hyperventilace způsobuje respirační alkalózu, kterou v dalším průběhu vystřídá metabolická acidóza. Hemokultura může odhalit přítomnost baktérií. Ve vyšetření krevního obrazu je zprvu leukocytóza, později leukopenie, vyšetření často odhalí průvodní trombocytopenii. S postupující hemokoncentrací klesá srdeční výdej a kůže je chladná a zpocená. Sepse se rozvíjí v řadě sepse – těžká sepse – septický šok – MODS. Klinická charakteristika a diagnostika těchto stavů jsou popsány v kapitole SIRS, MODS.
Septický šok je distribuční povahy. V periferii dochází k mohutné vazodilataci. Vyvíjí se hyperkinetická cirkulace. Krev však hlavně prochází abnormálně otevřenými arteriovenózními anastomózami, takže tkáně z ní mají jen malý užitek a trpí hypoperfúzí a ischémií. Druhým kritickým faktorem tkáňové ischémie je přítomnost toxických inhibitorů oxidativní fosforylace v buňkách. Toxiny, anafylatoxiny komplementu a cytokiny uvolňované z aktivovaných buněk imunitního systému stimulují tkáňový metabolismus. Rychle se stupňují katabolické děje. Chybí ATP a podněty pro anabolismus. Vznikají volné radikály. Rozvíjí se generalizovaná endotelová dysfunkce. Shluky baktérií, které jsou případně obalené chomáčky aktivovaných bílých krvinek anebo hnisu, vytvářejí v kapilárách mikrotromby, a tím dále zhoršují metabolismus tkání. Intravazální tekutina se porušenými stěnami kapilár přesunuje do intersticia a dochází k hemokoncentraci, která podporuje tendenci k tvorbě mikrotrombů. Je mimořádně velké riziko progrese do MODS.
Neurogenní šok
Neurogenní šok vzniká vyřazením vazomotorických center v mozkovém kmeni anebo přerušením drah, které vedou jejich signály. Typicky k tomu dochází při:
- Destrukci vazomotorických center;
- Poškození krční nebo horní hrudní míchy.
Nastává ztráta cévního tonu a rozvíjí se distribuční šok. Průvodním znakem je bradykardie, protože vyřazená sympatická inervace, a tedy převaha vagu, nedovoluje reagovat na snížený krevní tlak tachykardií. Charakteristická kombinace hypotenze a bradykardie je typickým znakem neurogenního šoku. Při další stimulaci vagu, např. při intubaci dýchacích cest, se může stav ještě zhoršit.
Podobné následky má inhibiční působení toxinů na vazomotorická centra. Projeví se masívní periferní vazodilatací. Tento mechanismus má své místo v rozvoji cirkulačního šoku při otravách drogami, narkotiky, barbituráty anebo anestetiky. Navíc se na něm může podílet i současná farmakologická blokáda periferních ganglií. Kromě kardiovakulárního systému je ovšem postiženo i dýchání (útlum respiračních center). Časté je bezvědomí.
Od neurogenního šoku se odlišuje spinální šok. Na rozdíl od neurogenního šoku je způsoben přerušením míchy. Pokud dojde k přerušení v krční anebo v horní hrudní oblasti, je jeho podstatnou složkou i šok neurogenní. Pokud je mícha přerušena níže, dostaví se jako bezprostrřední reakce na její poranění masívní sympatická stimulace, která způsobí mimořádný vzestup tlaku. Po ní zpravidla následuje rychlá reflexní aktivace parasympatiku, která klinický obraz doplní o bradykardii. Pod místem přerušení míchy je navíc ztraceno veškeré čití a je přítomna paralýza. Protože současně mohou být přerušeny také paravertebrální sympatické provazce, cévy v tělních segmentech pod místem přerušení ztrácejí sympatický tonus. Jejich průsvit je potom regulován cirkulujícími hormony a hlavně samotnými tkáněmi. Zásadním způsobem je narušena kontrola vyprazdňování močového měchýře.
Kardiální (kardiogenní) šok
Kardiální šok je normovolemický šok. V daleko největším počtu případů je způsoben rozsáhlým akutním infarktem myokardu levé komory na podkladě vícečetného postižení koronárních tepen. Infarkty pravé komory (obvykle při ischémii spodní stěny) jsou daleko méně časté. Ještě vzácnější jsou případy kardiálního šoku vyvolaného neléčenou srdční vadou, progredující kardiomyopatií, zánětem nebo srdeční tamponádou.
Levá komora selhává při infarktu, který rozruší přibližně 40 % anebo více její svalové masy. Ischemizovaná vlákna jsou nefunkční. Echokardiografické vyšetření ukáže hypokinetickou komoru, klesá ejekční frakce, klesá srdeční index. Rozvíjí se postkapilární plicní hypertenze, tlak v zaklínění překračuje kritickou hodnotu 18 mm Hg. Pokud není přítomna hypovolémie, jsou tlaky v pravé síni normální. Ve tkáních se rozvíjí anaerobní metabolismus, zvyšuje se laktát v krvi. Při stavech s nejtěžších prognózou může ejekční frakce klesnout pod 20 %, srdeční index pod 2,2 l/min/m2a střední arteriální tlak pod 60 mm Hg; laktát v krvi vzroste nad 4 mmol/l.
Obstrukční šok
Jak už bylo uvedeno výše, obstrukční šok je vyvolán překážkou, která brání adekvátnímu plnění pravé anebo levé komory. Mezi nejčastějšími příčinami mohou být:
- Srdeční tamponáda;
- Konstriktivní perikarditida;
- Záklopkový pneumothorax;
- Masívní plicní embolie;
- Stenóza plicní arterie;
- Prekapilární plicní hypertenze;
- Trombus nebo myxom uzavírající chlopenní ústí.
Endokrinní šok
Typickým šokem z endokrinních příčin je šok vyvolaný akutním selháním kůry nadledvin (adrenální insuficience, adrenální krize, též Addisonská krize, Waterhouseův-Friderichsenův syndrom).
Adrenální krize může vzniknout jako primární postižení nadledvin anebo jako sekundární následek jiné poruchy. Ohlašuje se hypotenzí a tachykardií. Projevuje se nápadnou únavností a slabostí (adynamie), bolestmi břicha anebo bolestmi v dolní části zad, nauzeou a zvracením, průjmy, hyperpyrexií, zmateností až deliriem a křečemi. Na šoku se podílí jak oligemická složka (hypovolémie ze ztrát tekutin ledvinami a zvracením), tak distribuční složka pro chybějící permisivní účinek glukokortikoidů (cévy přestávají odpovídat na sympatickou stimulaci). Stav vyúsťuje v koma. Laboratorním vyšetřením se zjistí hyperkalémie, nízký poměr Na+/K+ v plazmě s acidózou a nízké plazmatické i močové hladiny mineralokortikoidů a glukokortikoidů. Pro nedostatek glukokortikoidů se vyvíjí hypoglykémie, která může způsobit hypoglykemické koma. Je nezbytné si zapamatovat, že lékař může způsobit náhlé selhání nadledvin i iatrogenně při neuváženém náhlém vysazení terapie glukokortikoidy.
Adrenální krize vyvolaná masívním krvácením do nadledvin se nazývá Waterhouseův-Friderichsenův syndrom („hemoragická adrenalitis“). Nejčastěji se vyskytuje jako komplikace těžkých infekcí, zejména infekcí meningokoky (Neisseria meningitidis), ale také Streptococcus pneumoniae, Staphylococcus aureus, Haemophilus influenzae anebo Mycobacterium tuberculosis. Byly zaznamenány i zprávy o adrenálních krizích vyvolaných cytomegaloviry.
Jindy může být endokrinní šok součástí tyreotoxické krize při akutně vystupňovaném působení tyroidních hormonů.
Akutní život ohrožující příhoda při hypotyreóze se naproti tomu označuje jako myxedémové koma.
Šok, MODS a SIRS
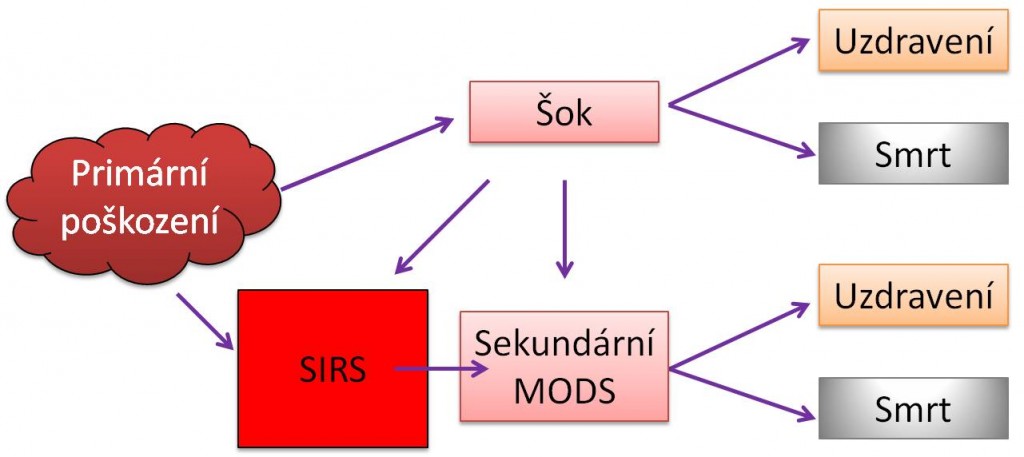
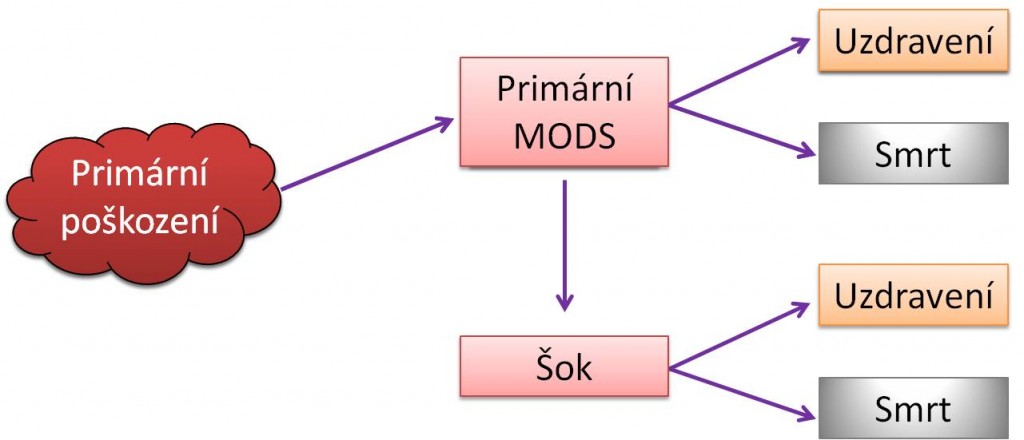
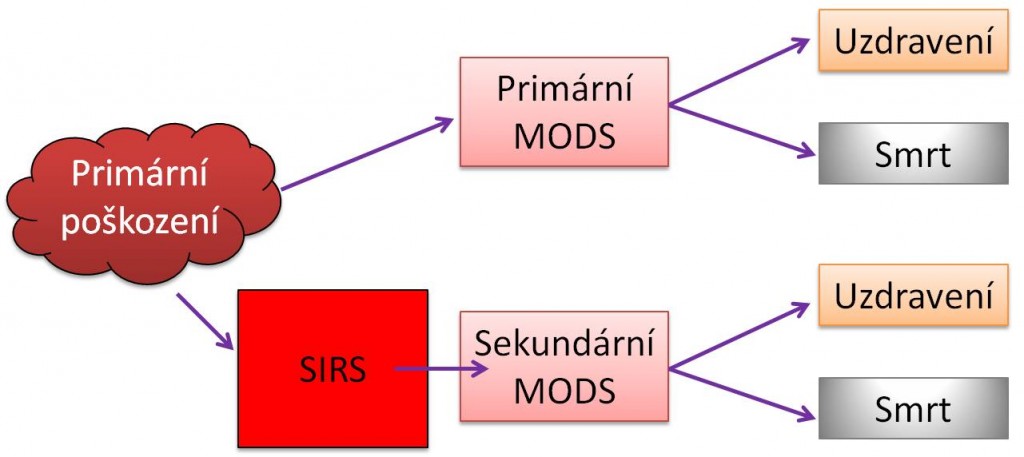
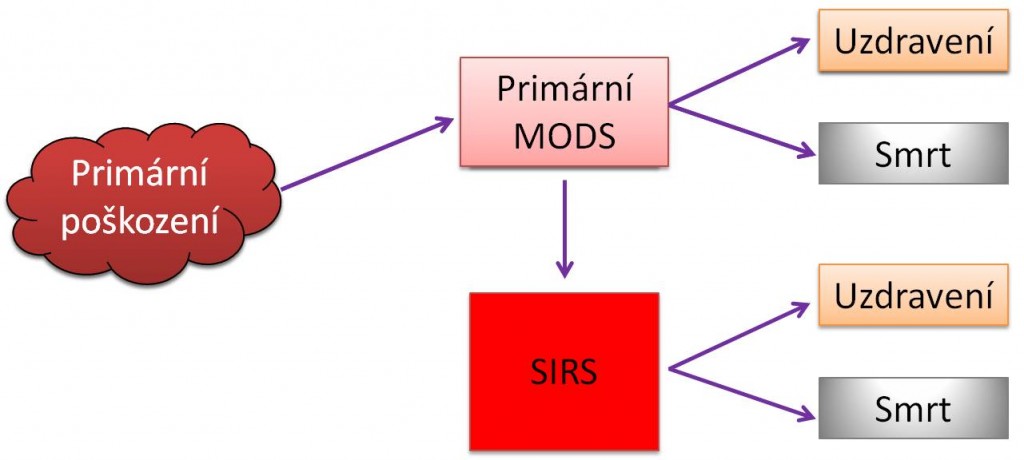
Vztahy mezi šokem, syndromem systémové zánětové odpovědi (SIRS) a syndromem multiorgánové dysfunkce (MODS) jsou mnohostranné. Každý z těchto stavů se může vyvinout buď jako primární, nebo být sekundárním následkem druhého anebo následkem jiného poškození.
Syndrom mnohočetného orgánového poškození (MODS) může začít primárním poškozením dvou a více orgánů, např. úrazem. Častěji však vyjadřuje klinicky pozorovanou skutečnost, kdy poškození původně jednoho místa v těle může vyvolat těžké sekundární poškození na vzdálených místech. Významné je, že MODS se může rozvinout několik dní, nebo dokonce až týdnů po primárním poškození. Statisticky bývají jako první zasaženy plíce (syndrom akutní dechové tísně, ARDS), dále se rozvíjí selhání jater, GIT (ileus, stresovbý vřed) a ledvin; pořadí však naprosto není uniformní. Krevní změny (DIC) a cirkulační selhání se mnohdy dostavují naposled. CNS může být postižen už v začátcích, nebo v pozdních fázích MODS. Typickými charakteristikami MODS jsou hyperkinetická cirkulace a hypermetabolismus; i tyto znaky však mohou být modifikovány působícími příčinami a jinými faktory. Vždy je třeba mít na paměti, že postižení GIT, hrozící ztráta bariérových funkcí v něm a přestup bakterií do krve jsou hnacím motorem rozvoje SIRS a sepse.
Syndrom systémové zánětové reakce (SIRS) je výsledkem aktivace imunitních mechanismů stimulovaných buď původně lokálním tkáňovým, nebo generalizovaným tělovým poškozením (hypoxémie a hypoxie, popáleniny, inkompatibilní transfúze, otravy, celotělové ozáření, poškození tlakovou vlnou atd.). SIRS z infekčních příčin je sepse. Klinická diagnóza SIRS se opírá o zjištění přítomnosti alespoň dvou ze 4 následujících kritérií:
- Tělesná teplota nad 38 °C, nebo pod 36 °C;
- Tepová frekvence nad 90/min;
- Frekvence dýchání nad 20/min, nebo hyperventilace s PaCO2 pod 32 mm Hg;
- Počet leukocytů vyšší než 12.1012, nebo nižší než 4.1012, nebo přítomnost více než 10 % nezralých forem leukocytů (tyček).
Jedním z významných znaků MODS i SIRS je katabolický stres (stresové hladovění), provázený hyperglykémií a těžkou inzulinovou rezistencí.
SIRS a MODS jsou podrobněji popsány v kapitole SIRS, MODS.
Obr. 2. Vztahy mezi šokem, MODS a SIRS – Varianty vzniku primárního a sekundárního MODS.
Diagnóza a monitorování cirkulačního šoku
viz též oddíl Respirační systém – Hypoxie
Zásady terapie
V posledním desetiletí se postupně mění názory na používání izotonických roztoků při léčbě oběhového selhání, přinejmenším u části klinických pracovníků. Aplikace izotonických roztoků má poměrně vysoké riziko objemového přetížení a následného plicního edému. Proto se při hrazení ztrát tekutin a krve při hypovolemických stavech stále větší pozornost věnuje podávání hypertonických roztoků krystaloidů.
Hlavní pozitivní účinky hypertonických roztoků při léčbě hypovolemických stavů kromě dodávky objemu tekutin spočívají v rychle nastupující dilataci prekapilárních svěračů, redukci periferní rezistence, a tím zlepšení žilního návratu, srdečního výdeje a periferního krevního zásobení. Další studované efekty dokonce ukazují na příznivé ovlivnění imunitní opovědi.
Náhlá smrt
Náhlá smrt přichází bez přechozích známek onemocnění a dostavuje se do 1 – 2 hodin po objevení se prvních příznaků. Náhlá smrt – podle definice – nastává z vnitřních, ne z vnějších příčin (nejedná se tedy např. o otravu nebo smrt úrazem).
Podle prevalence jednoznačně vedou onemocnění kardiovaskulární soustavy. Nejčastěji se jedná o selhání srdce, tzn. o náhlou srdeční smrt.
- Na prvním místě jsou zhoubné srdeční arytmie. Za 85 – 90 % případů odpovídá fibrilace komor na podkladě absolutní anebo relativní ischémie (na vrub čerstvého infarktu myokardu jde celých 25 % náhlých úmrtí).
- Dalších asi 10 % tvoří případy náhlé asystolie (vymizení elektrické, a tedy i mechanické činnosti srdce).
- Pokud srdce vykazuje elektrickou aktivitu, která ale není provázena kontrakcemi, jedná se o elektromechanickou disociaci (srdce netepe – tzv. bezpulsová elektrická aktivita); je v pozadí asi 5 % případů náhlé srdeční smrti.
- Kromě následků ischemické nemoci srdeční je namístě zmínit jiné poruchy tvorby anebo vedení vzruchů v srdci, a dále plicní embolii, chlopenní vady, kardiomyopatie atd.
Případy náhlé smrti vyprovokované iatrogenně (např. fibrilace komor z hypokalémie navozené diuretiky, nebo vedeljšími arytmogenními účinky antiarytmik, např. digoxinu, chinidinu apod). lze klasifikovat také jako intoxikace, a jsou tedy přinejmenším na pomezí mezi náhlými úmrtími z vnitřních a vnějších příčin.
Náhlá smrt při sportu:
- Nejčastěji se objevuje na podkladě nepoznané anebo podceněné chlopenní vady (např. aortální stenózy), obstrukční (hypertrofické) anebo dilatační kardiomyopatie, abormality odstupu anebo průběhu koronární artérie, nediagnostikované myokarditidy, aneurysmatu, náhlé disekce aorty apod.
- Tzv. vagová smrt, rovněž spojená se sportovními výkony, už spíše spadá mezi úmrtí způsobená vnějšími příčinami. Může nastat zejména u citlivějších osob po úderu na srdeční krajinu, plexus solaris anebo sinus caroticus.
- Podobně se to má s náhlým úmrtím následkem skoku do studené vody. Zde se podílí více faktorů:
- Náhlé zvýšení předtížení (preload) pro rozsáhlou venokonstrikci;
- Náhlé zvýšení dotížení (afterload) pro rozsáhlou periferní arteriolokonstrikci;
- Náhlé podráždění sinus caroticus a útlum sympatiku;
- Valsalvův manévr vyvolaný chladem;
- Trigeminovagální reflex vyvolaný působením chladu v obličeji.
Zpracovali: Jaroslav Veselý a Květoslava Dostálová, Ústav patologické fyziologie LF UP v Olomouci